CDH13基因在轉移性腎透明細胞癌中的研究*
鄭 倩,周曉慧,王怡方,周曉瑩
(廣西醫科大學生命科學研究院,南寧 530021)
腎細胞癌(renal cell carcinoma,RCC)是泌尿系統中最常見的惡性腫瘤之一[1]。RCC可分為腎透明細胞癌(kidney clear cell carcinoma,KIRC)、腎乳頭狀細胞癌(kidney papillary cell carcinoma,KICH)和腎嫌色細胞癌(kidney chromophobe,KIRP)等亞型,其中以KIRC 最為常見,占腎細胞癌死亡人數75%[2]。局部腎細胞癌可以通過腎切除和立體定向消融放療來治療,但是仍有30%的患者最終發生轉移,其中KIRC 在轉移性腎癌中占83%~88%。盡管基 于VEGF(vascular endothelial growth factor,VEGF)和雷帕霉素(mamalian target of rapamycin,MTOR)等分子靶向藥物已經應用于腎細胞癌的臨床治療,但是對于大多數具有遠處轉移患者的效果卻微乎其微[3-4]。因此,找尋新的腎細胞癌生物分子標志物對于疾病診斷、預后的判斷、制定精準的治療方案具有重要的意義。
CDH13基因位于染色體16q14.2-3,編碼T-鈣粘蛋白(T-cadherin,T-cad),是鈣粘蛋白家族的成員之一。越來越多的研究表明,T-cad的下調與腫瘤的侵襲和轉移有關,如胃癌、膀胱癌、前列腺癌等,推測T-cad 可能是一種腫瘤轉移抑制因子[5-7],但在KIRC中的研究尚未見報道。本文主要探索CDH13 在KIRC中的轉錄、蛋白表達改變和調控機制,及其作為預后標志物的價值,以期為臨床治療KIRC 提供實驗依據。
1 材料與方法
1.1 TCGA 數據庫 利用UCSC Xena 數據庫(https://xena.ucsc.edu/)下載TCGA 數據庫分析533例KIRC組織和72例正常腎組織RNA-Seq數據,分析CDH13 在KIRC 中的轉錄水平及與患者臨床病例特征之間的相關性。
1.2 GEO數據庫 從NCBI中的GEO數據庫(https://www.ncbi.nlm.nih.gov/gds/)搜索KIRC 相關的表達譜芯片,納入標準:(1)至少包含KIRC 組織和非癌組織各3 例;(2)來源物種為人類;(3)包含CDH13的數據,由此共納入13套表達譜芯片,包含476 例KIRC 組織和312 例正常腎組織,對CDH13 mRNA轉錄水平進行Meta分析。
1.3 分析CDH13 在KIRC 啟動子區甲基化水平與患者生存時間之間的關聯 使用UALCAN 網頁(http://ualcan.path.uab.edu/index.html)分別對CDH13蛋白表達和DNA 甲基化水平進行分析。利用SMART 在線分析網頁(http://www.bioinfo-zs.com/smartapp),確定CDH13啟動子區CpG島在KIRC中的甲基化修飾水平。通過MethSurv 在線甲基化分析網頁(https://biit.cs.ut.ee/methsurv/)分析CDH13在KIRC啟動子區甲基化水平與患者生存時間之間的關聯。
1.4 細胞及培養
人腎癌細胞系A498(貨號CL-0254)購于武漢普諾賽生命科技有限公司,Caki-2 置于液氮中長期保存,分別使用DMEM和5A培養基(均含有10%的澳洲胎牛血清和1%的青鏈霉素混合液)中進行培養。利用甲基轉移酶抑制劑5-氮雜-2’-脫氧胞苷(5-aza-dC)處理腎癌細胞系,將處于對數生長期的A498和Caki-2細胞接種與6孔板中,使用DMSO配制5-aza-dC 工作液濃度為5 μmol/L,連續處理4 d,對照組細胞則用DMSO處理。
1.5 實時熒光定量PCR檢測CDH13轉錄水平
腎癌cDNA芯片購自上海芯超生物科技有限公司,其cDNA 芯片(cDNA-HKidE030CS01)包含15例KIRC組織和匹配的鄰近組織。通過實時熒光定量PCR 對15 例KIRC 組織樣本與15 例匹配的癌旁組織樣本,利用SYBR Green 定量試劑盒,在Quant-Studio 5 Flex Real-time PCR系統使用Q-PCR反應檢測CDH13 mRNA 表達水平,實驗采用20 μL 體系,包括SYBR 10 μL,去離子水7 μL,正反向引物和cDNA各1 μL構成。PCR擴增程序:95 ℃(預變性)10 min;95 ℃10 s,60 ℃1 min 共40 個循環。采用Ct(2-ΔΔCt)法方法計算CDH13 的mRNA 轉錄水平。引物序列(5'~3'):CDH13-Forward:AGAAAGGTCCAAGTTCCGGC,CDH13-Reverse:ACTTCTCTGTCCAAGGTCCGT;GAPDH-Forward:AAGCTCACTGGCATGGCCTT,GAPDH-Reverse:CTCTCTTCCTCTTGTGCTCTTG。
1.6 統計學方法
采用SPSS 23.0 統計軟件進行數據分析,數據均為計量資料,數據間使用兩兩獨立樣本t檢驗進行分析,數據采用均數±標準差()表示,利用stataSE-64 12.0統計軟件進行Meta分析,以P<0.05表示差異具有統計學意義。
2 結果
2.1 CDH13 在KIRC 中的mRNA 轉錄和蛋白表達改變 CDH13在KIRC患者中的轉錄水平較正常對照組織上調(P<0.05),見表1。Meta 分析顯示KIRC 組織CDH13 mRNA 水平高于正常組織(P<0.05),與TCGA 數據分析結果一致。森林圖顯示CDH13 在KIRC 中的表達研究存在異質性(I2=85.6%,P=0.000)(圖1 A),使用隨機效應模型進行分析,95%置信區間CI:1.57~2.51(P=0.000)(圖1B),Beggar’s 漏斗圖法顯示發表性存在發表偏倚(P<0.05)(圖1C)。
KIRC組織中CDH13轉錄水平較正常組織明顯升高(P=0.012)(圖1D),與生物信息分析結果一致。利用UALCAN網頁中CPTAC數據庫分析發現CDH13 蛋白表達水平在KIRC 組織(n=110)較正常組織(n=84)中明顯上調(P<0.05,圖1E)。

圖1 CDH13在KIRC中的mRNA轉錄和蛋白表達改變
2.2 CDH13 在KIRC 中的mRNA 和蛋白表達與臨床特征的相關性 CDH13的轉錄水平在伴有淋巴、遠處器官轉移的KIRC患者中顯著低于無轉移的患者(P<0.05),見表1。表1 結果提示CDH13 mRNA表達水平與KIRC 的疾病進程密切相關。此外,CDH13 的蛋白水平在Ⅰ~Ⅳ期的KIRC 中均顯著高于正常組織(P<0.05),但隨著分期越高,CDH13表達則有下降趨勢(圖2A),CDH13 的蛋白水平雖然較正常組織升高,但隨著臨床分級的不斷發展,其蛋白變化不明顯(圖2A),卻隨著腫瘤分級的程度的不斷惡化而逐漸降低(P<0.05)(圖2B)。

圖2 CDH13在KIRC中蛋白表達水平與臨床特征之間的關系
表1 CDH13 在KIRC 中mRNA 表達水平及其與臨床病特征的關系

表1 CDH13 在KIRC 中mRNA 表達水平及其與臨床病特征的關系
2.3 KIRC中CDH13啟動子區甲基化水平
KIRC組織中CDH13啟動子區甲基化水平較正常組織升高(P<0.001);通過SMART網頁對CDH13 在KIRC 中啟動子區含有CpG 島的位點進行篩選,得到6 個cg 位點,分別是cg08747377、cg05374412、cg00806490、cg08856946、cg09189772、cg09369556。通過對cg位點甲基化修飾分析,發現不同位點中CDH13 甲基化水平均在KIRC 中上調。為了驗證CDH13 啟動子區確實受到甲基化修飾的調控,使用甲基轉移酶抑制劑5-aza-dC 處理A498 與caki-2 兩株腎癌細胞系,發現經過5-aza-dC處理4 d 后,CDH13 的轉錄水平高于未經處理組(P<0.05),說明CDH13 的啟動子區確實受甲基化的調控,見圖3。

圖3 KIRC中CDH13啟動子區甲基化水平
2.4 CDH13甲基化水平與KIRC臨床特征的相關性
CDH13隨著臨床分期的升高,甲基化水平逐漸升高(P<0.05);此外,利用SMART 在線分析工具,對不同cg位點的甲基化水平進行分析,發現不同位點均隨著腫瘤分期的發展逐漸而升高(P<0.05),見圖4。

圖4 CDH13啟動子區甲基化修飾水平與KIRC臨床特征之間的關系
2.5 CDH13 mRNA和甲基化的預后分析 為進一步驗證其預后,利用TCGA 數據庫中KIRC 患者的生存時間與CDH13的轉錄和甲基化水平進行分析,發現mRNA 轉錄水平中隨著CDH13 低表達患者生存時間明顯下降(圖5A),差異具有統計學意義(P<0.05)。同時對啟動子區cg 位點的甲基化水平進行生存分析,發現5個cg位點隨著甲基化水平的升高,患者的生存時間明顯下降(P<0.05)(圖5B~圖5F)。因此,CDH13可以作為轉移性KIRC預后的有效分子標志物。
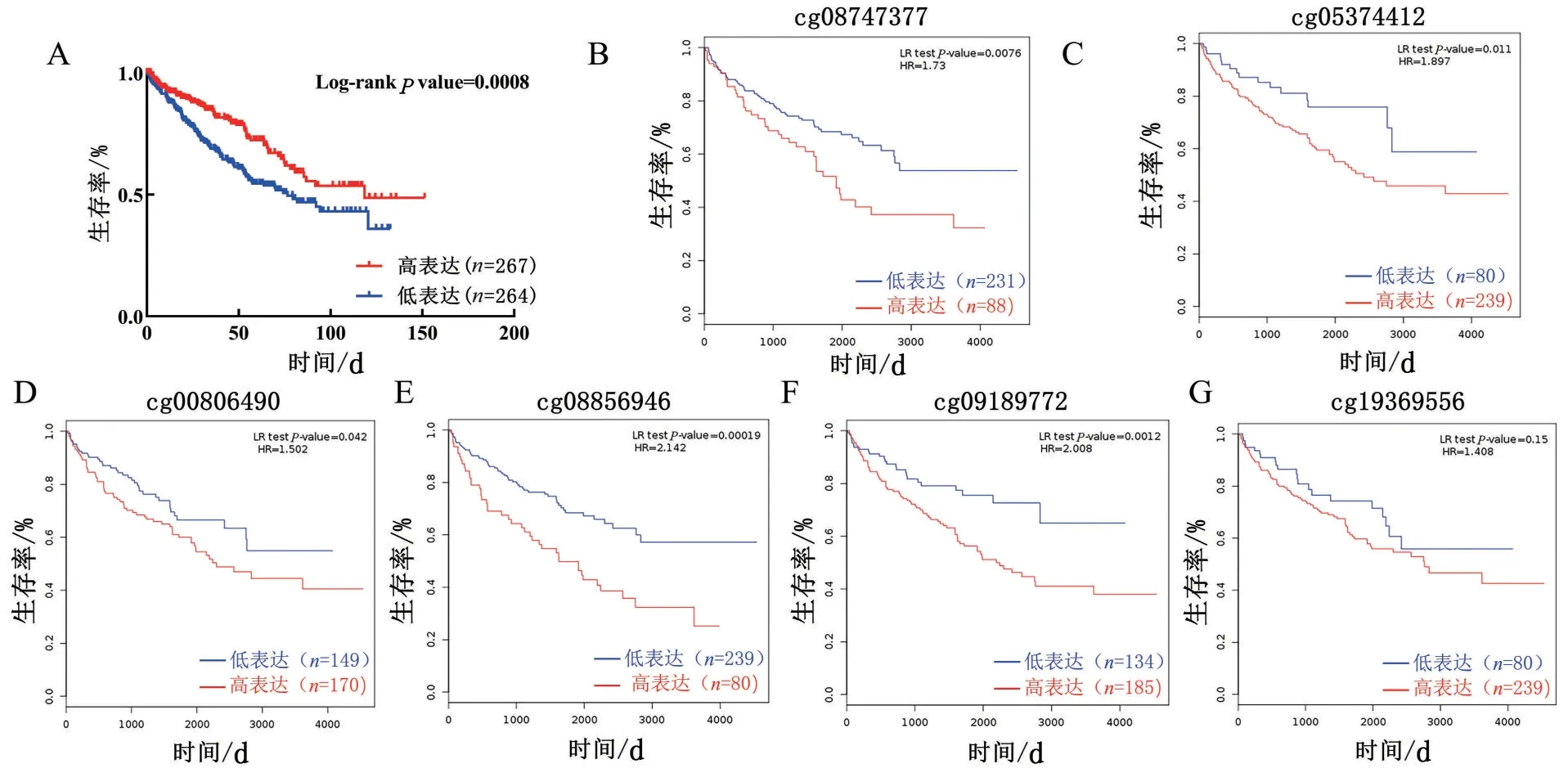
圖5 CDH13表達和甲基化在KIRC中的預后相關性分析
3 討論
研究表明,CDH13通過細胞—細胞黏附和整合素介導的細胞—基質接觸之間的交叉作用調控腫瘤的侵襲和轉移[8]。其與腫瘤的發展,尤其是在侵襲與轉移過程可以作為重要的抑制因子[5],CDH13的高表達可逆轉上皮—間質轉化通路,通過上調CDH1、下調VIM、MMP-2 的表達影響胃癌細胞的遷移和侵襲[9]。此外,在口腔癌中CDH13表達下調可激活PI3K/AKT/mTOR 途徑促進癌細胞的增殖[10]。本研究發現,CDH13 隨著KIRC 患者病程的發展逐步表達下調,有淋巴轉移、遠處器官轉移的患者較無轉移的患者,其轉錄水平和蛋白水平均降低,提示CDH13的下調可能參與KIRC的轉移。
本研究還發現,CDH13 基因DNA 啟動子區在KIRC 中呈高甲基化,同時啟動子區含有CpG 島的cg位點也呈現高甲基化,并隨著腫瘤發展而逐步增高,利用去甲基化藥物5-aza-dC 處理后可恢復CDH13的表達,進一步驗證了CDH13在KIRC中受DNA 甲基化修飾的調控。表觀遺傳學在腫瘤中的作用一直是研究的熱點,尤其是啟動子區的高甲基化導致基因的轉錄沉默。在許多研究中,CDH13高甲基化在許多腫瘤中被報道,如乳腺癌、肺癌、前列腺癌等[5,7,11]。作為一種腫瘤生長和轉移中的抑制因子,CDH13 異常高甲基化導致mRNA 水平明顯降低,與腫瘤的發生、增殖、浸潤和轉移密切相關[12],而調控腫瘤基因功能的主要機制之一是啟動子區域的異常甲基化,導致基因表達下調。Shenog 等[4]發現,CDH13啟動子異常甲基化在結直腸癌中通過下調其表達在發病機制中起重要作用。在乳腺癌和肺癌中,Polβ(DNA polymerase β)的過表達可抑制腫瘤,而DNA 去甲基化可促進CDH13 轉錄表達上調從而誘導Polβ 的表達,進而抑制腫瘤的發展[13]。而本研究也證實CDH13 受DNA 甲基化調控,并可能參與KIRC的轉移,與上述研究結論相符。
CDH家族有較多成員在KIRC中轉錄和表達異常,與腫瘤的分期和分級密切相關,并可以預測KIRC患者的預后情況[14]。本課題組前期研究發現,CDH4 的mRNA 轉錄水平在KIRC 的發展進程中逐漸下調,并且與晚期轉移的KIRC 患者的CDH4 的轉錄水平呈負相關,提示CDH4 可作為KIRC 的潛在診斷和預后標志物[15]。此外,miR-27a-3p 靶向調控CDH5 的表達,使其在KIRC 的腫瘤分期和轉移中轉錄水平下降,并且CDH5 低表達與KIRC 患者的生存及預后呈正相關關系,說明miR-27a-3p作為KIRC 的診斷標志物[16]。在本研究中,CDH13 在腫瘤發展進程其甲基化水平逐漸升高,導致KIRC 中CDH13 的轉錄和表達水平逐漸降低,提示其在KIRC 中的分期、分級和遠處轉移中可能受到廣泛的甲基化修飾,且低表達CDH13的腎細胞癌患者生存時間降低,預后效果差。因此,CDH13 的表達在轉移性KIRC的發生發展中起重要作用。
綜上所述,本研究的結果初步發現CDH13 在KIRC 中由于受到DNA 高甲基化調控,隨著疾病的進展,其轉錄和表達水平進一步失活,且通過轉移性KIRC 患者的CDH13 轉錄水平可評估其預后效果。因此,CDH13 可能是轉移性KIRC 潛在的預后標志物,為腎細胞癌的預后評價提供新研究的方向。

