磷霉素對萬古霉素致大鼠腎損害的保護作用及機制研究*
黃麗蓓,楊 斌,黃曉青,林子杰,李潔靜,唐生平,丘 岳△
(1.廣西醫科大學第一附屬醫院,南寧 530021;2.廣西醫科大學藥學院,南寧 530021;3.廣西醫科大學第一臨床醫學院,南寧 530021)
腎毒性是萬古霉素的主要副作用。據報道,萬古霉素的腎毒性發生率為5%~25%,聯用氨基糖苷類藥物可高達35%。新的治療指南建議,使用高劑量(15~20 mg/L)和長療程萬古霉素治療耐甲氧西林金黃色葡萄球菌(MRSA)導致的復雜感染,例如菌血癥和醫院獲得性肺炎,可增加腎損傷(KI)的風險[1-2]。
磷霉素具有廣譜抗菌活性,對革蘭陽性菌及陰性菌均具有抗菌活性。萬古霉素聯合磷霉素是臨床治療耐藥革蘭陽性球菌感染的常用方案。研究顯示,磷霉素通過干擾體內炎癥因子如腫瘤壞死因子(TNF)-α、白細胞介素(IL)-1β、IL-6水平來調節急性期炎癥反應[3]。磷霉素對萬古霉素、氨基糖苷類藥物、順鉑等藥物引起的腎功能損害有保護作用,但其作用機制尚未明確[4-5]。本研究通過建立萬古霉素誘導的KI 大鼠模型,探討磷霉素對萬古霉素KI的保護作用及其機制。
1 材料與方法
1.1 藥品與主要試劑 注射用鹽酸萬古霉素(浙江醫藥新昌制藥廠);注射用磷霉素鈉(東北制藥集團沈陽第一制藥廠)。丙二醛(MDA)、超氧化物歧化酶(SOD)、一氧化氮(NO)、肌酐(SCr)試劑盒(南京建成生物工程研究所);尿素氮(BUN)試劑盒(江蘇晶美生物科技有限公司);胱抑素C(Cys C)試劑盒(上海酶聯生物科技有限公司)。
1.2 實驗動物 成年健康清潔級雄性SD大鼠60只,體重180~220 g,購自廣西醫科大學實驗動物中心,動物生產許可證號:SCXK(桂)2019-0035。大鼠飼養于溫度(26±1)℃、濕度85%、清潔級動物實驗室內,自由飲水、進食,實驗前適應性喂養3 d。
1.3 動物分組與給藥 將60 只SD 大鼠隨機分為6組,即空白對照組、磷霉素對照組、KI組、KI+磷霉素低劑量組(KI-L 組)、KI+磷霉素中劑量組(KI-M組)、KI+磷霉素高劑量組(KI-H組),每組10只。KI組腹腔注射200 mg/kg萬古霉素建立KI模型。KI-L組、KI-M 組、KI-H 組分別腹腔注射125 mg/kg、250 mg/kg、500 mg/kg 磷霉素,30 min 后腹腔注射200 mg/kg 萬古霉素,磷霉素對照組僅腹腔注射250 mg/kg磷霉素,空白對照組腹腔注射等量生理鹽水,1次/d,連續21 d。
1.4 血清Cys C、BUN、Scr 水平測定 給藥結束后24 h,稱體重,麻醉,取腹主動脈血,3 000 r/min離心15 min,取上層血清,采用酶聯免疫吸附試驗(ELISA)法檢測各組大鼠血清中Cys C、BUN、Scr 水平。檢測過程嚴格按照試劑盒說明書進行操作。
1.5 腎組織病理形態觀察 取血后處死大鼠,取雙側腎臟,生理鹽水清洗后稱重,右腎置于-80 ℃冰箱中保存。將左腎置于10%福爾馬林溶液固定24 h,常規脫水,石蠟包埋、切片(厚度為5μm),行蘇木精—伊紅(HE)染色,顯微鏡下觀察腎組織病理形態變化。
1.6 腎組織SOD、NO 和MDA 水平測定 取右腎組織,用生理鹽水制成10%腎勻漿,取上清液,測定SOD、NO和MDA水平。
1.7 統計學方法 采用SPSS 21.0統計軟件分析數據,計量資料以均數±標準差()表示,多組間比較采用方差分析,組間兩兩比較采用LSD-t檢驗,以P<0.05為差異有統計學意義。
2 結果
2.1 大鼠血清Cys C、BUN、Scr 水平比較 與空白對照組比較,KI組大鼠血清中Cys C、BUN、Scr水平顯著升高(均P<0.01);與KI 組比較,KI-L 組和KIM組上述指標均顯著降低(P<0.05);KI-H組Cys C和Scr水平明顯下降(P<0.05),但BUN無明顯差異(P>0.05);空白對照組與磷霉素對照組比較,差異無統計學意義(P>0.05),見表1。
表1 6組大鼠血清中Cys C、Scr、BUN水平比較,n=10
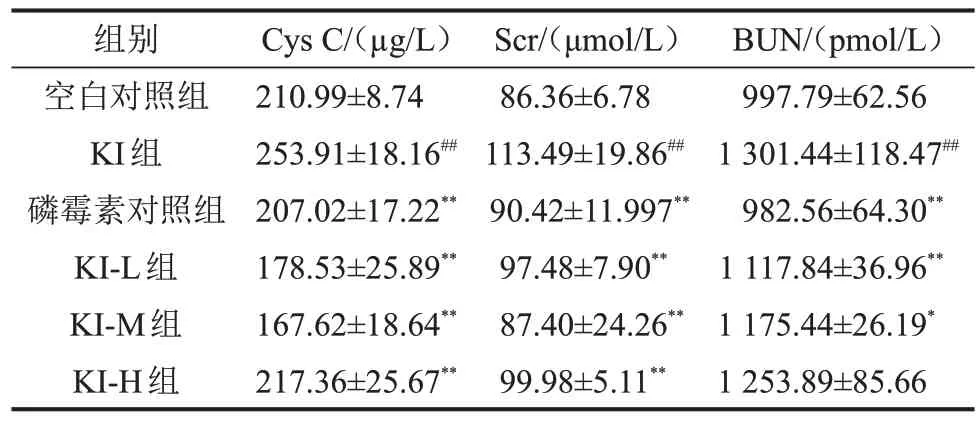
表1 6組大鼠血清中Cys C、Scr、BUN水平比較,n=10
與空白對照組比較,##P<0.01;與KI 組比較,*P<0.05,**P<0.01。
2.2 大鼠腎組織病理形態比較 HE 染色結果顯示,空白對照組大鼠腎小管和腎小球形態正常、結構清晰,無異常病理表現;KI 組大鼠腎小管出現不同程度的變性和壞死,腎間質出現嚴重水腫、大量嗜酸性粒細胞和中性粒細胞浸潤,引起腎小管—間質性腎炎;各給藥組大鼠腎組織上述形態均有所改善,見圖1。
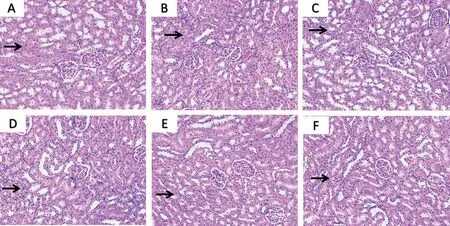
圖1 大鼠腎組織HE染色圖(×200)
2.3 大鼠腎組織SOD、NO、MDA水平比較
與空白對照組比較,KI 組大鼠腎組織NO、MDA 含量顯著升高,SOD 活性降低(均P<0.01);與KI組比較,磷霉素各劑量組SOD活性明顯升高,KI-M組和KI-H組NO含量明顯降低,KI-H組MDA含量明顯降低(均P<0.05),空白對照組與磷霉素對照組比較,差異無統計學意義(P>0.05),見表2。
表2 6組大鼠腎組織SOD、NO、MDA水平比較,n=10
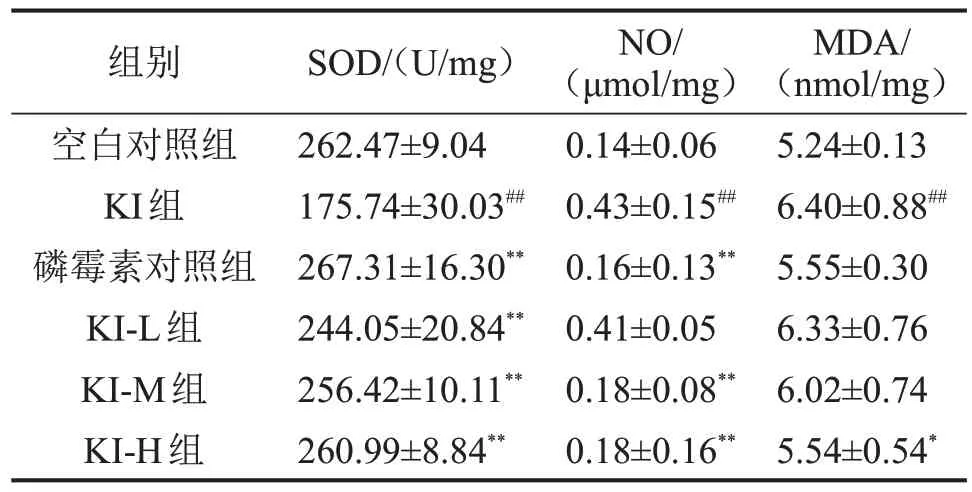
表2 6組大鼠腎組織SOD、NO、MDA水平比較,n=10
與空白對照組比較,##P<0.01;與KI 組比較,*P<0.05,**P<0.01。
3 討論
急性KI是由各種原因導致的腎單位和間質、血管損傷所致,以腎缺血和腎毒性物質導致的腎小管上皮細胞損傷最為常見。腎毒性物質包括外源性和內源性毒素。外源性腎毒素以藥物多見。血清Scr、BUN為臨床常規用于監測腎功能的指標,由于腎臟強大的儲備和代償能力,在KI 早期,BUN 和Scr 仍可維持在正常水平。而血Cys C 具有較高的敏感度,且不受個體生理因素和外在條件的影響,是評估腎功能變化的良好指標。文獻報道,Cys C可能是評估萬古霉素相關腎毒性的理想生物標志物[6-7]。血清Scr與Cys C聯合測定對早期KI的預測有較好的應用價值。
萬古霉素在近曲小管細胞內積聚引起細胞氧化應激和凋亡是KI發生的可能機制之一,其可能通過間接生成與炎癥相關的氧自由基,引起細胞膜脂質過氧化、蛋白質變性及DNA損傷,從而導致腎細胞損傷。萬古霉素可通過線粒體活性氧的產生和線粒體心磷脂過氧化誘導豬近端腎小管上皮細胞凋亡[8-10]。SOD 與MDA 分別為評價氧化應激在抗氧化能力和氧化能力方面的重要指標,MDA 含量可反映機體脂質過氧化的程度,間接反映出細胞損傷的程度[11]。本研究中大鼠腎組織SOD活性下降,MDA、NO 含量增多,表明氧化應激途徑在萬古霉素誘導KI時被激活。
如何降低萬古霉素所致的KI,潛在的策略包括延長輸液時間、降低最大濃度、給予抗氧化劑、增強藥物排泄、重組萬古霉素改變腎臟清除機制等[12]。可能對萬古霉素致KI有效的藥物包括抗氧化劑、轉運抑制劑(西司他丁、磷霉素)、溶酶體膜穩定劑(磷霉素)、自噬抑制劑(氯喹、巴絲霉素A1)、mTOR 激活劑等。Jennifer 等[13]在豚鼠KI 組中發現,磷霉素可減輕順鉑引起的急性腎小管壞死和間質性腎炎。磷霉素可抑制慶大霉素誘導的脂質過氧化反應,保護大鼠腎臟溶酶體膜,而對肝線粒體無效[14]。本研究中,KI組大鼠血清Cys C、BUN、Scr水平顯著升高,表明成功制作大鼠急性KI 模型;顯微鏡下可見明顯的腎臟病理改變,以腎小管—間質性炎癥病變為主。給予磷霉素后,KI 大鼠血清Cys C、Scr、BUN水平均有不同程度地降低,提示磷霉素對萬古霉素所致KI有保護作用。磷霉素能顯著降低KI大鼠腎組織NO、MDA水平,提高SOD活性,提示磷霉素減輕萬古霉素KI 的機制可能與抑制氧化應激狀態有關。此外,在本研究中,磷霉素對照組與空白對照組腎功能指標比較無明顯差異,表明在正常機能狀態下注射磷霉素時,磷霉素并未對大鼠的腎功能產生不良影響。
綜上,磷霉素通過增強大鼠體內抗氧化能力,發揮萬古霉素KI 的保護作用。但本研究尚未就調控氧化應激上游的具體分子機制進行闡述。本課題組擬進一步研究Keap1-Nrf2/ARE氧化應激信號通路在萬古霉素KI 中的作用及磷霉素的保護機制。此外,免疫介導機制也可能參與了萬古霉素誘導的KI,磷霉素也有免疫調節作用,免疫機制在磷霉素對萬古霉素KI 的保護作用機制亦值得進一步探討。

