基于網(wǎng)絡藥理學研究止嗽散治療咳嗽變異性哮喘的分子機制
陳麗君,闞紅星,丁 然,侯 俊,楊銀鳳
(安徽中醫(yī)藥大學醫(yī)藥信息工程學院,安徽 合肥 230012)
咳嗽變異性哮喘(cough variant asthma,CVA)通常表現(xiàn)為氣道反應過度,嗜酸性炎癥和咳嗽。CVA是哮喘的前兆。據(jù)統(tǒng)計,有50%~80%的兒童和10%~33%的CVA成人會發(fā)展為典型的哮喘。CVA的發(fā)病機制及病理生理表現(xiàn)與典型哮喘相似,均為多種炎癥細胞和炎癥遞質參與的慢性呼吸道炎癥性疾病。目前治療CVA的藥物有激素和支氣管擴張劑,但此類藥物長期使用存在毒性和不良反應,而且停藥后易復發(fā)。
止嗽散收載于清代程鐘齡《醫(yī)學心悟》中,對CVA具有顯著的療效。該方由桔梗、甘草、白前、紫菀、荊芥、陳皮、百部組成。方中紫菀、百部味苦,止咳化痰,共為君藥;桔梗開宣肺氣,白前降氣化痰,共為臣藥;荊芥疏風解表,陳皮理氣化痰,共為佐藥;甘草調和諸藥,配桔梗又有利咽止咳之功,共為佐使藥。
本研究旨在通過整合藥物代謝動力學數(shù)據(jù),進行多重藥物靶點預測和分子對接分析,以探究止嗽散治療CVA的作用機制。
1 方法
1.1 活性成分的篩選 通過中藥系統(tǒng)藥理學數(shù)據(jù)庫和分析平臺(traditional Chinese medicine systems pharmacology database and analysis platform, TCMSP)、中國中藥整合數(shù)據(jù)庫(traditional Chinese medicine integrated database,TCMIP)和文獻檢索收集止嗽散中7味中藥的分子數(shù)據(jù)集。同時,將口服生物利用度(oral bioavailability,OB)、類藥性(drug likeness,DL)、藥物半衰期(half life,HL)的閾值分別設置為OB≥30%,DL≥0.2,HL≥4,以同時滿足這3個條件的化合物作為止嗽散方中潛在的活性成分。
1.2 靶點的預測 運用TargetNet、Swiss Target Prediction和基于支持向量機(support vector medicine,SVM)、隨機森林法(random forest, RF)的SysDT(Systems drug targeting,SysDT)模型預測靶點。在SysDT方法中,將同時滿足RF≥0.7和SVM≥0.8的化合物-靶點相互作用視為有效靶點。此外,將化合物的簡化分子線性輸入規(guī)范(simplified molecular input line entry system,SMILES)值輸入Swiss Target Prediction和TargetNet數(shù)據(jù)庫,以補充獲取活性成分的靶基因信息。
1.3 CVA致病候選基因的獲取 結合GeneCards和OMIM兩大疾病數(shù)據(jù)庫,以“cough variant asthma”為關鍵詞進行檢索,獲取CVA的致病基因。
1.4 網(wǎng)絡構建 將活性成分作用靶點與致病候選基因取交集后的靶點導入蛋白互作平臺數(shù)據(jù)庫(String),以獲取蛋白與蛋白相互作用(protein-protein interaction,PPI)關系,并利用Cytoscape 3.7.2軟件繪制PPI網(wǎng)絡和“活性成分-靶點-疾病(C-T-D)”網(wǎng)絡。最后,運用“Network Analyzer”功能計算PPI和C-T-D網(wǎng)絡的“度(degree)”和“介數(shù)(betweenness)”值。
1.5 生物學功能富集分析 為了進一步探討止嗽散治療CVA的分子作用機制,將上述獲得的潛在靶點導入到DAVID 6.8數(shù)據(jù)庫(http://david.abcc.ncifcrf.gov),采用京都基因與基因組百科全書(Kyoto encyclopedia of genes and genomes,KEGG)進行富集分析。
1.6 分子對接 為進一步探索止嗽散的活性成分與其靶點的結合模式,從PPI網(wǎng)絡獲取的關鍵靶點中隨機選擇3個靶點與其相應的關鍵活性分子進行分子對接驗證。這些靶蛋白的X射線晶體結構從蛋白質數(shù)據(jù)(protein data bank,PDB)(http://www.rcsb.org)獲取。然后,采用AutoDock Vina軟件進行分子對接,得到結合能,并繪制活性分子和蛋白的結合模式圖。
2 結果
2.1 止嗽散活性成分篩選 根據(jù)前面設置的閾值,盡管部分化合物的OB、DL和HL值很低,但這些化合物如柚皮素、β-谷甾醇等已有相關文獻報道其藥理學活性,故入選有效化學成分庫,最終篩選出止嗽散的潛在活性成分有97個,止嗽散的部分活性成分見表1。
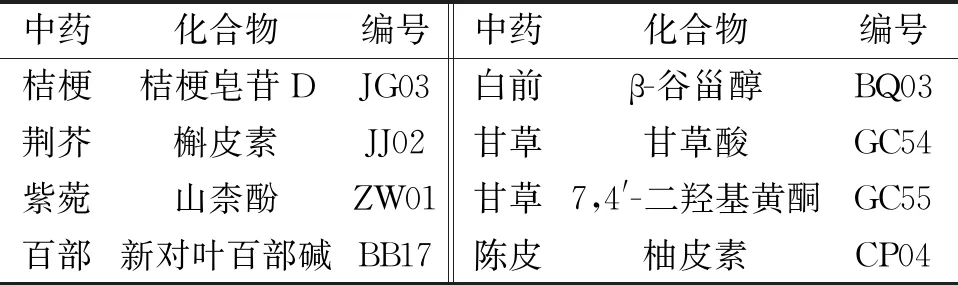
表1 止嗽散部分活性成分
2.2 交集靶點篩選結果 通過多重藥物靶點預測方法對這97個化合物進行打靶,共獲取2 118個靶點,與CVA對應的1 250個致病候選基因取交集后,最終獲得共有基因靶點144個。
2.3 網(wǎng)絡構建 為了探討止嗽散對CVA治療的分子機制,構建PPI和C-T-D網(wǎng)絡。圖1展示由143個節(jié)點和1 884個邊組成的PPI網(wǎng)絡。分析該網(wǎng)絡拓撲參數(shù),得到靶基因的平均度值為26.35,度值越大,節(jié)點大小越大,對應的重要程度越高。取度值前10位的靶基因作為核心靶點(見表2)。
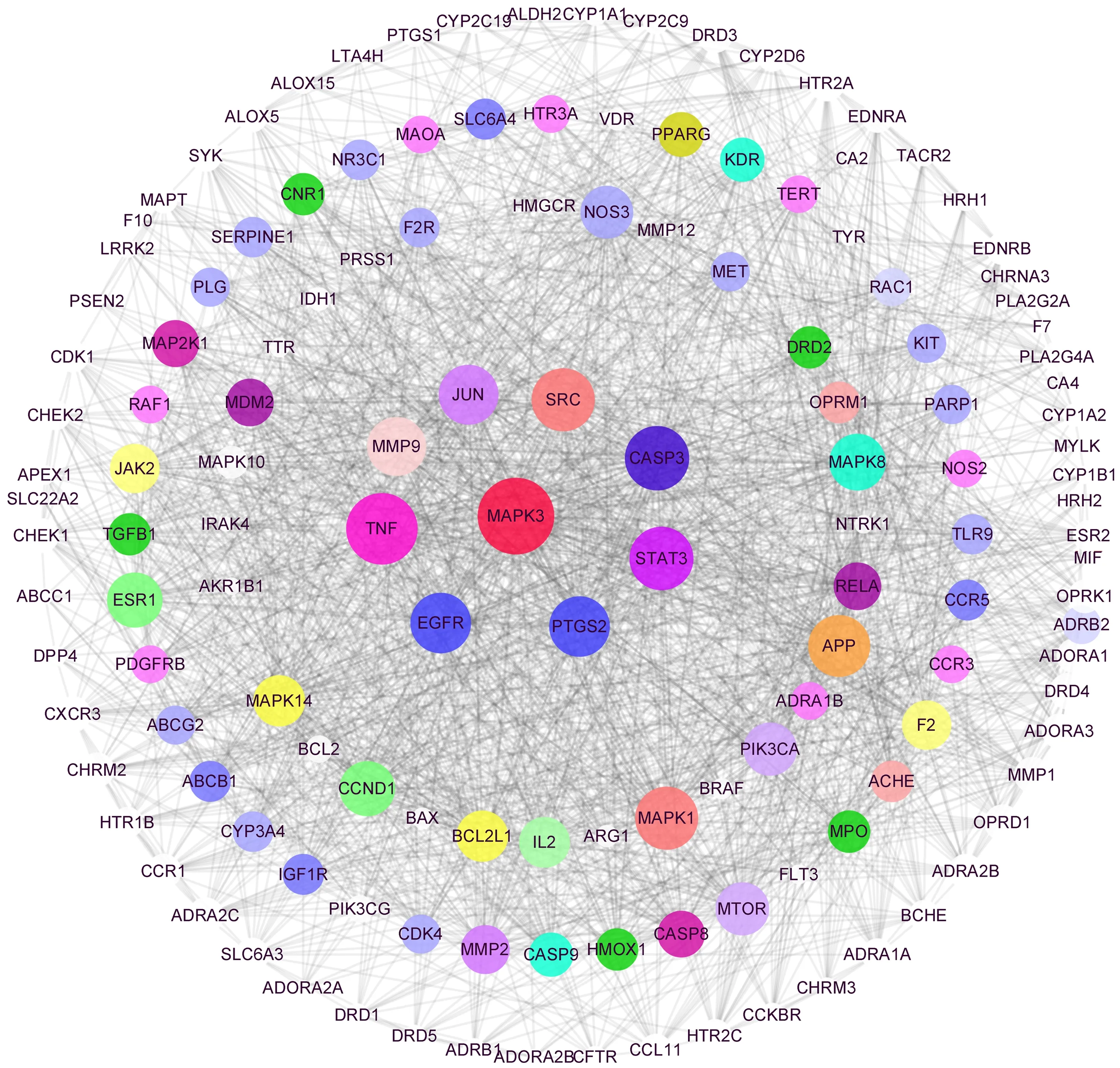
圖1 止嗽散治療CVA的核心基因的PPI網(wǎng)絡
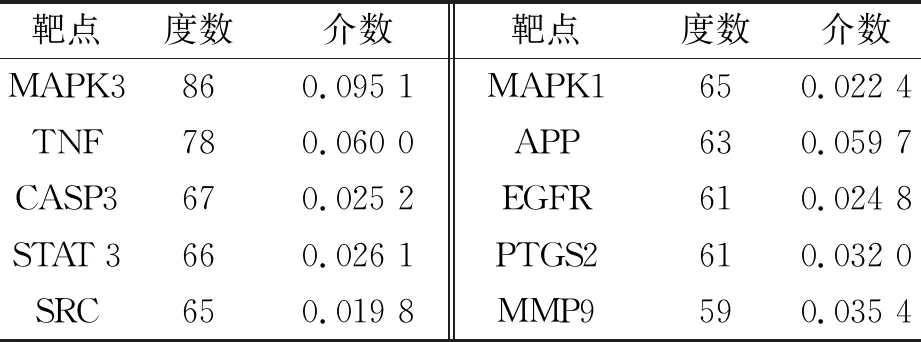
表2 止嗽散靶基因中排名前10的潛在靶點
此外,通過分析C-T-D網(wǎng)絡,得到該網(wǎng)絡節(jié)點的平均度值為8.73。其中,排名前列的分別是白前苷元C、7,4′-二羥基黃酮、甘草酸、新對葉百部堿、β-谷甾醇等(見表3)。例如,甘草中甘草酸可以通過減輕哮喘小鼠模型的氣道炎癥緩解哮喘癥狀。此外,Chung等發(fā)現(xiàn),百部中新對葉百部堿對豚鼠咳嗽模型的鎮(zhèn)咳作用最強。因此,將這些化合物作為止嗽散治療CVA的關鍵成分。
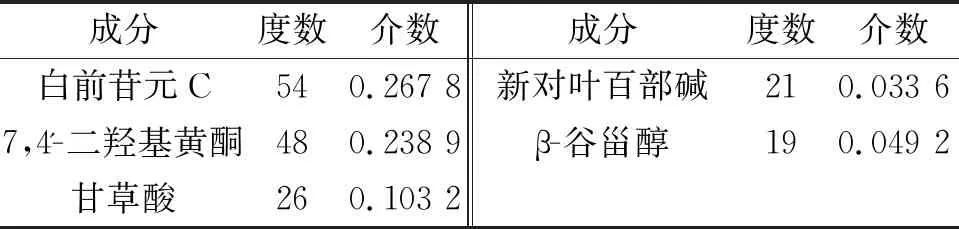
表3 止嗽散治療CVA的關鍵化合物信息
2.4 生物學功能富集分析 對144個潛在靶點進行生物學功能富集分析,圖2提示止嗽散治療CVA的主要通路是PI3K/Akt信號通路、核因子-κB(nuclear factor kappa B,NF-κB)信號通路和缺氧誘導因子-1(hypoxia-inducible factor-1,HIF-1)信號通路。為了進一步闡明止嗽散治療CVA的分子機制,筆者將止嗽散的潛在靶點映射到這3條關鍵信號通路(見圖3)上。
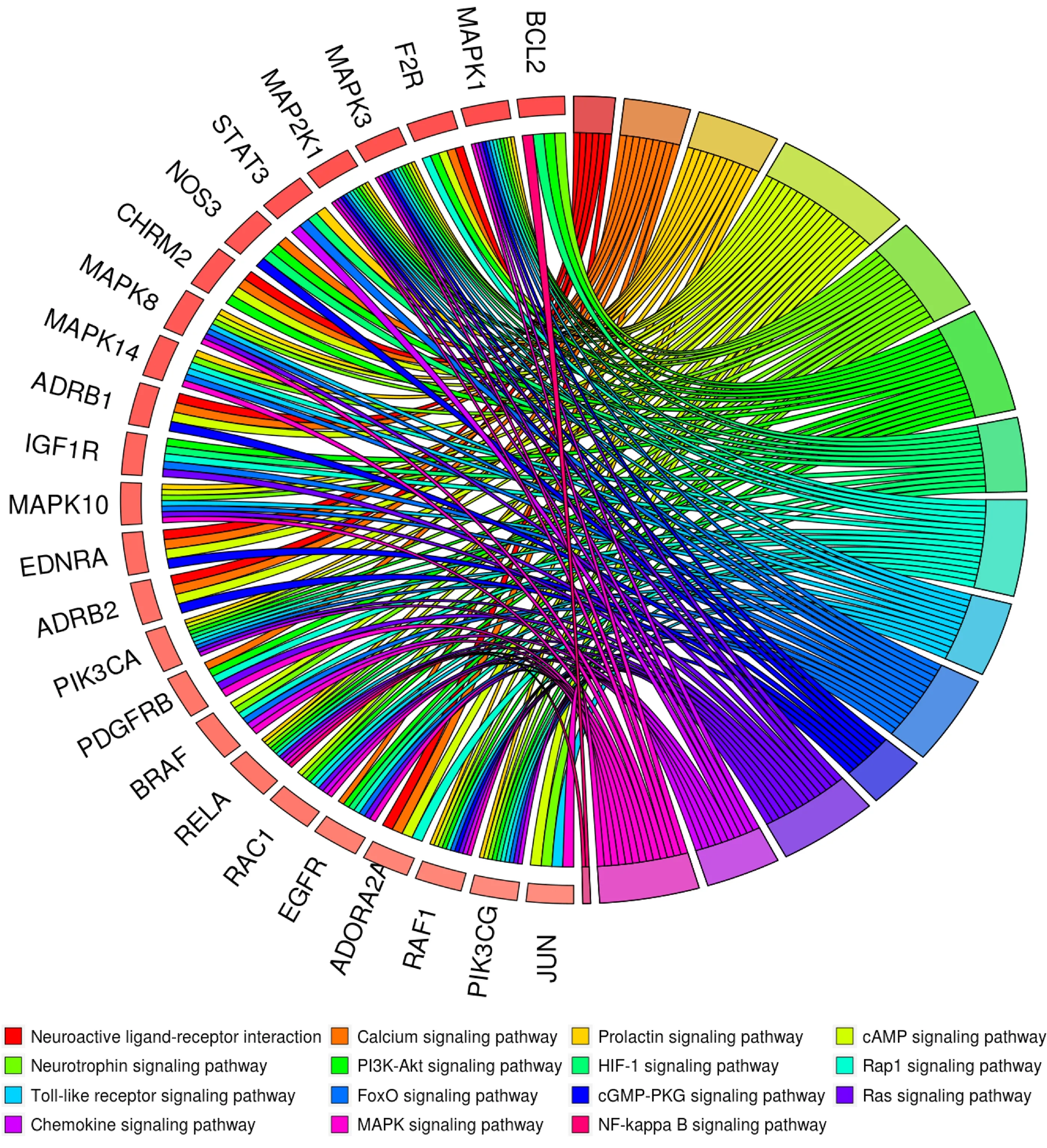
圖2 生物學功能富集分析弦圖
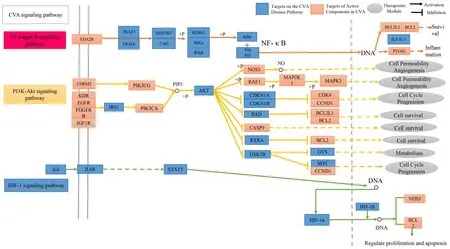
注:“→”表示激活,“┥”表示抑制
2.5 分子對接 從止嗽散有效成分中選取度值和介數(shù)靠前的核心成分,篩選出與CVA相關的3個核心靶點進行分子對接(見表4)。從表4發(fā)現(xiàn),這3個關鍵的靶點與其關鍵的化合物的結合能均為負值,表示兩者間具有一定的結合活性。而當結合能小于-5 kJ/mol時,兩者具有較強的結合活性;當結合能小于-7 kJ/mol時,兩者具有強烈的結合活性。對接結果說明止嗽散中關鍵化合物與核心靶點均具有較強的結合活性。
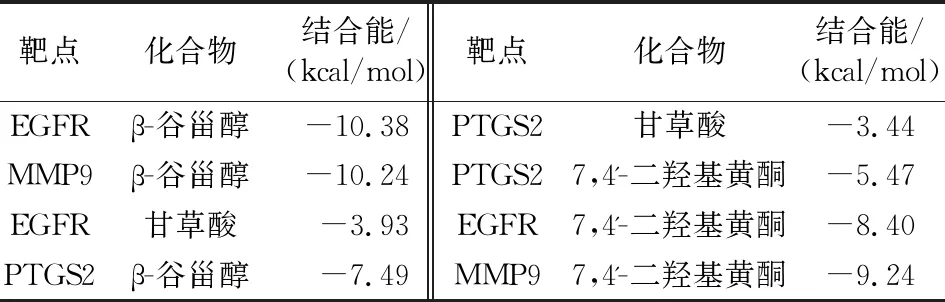
表4 關鍵化合物和關鍵靶點的結合能
選取結合力排名靠前的化合物β-谷甾醇與其關鍵靶點EGFR,作出兩者的空腔結合圖(見圖4)。從圖4可見,位于EGFR蛋白結合空腔中,分子β-谷甾醇與EGFR周圍的氨基酸殘基SER-720形成一個氫鍵作用,長度為0.29 nm。正是這些氫鍵形成的作用力使這些化合物牢牢地固定在活性位點處。

圖4 止嗽散關鍵化合物β-谷甾醇與其關鍵靶點EGFR的結合空腔圖
3 討論
本研究發(fā)現(xiàn),止嗽散治療CVA的關鍵活性成分有桔梗皂苷D、白前苷元C、新對葉百部堿、β-谷甾醇、甘草酸和7,4′-二羥基黃酮等。其中,桔梗皂苷D具有祛痰和抗炎活性。此外,白前中β-谷甾醇可以抑制Th2細胞因子的升高,防止氣道炎癥,具有治療過敏性哮喘的作用。而甘草中7,4′-二羥基黃酮顯著降低嗜酸性粒細胞性肺部炎癥患者血清IgE、IL-4、IL-13水平。因此,止嗽散治療CVA的機制與其活性成分減少氣道炎癥反應,降低氣道高反應,抑制氣道重塑有關。
在核心靶點中,甘草酸和7,4′-二羥基黃酮作用于前列腺素內過氧化物合酶2(prostaglandin-endoperoxide synthase 2,PTGS2),而PTGS2與哮喘的炎癥反應有密切的聯(lián)系。此外,7,4′-二羥基黃酮可作用于基質金屬蛋白酶9(matrix metalloproteinase-9,MMP-9)和表皮生長因子受體(epidermal growth factor receptor,EGFR)。MMP-9屬于蛋白酶超家族,可降解構成肺泡壁和基底膜的蛋白成分。研究表明,氣道炎癥部位的MMP-9活性較高,是氣道重塑的重要標志物。哮喘患者支氣管上皮中EGFR高表達,EGFR信號通路的過度激活通常參與氣道黏液過度分泌,并在慢性氣道炎癥中引發(fā)ERK1/2、PI3K、Akt激酶的激活。因此,可以推測7,4′-二羥基黃酮對PTGS2、MMP-9、EGFR的靶向作用可能是止嗽散治療CVA的作用機制。
生物學功能富集結果顯示,止嗽散治療CVA的主要信號通路有PI3K-Akt、NF-κB和HIF-1信號通路等。首先,PI3K/Akt信號通路在細胞的生長、增殖、轉移、凋亡和炎癥遞質的形成過程中產(chǎn)生重要的作用。經(jīng)PI3K激活的Akt利用磷酸化作用抑制或激活其下游Caspase9、Bad等靶基因,對細胞的增殖、凋亡、分化等起調控作用。例如,在PI3K/Akt信號通路中, Bad的磷酸化減少Bad與Bcl-2或Bcl-xl的結合,使Bad的促凋亡作用減輕,而Akt磷酸化可以繼續(xù)磷酸化Caspase 9,使其活性消失,同樣可以減輕促凋亡作用。這些表明活化后的Akt能維持氣道平滑肌細胞的增殖與凋亡的平衡狀態(tài)。另有文獻報道,PI3K/Akt通路與哮喘病程有關聯(lián),PI3K可影響氣道平滑肌的增殖以及嗜酸性粒細胞的招募,并影響肺部炎癥和感染的有害反應和保護性反應之間的平衡,調節(jié)粒細胞的募集、活化、凋亡。同時,有研究發(fā)現(xiàn),調節(jié)PI3K/Akt信號通路中基因的表達,可有效減輕哮喘老鼠的氣道重塑,從而達到治療哮喘的目的。
其次,NF-κB是細胞中重要的轉錄調節(jié)因子。NF-κB在哮喘發(fā)病機制和急慢性炎癥反應機制中起到重要作用,與樹突狀細胞、上皮細胞和嗜酸性粒細胞的生長、分化、炎癥因子的釋放、基因的表達有關。例如,在哮喘大鼠肺組織中NF-κB p65、NF-κB p50表達水平較高,IκBα表達水平較低,而止嗽散中柚皮素能下調NF-κB p65、NF-κB p50的表達水平,上調IκBα的表達水平,從而減輕哮喘大鼠的氣道炎癥及細胞損傷。
此外,HIF-1由HIF-1α和HIF-1β兩個亞基組成,在低氧狀態(tài)下可激活多種靶基因的轉錄,并且對于細胞生長發(fā)育和生理應激及在某些病理過程中起著重要作用。當前已發(fā)現(xiàn)在過敏性氣道炎癥發(fā)展中HIF-1α存在過表達。王莉等通過藥物進行干預,使HIF-1α表達水平下調,結果哮喘小鼠氣道炎癥的癥狀得到明顯緩解。這與本研究結果一致。所有這些結果都表明,止嗽散可能通過抑制HIF-1信號通路治療CVA。最后,分子對接結果顯示,止嗽散中潛在活性成分與其關鍵靶點的良好結合力是由其結合位點處穩(wěn)定的氫鍵導致的,進而驗證了本研究靶點預測方法的可靠性。
綜上,本研究通過整合藥物代謝動力學數(shù)據(jù)進行多重藥物靶點預測和分子對接分析,對止嗽散治療CVA的分子作用機制進行多途徑、多靶點研究,今后仍需要對止嗽散中關鍵成分抗CVA的作用進行驗證。

