基于硝態(tài)氮或銨態(tài)氮條件下楊樹根尖miRNAs 特征分析
闞東旭,逯巖,吳江婷,陳昕,石文廣,周婧*
(1.林木遺傳育種國家重點(diǎn)實(shí)驗(yàn)室,國家林業(yè)和草原局森林培育重點(diǎn)實(shí)驗(yàn)室,中國林業(yè)科學(xué)研究院林業(yè)研究所,北京 100091;2.林木遺傳育種國家重點(diǎn)實(shí)驗(yàn)室,東北林業(yè)大學(xué),黑龍江 哈爾濱 150040)
楊樹(PopulusL.)作為一種快速生長的木本植物,是我國最主要的速生豐產(chǎn)林樹種之一[1]。楊樹具有速生、易繁殖、適應(yīng)性強(qiáng)和生產(chǎn)力高等特性,在木材加工、碳匯造林、制漿造紙和生物燃料等方面發(fā)揮著重要作用[2-4]。目前,我國許多楊樹人工林種植園生長在氮素貧瘠的地區(qū)[5],易導(dǎo)致楊樹人工林生產(chǎn)力低下,原材料利用率不高,產(chǎn)品質(zhì)量差等問題。因此,開展楊樹根系響應(yīng)氮素分子調(diào)控機(jī)制的研究,可以實(shí)現(xiàn)楊樹人工林氮素高效利用的經(jīng)濟(jì)效益,意義重大。
氮素是植物生長發(fā)育所必需的大量礦質(zhì)營養(yǎng)元素之一,是蛋白質(zhì)、核酸、葉綠素等重要物質(zhì)的組成成分[6]。植物根系是吸收硝態(tài)氮或銨態(tài)氮的主要器官,良好的根系形態(tài)對植物氮素高效吸收利用至關(guān)重要[7]。有研究表明,植物可通過對外界不同氮形態(tài)響應(yīng)做出反應(yīng),從而改變根系形態(tài)并逐漸做出相應(yīng)的適應(yīng)[8-12]。Wei等研究表明,楊樹根系形態(tài)對低硝態(tài)氮處理響應(yīng)的初期表現(xiàn)是加快增加主根長度,隨后加速側(cè)根增殖,在低硝態(tài)氮處理2~4 d后,根系生物活性顯著增加,其根長和側(cè)根數(shù)顯著高于對照[5]。類似的動(dòng)態(tài)響應(yīng)在玉米(Zea maysL.)中也有報(bào)道[13]。上述研究結(jié)果表明:植物根系有能夠根據(jù)不同氮形態(tài)供應(yīng)而改變其形態(tài)的能力[14]。
除植物根系形態(tài)發(fā)生變化外,分子水平調(diào)節(jié)在植物響應(yīng)不同氮形態(tài)吸收同化過程中也發(fā)揮著重要作用,特別是來自具有調(diào)控功能的miRNAs 的調(diào)節(jié)[15-16]。miRNAs 是一類廣泛存在于真核生物中,長約18~24個(gè)堿基(nt)的高度保守小分子RNAs[17]。利用小RNA 高通量測序技術(shù)并結(jié)合生物信息學(xué)分析,前人研究中已鑒定出大量參與氮素吸收同化響應(yīng)相關(guān)的miRNAs[16,18-19],其中,部分miRNAs 也參與了植物根生長和發(fā)育過程[16,20-21]。如在擬南芥(Arabidopsis thaliana(L.) Heynh.)根中柱鞘細(xì)胞中,5 mmol·L?1硝態(tài)氮可以抑制miR167 的表達(dá),從而提高靶基因auxin response factor 8(ARF8)的表達(dá)水平,促進(jìn)擬南芥?zhèn)雀鹗己碗S后的萌發(fā)[20,22]。在水稻(Oryza sativaL.)中,miR396 的靶基因growth-regulating factor 4(GRF4) 能夠促使水稻根系吸收銨態(tài)氮從而改變水稻根系結(jié)構(gòu)[23];而miRNA 調(diào)控機(jī)制在不同氮形態(tài)處理?xiàng)顦涓馍洗嬖谠鯓拥牟町惐磉_(dá)模式尚不清楚,值得深入研究。
綜上所述,本研究以灰楊(Populus×canescens)根尖為試材,利用小RNAs 高通量測序技術(shù),分析根尖差異表達(dá)的miRNAs,并結(jié)合降解組和轉(zhuǎn)錄組測序結(jié)果,分析miRNAs 靶基因的差異表達(dá)模式,闡明楊樹根尖對硝態(tài)氮或銨態(tài)氮處理?xiàng)l件下miRNAs及其靶基因的表達(dá)調(diào)控機(jī)制。本研究成果可為培育氮素吸收利用效率高的林木奠定理論基礎(chǔ),具有理論與實(shí)踐意義。
1 材料和方法
1.1 試驗(yàn)材料
將灰楊組培苗在組培室 (白天/黑夜溫度25℃/18℃,相對濕度50%~60%,光照長度14 h,光照強(qiáng)度150 μmol·m?2·s?1) 中培養(yǎng)4 周。隨后,將生根的灰楊植株種植在10 L 的花盆里進(jìn)行砂培。每株植株隔天澆50 mL Long Ashton (LA)營養(yǎng)液(0.5 mmol·L?1NH4NO3、0.5 mmol·L?1KCl、0.9 mmol·L?1CaCl2、0.3 mmol·L?1MgSO4、0.6 mmol·L?1KH2PO4、42 μmol·L?1K2HPO4、10 μmol·L?1Fe-EDTA、2 μmol·L?1MnSO4、10 μmol·L?1H3BO3、7 μmol·L?1Na2MoO4、0.05 μmol·L?1CoSO4、0.2 μmol·L?1ZnSO4和0.2 μmol·L?1CuSO4,pH 5.5)。砂培植株在溫室(與組培室氣候條件相同)中培養(yǎng)14 d 后,具有相似高度(株高約30 cm)的植株被選擇并分成2 組(每組24株植物)。水培1~2 周后,將這2 組植株移植到分別添加等量氮供應(yīng)的0.5 mmol·L?1NaNO3(硝態(tài)氮)和0.5 mmol·L?1NH4Cl (銨態(tài)氮) 代替0.5 mmol·L?1NH4NO3的改良LA 營養(yǎng)液中進(jìn)行水培,培養(yǎng)時(shí)間為10 d。在處理10 d后對其進(jìn)行根系形態(tài)特征分析,然后選取根尖40 mm 進(jìn)行收獲。所有收獲樣品迅速置于液氮中,放于?80℃冰箱備用。為了獲得足夠的材料進(jìn)行進(jìn)一步分析,將8株植物的樣本均勻混合作為一個(gè)重復(fù),每種處理水平3個(gè)生物學(xué)重復(fù)。
1.2 試驗(yàn)方法
1.2.1 根系形態(tài)特征分析 試驗(yàn)苗進(jìn)行硝態(tài)氮或銨態(tài)氮處理后,對灰楊根系形態(tài)構(gòu)型進(jìn)行監(jiān)測,包括測量根系長度,二級可見側(cè)根發(fā)生位置等指標(biāo)。
1.2.2 不同處理水平根尖小RNA 測序 不同處理水平根尖小RNAs 測序按照Illumina 公司提供的標(biāo)準(zhǔn)步驟執(zhí)行。簡單來說,將2種不同氮形態(tài)處理下的樣品,每個(gè)處理3個(gè)重復(fù)分別利用RNA 提取試劑盒提取總RNAs (TRK1001,聯(lián)川生物技術(shù)公司,杭州,中國),將提取的總RNAs 質(zhì)量檢測后,利用miRNA 特有的5′端磷酸基團(tuán)和3′端羥基基團(tuán)屬性,將一個(gè)腺苷化單鏈DNA 3′接頭和5′接頭相繼連接到小RNAs 上,通過與3′端互補(bǔ)的RT 引物進(jìn)行反轉(zhuǎn)錄反應(yīng),對反轉(zhuǎn)錄產(chǎn)生的cDNA序列進(jìn)行PCR 擴(kuò)增。隨后通過6% polyacrylamideTris-borate-EDTA 切膠回收的方式對140~160 bp 長度范圍的PCR 產(chǎn)物進(jìn)行膠回收,最后利用杭州聯(lián)川生物技術(shù)公司Illumina HiSeqTM2000 高通量測序技術(shù)進(jìn)行小RNA 測序分析。
1.2.3 miRNAs 測序結(jié)果分析 將測得的RNAs 序列使用聯(lián)川生物技術(shù)公司開發(fā)的軟件進(jìn)行分析。首先,去除低質(zhì)量的序列,保留干凈的唯一的序列進(jìn)行分析,將剩余序列比對RFam 數(shù)據(jù)庫和重復(fù)序列數(shù)據(jù)庫用以去除rRNA、tRNA、snRNA 和snoRNA等,過濾后的數(shù)據(jù)使用已有的灰楊基因組數(shù)據(jù)庫(http://aspendb.uga.edu/index.php/databases/spta-717-genome)、miRNAs 數(shù)據(jù)庫(http://www.mirbase.org/)進(jìn)行比對,篩選出已知miRNAs。針對新的miRNAs 序列,利用miRNA 前體的標(biāo)志性發(fā)夾結(jié)構(gòu),通過Mfold 軟件(http://rna.tbi.univie.ac.at/cgibin/RNAfold.cgi)分析RNA 二級結(jié)構(gòu),鑒定新的miRNAs。
1.2.4 miRNAs 靶基因分析 把等量的每個(gè)處理水平的3個(gè)重復(fù)樣品合并,共2個(gè)處理水平的合并樣品利用聯(lián)川生物技術(shù)公司Illumina HiSeq2500 技術(shù)平臺進(jìn)行降解組測序,采用CleaveLand 軟件(3.0.1版本)預(yù)測miRNAs 的靶基因。為了進(jìn)一步挖掘靶基因的表達(dá)水平,6個(gè)cDNA 文庫被構(gòu)建,利用轉(zhuǎn)錄組數(shù)據(jù)Hiseq 測序平臺分析相關(guān)miRNAs 靶基因的表達(dá)模式,同時(shí)結(jié)合生物信息學(xué)Kyoto Encyclopedia of Genes and Genomes (KEGG)軟件和MapMan 軟件,分析差異表達(dá)miRNAs 靶基因的生物學(xué)功能。
1.2.5 熒光定量PCR 引物設(shè)計(jì)及合成 根據(jù)灰楊數(shù)據(jù)庫,利用Primer Premier 3.0 軟件設(shè)計(jì)引物并由上海生工生物工程有限公司合成相關(guān)miRNAs 和靶基因的引物。5.8s rRNA 和Actin 分別作為miRNAs和靶基因的內(nèi)參基因。序列見表1。
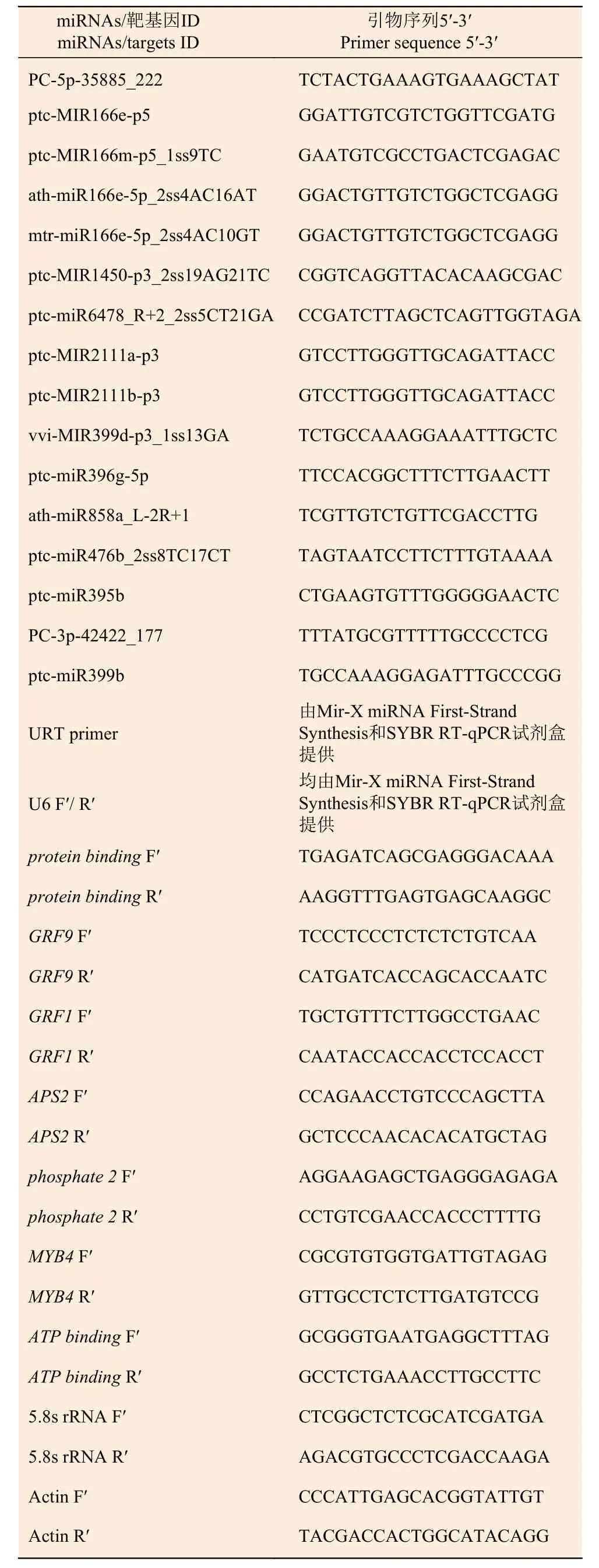
表1 RT-qPCR 引物序列Table 1 Primers used for RT-qPCR
1.2.6 統(tǒng)計(jì)分析 使用Statgraphics 軟件(STN,St Louis,MO,USA)進(jìn)行數(shù)據(jù)統(tǒng)計(jì)分析。在進(jìn)行統(tǒng)計(jì)分析之前,先對數(shù)據(jù)進(jìn)行正態(tài)性檢驗(yàn)。所有數(shù)據(jù)均采用單因素方差分析(ANOVA),以P<0.05 作為統(tǒng)計(jì)意義上的顯著水平。
利用transcripts per million(TPM)對miRNAs表達(dá)水平進(jìn)行定量。使用miRNA 在銨態(tài)氮處理下的TPM 除以硝態(tài)氮處理下的TPM 來計(jì)算miRNA的差異倍數(shù)(FC)。差異表達(dá)miRNAs 篩選閾值為P<0.05。
采用Fragments Per Kilobase of exon per Million mapped (FPKM)對靶基因mRNAs 表達(dá)水平進(jìn)行定量。基于FPKM 值,使用Ballgown package 計(jì)算mRNAs 的差異表達(dá)水平。使用mRNAs 在銨態(tài)氮處理下的FPKM 除以硝態(tài)氮處理下FPKM 來計(jì)算這個(gè)基因的差異倍數(shù)(FC)。差異表達(dá)mRNAs 篩選閾值為log2(FC) ≥1 或≤ ?1,P<0.05。
對于RT-qPCR 的測定,將qPCR 得到的Ct 值進(jìn)行歸一化,計(jì)算miRNAs 及其靶基因的相對表達(dá)量。
2 結(jié)果與分析
2.1 根系形態(tài)特征分析
由圖1 可知:在不同氮形態(tài)處理?xiàng)l件下灰楊根的形態(tài)特征具有顯著差別。測量表明,硝態(tài)氮處理下的根長為27.5 cm,比銨態(tài)氮處理的14.3 cm 幾乎長1 倍(p<0.001),但2種處理水平下其二級側(cè)根發(fā)生位置比較一致。這說明不同氮形態(tài)處理對根系生長發(fā)育的影響不同。選取二級側(cè)根形成前的根尖部分(40 mm)進(jìn)行后續(xù)分子實(shí)驗(yàn)。
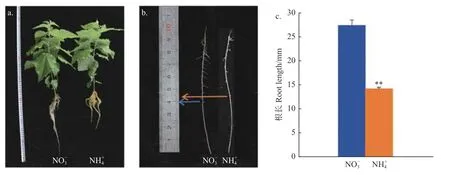
圖1 不同氮形態(tài)處理灰楊根系的表型Fig.1 Morphological parameters of P.×canescens roots with different nitrogen forms
2.2 miRNAs 深度測序數(shù)據(jù)分析
基于上述根尖形態(tài)特征分析的結(jié)果,進(jìn)行高通量小RNAs 測序分析。測序結(jié)果顯示:2個(gè)處理水平的測序分別得到的原始序列讀數(shù)為5 752 458 和7 800 546,進(jìn)行數(shù)據(jù)處理和雜質(zhì)的過濾,去掉低質(zhì)量序列和3′、5′缺失序列等,分別獲得1 996 697和2 608 788 條干凈序列(表2)。長度在18~25 nt的序列被保留下來做進(jìn)一步研究。
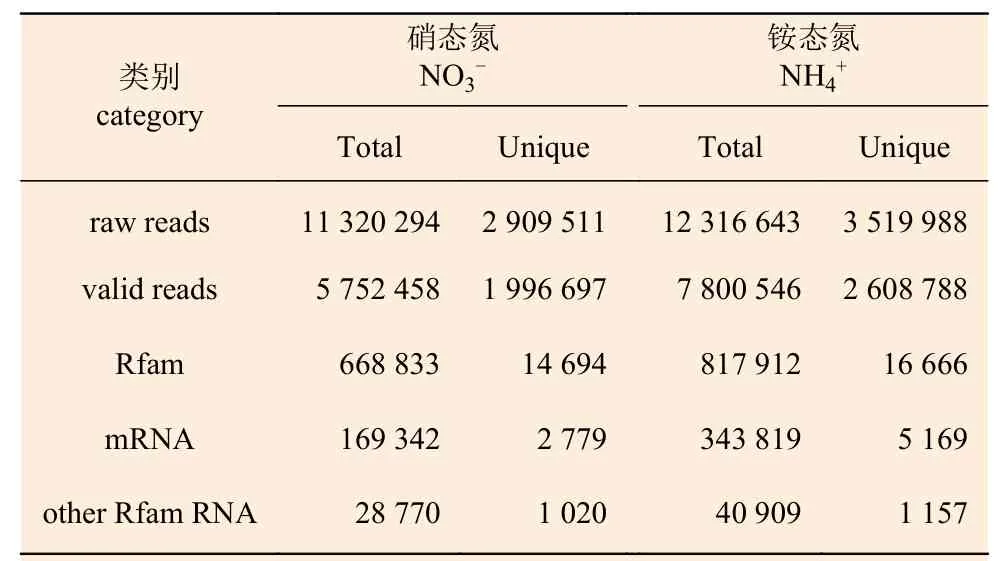
表2 小RNA 文庫測序數(shù)據(jù)統(tǒng)計(jì)Table 2 Distribution of small RNAs in different categories
2.3 已知和新的miRNAs 鑒定
在不同氮形態(tài)處理下,共鑒定灰楊523個(gè)已知的miRNAs 和42個(gè)新的miRNAs (表3)。研究表明,植物miRNAs 長度大多在21 nt 或22 nt,統(tǒng)計(jì)本實(shí)驗(yàn)2個(gè)處理水平miRNAs 文庫中所有18~25 nt 的miRNAs 長度,21-nt miRNA 出現(xiàn)頻率最高 (圖2),這說明該測序數(shù)據(jù)可靠。
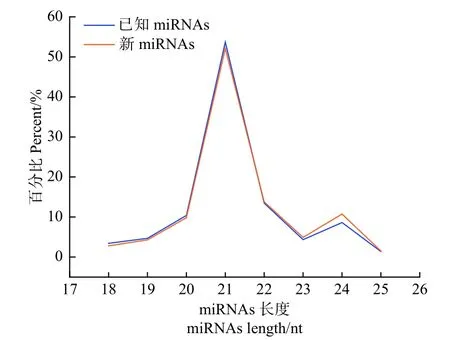
圖2 灰楊根尖已知和新miRNAs 長度分布Fig.2 Lengths of known and novel miRNAs in root tips of P.×canescens.
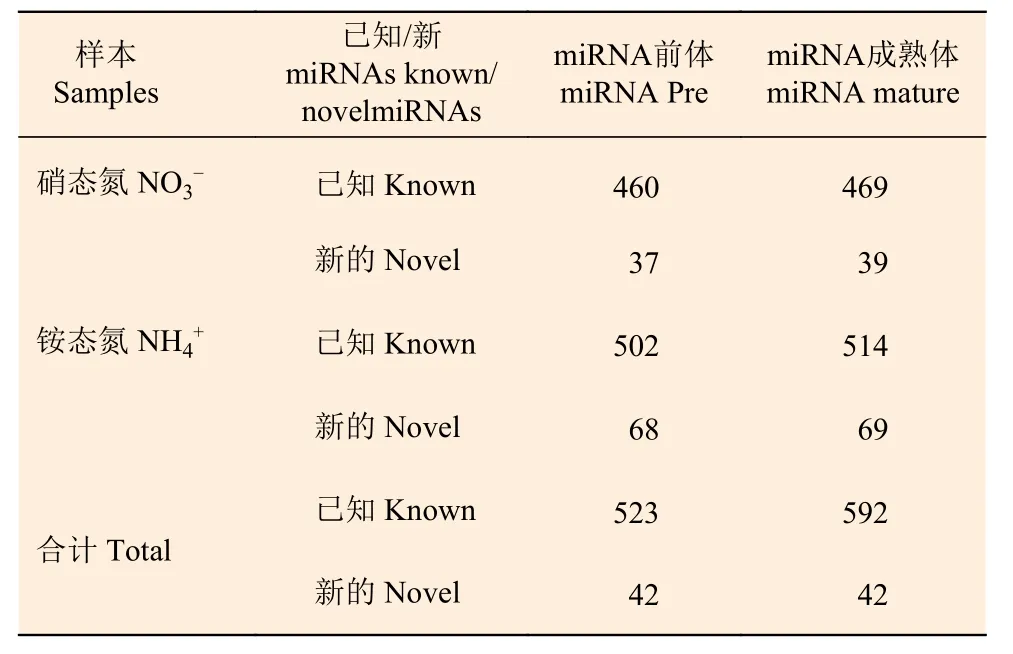
表3 基于高通量測序技術(shù)鑒定灰楊根尖已知和新的miRNAs 數(shù)量Table 3 The number of identified known and novel miRNAs in root tips of P.×canescens based on high-throughput sequencing
2.4 不同氮形態(tài)處理下灰楊根尖miRNAs 差異表達(dá)
為了解不同氮形態(tài)處理下,灰楊根尖對miRNAs的響應(yīng),對篩選出來的灰楊中已知miRNAs 和新miRNAs 的表達(dá)量進(jìn)行計(jì)算。分析表明:灰楊根尖共有96個(gè)miRNAs (p<0.05)在不同氮形態(tài)處理下展示出不同的表達(dá)模式,其中,包括33個(gè)已知miRNAs 家族和9個(gè)新的miRNAs。相比較于硝態(tài)氮處理,銨態(tài)氮處理有44個(gè)上調(diào)表達(dá)的miRNAs和52個(gè)下調(diào)表達(dá)的miRNAs (圖3a),其中29個(gè)顯著差異表達(dá)的miRNAs (p<0.001)見表4。
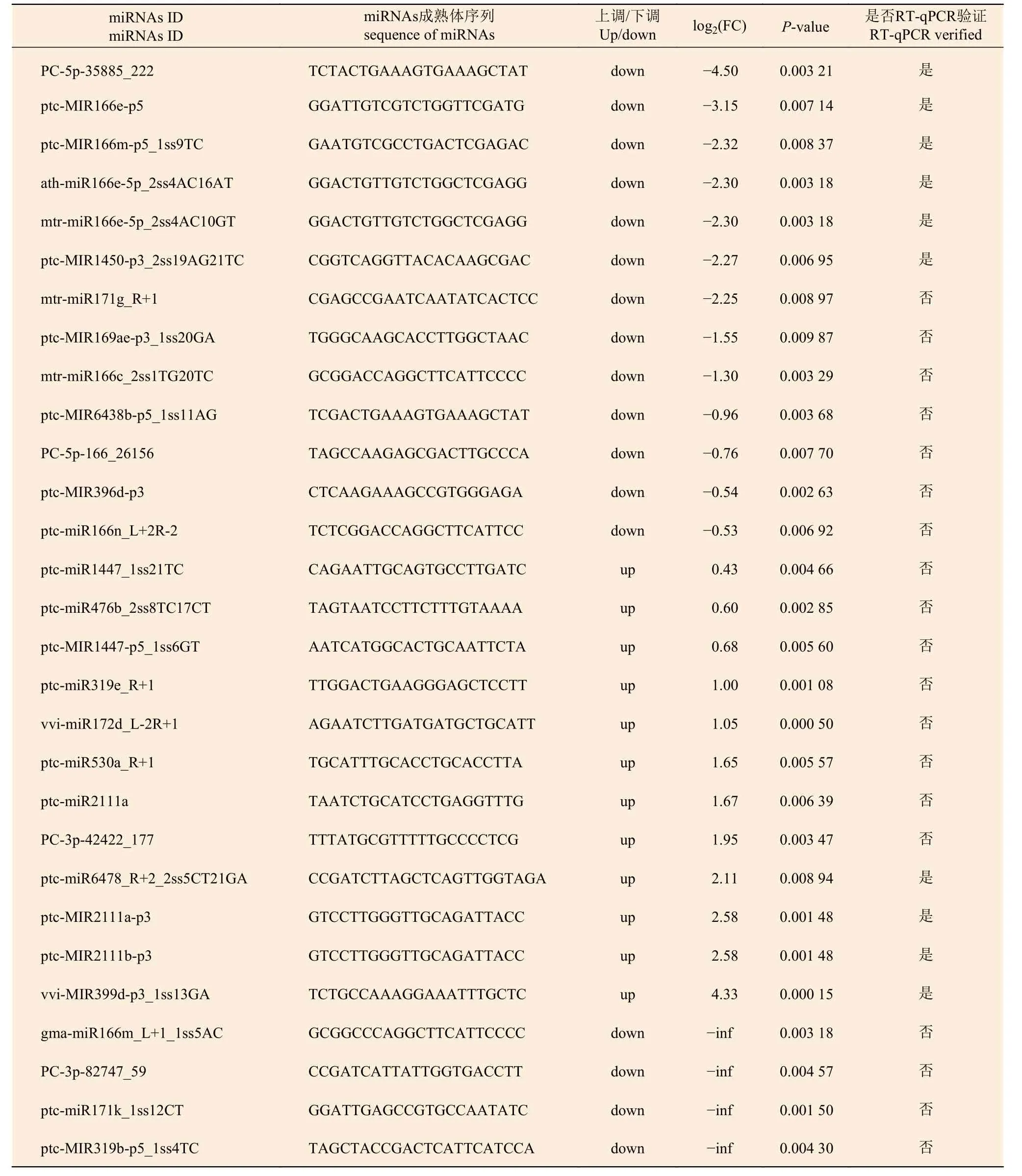
表4 29個(gè)顯著差異表達(dá)miRNAsTable 4 twenty-nine significantly differentially expressed miRNAs
同時(shí),隨機(jī)挑選了10個(gè)顯著差異表達(dá)miRNAs,利用RT-qPCR 進(jìn)一步證實(shí)了測序結(jié)果的可靠性(圖3b)。雖然miRNAs 表達(dá)水平的差異與測序得到的差異并不一致,但上調(diào)或下調(diào)表達(dá)的趨勢是相似的。2種技術(shù)在比率方面的差異是由2種技術(shù)的算法和靈敏度的本質(zhì)不同造成的。總體而言,本研究測序結(jié)果的可靠性較高。
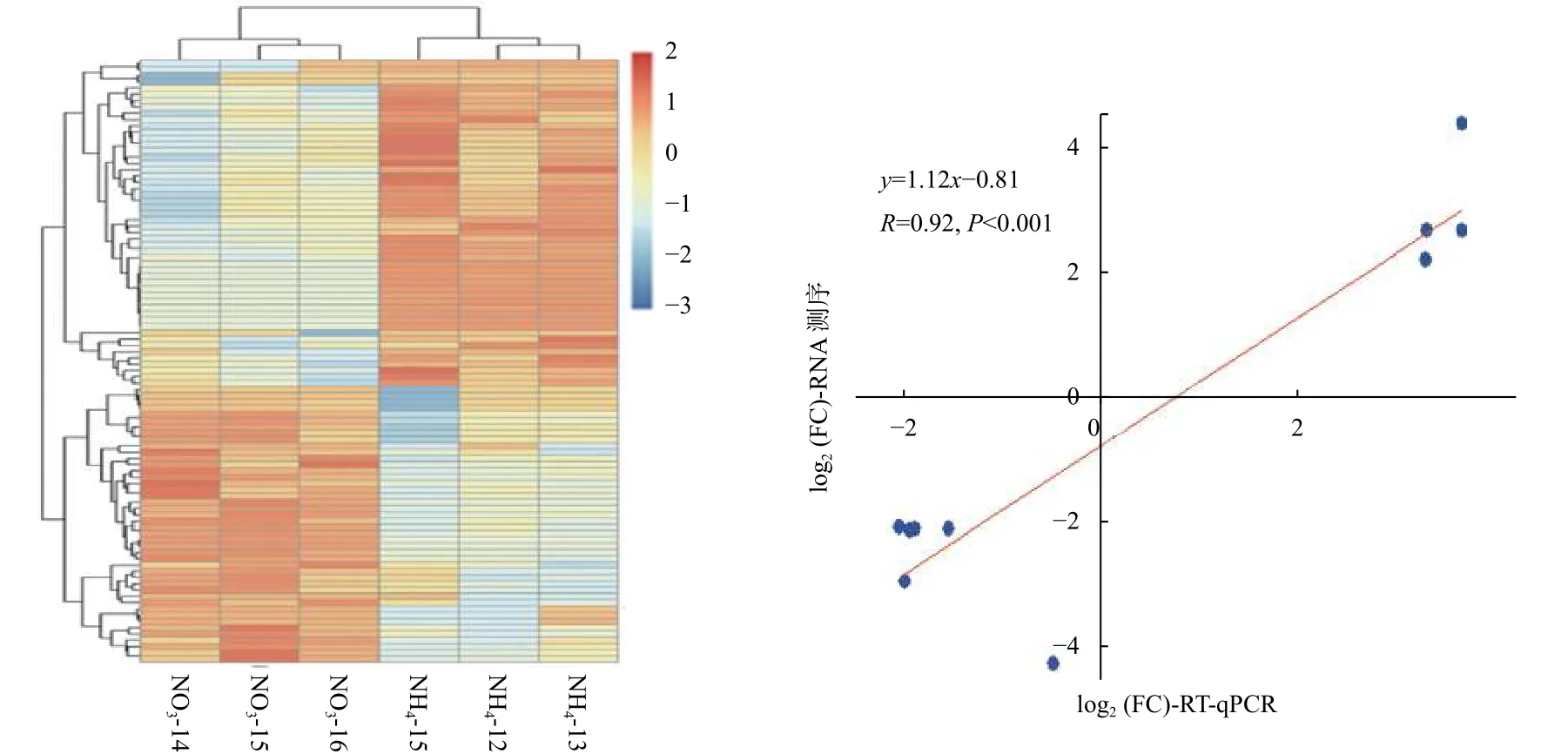
圖3 不同氮形態(tài)處理?xiàng)l件下灰楊根尖差異表達(dá)的miRNAsFig.3 Significantly differentially expressed miRNAs in root tips of P.×canescens under different nitrogen forms treatments
2.5 不同氮形態(tài)處理下灰楊根尖靶基因的功能
為了進(jìn)一步了解miRNAs 的作用,分別使用等量的總RNA 樣本對硝態(tài)氮和銨態(tài)氮2個(gè)混合降解組池進(jìn)行測序,以識別miRNAs 靶基因。結(jié)果表明:分別有67.13%和65.37%去除冗余的reads 可以比對到灰楊數(shù)據(jù)庫中。從降解組中共鑒定出2729個(gè)靶基因位點(diǎn),其中,2104個(gè)靶基因顯著差異表達(dá)。為了進(jìn)一步了解上述靶基因的功能,對識別出的2104個(gè)顯著差異表達(dá)靶基因進(jìn)行KEGG 通路分析(圖4);同時(shí)MapMan 分析進(jìn)一步揭示了這些差異靶基因在氮代謝過程中以及植物生長發(fā)育過程中參與的各種生物學(xué)過程,如ptc-miR166i-p5 有4個(gè)靶基因potri.015g017500.1/2/3/4均屬于NADH依賴的谷氨酸合成酶(NADH-dependent glutamate synthase family) 蛋白參與氮代謝過程。gra-MIR8723bp3_2ss6TC21TC 有3個(gè)靶基因Potri.003G111500.1/2/3均作為硝態(tài)氮轉(zhuǎn)運(yùn)體基因(nitrate transmembrane transporter1.1/NRT1.1) 在硝態(tài)氮運(yùn)輸中起到關(guān)鍵作用。ptc-MIR6462a-p5_1ss14TC 的靶基因Potri.005 G079200.1、gma-miR6300_1ss5TG和gma-miR6300_R+1_1ss5TG的靶基因Potri.001G300900.1/2均 編碼氨基酸運(yùn)輸或代謝相關(guān)蛋白,也對氮代謝有所響應(yīng) (表5);同時(shí),與植物生長發(fā)育相關(guān)的一些miRNA的靶基因也相繼被發(fā)現(xiàn)。如miR164 家族的多個(gè)靶基因均屬于NAC基因家族成員,其在植物生長發(fā)育過程中發(fā)揮重要功能 (表5)。

表5 灰楊根尖氮代謝以及生長發(fā)育相關(guān)差異表達(dá)靶基因Table 5 Significantly differentially expressed target genes related to nitrogen metabolism and growth and development of P.×canescens root tips

圖4 KEGG 通路分析鑒定差異表達(dá)靶基因Fig.4 KEGG pathway analysis of significantly differentially expressed target genes
2.6 不同氮形態(tài)處理下灰楊根尖miRNAs-靶基因調(diào)控網(wǎng)絡(luò)
為了研究不同氮形態(tài)處理下,楊樹根尖差異表達(dá)miRNAs 與靶基因調(diào)控網(wǎng)絡(luò),利用上述結(jié)果進(jìn)行聯(lián)合分析。表6 表明:有23個(gè)差異表達(dá)靶基因(log2(FC)≥1或≤?1,P<0.05) 隸屬于5個(gè)miRNA家族和一個(gè)新的miRNA (P<0.05)被鑒定,且miRNA-靶基因呈現(xiàn)負(fù)相關(guān)調(diào)控關(guān)系,表明這些靶基因可能是通過miRNAs 轉(zhuǎn)錄抑制作用而被降解。
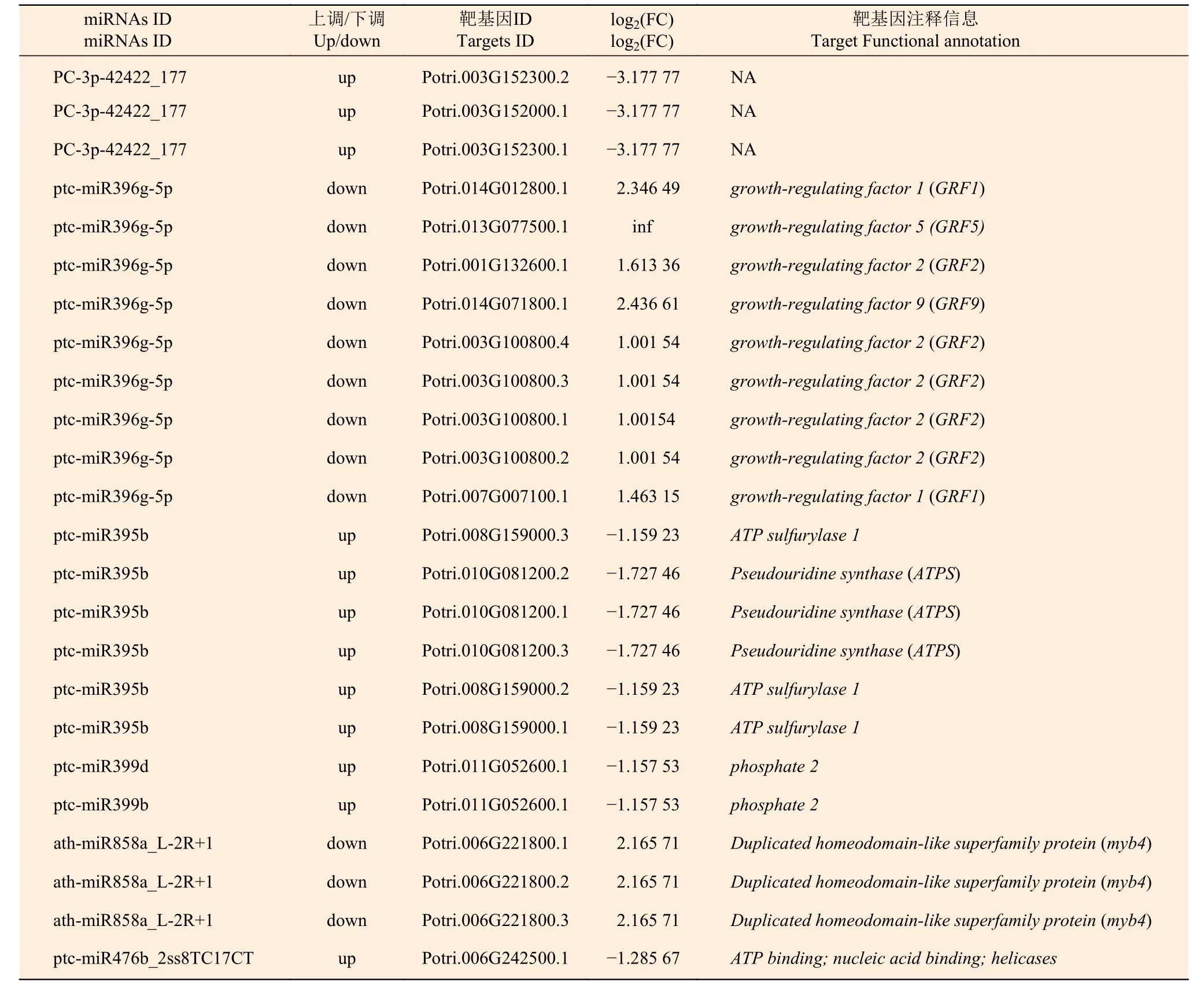
表6 不同氮形態(tài)處理?xiàng)l件下灰楊根尖差異表達(dá)miRNA-靶基因Table 6 Significantly differentially expressed miRNAs-target pairs in root tips of P.×canescens under different nitrogen forms treatments
通過RT-qPCR 實(shí)驗(yàn)驗(yàn)證了其中7個(gè)miRNA-靶基因的表達(dá)模式,結(jié)果顯示:差異表達(dá)miRNAs及其靶基因RT-qPCR 分析與高通量測序產(chǎn)生的表達(dá)模式相似,且表達(dá)模式呈負(fù)相關(guān)關(guān)系 (圖5)。
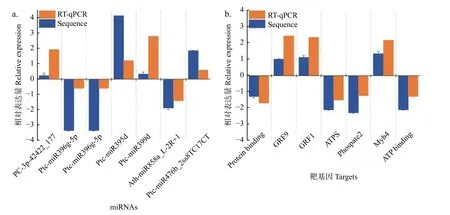
圖5 不同氮形態(tài)處理下miRNAs-靶基因?qū)Σ町惐磉_(dá)分析Fig.5 Validation of significantly differentially expressed miRNAs and their targets under different nitrogen forms treatments by sRNA-seq and RT-qPCR
3 討論
研究表明,基因的表達(dá)受miRNAs 調(diào)節(jié),不同氮形態(tài)可能導(dǎo)致miRNAs 及其調(diào)控的靶基因差異表達(dá),從而影響植物根尖生長和發(fā)育[24]。本研究利用高通量測序平臺研究不同氮形態(tài)處理下,楊樹根尖差異miRNAs 和靶基因的表達(dá)模式。
在不同氮形態(tài)處理10 d 后,收獲楊樹根尖40 mm 區(qū)段材料,經(jīng)過小RNA 高通量測序分析,獲得96個(gè)顯著差異表達(dá)miRNAs,其中,vvi-MIR399dp3_1ss13GA 上調(diào)表達(dá)倍數(shù)最高。前人研究表明,miR399 參與調(diào)控水稻多種營養(yǎng)饑餓反應(yīng)[25]。在本研究中,miR399 靶基因?yàn)榉核鼗B接酶,且與miR399 呈負(fù)相關(guān)關(guān)系。有研究證明,泛素分子主要通過泛素活化酶、泛素結(jié)合酶和泛素化連接酶將靶蛋白泛素化,泛素化的蛋白最后被26S 蛋白酶體識別和降解[26],該過程對植物營養(yǎng)缺乏等非生物脅迫發(fā)揮著重要作用[27]。因此,可以推測miR399 及其靶基因泛素化連接酶在不同氮形態(tài)脅迫響應(yīng)中發(fā)揮著重要的調(diào)控作用。在本試驗(yàn)條件下,部分差異表達(dá)miRNAs 與楊樹根尖生長發(fā)育相關(guān),這與在水稻中的研究結(jié)果相似[15]。如miR171 家族成員,其靶基因之一是DELLA protein RHT-1。DELLA蛋白家族是GA 信號途徑中的負(fù)調(diào)控因子,可以抑制GA 途徑的基因表達(dá)從而抑制植物生長[28]。另有研究表明,DELLA-GRF4介導(dǎo)植物生長與氮代謝的協(xié)同調(diào)控機(jī)制,DELLA的積累不僅導(dǎo)致水稻生長矮化,而且降低了氮素利用效率[23]。在本研究中,相比較于硝態(tài)氮處理,銨態(tài)氮處理誘導(dǎo)miR171 靶基因DELLA表達(dá),從而導(dǎo)致楊樹根尖發(fā)育受到抑制,根長變短。該研究說明楊樹根尖部分差異表達(dá)miRNAs 及其靶基因有通過對不同氮形態(tài)處理的響應(yīng)而改變其根尖形態(tài)結(jié)構(gòu)的能力。
對差異靶基因KEGG 通路分析表明,一些靶基因富集參與氮代謝途徑,如NADH-dependent glutamate synthase family protein和nitrate transmembrane transporter(NRT1.1) 。NADHdependent glutamate synthase family protein酶作為銨態(tài)氮吸收同化過程中的關(guān)鍵酶對植物幼苗期根系的初級銨同化很重要[29]。另有研究表明,在水稻NADH-gogat1突變體中,相比較于1 mmol·L?1硝態(tài)氮處理,1 mmol·L?1銨態(tài)氮處理抑制其根系的生長[29],該研究結(jié)果與本研究結(jié)果相一致。相比較于硝態(tài)氮處理,銨態(tài)氮處理抑制靶基因NADH-dependent glutamate synthase family protein表達(dá),從而導(dǎo)致楊樹根尖發(fā)育受到抑制,這表明NADH-dependentglutamate synthase family protein 可能在植物根尖響應(yīng)不同氮形態(tài)時(shí)發(fā)揮重要的作用。NRT1.1作為硝態(tài)氮轉(zhuǎn)運(yùn)體對硝態(tài)氮的反應(yīng)范圍廣泛,從初始硝酸鹽反應(yīng)到長期發(fā)育變化,且對側(cè)根發(fā)育的影響發(fā)揮著重大作用,即NRT1.1在低濃度硝態(tài)氮條件下抑制側(cè)根生長,而在高濃度硝態(tài)氮條件下促進(jìn)植物側(cè)根生長[30],該結(jié)論與本文研究結(jié)果一致。在本研究中,相比較于硝態(tài)氮處理,銨態(tài)氮處理下靶基因NRT1.1上調(diào)表達(dá),抑制了楊樹側(cè)根的伸長生長。另外,對灰楊根尖氮代謝以及生長發(fā)育相關(guān)差異表達(dá)靶基因進(jìn)行MapMan 分析表明,NAC基因家族出現(xiàn)頻率最多。在擬南芥中,NAC4基因作為protein auxin signaling F-BOX 3(AFB3)的下游基因,參與硝態(tài)氮響應(yīng),從而影響根系形態(tài)結(jié)構(gòu)[31]。在小麥中,TaNAC2-5A可直接結(jié)合硝酸鹽轉(zhuǎn)運(yùn)體和谷氨酰胺合成酶基因的啟動(dòng)子區(qū)域,過表達(dá)TaNAC2-5A可促進(jìn)小麥根系生長和硝酸鹽流入[32]。在本研究中,相比較于銨態(tài)氮處理,硝態(tài)氮處理中NAC1基因高表達(dá),從而促進(jìn)根生長,這一結(jié)論與前人的研究結(jié)果相一致。
在聯(lián)合分析中,共發(fā)現(xiàn)24 對miRNA-靶基因呈負(fù)相關(guān)關(guān)系,其中,miR396-GRF是聯(lián)合分析中出現(xiàn)最多的一組關(guān)系對。GRF4作為miR396 的靶基因能夠驅(qū)動(dòng)水稻根對銨態(tài)氮的吸收[23],同時(shí)GRF4能夠驅(qū)動(dòng)硝態(tài)氮轉(zhuǎn)運(yùn)體的轉(zhuǎn)錄水平,例如NRT1.1B和NRT2.3a、GRF4還能夠驅(qū)動(dòng)硝態(tài)氮同化酶基因nitrate reductase 1(NIA1)、NIA3和nitrite reductase 1(NiR1)的合成從而去調(diào)節(jié)氮代謝,且在水稻中,GRF4突變抑制植物生長[23]。在本研究中,相比較于硝態(tài)氮處理,在銨態(tài)氮處理中miR396下調(diào)表達(dá),其靶基因GRF1/2/5/9均上調(diào)表達(dá),從而促進(jìn)楊樹根生長,這一結(jié)論與前人的研究結(jié)果相一致。該結(jié)果說明miR396-GRF在不同氮形態(tài)脅迫響應(yīng)中發(fā)揮著重要的調(diào)控作用。另外,表達(dá)差異最顯著的靶基因?yàn)樾耺iRNAPC-3p-42422_177 的3個(gè)靶基因,但其功能未知,有待進(jìn)一步研究證實(shí)。
4 結(jié)論
本研究從2種不同氮形態(tài)處理?xiàng)顦涓鈓iRNAs文庫中鑒定出523個(gè)已知miRNAs 和42個(gè)新miRNAs,其中,有96個(gè)miRNAs 顯著差異表達(dá)。與硝態(tài)氮處理相比,銨態(tài)氮處理下有44個(gè)miRNAs 上調(diào)表達(dá),52個(gè)下調(diào)表達(dá),其中,miR396-GRF模塊引起筆者的關(guān)注。研究表明,miR396-GRF模塊可能通過響應(yīng)不同氮形態(tài)調(diào)控楊樹根系形態(tài)構(gòu)型。該研究不僅可以為我國轉(zhuǎn)基因楊樹研究儲備基因資源信息,還可以加快氮吸收能力強(qiáng)的楊樹優(yōu)質(zhì)速生良種的培育。

