鄰氨基苯甲酸重氮化反應熱穩定性及安全評價
康淑荷,王明強,牛振軍,楊永強
(1.西北民族大學 化工學院 環境友好復合材料及生物質利用甘肅省高校重點實驗室,甘肅 蘭州 730030;2.甘肅貝斯化工有限公司,甘肅 蘭州 730000;3.蘭州更新城市建設發展有限公司,甘肅 蘭州 730000)
在低溫條件下伯胺和亞硝酸生成重氮鹽的反應稱為重氮化反應[1].脂肪族伯胺生成的重氮鹽非常不穩定,在合成方面沒有應用價值,而芳香族伯胺生成的芳香重氮鹽低溫下較穩定,通常在水溶液中就能制備,不需要分離即可使用,從而在醫藥、高分子材料、精細化工和染料等方面應用廣泛[2-4].多數芳香重氮鹽5 ℃以下時穩定,干燥或者升溫則易分解.溫度每升高10 ℃,重氮鹽分解速率約為原來的2倍.同時分解放出大量的熱,會引起燃燒或爆炸的可能,因此重氮化反應被國家安監總局列為18種重點監管危險化工工藝之一[5-6].國內外學者對重氮化反應的研究較多[7-11],但有關鄰氨基苯甲酸重氮化工藝的反應熱穩定性及安全評價文獻報道較少.結合工業生產工藝,筆者對鄰氨基苯甲酸重氮化反應熱穩定性(熱穩定性DSC、反應量熱RC1、重氮化反應完成液的絕熱量熱)進行研究并對其安全進行評價,以期能指導現場安全生產.
1 反應原理
鄰氨基苯甲酸重氮化反應方程式為:

反應機理見圖1.該反應為二級反應,在酸性條件下,鹽酸和亞硝酸鹽生成亞硝酸后,親核試劑Cl-通過HNO2轉化為一個更好的親電試劑(NOCl)而催化該反應[2].

圖1 鄰氨基苯甲酸重氮化反應機理
2 實驗材料
鄰氨基苯甲酸、 亞硝酸鈉和鹽酸均為市售工業純(未經進一步處理),水為純化水.反應的主要物料的基本信息見表1.

表1 物料信息
實驗所用主要儀器:DSC1差示掃描量熱儀和帶RC1 軟件的RC1e全自動反應量熱儀(METTLER TOLEDO公司,瑞士);TAC-500A 絕熱加速量熱儀(杭州仰儀科技有限公司).
3 方法
3.1 熱穩定性DSC測定
反應熱測定條件:樣品坩堝為HP plated 25 μL;樣品中量為3.28 mg;溫度為0~480 ℃;升溫速率為10 ℃/min.
3.2 反應量熱RC1測定
常壓下在全自動反應量熱儀RC1e的2 L玻璃反應釜中加入665 g的鹽酸和123 g的鄰氨基苯甲酸,攪拌,待完全溶解后降溫至 2 ℃,穩定校準.保持溫度 2 ℃,然后滴加216 g的NaNO2溶液,滴加時間約為90 min.滴加完畢,保溫60 min.穩定校準,反應量熱測定結束.
3.3 反應完成液的絕熱量熱測定
測定模式為HWS;升溫速率為3 ℃/min;溫度范圍為25~350 ℃;樣品池為不銹鋼球;樣品質量為892.1 mg.
3.4 安全評價依據[5]
依據國家安監總局的安監總管三〔2017〕1 號文件內容及要求,反應安全風險評估主要從五個方面進行安全評價.
3.4.1 物質分解熱、嚴重度和可能性評估
根據物料分解放熱情況,進行風險評估.通過絕熱溫升ΔTad進行嚴重度評估,準則見表2.TMRad表示在絕熱條件下,失控反應最大反應速率到達的時間(致爆時間),用TMRad表示進行評估反應失控發生的可能性,準則見表2[7].

表2 分解熱、嚴重度和可能性評估
3.4.2 矩陣評估
風險矩陣評估見圖2 .
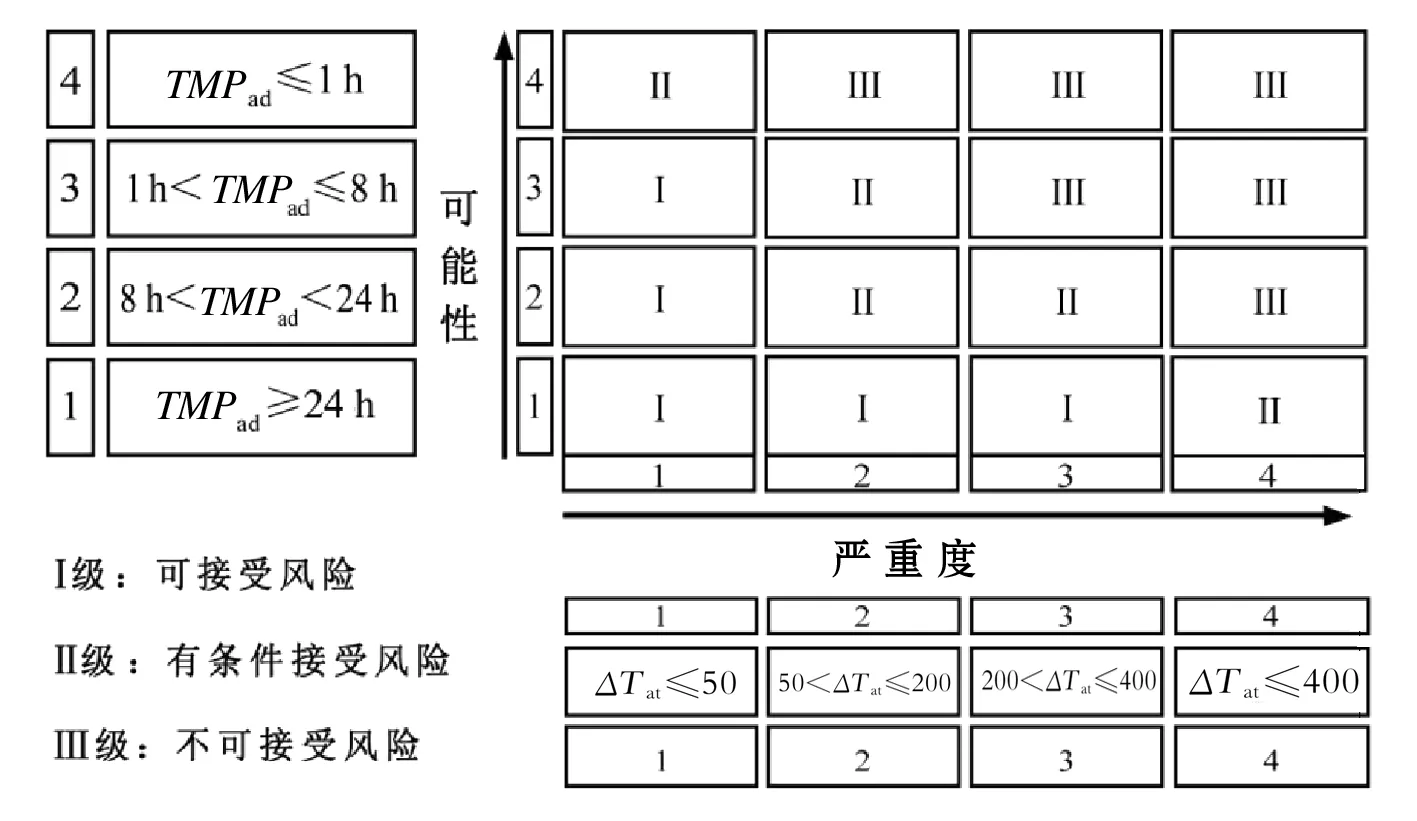
圖2 風險評估矩陣
3.4.3 反應工藝危險度評估
考查工藝操作溫度Tp、技術最高溫度MTT、TD24為失控體系最大反應速率到達時間(用TMRad表示)為24小時時所對應的溫度,以及失控體系可能達到的最高溫度(Maximun Temperature of Synthesis Reaction 簡稱MTSR),評估準則參見表3[5].

表3 反應工藝危險度等級評估
危險程度為1級時,生產中一般無需采取特殊控制措施,但為盡可能降低生產風險,建議配套自動控制系統(DCS),并注意安全管理.危險度為2級及以上時,工業生產中則要強制配套自動控制系統(DCS)和安全切斷系統(SIS).
4 結果與討論
4.1 反應熱
鄰氨基苯甲酸重氮化反應液DSC測定曲線(見圖3)顯示溫度在0~480 ℃時,有1個放熱峰和1個吸熱峰.放熱峰從48.39 ℃開始,到 107.59 ℃結束,放出熱量為188.44 J/g,表明反應液中部分物料不穩定,分解釋放大量熱量,故該反應需要嚴格控制反應溫度.而吸熱峰從219.68 ℃開始,到285.34 ℃結束,吸收熱量為1 178.0 J/g,表明有物料在219.68 ℃時會發生變化,但物料吸收熱量后未引起進一步的熱量變化,故對反應影響不大.

圖3 重氮化反應液 DSC 曲線
4.2 反應量熱
反應加料、放出的熱量、Tcf、熱累積率、熱轉化率數據經RC1e軟件處理,結果見圖4.該反應為滴加工藝.90 min內勻速緩慢滴加物料,加料階段20 min內熱累積率迅速上升,最大可達80.3%,表明反應為熱累積型.若未及時冷卻或散熱不均勻,則反應物料溫度會自動升高,進而引起混合物分解.20 min后熱累積率逐步降低,熱轉化率則持續增大.物料滴加結束后熱轉化率達100%.圖4中放熱過程對時間積分得到重氮化反應的放熱總量為87.747 kJ,參與反應的物料總量為1 004 g.反應的比放熱量按公式(1)計算.

圖4 反應加料、放出的熱量、Tcf、熱累積率、熱轉化率曲線
工業生產工藝為半間歇常壓反應工藝,MTSR為任意時刻冷卻失效情形下停止加料后,累積的熱量可能使體系升高的溫度,又稱Tcf.MTSR除了與熱累積度相關外,還與當時物料的質量M及比熱容Cp相關.圖4顯示該工藝的MTSR=22.5 ℃;MTT為反應體系溶劑或者混合物料的沸點.該工藝生產中以反應體系溶劑的沸點,即水的沸點100 ℃為MTT值[11].
4.3 反應完成液的絕熱量熱
圖5為鄰氨基苯甲酸重氮化反應完成液ARC的時間—溫度—壓力曲線.絕熱量熱實驗測定曲線見圖6所示.選取黑色方框內放熱峰進行分析,在測定溫度范圍內,該段放熱從36.336 ℃開始,到41.136 ℃結束.通過RC1e軟件進行熱力學參數計算,得到具體數據見圖7所示.
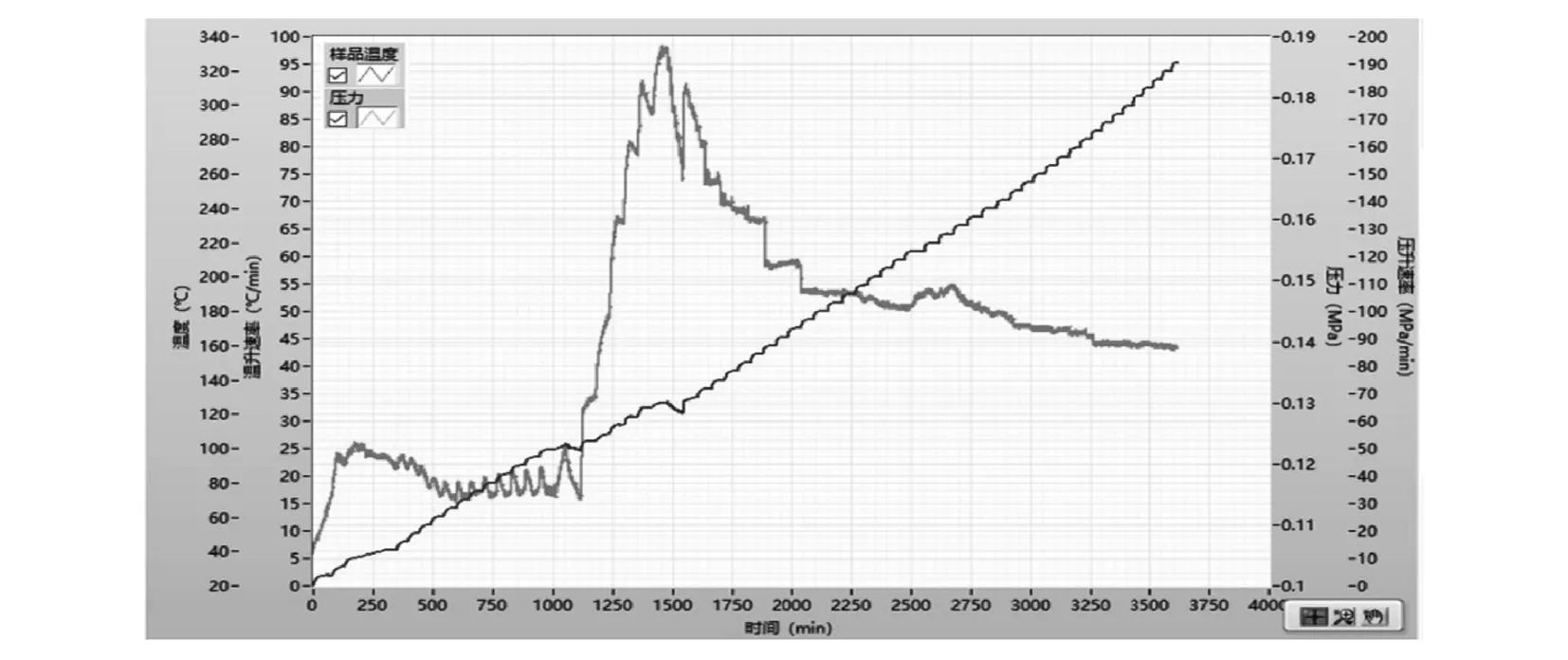
圖5 反應完成液ARC的時間—溫度—壓力曲線
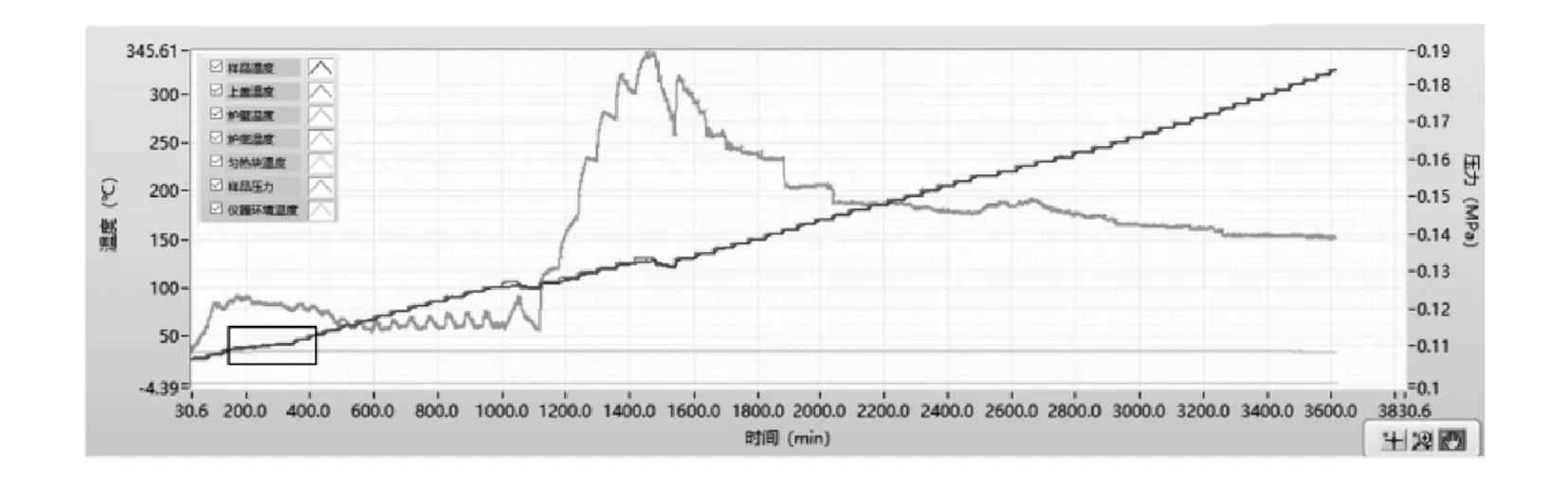
圖6 反應完成液絕熱量熱曲線
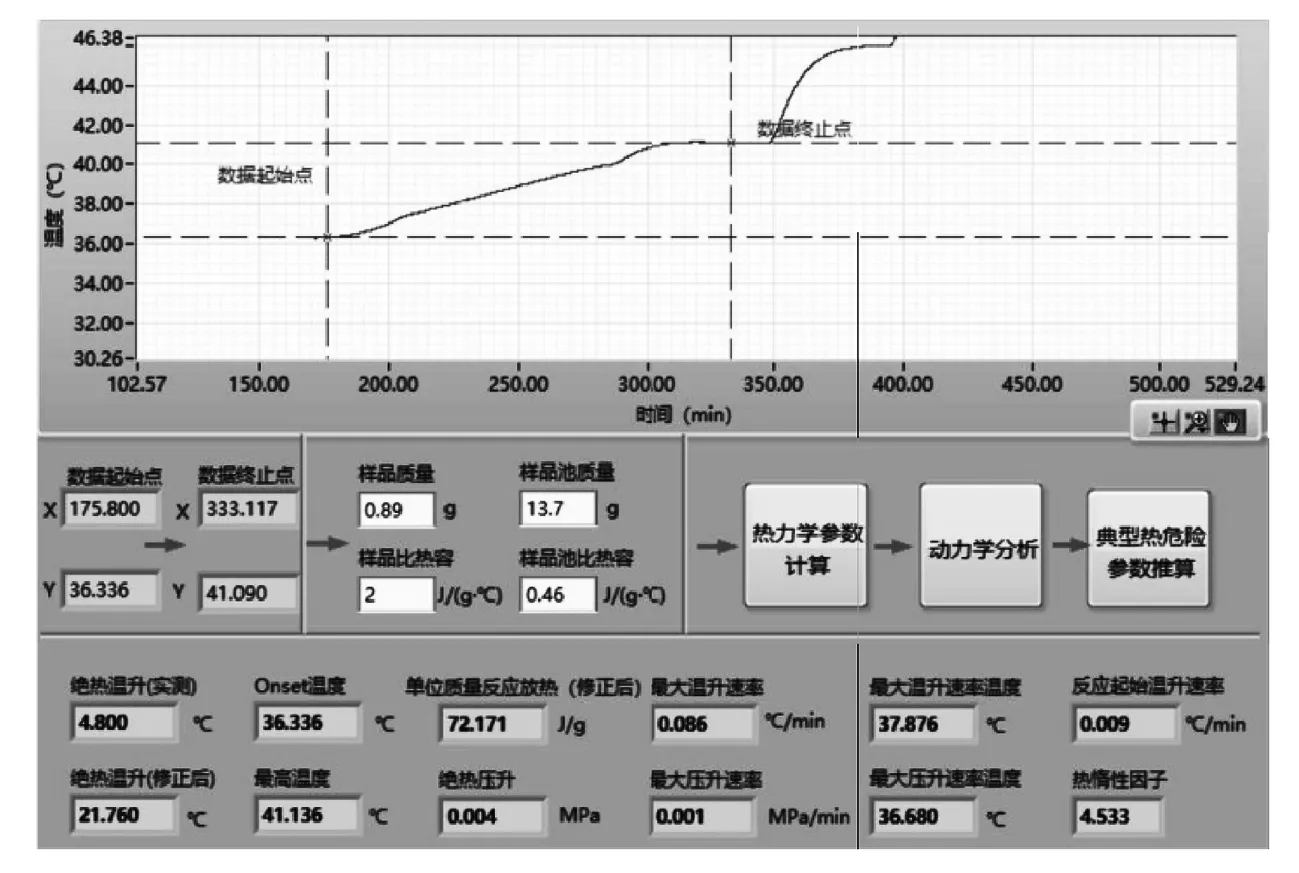
圖7 反應完成液熱力學參數計算
圖5顯示絕熱條件下鄰氨基苯甲酸重氮化反應在測定溫度范圍25~350 ℃內檢測到的1個放熱峰.系統溫度隨時間的延長而升高,系統內壓力隨溫度的升高呈現無明顯規律性變化.
圖7表明,系統的最大絕熱溫升速溫度為37.876 ℃,最大絕熱溫升速率0.086 ℃/min,最大絕熱壓升速率溫度為36.680 ℃,最大絕熱壓升速率0.001 MPa/min.表明絕熱條件下,在開始的600 min內,反應放熱、系統溫度和壓力均增加,但溫度未超過20 ℃.系統壓力稍有增加,小于0.125 MPa,此時若及時移出反應放出的熱量,則不影響安全生產.由于絕熱條件下,反應放出的熱量累積,故600~1 000 min內隨反應時間的延長,溫度持續增加,壓力則相對未發生明顯變化.結合圖8,TD24為29.9 ℃,即絕熱條件下系統內溫度達到29.9 ℃時,該反應液發生二次分解,放熱為72.171 J/g,系統溫度急劇上升,壓力迅速增加.反應進行到1 450 min時,壓力最大達0.19 MPa,表明反應液二次分解放出大量氣體,使系統內壓力增加.反應液二次分解結束后,壓力則保持在0.14 MPa左右,系統溫度則持續增加,最高達到330 ℃,表明該反應液二次分解會放出大量的熱量,因此實際生產中應該嚴格控制溫度.

圖8 反應完成液絕熱實驗TMR計算
生產工藝中MTT=100 ℃.因重氮鹽極不穩定且易分解,反應液必須在充分攪拌的條件下,用冷凍鹽水冷卻,保持反應溫度在10 ℃以內,以免散熱不均,導致局部溫度過高,引起安全事故的發生.該反應技術溫度Tp= 2 ℃,TMRad>24 h.體系最高溫度MTSR=22.5 ℃,TMRad>24 h.
4.4 安全風險評估
4.4.1 分解熱評估
反應完成液分解熱為188.44 J/g<400 J/g.按照3.4.1評估準則,鄰氨基苯甲酸重氮化反應分解熱評估等級為1級,存在潛在爆炸危險.工業生產中要界定物料的安全操作溫度,避免超過規定溫度而引發爆炸事故的發生.
4.4.2 嚴重度和可能性評估
反應體系為常壓反應(無壓力影響),ΔTad=25.9 K<50 K,故按照3.4.1評估準則,該反應過程失控反應嚴重度為1級.表明失控反應的危險性低,反應失控僅可能導致單批次的物料損失.該反應工藝TP= 2 ℃,TMRad>24 h,MTSR=22.5 ℃,TMRad>24 h,依據3.4.2評估準則,鄰氨基苯甲酸重氮化反應失控發生的可能性評估為1級,較少發生反應失控.
4.4.3 風險矩陣評估
反應嚴重度評估結果1級,可能性評估結果1級.按3.4.2評估準則,該反應的風險矩陣評估為1級,為可接受風險,可以采取常規的控制措施,并適當提高安全管理和裝備水平[12].
4.4.4 反應工藝危險度評估
該反應工藝的Tp 鄰氨基苯甲酸重氮化反應的安全風險評估為2級.該工藝過程反應失控后,溫度達不到技術極限(MTSR5 結論

