白楊素調控lncRNA GAS5表達對高糖誘導的人視網膜微血管內皮細胞損傷的影響
何昭華,梁文旺,鐘茜
糖尿病視網膜病變(diabetic retinopathy,DR)是導致成年人視力喪失的主要原因之一,而高血糖被認為是DR 的主要致病因素,并與視網膜微血管內皮細胞凋亡、氧化應激增加有關[1]。白楊素(chrysin)是一種天然的黃酮類化合物,具有抗炎、抗氧化和抗腫瘤特性,其對小鼠局灶性腦缺血再灌注損傷具有保護作用[2]。白楊素與黃芩苷聯用對腎小管損傷、腎功能紊亂具有改善作用[3]。長鏈非編碼RNA(long non-coding RNA,lncRNAs)是長度超過200 nt、蛋白編碼潛力缺失的RNA 轉錄本,因其在細胞增殖、凋亡、氧化應激損傷等生物學過程中的作用而受到廣泛關注。研究顯示[4],上調lncRNA 生長抑制特異性轉錄本5(growth suppression-specific transcript 5,GAS5)表達可改善脂多糖誘導的軟骨損傷。DR患者外周血中lncRNA GAS5 表達降低[5],但白楊素是否調控lncRNA GAS5 表達保護視網膜微血管內皮細胞損傷并不清楚。本研究以高糖刺激人視網膜微血管內皮細胞(human retinal microvascular endothelial cells,HRMECs)構建細胞損傷模型,探討白楊素對該損傷是否具有保護作用,分析其機制是否與調控lncRNA GAS5 表達有關,以期為DR 治療提供有效策略。
1 材料與方法
1.1 實驗材料
HRMECs 細胞購于上海啟達生物科技公司;白楊素(純度≥98%,規格20 mg)購于上海源葉生物科技公司;GAS5小干擾RNA(si-GAS5)及其陰性對照(si-NC)、GAS5 過表達質粒(pcDNA-GAS5)與其空載體質粒(pcDNA)購于北京華大六合基因公司;脂質體2000(Lipofectamine 2000)購于美國Invitrogen公司;逆轉錄試劑盒、SYBR Premix Ex Taq II 試劑盒購于上海生工生物公司;丙二醛(MDA)含量檢測試劑盒、超氧化物岐化酶(superoxide dismutase,SOD)活性檢測試劑盒、膜聯蛋白V(annexin V)-異硫氰酸熒光素(fluorescein isothiocyanate,FITC)/碘化丙啶(propidium iodide,PI)凋亡檢測試劑盒購于北京索萊寶科技公司;細胞計數試劑盒(CCK-8)購于上海貝博生物公司;兔源B 細胞淋巴瘤-2 蛋白(B cell lymphoma 2,Bcl-2)、Bcl 相關x 蛋白(Bcl associated x protein,Bax)、甘油醛-3-磷酸脫氫酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗體以及山羊抗兔IgG購于上海碧云天生物公司。
1.2 細胞培養、轉染
取1×106個HRMECs 細胞接種在24 孔板,當細胞60%匯合時,利用脂質體2000 試劑進行細胞轉染,即將脂質體2000(1 μL)和無血清培養液(50 μL)置于無菌EP 管中室溫靜置5 min,將轉染的RNA(20 pmol 的pcDNA-GAS5 或pcDNA 或si-GAS5 或si-NC)和無血清培養液(50 μL)置于另一無菌EP試管中。將上述兩管溶液混合,室溫靜置20 min,得到RNA與脂質體復合物。將混合物加入含有細胞的培養皿中,37℃+5%CO2條件下轉染培養6 h,更換為完全培養基代替,收獲轉染48 h細胞進行下一步實驗。
1.3 實驗分組
正常組(normal group,NG):用含5.5 mmol/L 葡萄糖的培養液孵育HRMECs 48 h。
高糖組(high glucose group,HG):用含30 mmol/L葡萄糖孵育HRMECs 48 h[6]。
白楊素組(chrysin group,CG):分為3個劑量組,白楊素低劑量組(low dose chrysin group,LCG)、白楊素中劑量(medium dose chrysin group,MCG)、白楊素高劑量(high dose chrysin group,HCG)組:用含30 mmol/L葡萄糖和不同濃度白楊素培養液(12.5、25.0、50.0μmol/L)分別孵育HRMECs 48 h[7]。
pcDNA 組、pcDNA-GAS5 組:用含30 mmol/L 葡萄糖培養液孵育轉染pcDNA 或轉染pcDNA-GAS5細胞48 h。
HCG+si-NC組、HCG+si-GAS5組:用含30 mmol/L葡萄糖和50.0 μmol/L 白楊素的培養液孵育轉染si-NC或轉染si-GAS5細胞48 h。
1.4 觀察指標及方法
1.4.1 細胞中MDA 含量以及SOD 活性 收集各組HRMECs 至EP 管,離心后棄上清。參照試劑盒說明書加入提取液,冰浴、超聲波破碎細胞,4℃離心機10000 rpm 離心10 min,收集上清置于冰上。按照各個試劑盒操作步驟分別測定MDA 水平、SOD 和GSH-Px活性。實驗獨立重復3次。
1.4.2 CCK-8 法檢測細胞活力 將各組HRMECs細胞以1×106個/孔的密度接種96孔板,分別在孵育24、48、72 h時間點向各實驗孔加入10 μL的CCK-8工作液,反應2 h。酶標儀檢測在450 nm 處光密度(OD)值以表示細胞增殖活力。實驗獨立重復3次。
1.4.3 流式細胞術檢測細胞凋亡 收集各組細胞,室溫3000 rpm離心5 min,用預冷的磷酸鹽緩沖液重新懸浮細胞,3000 rpm 離心5~10 min,洗滌后加入300 μL 的結合緩沖液重新懸浮細胞。3000 rpm 離心5~10 min,洗滌后加入300 μL 的結合緩沖液重新懸浮細胞。加入5 μL的Annexin V-FITC,暗室孵育15 min。再加入5 μL的PI,暗室孵育5 min。采用流式細胞儀檢測細胞凋亡情況。實驗獨立重復3次。
1.4.4 免疫印記法檢測Bcl-2 和Bax 蛋白表達 用放射免疫沉淀試驗(radioimmunoprecipitation assay,RIPA)裂解緩沖液處理HRMECs,收集總蛋白,然后用二喹啉甲酸法測定蛋白濃度。采用SDS-PAGE分離細胞蛋白,隨后使用濕轉移法將蛋白條帶轉移到硝酸纖維素膜。用5%脫脂牛奶在室溫下孵育膜1 h,然后孵育用一抗溶液孵育膜過夜。次日,用PBS 和Tween-20溶液(PBST)洗滌3次,再用稀釋的二抗溶液孵育膜2 h,然后用PBST 沖洗三次。將膜置于暗盒內,加入顯影劑顯影。蛋白相對表達量=目的條帶灰度值/GAPDH條帶灰度值。實驗獨立重復3次。
1.4.5 實時定量聚合酶鏈式反應(real-time quantitative polymerase chain reaction,RT-qPCR)檢 測lncRNA GAS5表達 采用Trizol 試劑提取各組細胞的總RNA,取總5 μL RNA 樣本用無RNA 的超純水稀釋20倍,紫外分光光度法在260 nm和280 nm測定光密度(OD)值,以確定RNA 的濃度和純度,如果OD260/OD280值在1.7~2.1之間,則認為RNA合格可用于后續實驗。按照逆轉錄試劑盒將總RNA 反轉錄成cDNA模板,根據SYBR Premix Ex Taq II試劑盒說明書進行RT-qPCR。2-ΔΔCt法計算lncRNA GAS5表達量。引物序列如下(表1),實驗獨立重復3次。
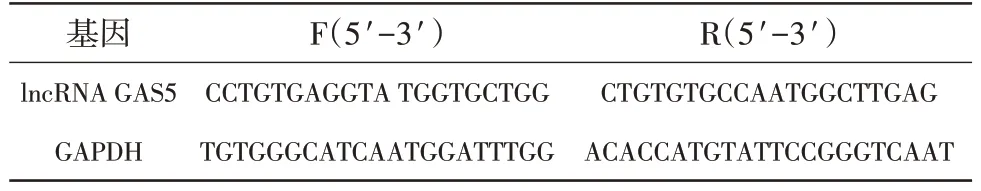
表1 RT-qPCR引物序列
1.5 統計學方法
所有數據采用SPSS 21.0 軟件進行分析。計量資料以均數±標準差()表示。多組間比較采用單因素方差分析,進一步組間兩兩比較采用LSD-t檢驗。當P<0.05時,則認為差異具有統計學意義。
2 結果
2.1 白楊素對高糖誘導的HRMECs氧化損傷的影響
與NG 組比較,HG 組HRMECs 中GAS5 表達量降低(t=45.322,P=0.000),細胞SOD活性降低(t=26.923,P=0.000),MDA含量升高(t=36.123,P=0.000);與HG組比較,MCG組HRMECs中GAS5表達量升高(t=17.391,P=0.000),細胞SOD 活性升高(t=12.231,P=0.000),MDA 含量降低(t=7.510,P=0.002);與HG 組比較,HCG 組HRMECs 中GAS5 表達量升高(t=36.363,P=0.000),細胞SOD 活性升高(t=22.654,P=0.000),MDA 含量降低(t=27.228,P=0.000),差異均有統計學意義(表2)。
表2 對高糖誘導的HRMECs中GAS5表達及氧化損傷的影響(,n=3)
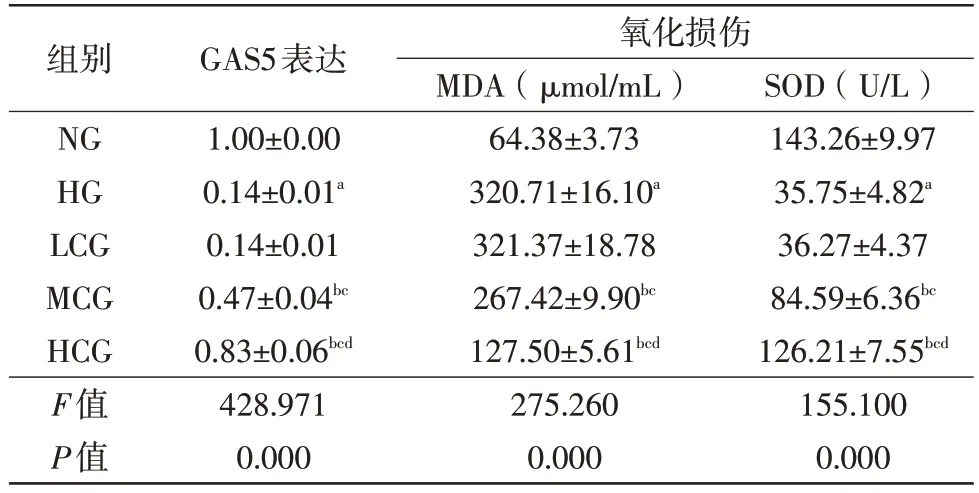
表2 對高糖誘導的HRMECs中GAS5表達及氧化損傷的影響(,n=3)
注:a 與NG相比,P<0.05;b 與HG相比,P<0.05;c 與LCG相比,P<0.05;d與MCG相比,P<0.05。NG 正常組;HG 高糖組;LCG 白楊素低劑量組;MCG 白楊素中劑量組;HCG 白楊素高劑量組;Bcl B細胞淋巴瘤-2蛋白;Bax Bcl相關x蛋白
2.2 白楊素對高糖誘導的HRMECs凋亡的影響
與NG 組比較,HG 組HRMECs 中Bax 蛋白表達量升高(t=24.003,P=0.000),凋亡率升高(t=36.811,P=0.000),Bcl-2蛋白表達量降低(t=27.391,P=0.000),細胞活力(48 h、72 h)降低(t48h=9.507,P=0.001;t72h=16.089,P=0.000);與HG 組比較,MCG 組HRMECs中Bax蛋白表達量降低(t=8.943,P=0.001),凋亡率降低(t=8.896,P=0.001),Bcl-2蛋白表達量升高(t=8.593,P=0.001),細胞活力(48h、72h)升高(t48h=4.406,P=0.012;t72h=6.689,P=0.003);與HG 組比較,HCG 組HRMECs 中Bax 蛋白表達量降低(t=18.464,P=0.000),凋亡率降低(t=24.091,P=0.000),Bcl-2 蛋白表達量升高(t=20.409,P=0.000),細胞活力(48 h、72 h)升高(t48h=7.884,P=0.001;t72h=12.835,P=0.000),差異均有統計學意義(表3、圖1A、圖2A)。
表3 白楊素對高糖誘導的HRMECs細胞增殖活力及凋亡的影響(,n=3)
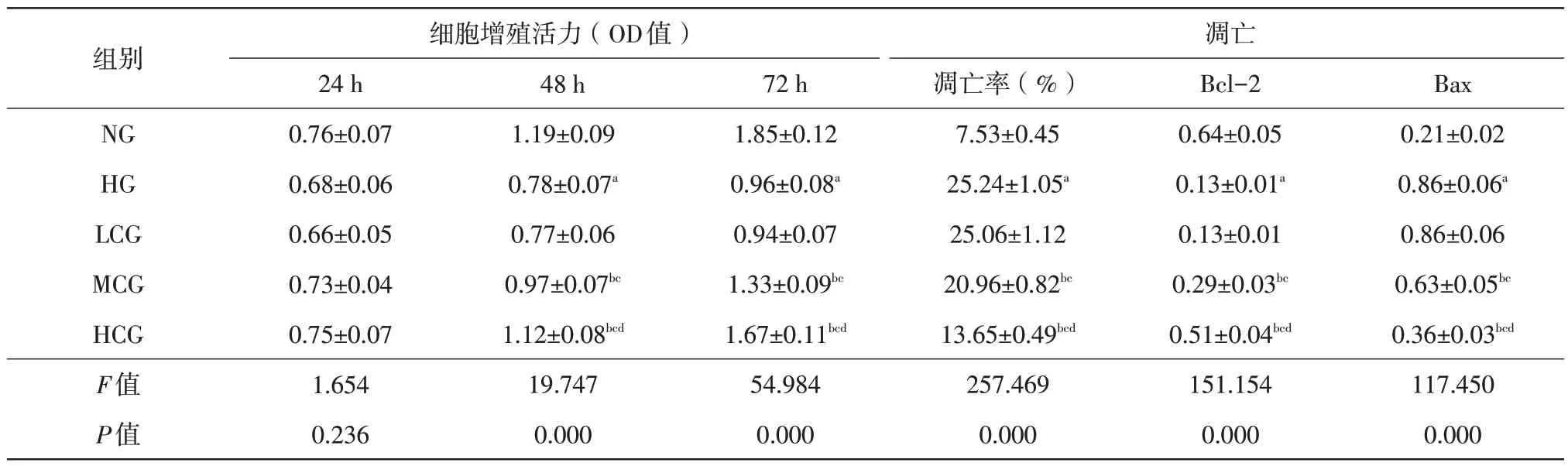
表3 白楊素對高糖誘導的HRMECs細胞增殖活力及凋亡的影響(,n=3)
注:a 與NG相比,P<0.05;b 與HG相比,P<0.05;c 與LCG相比,P<0.05;d與MCG相比,P<0.05。NG 正常組;HG 高糖組;LCG 白楊素低劑量組;MCG 白楊素中劑量組;HCG 白楊素高劑量組;Bcl B細胞淋巴瘤-2蛋白;Bax Bcl相關x蛋白
2.3 過表達GAS5對高糖誘導的HRMECs凋亡及氧化損傷的影響
與HG 組,pcDNA-GAS5 組HRMECs 細胞凋亡率降低(t=26.250,P=0.000),Bax蛋白表達量降低(t=1004.667,P=0.000),MDA含量降低(t=24.068,P=0.000),SOD 活性升高(t=29.198,P=0.000),Bcl-2 蛋白表達量升高(t=22.517,P=0.000),細胞活力(48 h、72 h)升高(t48h=7.754,P=0.001;t72h=13.612,P=0.000);與pcDNA 組比較,pcDNA-GAS5 組HRMECs 細胞凋亡率降低(t=26.321,P=0.000),Bax蛋白表達量降低(t=1004.667,P=0.000),MDA含量降低(t=24.231,P=0.000),SOD 活性升高(t=29.259,P=0.000),Bcl-2 蛋白表達量升高(t=22.517,P=0.000),細胞活力(48 h、72 h)升高(t48h=7.323,P=0.002;t72h=13.244,P=0.000),差異均有統計學意義(表4、圖1B、圖2B)。
表4 GAS5對高糖誘導的HRMECs細胞增殖活力、凋亡及氧化損傷的影響(,n=3)
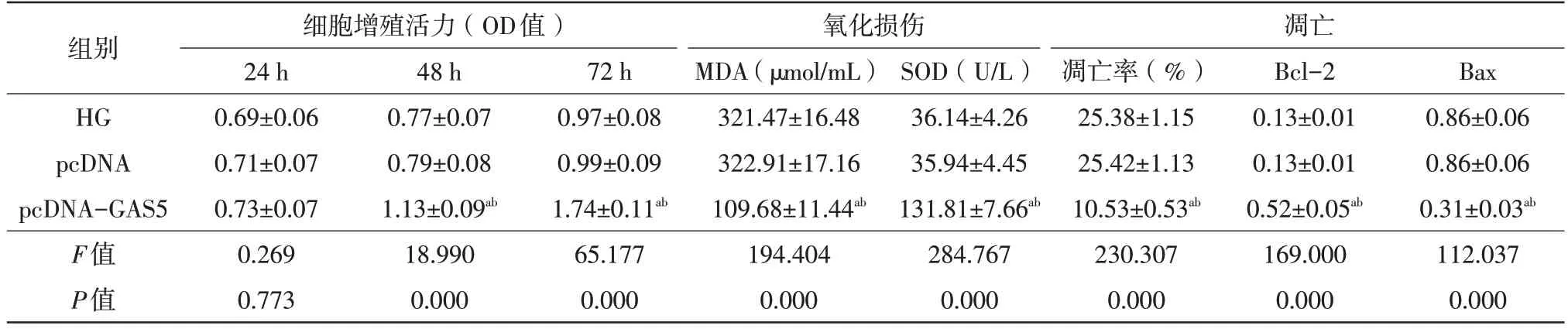
表4 GAS5對高糖誘導的HRMECs細胞增殖活力、凋亡及氧化損傷的影響(,n=3)
注:a 與HG相比,P<0.05;b 與pcDNA相比,P<0.05。HG 高糖組;pcDNA 空載質粒;GAS5 生長抑制特異性轉錄本5;Bcl B細胞淋巴瘤-2蛋白;Bax Bcl相關x蛋白;MDA 丙二醛;SOD 超氧化物岐化酶
2.4 抑制GAS5對高糖誘導的HRMECs損傷的影響
與HG 組比較,HCG 組HRMECs 凋亡率降低(t=21.014,P=0.000),Bax 蛋白表達降低(t=22.743,P=0.000),MDA含量降低(t=29.448,P=0.000),Bcl-2蛋白表達升高(t=19.919,P=0.000),SOD 活性升高(t=23.893,P=0.000),細胞活力(48 h、72 h)升高(t48h=6.694,P=0.003;t72h=11.976,P=0.000);與HCG+si-NC 組比較,HCG+si-GAS5 組HRMECs 凋亡率升高(t=14.135,P=0.000),Bax 蛋白表達升高(t=15.465,P=0.000),MDA含量升高(t=21.766,P=0.000),Bcl-2蛋白表達降低(t=13.280,P=0.000),SOD 活性降低(t=19.410,P=0.000),細胞活力(48 h、72 h)降低(t48h=4.909,P=0.008;t72h=9.581,P=0.001),差異均有統計學意義(表5、圖1C、圖2C)。
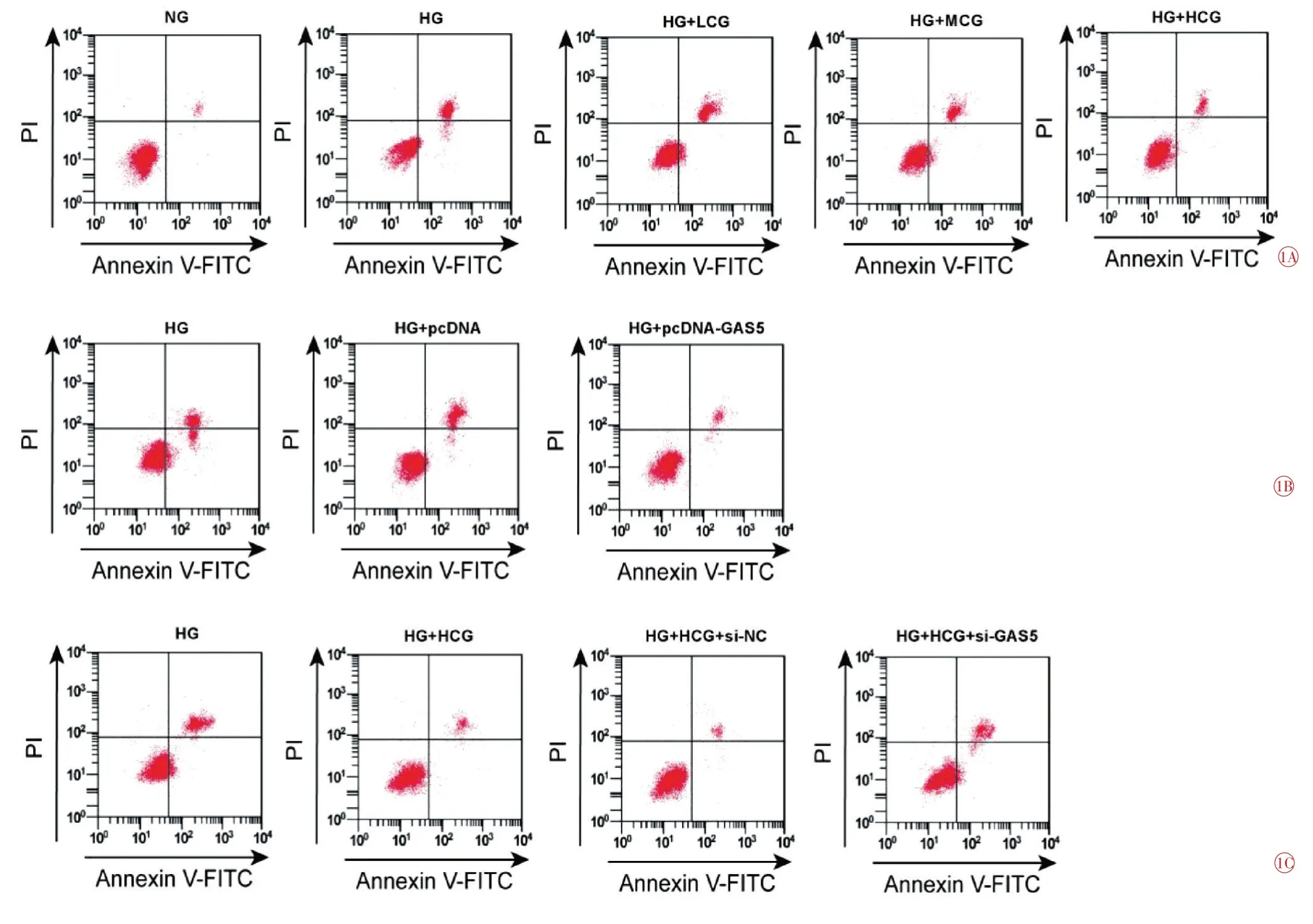
圖1 流式細胞術檢測細胞凋亡圖。1A 白楊素對高糖誘導的HRMECs 凋亡的影響;1B GAS5 對高糖誘導的HRMECs 凋亡的影響;1C 抑制GAS5對高糖誘導的HRMECs凋亡的影響
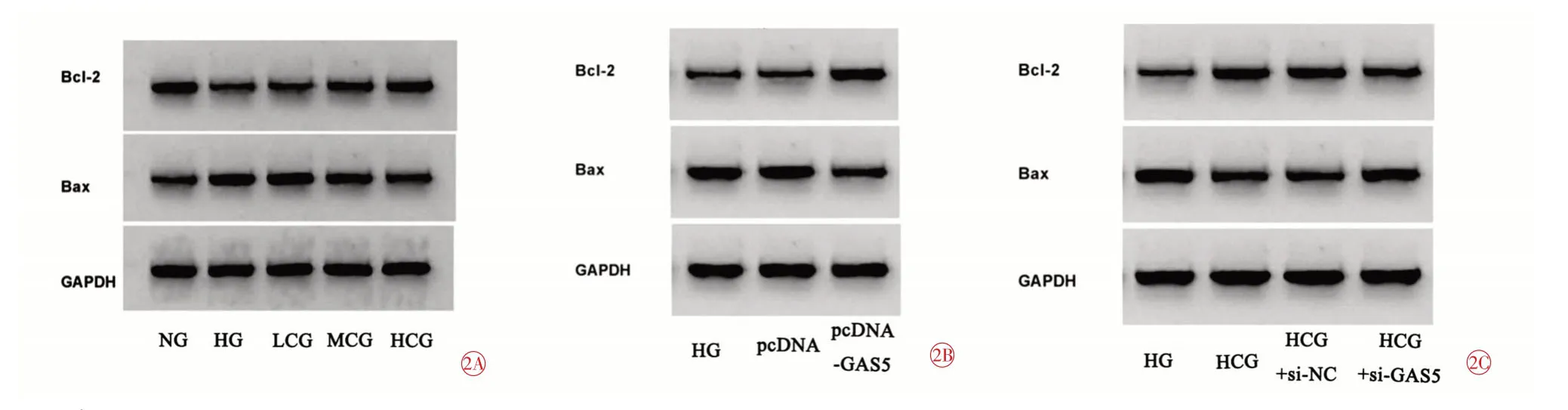
圖2 western blot檢測Bcl-2和Bax蛋白表達圖。2A 白楊素對高糖誘導的HRMECs中凋亡蛋白表達的影響;2B 白楊素對高糖誘導的HRMECs中凋亡蛋白表達的影響;2C 抑制GAS5對高糖誘導的HRMECs中凋亡蛋白表達的影響
表5 抑制GAS5對高糖誘導的HRMECs細胞增殖活力、氧化損傷及凋亡的影響(,n=3)
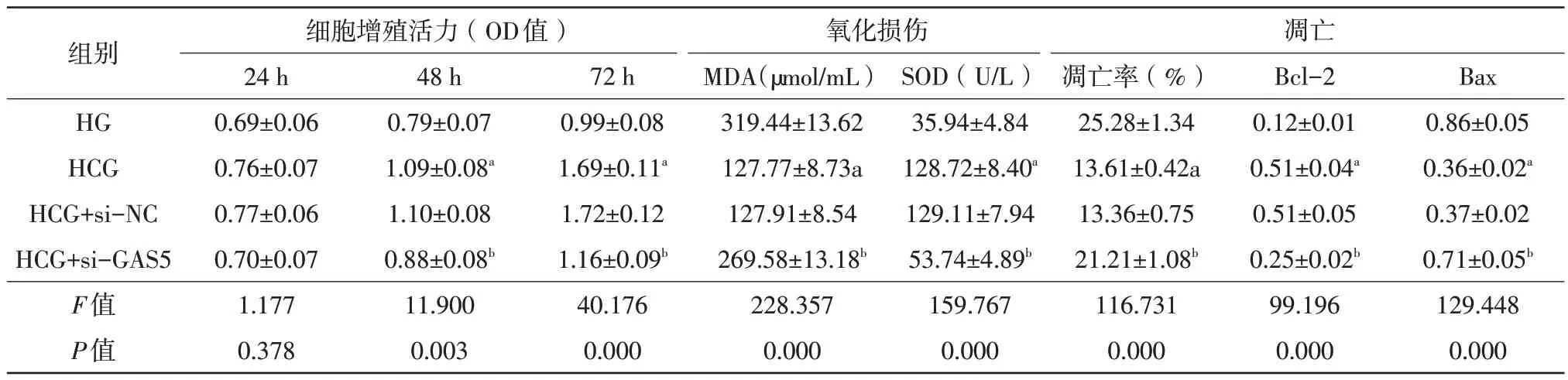
表5 抑制GAS5對高糖誘導的HRMECs細胞增殖活力、氧化損傷及凋亡的影響(,n=3)
注:a 與HG相比,P<0.05;b 與HCG+si-NC 相比,P<0.05。HG 高糖組;si-NC 小干擾RNA陰性對照組;si-GAS5 小干擾RNA-生長抑制特異性轉錄本5;Bcl B細胞淋巴瘤-2蛋白;Bax Bcl相關x蛋白;MDA 丙二醛;SOD 超氧化物岐化酶
3 討論
白楊素是菊科植物中黃酮類化合物的主要活性成分,具有廣泛的藥理活性。研究顯示,白楊素可抑制NF-κB信號通路的激活,進而對體內、外炎癥反應具有抑制作用[8]。白楊素還可抑制紫外線誘導的細胞凋亡、活性氧產生以及環氧合酶2(cyclooxygenase 2,COX-2)表達,保護角質形成細胞免受紫外線誘導的損傷[9]。本研究主要探討白楊素對高糖誘導的HRMECs 損傷的保護作用,結果發現,高糖刺激后HRMECs 抗氧化酶SOD 活性顯著降低,脂質過氧化產物MDA含量、細胞凋亡率顯著增加,說明DR細胞損傷模型構建成功。進一步分析表明,中、高劑量的白楊素能增加SOD 活性,降低MDA 含量,抑制細胞凋亡,并表現出劑量依賴性,說明一定劑量的白楊素提高改善細胞氧化應激和細胞凋亡對高糖誘導的HRMECs 損傷具有保護作用。與本研究發現類似,Ali N 等[10]研究證實經白楊素預處理后,可通過改善氧化應激、組織病理改變和凋亡來預防甲氨蝶呤誘導的肝臟毒性。Bax是促凋亡蛋白,Bcl-2是抗凋亡蛋白,Bax表達增加、Bcl-2表達降低可誘導caspase-3活化,促進細胞凋亡,有研究指出白楊素能以劑量依賴性方式,恢復高糖暴露對腎足細胞中Bax 和Bcl-2 蛋白表達的影響[11]。本研究中高糖刺激能上調Bax 蛋白表達,下調Bcl-2 蛋白表達,而白楊素預處理可以逆轉上述改變,進一步證實白楊素的抗凋亡作用。以上數據提示白楊素對高糖誘導的HRMECs損傷具有保護作用。
lncRNA GAS5是非編碼RNA家族重要成員,其通過抑制細胞增殖、轉移、化療耐藥,誘導細胞自噬和凋亡,在宮頸癌、胰腺癌等多種惡性腫瘤中扮演抑癌基因角色[12-14]。此外,GAS5 被證實與多種細胞損傷相關。在膿毒癥誘導的足細胞損傷中GAS5表達降低,過表達GAS5 顯著減弱膿毒癥性足細胞損傷[15]。異硫維醇鈉通過調節GAS5 表達減弱調節缺血性卒中小膠質細胞/巨噬細胞極化,發揮神經保護作用[16]。本研究中高糖刺激后HRMECs 中GAS5 表達量顯著降低,而中、高劑量的白楊素處理能逆轉上述改變,說明白楊素的細胞保護作用可能與調控GAS5表達有關。驗證GAS5功能顯示,過表達GAS5可增加SOD活性、Bax蛋白表達量,降低MDA 含量、Bcl-2蛋白表達量,抑制細胞凋亡,說明過表達GAS5對高糖誘導的HRMECs 損傷具有保護作用。此外,干擾GAS5 表達能減弱白楊素處理對高糖誘導的HRMECs凋亡、氧化損傷的影響,這進一步證實白楊素的保護作用可能與上調lncRNA GAS5表達有關。
總之,本研究發現,白楊素能夠減弱高糖誘導的HRMECs 凋亡、氧化損傷,其機制可能是通過上調lncRNA GAS5 表達實現的。這闡明了白楊素的可能的保護作用機制,為白楊素用于防治DR 提供了一定理論支撐。

