不同濃度生長因子對人臍靜脈內皮細胞增殖影響的實驗研究
魏建國 段東明 井一涵 婁愛菊 曾裕威 劉子愷 王簕
廣州醫科大學附屬第三醫院1骨科,2再生醫學與3D 打印轉化中心(廣州510150);3廣州醫科大學附屬荔灣醫院風濕科(廣州510150)
組織修復是一個復雜的過程,基本包括炎癥反應期,肉芽生成期,以及組織塑形期。細胞作為器官組織的基本構成單位,需要細胞大量增殖、分化來形成組織[1]。而組織修復需要生長因子在時間空間上相互調節細胞增殖、分化、成血管以及組織生長的基因表達[2]。血小板衍生生長因子(platelet derived growth factor,PDGF)是血小板α 顆粒中的一種堿性蛋白質,當PDGF 和靶細胞的受體結合后,細胞合成新的DNA,從而促進細胞有絲分裂而增殖[3]。血管內皮生長因子(vascular endothelial growth factor,VEGF)是一種高度特異性的促血管內皮細胞生長因子,能促進血管內皮細胞的增殖分化,在血管系統發生發展過程中起著明顯的調節作用[4-5]。隨著醫學發展,PDGF 和VEGF 將被越來越多的應用于再生修復治療,如治療老年性骨量丟失、糖尿病創面等[6-8]。近來,生物材料在醫學再生領域研究以及應用較為火熱,如水凝膠、3D 打印支架等[9-11]。這些材料基本由明膠(gelatin)或者PCL 等為基材,通過化學或物理方式對其進行改造成為生物修復材料,并負載藥物如生長因子,給組織提供修復微環境以促成骨或促成血管[12-13]。
雖然生長因子對組織修復的作用很重要,但目前學術界對于如何把控生長因子的劑量使用研究鮮有報道[14-16],推測存在一個生長因子濃度,對組織修復有最佳的效應。本研究將使用不同濃度的PDGF-BB 和VEGF-A,在二維和三維培養條件下,探討其對人臍靜脈內皮細胞(human umbilical vein endothelial cell,HUVEC)增殖效率的影響。
1 材料與方法
1.1 主要材料PDGF-BB(近岸蛋白)、VEGF-A(MCE)、明膠(typeA,sigma)、透明質酸(40 kDa,華熙福瑞達)、lenti-eGFP(CyagenBiosciences)、HUVEC(CyagenBiosciences),tryple(Gibco)、CCK-8(碧云天)、Carbohydrazide(HDZ,Aladdin)、1-Hydroxybenzotriazolemonohydrate(HOBt,Aladdin)、1-(3-Dimethylaminopropyl)-3-ethylcarbodiimidehydrochloride(EDC,Aladdin)、(S)-3-Amino-1,2-propanedlol(Aladdin)、NaIO4(Macklin),EG(Ethylene Glycol,Macklin),ECM(EndothelialCellMedium,ScienCell),FBS(Gibco),雙抗(Solarbio),熒光顯微鏡(OlympusIX83),酶標儀(TECANM200pro)。
1.2 實驗分組在完全培養基中加入不同濃度的PDGF-BB 或者VEGF-A,按因子濃度將實驗分成以下組:0 μg/mL 組(Control組)、0.02 μg/mL GFs組、0.2 μg/mL GFs 組、2 μg/mL GFs 組、5 μg/mL GFs組,每組至少設置3 個復孔。
1.3 水凝膠材料的制備作為三維培養的生物材料,用經碳酰肼改性的gelatin 和醛基修飾的HA,碳酰肼基團和醛基之間交聯形成穩定的希夫堿[17],凝膠整體較為穩定。對于Gel-CDH 的合成,準備300 mL 的1%明膠水溶液,劇烈攪拌下加入6.49 g HDZ,1.1 g HOBt,調節溶液pH 4.7,反應1 h 后加入0.46 g EDC,反應過夜。第二天經0.3 mol/L NaCl,純水透析4 d,最后凍干得Gel-CDH。對于HA-mCHO的合成,其分兩步反應;首先,準備500 mL 的2%HA 水溶液,劇烈攪拌下加入4.55 g Amino,3.83 g HOBt,調節pH 6.0,反應2 h后加入1.45 g EDC,反應過夜。第二天經0.3 mol/L NaCl,純水透析4 d,最后凍干得HA-mCHO-diol。準備482 mL 的1%HAmCHO-diol 水溶液,劇烈攪拌下,加入2.58 g NaIO4水溶液,避光反應5 min,隨后加入14.95 g EG,反應2 h。0.3 mol/L NaCl,純水透析4 d,最后凍干得HA-mCHO。
1.4 HUVEC 的培養與lenti-eGFP 的轉染及觀察鑒定原代HUVEC 購買于Cyagen Biosciences,使用ECM 完全培養基接種于T75 培養瓶,于37 ℃、5%CO2無菌培養箱培養。在細胞狀態良好的早期代數中消化并收集細胞,重懸細胞至5 × 105/mL,再接種于24 孔板內,每孔1 mL 細胞懸液,于細胞培養箱培養。次日,將慢病毒、Polybrene 取出,于冰浴融解并保持低溫狀態;取20 μL/孔對應的lenti-eGFP 總量加入到對應培養基中,輕柔混勻;再加入5 μg/mL 對應的Polybrene 輕柔搖勻,吸去原有培養基,PBS 沖洗1 次;加入含lenti-eGFP 培養基;輕輕搖動培養皿,使培養基覆蓋所有細胞;放入細胞培養箱中。24 h 后,吸去原有lenti-eGFP 培養基,更換為新鮮的完全培養基,得到lenti-GFP HUVEC。24 h 及72 h 觀察熒光轉染效果。
1.5 二維條件下給予不同濃度生長因子的GFPHUVEC培養效果觀察實驗對象取自上述實驗經GFP 轉染的HUVEC。GFP-HUVEC 按照1 × 105/mL接種于24孔板內,培養1 d以穩定細胞狀態。隨后,在狀態良好情況下,除去孔內培養基,PBS 洗滌1 次,加入新鮮的含不同濃度PDGF-BB或者VEGF-A的1 mL 完全培養基,每天更換1 次新鮮培養基。按照預定分組,每組設置3 個復孔。在第1、4、7 天時,在熒光顯微鏡下觀察并拍照,并使用image-Jv1.58 軟件對熒光數量進行半定量分析。
1.6 二維條件下CCK-8HUVEC 增殖檢測實驗對象取自上述實驗第4 代HUVEC,使用tryple 收集足夠數量并且狀態良好的HUVEC,以5 × 103/mL數量接種至24 孔板內,培養1 d 以穩定細胞狀態。而后在細胞狀態良好情況下,除去孔內培養基,PBS 洗滌1 次,加入新鮮的含不同濃度PDGF-BB 或者VEGF-A 的100 μL 完全培養基,每天按此換液1 次。按照預定分組,每組設置5 個復孔。在第1、4、7 天時,按照CCK-8 說明書檢測OD值。
1.7 三維條件下給予不同濃度生長因子的GFPHUVEC 培養效果觀察實驗對象取自上述實驗經GFP 轉染的HUVEC。首先取Gel-CDH 制備4%的PBS 溶液于無菌EP 管中,置于37 ℃中備用。再取HA-mCHO 制備5.34%的PBS 溶液于無菌EP 管中,用0.22 μm 濾膜過濾殘渣后備用。收集足夠數量并且狀態良好的GFP-HUVEC,用PBS 重懸至2 × 106/mL,然后以此細胞懸液稀釋等量的HAmCHO 溶液至2.67%。最后,25 μL Gel-CDH 和含細胞的25 μL HA-mCHO 劇烈混合,并靜置30 min以充分反應。凝膠放入24 孔板,每孔含1 mL 不同濃度PDGF-BB 或者VEGF-A 的完全培養基。每孔設置3 個復孔。在第1、4、7 天時,在熒光顯微鏡下觀察并拍照,并使用imageJv1.58 軟件對熒光數量進行半定量分析。
1.8 統計學方法實驗結果數據用()表示,由統計軟件SPSS 20.0 進行統計分析,graphpadprismv 8.0 進行數據繪圖展示。實驗各組樣本結果均數采用單因素方差分析,P<0.05為差異有統計學意義。
2 結果
2.1 HUVEC 培養和慢病毒轉染效果HUVEC 按照供應商的實驗方法并結合本實驗研究計劃進行培養并轉染lenti-eGFP,細胞狀態良好,可以用于后續的實驗(圖1)。
圖1 HUVEC 培養和慢病毒轉染后1 d 和3 d 的效果Fig.1 Effects of HUVEC culture and lentivirus transfection on day 1 and day 3
2.2 二維條件下給予不同濃度生長因子的GFPHUVEC 培養效果為了觀察鏡下HUVEC 的生長情況,按照預定實驗計劃,除了使用完全培養基外,對實驗對象額外單獨添加兩種不同濃度的PDGFBB 和VEGF-A,以不加生長因子作為實驗對照組。在PDGF-BB 實驗組內(圖2a-b),在第1、4、7 天,2 μg/mL 組始終保持較高的熒光數量(P<0.01);同樣,在VEGF-A 組實驗組內(圖2c-d),0.2 μg/mL組表現出相同趨勢(P<0.05)。此外還觀察到,5 μg/mL 組呈現低熒光數量。可見,2 μg/mL 的PDGFBB或者0.02 μg/mL 的VEGF-A 對HUVEC起明顯促進效果(P<0.05)。
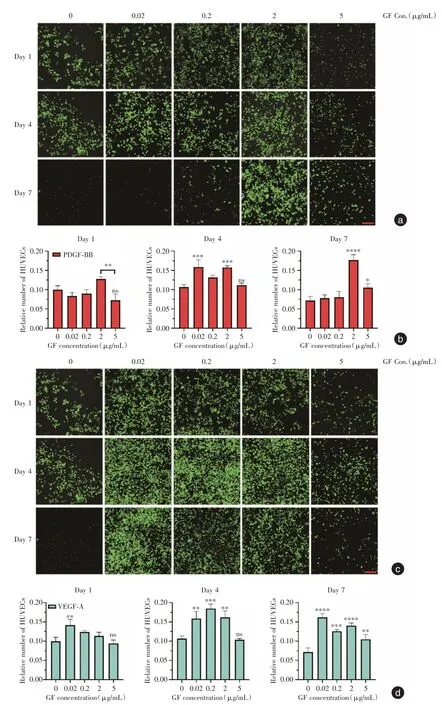
圖2 不同濃度PDGF-BB 或VEGF-A 下HUVEC 在孔板中的生長情況Fig.2 Proliferation of HUVEC in plate with different concentrations of PDGF-BB or VEGF-A
2.3 二維條件下CCK-8 檢測HUVEC 增殖結果為了檢測在二維條件下HUVEC 的增殖情況,在給予了不同濃度PDGF-BB 或者VEGF-A 后進行了CCK-8 檢測,見圖3。在第1 天時,PDGF-BB 實驗組內,與對照組相比,2 μg/mL 與5 μg/mL 細胞增殖情況有所下降(P<0.05),而其余組卻無明顯差別(P>0.05);但在第4、7 天時,2 μg/mL 組保持較高增殖活性(P<0.05)。在VEGF-A 組內,第1、4、7天時,0.02 μg/mL 組始終保持較高的增殖活性(P<0.05)。但觀察到兩個因子5 μg/mL 組表現較低甚至是抑制效應。說明這與上述的結果相一致,并且過高的因子濃度可能會出現抑制效應。
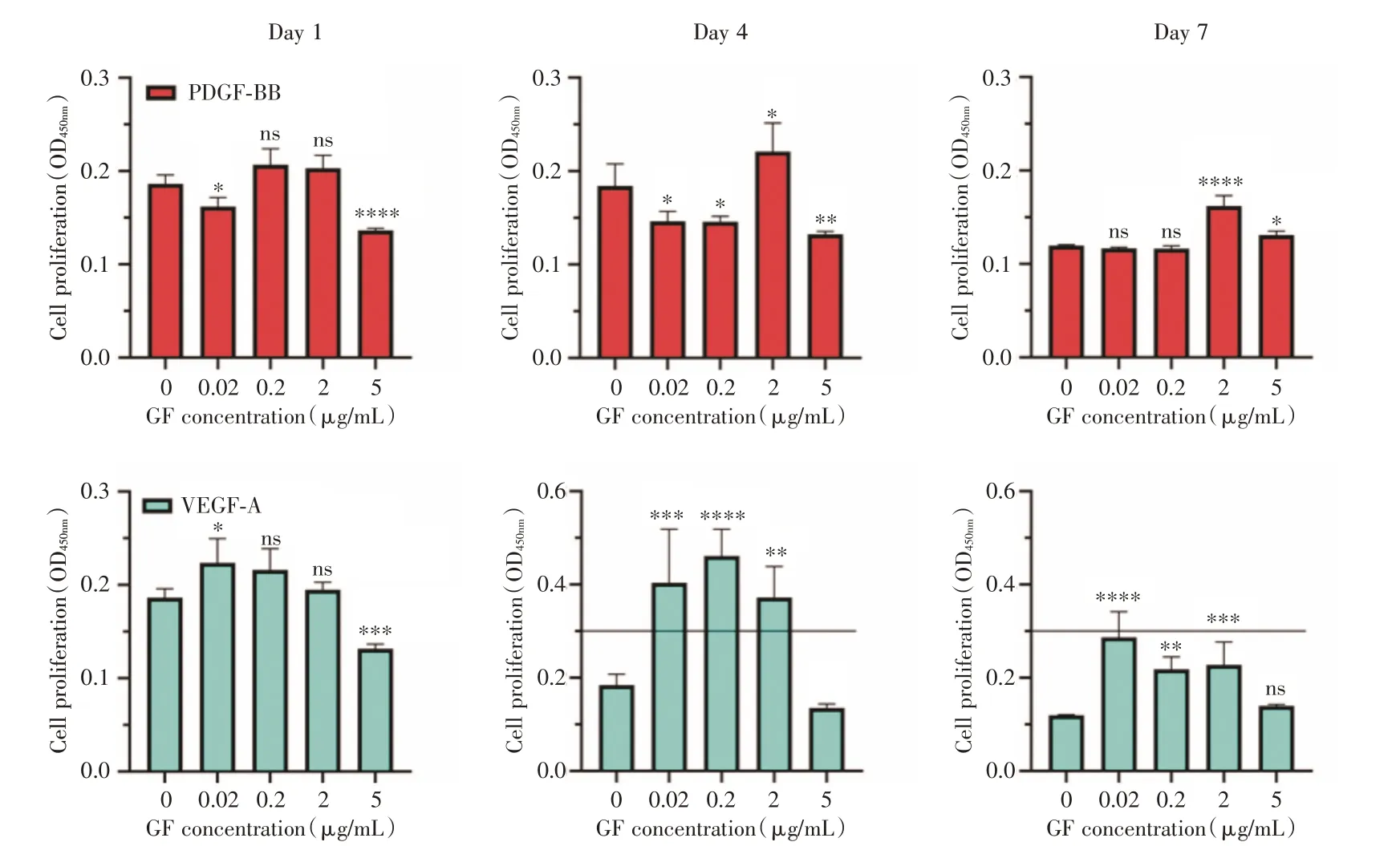
圖3 CCK-8 檢測不同濃度生長因子對HUVEC 增殖的影響Fig.3 Effects of different concentrations of growth factors detected by CCK-8 on HUVEC proliferation
2.4 三維條件下給予不同濃度生長因子的GFPHUVEC 培養結果按照預定實驗計劃,將轉染了慢病毒的HUVEC 包裹進水凝膠里面,以模擬三維生長環境,并在培養基中添加不同濃度生長因子,觀察其生長情況。在第1、4、7 天,PDGF-BB 組內2 μg/mL 始終表現出較多熒光數量(P<0.01)。VEGF-A 組內0.02 μg/mL 與前者表現出相同趨勢(P<0.01)。說明在三維條件下,仍以2 μg/mL 的PDGF-BB 或0.02 μg/mL 的VEGF-A 對HUVEC 有更好的促進效應,過高的因子濃度可能會出現抑制,這與上面的實驗結果較為相符。
3 討論
生長因子是一類調節細胞組織正常生長代謝所必需的有機物,其可控制組織缺損修復、創面愈合等過程中的許多關鍵細胞活動,如新血管生成、細胞遷移與增殖等[18-19]。由于生長因子良好的修復作用,所以為各種原因導致的創傷治療帶來了新的希望。水凝膠是生物相容性較高的再生修復材料,負載生長因子之后,它可以隨時間而逐漸降解并釋放更多的生長因子,因而進一步促修復,形成良性循環,最終材料降解消失,組織愈合[20-21]。LIENEMANN 等[22]和賈樂寧等[23]用含生長因子的水凝膠研究修復效應,得出其能明顯促進骨缺損修復和新血管生成的結論。
雖然生長因子已被廣泛使用,但許多研究對其劑量的效應探討并無詳細贅述,如果在治療修復方面每次都使用大劑量,那可能將會對患者產生過高的消費,副作用及其他未知問題[24]。在此,筆者探討了較低濃度下的PDGF-BB 和VEGF-A 對于再生修復的效果。以GFP-HUVEC 為實驗對象,將其接種在孔板上或者在水凝膠里面,再添加不同濃度的PDGF-BB 和VEGF-A 進行培養,用lenti-GFP的熒光和CCK-8 來檢測,結果發現,2 μg/mL 的PDGF-BB 或0.02 μg/mL 的VEGF-A 始終對細胞表現出促進作用。
雖然已基本證實有一個濃度的生長因子對細胞表現出最佳促效應,但是在凝膠實驗中還發現細胞在其中生長速率總體比在孔板中較慢。水凝膠是含大量水、少量gelatine 和HA 組成的生物材料,形成有一定密閉性的微環境,而HUVEC 生長會涉及延伸、黏附以及成網等。猜測這可能水凝膠對培養基中的物質通透、對細胞的生長限制等有關。如能對凝膠的理化性質如物質通透性等進行測試,可能將更了解該凝膠對細胞的生物兼容性。
綜上所述,得出結論,2 μg/mL PDGF-BB 和0.02 μg/mL VEGF-A 對HUVEC 產生的增殖效果最好,過高濃度的生長因子對于其可能有抑制作用。但本研究只在細胞層面驗證了該結論,由于體內微環境的復雜性,尚不清楚在動物模型上是否得到相同的結論。后續會在本文基礎上增加動物模型實驗,使結論更具可靠性。
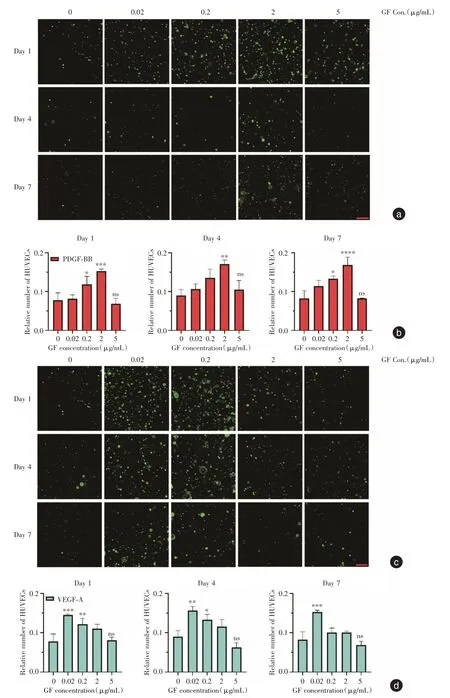
圖4 不同濃度PDGF-BB 或VEGF-A 下HUVEC 在凝膠中的生長情況Fig.4 Proliferation of HUVEC in hydrogels with different concentrations of PDGF-BB or VEGF-A

