TAP63γ基因調節Col10a1基因表達及軟骨細胞分化成熟*
李 娜,王 倩,夏 康,孫曉曦,展丙香,吳 璇,陳 晨,鄭其平△
1.安徽醫科大學第一附屬醫院輸血科,安徽合肥 230022;2.江蘇大學醫學院,江蘇鎮江 212013
骨骼包括兩種組織,即分別由成骨細胞和軟骨細胞形成的骨與軟骨。骨骼的發育或形成又有兩種方式:膜內成骨及軟骨內成骨。正常生理狀況下,機體的膜內成骨和軟骨內成骨合理、協調地進行。當膜內成骨受損時可致多種頜面部骨骼畸變,而軟骨內成骨異常則可致骨與軟骨發育不良或過生長[1-3]。 P63作為P53抑癌基因家族的重要成員,同時發揮了抑癌基因(介導細胞衰老)和原癌基因(促增殖、促生長)的雙重作用[4-5]。近年來,研究發現除了嚴重的上皮缺陷,P63基因缺失型小鼠的肢體嚴重縮短或缺如并伴有頜面部異常[6-7]。此外,P63基因突變也可致人體發生明顯的骨骼改變,進一步說明P63基因在機體骨骼發育,尤其是軟骨內成骨中的作用[4,8]。然而,小鼠P63有8種變異體[9-10],這些變異體與骨骼發育的關聯目前知之甚少。基于前期對P63變異體的研究,筆者推測TAP63γ是控制長骨發育的效應P63變異體[2,11]。MCT 細胞是經過SV40大T抗原轉化的軟骨細胞,這些細胞在32 ℃培養時可持續生長,而在37 ℃培養時會出現生長阻滯并高表達十型膠原蛋白基因(Col10a1基因)[1]。ATDC5細胞是由小鼠畸胎瘤衍生的細胞系,具有類似于軟骨細胞的生長特性, 長期培養(+ITS誘導)可向分化成熟過渡,并且也高表達Col10a1等基因[2]。TAP63γ基因在肥大型MCT細胞和經誘導向成熟分化的ATDC5細胞中的水平明顯升高[10],提示TAP63γ基因可能在軟骨細胞分化成熟時起作用。因此,本研究擬進一步探討TAP63γ基因如何影響Col10a1基因表達及軟骨細胞的分化與成熟。
1 材料與方法
1.1儀器與試劑 主要儀器:細胞培養箱(Thermo Fisher Scientific)、PCR儀(GENE)、熒光定量PCR儀(BIO-RAD)。主要試劑:TRIzol 試劑盒(15596018,Invitrogen)、iScriptTMcDNA Synthesis Kit(1708890,BIO-RAD)、DreamTaq Green PCR Master Mix(2x)(K1071,Thermo Fisher Scientific)、iQTMSYBR Green Supermix(1708882,BIO-RAD)、ITS(胰島素-轉鐵蛋白-Selenium-硒)、ITS(13146,Sigma)、引物(上海生工生物工程有限公司)、茜素紅染色試劑盒(A5533,Sigma)、堿性磷酸酶染色試劑盒(南京建成生物研究所CAKP D001-2)、阿爾新藍染色試劑盒(上海生工生物工程有限公司A0298-1g)、TAP63γ基因 SiRNA(SR417746,Origene)、pCMV6-TAP63γ基因過表達載體(MR227536,Origene)、pCMV6空載體(PS100001,Origene)、LipofectamineTM2000脂質體(11668027,Invitrogen)、G418(158782,MP Biomedicals)。
1.2方法
1.2.1引物設計 在GenBank數據庫中查找基因的mRNA序列(NCBI,https://www.ncbi.nlm.nih.gov/gene)。運用Primer3軟件設計引物,并在PubMed-Blast中驗證所設計的引物,見表1。

表1 qRT-PCR引物
1.2.2MCT與ATDC5細胞株的培養 (1)MCT細胞使用含有8%FBS的DMEM培養基,置于8%CO2的32 ℃培養箱培養。MCT細胞培養至80%融合度時,把MCT細胞從32 ℃、8%CO2的培養箱移到37 ℃、5%CO2培養箱內繼續培養,兩種狀態下(32 ℃/37 ℃)的MCT細胞需做3個復孔,隔1 d換1次培養液。(2)ATDC5細胞使用含有5%FBS的DMEM/F12(1∶1)培養基,置于5%CO2的37 ℃培養箱培養。ATDC5細胞生長至80%融合度時,加入含1%ITS誘導劑的完全培養基開始誘導培養。開始誘導記為0 d(無ITS),兩組的ATDC5細胞均需做3個復孔,隔1 d換1次培養液。
1.2.3細胞轉染及瞬時轉染 使用干擾片段TAP63γ基因 SiRNA,分別轉染MCT細胞(32 ℃培養24 h后轉入37 ℃繼續培養24 h)和ATDC5細胞(37 ℃培養24 h),即轉染干擾片段組。穩定轉染: 分別轉染TAP63γ基因表達質粒和pCMV空載體質粒,利用G418篩選,生成了過表達TAP63γ基因(目的組)和含有空載體(對照組)的ATDC5穩定轉染細胞系[6],未進行轉染的ATDC5細胞系設為空白組。質粒轉染實驗參照說明書和參考文獻[3,6]進行。簡要的步驟如下:待細胞長至 70%~80%融合度時, MCT/ATDC5 細胞使用LipofectamineTM2000無血清轉染 6 h后,完全培養基再培養 24~48 h。穩定轉染再換含有G418的完全培養液,并連續培養兩周,隔1 d換1次培養液,剩下沒有被殺死的細胞繼續傳代培養,以備后續實驗。
1.2.4細胞RNA提取、反轉錄及熒光定量PCR 使用TRIzol試劑進行RNA的提取,按說明書的實驗步驟依次進行RNA提取、DNA酶處理及反轉錄。得到的cDNA 1∶10稀釋,按照iQTMSYBR Green supermix反應體系配比,在BIO-RAD熒光定量PCR儀上進行擴增。Gapdh作為內參和目的基因同時進行qRT-PCR,采用相對定量2-ΔΔCT方法計算基因的相對表達量。
1.2.5細胞染色 染色實驗參照說明書進行,簡要步驟如下。阿爾新藍染色:細胞采用-20 ℃甲醇固定2 min,加入0.1%的阿爾新藍(0.1 g阿爾新藍粉末加入鹽酸溶液至100 mL,配成0.1 mol/L的鹽酸溶液),靜置過夜,洗凈鏡檢;堿性磷酸酶染色:4%多聚甲醛固定1 min,加入新鮮配制的堿性磷酸酶染液,濕盒內37 ℃避光孵育10 min,洗凈,蘇木精-伊紅復染3~5 min,洗凈鏡檢;茜素紅染色:95%乙醇固定10 min,洗凈后加入1%茜素紅(pH值6.4),室溫靜置10 min,洗凈鏡檢。
1.3觀察指標 (1)分析TAP63γ基因和Col10a1基因分別在增殖/肥大狀態下小鼠MCT細胞和ATDC5細胞中的表達;(2)過表達或抑制TAP63γ基因,觀察其對Col10a1基因表達的調控作用;(3)進行細胞染色,并比較誘導培養第4、7、14、21天的對照組與目的組的陽性染色面積。
1.4統計學處理 目的基因在肥大型軟骨細胞內和增殖型軟骨細胞內的比較采用配對t檢驗,以P<0.05為差異有統計學意義。
2 結 果
2.1Col10a1基因與TAP63γ基因在兩種肥大型軟骨細胞模型中的表達 MCT細胞在37 ℃誘導3 d后Col10a1基因相對表達量為50.20±1.99(P<0.001),TAP63γ基因相對表達量為4.90±0.13,與32 ℃增殖狀態下MCT細胞基因相對表達量(基因相對表達量設為1)比較,差異有統計學意義(P<0.05)。ATDC5細胞在肥大狀態下(ITS誘導14 d)Col10a1基因相對表達量為2.60±0.79,TAP63γ基因的相對達量為2.58±0.10,與ATDC5細胞在增殖狀態下(無ITS)基因相對表達量(基因相對表達量設為1)比較,差異有統計學意義(P<0.05)。
2.2ATDC5細胞中過表達TAP63γ基因對Col10a1基因的影響 在誘導培養的第0、7、21天,發現目的組的TAP63γ基因相對表達量明顯高于對照組,差異有統計學意義(P<0.05);同時在第7、14、21天,目的組的Col10a1基因相對表達量明顯高于對照組,差異有統計學意義(P<0.05)。空白組與對照組TAP63γ基因、Col10a1基因相對表達量比較,差異無統計學意義(P>0.05)。見表2。
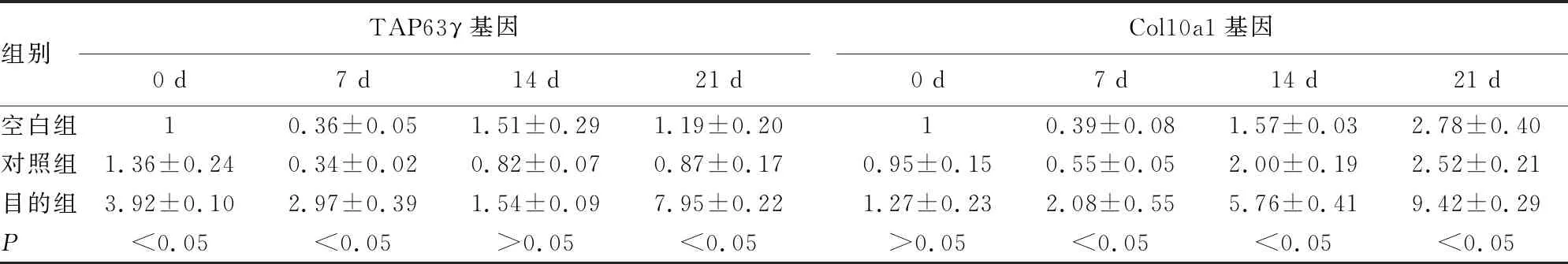
表2 不同誘導時間的TAP63γ基因、Col10a1基因相對表達量
2.3空白組和轉染干擾片段組細胞中TAP63γ基因與Col10a1基因的表達 在MCT細胞中,與空白組(基因相對表達量設為1)比較,轉染干擾片段組TAP63γ基因相對表達量(0.79±0.11)明顯降低,同時Col10a1基因相對表達量(0.68±0.03)也明顯降低,差異有統計學意義(P<0.05)。 在ATDC5細胞中,與空白組(基因相對表達量設為1)比較,轉染干擾片段組TAP63γ基因相對表達量(0.42±0.10)明顯降低,同時Col10a1基因相對表達量(0.35±0.04)也明顯降低,差異有統計學意義(P<0.05)。
2.4染色結果 阿爾新藍染色在誘導培養的第7天顯示出最強的染色強度,但目的組與對照組間沒有顯示出明顯的差異。同時在第4、14、21天也沒有觀察到明顯的染色強度差異(圖1)。在誘導培養的第21天,觀察到目的組與對照組相比顯示出更強的堿性磷酸酶染色強度(圖2)。對誘導培養第21天的目的組和對照組進行茜素紅染色,然而并沒有觀察到明顯的染色強度差異(圖3)。
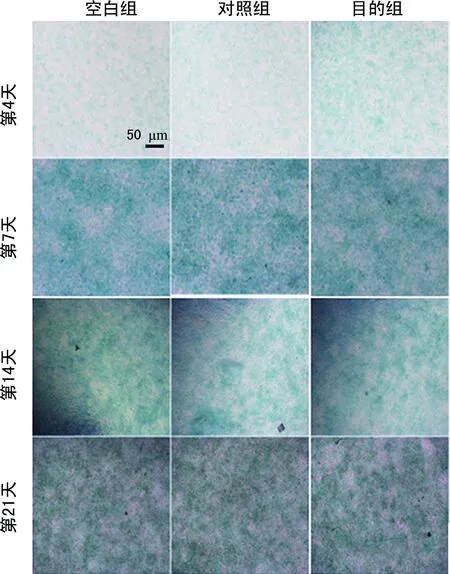
圖1 阿爾新藍染色結果(×4)
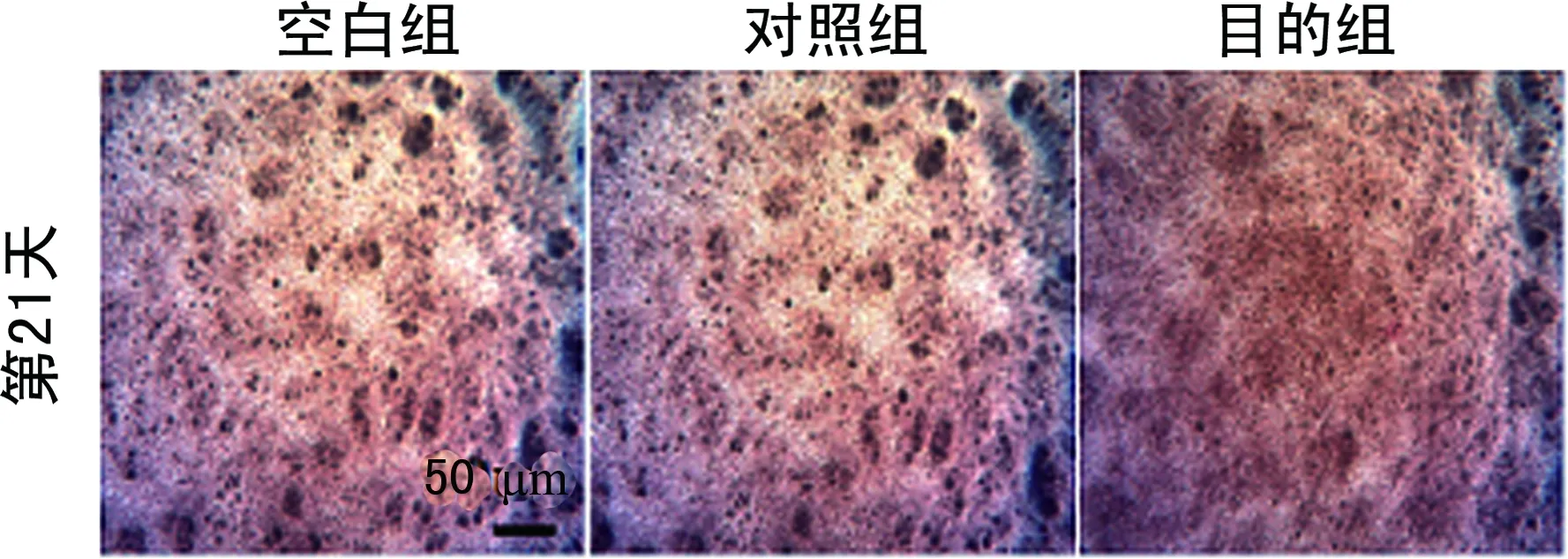
圖3 茜素紅染色結果(×4)
3 討 論
大量的研究揭示了P63基因在腫瘤形成和發育過程中的多樣性功能[12-13]。由于啟動子的不同和可變剪接,P63含有多種異構體,不同異構體之間也會產生相互作用[14-15],這不僅導致了P63基因功能的多樣性,同時也阻礙了對其體內功能的研究。小鼠肢體的缺陷主要歸于受損的上皮發育,即頂外胚層脊缺失導致肢體的起始發育不能正常進行。然而,肢體縮短和頜面部骨骼改變提示P63缺失型小鼠的軟骨內成骨和膜內成骨均受損[16-17]。這些結果提示P63可能在機體的軟骨內成骨過程中發揮重要作用 。
本研究進行了TAP63γ基因在兩種軟骨細胞模型中的表達分析。結果表明,相比增殖型細胞,肥大型MCT和ATDC5細胞中Col10a1基因的上調與增加的TAP63γ基因表達一致。為了確認兩個基因之間的相關性,本研究在ATDC5細胞中過表達TAP63γ基因,可見Col10a1基因相對表達量上調;同時,在MCT和ATDC5細胞中抑制TAP63γ基因的表達活性則進一步降低Col10a1基因的表達。這些結果證明了TAP63γ基因和Col10a1基因表達之間的直接關聯。在誘導培養的第21天,觀察到TAP63γ基因過表達(目的組)與對照組相比顯示出更強的堿性磷酸酶染色強度(圖2)。與此同時,在目的組和對照組之間,阿爾新藍染色和茜素紅染色都沒有檢測到明顯差異(圖1、3)。這些結果清楚地表明TAP63γ基因促進和加速軟骨細胞肥大分化并可能促進隨后的基質礦化,而在ATDC5細胞早期的增殖和后期的成骨分化階段中可能影響甚微。
此前的研究表明TAP63γ基因型異構體可能在胚胎骨骼發育的不同階段發揮不同功效,TAP63γ基因可能參與軟骨內成骨過程中的軟骨成熟[10,18]。Col10a1基因是軟骨內成骨過程中眾所周知的肥大型軟骨細胞的標志基因。在本研究中,進一步分析了TAP63γ基因與Col10a1基因的關系,以及TAP63γ基因對軟骨細胞分化成熟的影響。本研究已經用數據表明TAP63γ基因表達對Col10a1基因的正向調控作用,還證實了Col10a1基因上調與體外軟骨內成骨的細胞模型中增強的軟骨細胞肥大分化相一致。這些發現可能解釋和支持TAP63γ基因在骨折愈合過程中類似于軟骨內成骨的作用。然而,關于TAP63γ基因在骨的形成和修復中的確切機制還需要進一步的研究。

