乳清蛋白改性研究進展
劉培玲,張晴晴,高增麗,楊 嵐,烏 云,曹文慧,母智深,*
(1.內蒙古蒙牛乳業(集團)股份有限公司,內蒙古 呼和浩特 011500;2.內蒙古工業大學食品與生物工程系,內蒙古 呼和浩特 010051)
乳清是一種年產量很高的干酪副產物[1]。乳清蛋白是乳清的主要成分,含有多種組成物質,主要包括β-乳球蛋白、α-乳白蛋白、免疫球蛋白和牛血清白蛋白等[2](表1)。乳清蛋白含有豐富的必需氨基酸,易被生物體消化吸收[3],有“蛋白之王”的美譽,因此被作為功能性食品、營養制品等的重要原料和成分,廣泛應用于食品生產中。目前主要通過超濾技術或透析過濾技術制備乳清蛋白產品,依據蛋白質含量的不同,可將濃縮乳清蛋白分為4 類,分別為WPC34、WPC50、WPC75、WPC80,而分離乳清蛋白是指蛋白質相對含量高于90%的乳清蛋白產品。

表1 牛乳清蛋白的組成及功能[2]Table 1 Composition and functions of whey protein from cow’s milk[2]
乳清蛋白中的一些成分容易引發過敏反應,β-乳球蛋白和α-乳白蛋白是其中主要的過敏原,能夠使機體產生免疫應答,從而表現出強致敏性[4]。乳清蛋白自身性質也不穩定,在加工生產過程中高級結構容易被破壞,致使其物理、化學及生物功能發生改變,限制了乳清蛋白的應用。通過對乳清蛋白進行改性處理能夠改變其疏水基團分布、空間排列構象以及氨基酸的組成等,進而改善乳清蛋白的功能性質或開發新的功能特性[5]。
本文主要綜述了國內外學者們對乳清蛋白的改性技術,總結了乳清蛋白物理化學及酶法改性技術的應用及對乳清蛋白結構及功能影響的研究進展,以期為提高乳清蛋白資源的高效利用和經濟價值提供參考。
1 物理改性
物理改性是通過物理方法(如機械能、熱能和聲能)來修飾蛋白質的一種改性方法,主要使蛋白質的高級結構和分子凝集模式發生改變。和化學改性相比,物理改性具有一定的優勢,其不需要添加食品以外的其他化學成分,改性后的產品也不具有化學殘留物,具有很好的安全性。物理改性乳清蛋白的方法主要包括熱處理、高壓處理、微波處理、超聲波處理、超臨界二氧化碳流體處理和等離子體處理。
1.1 熱變性
1.1.1 溫度對乳清蛋白物理改性的影響
乳清蛋白在加熱過程中,會改變β-乳球蛋白和α-乳白蛋白的結構。β-乳球蛋白常溫狀態以自然二聚物形式存在,當溫度高于60 ℃時,球狀折疊結構打開伸展,內部巰基(—SH)暴露,在二硫鍵(S—S)的作用下分子間重新折疊,形成熱變性聚集物;當溫度高于85 ℃時,聚集物中的S—S發生斷裂,β-乳球蛋白進一步伸展[6]。雖然α-乳白蛋白不含游離—SH,但其中的S—S遭到破壞后與其他含有游離—SH的蛋白質聚合進一步形成蛋白復合物[7]。
由于加熱過程中乳清蛋白的固有結構發生改變,因此其理化性質也會發生改變。例如,當加熱溫度控制在60 ℃以上時,乳清蛋白的起泡性變差,泡沫穩定性卻被改善,主要由于β-乳球蛋白的展開暴露了游離—SH,促進了S—S的形成,蛋白質發生交聯從而造成起泡性變差。然而泡沫一旦形成,溫度升高,伴隨著S—S數量的增多,增加了形成泡沫的強度[8]。85 ℃加熱處理能夠提高濃縮乳清蛋白和分離乳清蛋白的乳化穩定性,乳清蛋白聚合物通過S—S的作用折疊生成,85 ℃加熱處理后聚集物中的S—S發生斷裂,β-乳球蛋白進一步伸展,有利于分子有序重排,從而使蛋白的親水親油性增強,更容易分散在乳化界面中[6]。Glibowski等[9]將質量分數10%的乳清蛋白分散液分別進行單次加熱(pH 7.0、80 ℃下加熱30 min)和二次加熱(pH 8.0、80 ℃下加熱30 min,pH 7.0、80 ℃下加熱30 min),結果發現二次加熱影響乳清蛋白的凝膠特性,乳清蛋白成膠速度快,具有較低的剪切應力和剪切應變,黏度增加。因此,升高溫度可使乳清蛋白的乳化穩定性、凝膠性及黏度增強。
1.1.2 時間對乳清蛋白物理改性的影響
乳清蛋白的變性程度和功能性質受熱處理時間的影響。吳丹陽等[10]發現乳清蛋白的變性程度和乳清蛋白-酪蛋白的結合程度隨著熱處理時間的延長明顯增大。劉翠平等[11]發現乳清蛋白在75~95 ℃的溫度變性區間內熱穩定性隨熱處理時間的延長而逐漸增加,這可能是因為熱處理時間過長乳清蛋白的結構被破壞。韓宛君等[12]發現延長熱處理時間會導致乳清蛋白的黏度增加,這可能是因為加熱過程使乳清蛋白分子鏈發生熱運動,進而暴露了內部的疏水基團,疏水鍵和S—S的共同作用使疏水基團凝集。
1.1.3 金屬離子對乳清蛋白物理改性的影響
對于熱誘導乳清蛋白形成凝膠的過程,添加金屬離子后蛋白質構象會發生改變。分子間的靜電屏蔽作用和氫鍵的作用使得蛋白質的分子展開,二級結構中β-折疊的含量升高,α-螺旋、β-轉角及無規卷曲含量降低,有序性降低,蛋白分子間的相互作用增強,促進更多分子的聚集和交聯,從而誘導蛋白聚合物的形成[13]。一般用來誘導乳清蛋白凝膠的金屬離子有鈉離子和鈣離子。當體系pH值為7、NaCl濃度為50 mmol/L或者CaCl2濃度為10 mmol/L時,在較低濃度乳清蛋白條件下加熱即可形成熱誘導凝膠[14]。鈉離子和鈣離子的添加能夠縮短乳清蛋白凝膠的形成時間,加快聚合速度,改變聚集體尺寸[14]。鈉離子主要依靠靜電屏蔽作用使蛋白質分子聚集,形成的凝膠結構致密、光滑,孔隙小,凝膠切口呈纖細絲狀;鈣離子除了靜電屏蔽作用還可以與帶負電的—COOH形成離子橋[15]。鈣離子形成的凝膠結構疏松多孔,形成由單一顆粒鏈節交聯而成的“串球狀”膠束,凝膠膠束比鈉離子粗且不均勻。
低濃度的鈉離子不能使乳清蛋白形成凝膠,在pH 6.7、溫度90 ℃下反應20 min,只有鹽離子濃度增至40~60 mmol/L時才能形成凝膠。當濃度繼續增加至60~100 mmol/L時,凝膠的彈性模量、黏彈恢復性、持水力隨著濃度的升高而升高,此時亮度較低;當濃度為150~200 mmol/L時,凝膠彈性模量和黏彈恢復性降低,持水力和亮度升高;當濃度為200 mmol/L時凝膠強度最大;當濃度大于200 mmol/L時,只有加熱溫度在60 ℃以上時,β-乳球蛋白才能發生不可逆的變性作用[16-18]。
乳清蛋白溶液只有加熱到70 ℃才能對鈣離子產生一定的敏感性,從而誘導形成凝膠[19]。低濃度鈣離子使乳清蛋白形成的凝膠是透明的線性結構,隨著濃度的升高會逐漸形成塊狀(不透明)凝膠。當鈣離子濃度為10~20 mmol/L時,凝膠硬度迅速增加,20~30 mmol/L時凝膠硬度最大,繼續增加濃度凝膠硬度下降,50 mmol/L之后凝膠硬度變化較小;當鈣離子濃度為50 mmol/L時凝膠彈性最大,60 mmol/L時內聚性最大。鈣離子濃度較高時,凝膠強度無明顯變化,但凝膠率增加。鈣離子濃度增加至180 mmol/L的過程中,剪切應力逐漸變大,剪切應變逐漸變小[20-21]。
1.1.4 乳清蛋白濃度對乳清蛋白物理改性的影響
當乳清蛋白濃度偏高時,變性后的蛋白質分子先是呈線狀或顆粒狀的聚合物,進而聚集為無定型的簇狀聚合體,當濃度繼續增加時,這種聚合體會產生凝膠或者沉淀,此時的濃度為蛋白質的臨界質量分數,一般為9%~12%[22]。質量分數10%分離乳清蛋白以及β-乳球蛋白分別經80、85、90 ℃處理后乳清蛋白逐漸形成凝膠,黏度隨溫度的升高而增加[22]。
1.1.5 其他成分對乳清蛋白物理改性的影響
Beaulieu等[23]研究發現將乳清蛋白和果膠混合體系加熱會形成以果膠和乳清蛋白絡合物形式存在的凝膠。乳清蛋白呈三維網絡結構,液體果膠存在于三維網絡的空隙中。Line等[24]在pH 7、85 ℃條件下加熱β-乳球蛋白懸浮液45 min制備乳濁液,后與向日葵油混合制備冷凝膠,發現形成的乳濁液冷凝膠性質受到向日葵油含量的影響,提高向日葵油含量,得到的凝膠具有較高的儲能模量和持水力。Nikolaidis等[25]在pH 7.0下加熱(80 ℃、15 min)乙醇和乳清蛋白,利用差示紫外光譜分析共混產物,結果發現乙醇體積分數在20%~50%范圍時,乳清蛋白變性程度急劇增加。Schmitt等[26]研究了礦物質和乳清蛋白成分對蛋白微凝膠形成的影響,發現脫礦質后的α-乳白蛋白和β-乳球蛋白在pH 5.7下以質量比2∶8或在pH 5.8下以純β-乳球蛋白的形式85 ℃加熱15 min可以制得微凝膠。但單獨利用α-乳白蛋白不能形成凝膠,這是因為α-乳白蛋白會降低參與微凝膠形成的疏水吸引力,從而使平衡向可溶性聚集體方向轉移。
1.1.6 乳清蛋白來源對乳清蛋白物理改性的影響
駱駝奶中的乳清蛋白相對耐熱,具有較高的變性溫度。90 ℃熱處理5 min后,駱駝奶中有67%的α-乳清蛋白未變性,而牛乳中僅有5%的α-乳清蛋白未變性。為了保證食品安全性,某些國家或地區會干預奶酪的制作過程,強制性要求對制備奶酪的牛奶進行熱處理,但較高溫度的熱處理會影響奶酪質量與風味,前人優化駱駝奶干酪工藝條件后,建議采用65 ℃、30 min或72 ℃、30 s的熱處理工藝[27]。
水牛奶中的乳清蛋白熱穩定性較差,研究發現,延長提取時間或升高提取溫度均會降低水牛奶的單體乳清蛋白和總乳清蛋白的提取率,進而影響乳清蛋白熱穩定性效果。乳清蛋白的4 種主要成分中,α-乳白蛋白熱穩定性最好,免疫球蛋白熱穩定性最差,4 種成分的熱穩定性由高到低依次為α-乳白蛋白、β-乳球蛋白、血清蛋白、免疫球蛋白[28],這與牛乳中各成分的熱穩定性是一致的。
1.2 高壓誘導變性
高壓處理方法包括高靜水壓(high hydrostatic pressure,HHP)處理、高壓均質和動態高壓處理。高壓一般被用于食品中微生物和芽孢的滅活,此外還可以利用高壓制備乳清蛋白凝膠。
1.2.1 高壓誘導變性機理
高壓作用主要影響和破壞蛋白質三級結構和四級結構中的離子鍵和氫鍵等非共價鍵,S—S和—SH發生斷裂和重排,增強疏水相互作用,而對共價鍵的影響很小。蛋白分子經高壓處理后解聚為一些較小的顆粒亞基單位,隨后亞基單位開始伸展,極性和疏水基團原來包裹在球狀蛋白分子內部,在亞基單位伸展后暴露出來,增強了蛋白顆粒表面的電荷分布,當超過臨界壓力后,之前解聚的蛋白質會再次聚集。高壓作用對蛋白質二級結構也有一定的影響,研究發現蛋白質二級結構中的α-螺旋、β-折疊和β-轉角含量減少,轉化為無規卷曲結構,但是高壓不會影響其一級結構[29-30]。He等[31]采用相分離理論和原位光散射技術研究了高壓誘導的乳清蛋白凝膠化的動力學過程,發現成膠時間隨乳清蛋白濃度的升高而縮短,散射光強度與時間的對數遵循線性關系,表明在高壓作用下乳清蛋白的凝膠化過程出現了相分離現象。
1.2.2 高靜水壓對乳清蛋白物理改性的影響
HHP技術是指在室溫或溫和條件下利用100~2 000 MPa的靜水(油)壓力處理物料,以殺菌、提取、蛋白改性(酶)等為目的的非熱處理技術[32]。HHP處理會破壞蛋白質的非共價鍵(如離子鍵、氫鍵和疏水鍵等),但不改變共價鍵結構[33]。單糖、寡糖、氨基酸和維生素等小分子物質和一些風味組成物質不會受HHP影響[34]。
van Camp等[35]利用高壓處理乳清蛋白,當壓力為400 MPa、時間為30 min時,乳清蛋白形成較多孔隙的網絡結構凝膠。經流變學振蕩實驗發現,高壓誘導的凝膠有較低的消耗模量、儲能模量及較高的凝膠強度[36]。Lim等[37]針對HHP處理后乳清蛋白的功能特性進行了研究,發現經過處理的乳清蛋白溶解性和起泡性增強。Keim等[38]在600 MPa、30 ℃和0~30 min條件下研究了高壓誘導乳清蛋白凝膠的形成,發現延長HHP處理時間,乳清蛋白中β-乳球蛋白和α-乳白蛋白含量降低,分子間S—S數量增多,形成的凝膠彈性與硬度變大,說明S—S數量直接影響高壓誘導乳清蛋白凝膠的質構特性。Dumay等[39]研究了乳清蛋白濃度對HHP改性過程的影響,發現30 min、400 MPa下濃縮乳清蛋白的質量分數至少達到11%才能形成凝膠,降低壓力到200 MPa時,濃縮乳清蛋白的質量分數至少為22%才能形成凝膠。
1.2.3 高壓均質對乳清蛋白物理改性的影響
高壓均質是一種利用高速運動和高壓能的釋放將顆粒粗大的液體物料粉碎成顆粒細微的穩定乳濁液或懸濁液的新型乳品加工技術[40]。高壓均質能夠使乳清蛋白二級結構中的α-螺旋以及β-折疊含量降低,導致乳清蛋白的伸展和疏水基團的暴露,進而提高溶解度;同時乳清蛋白的柔韌性增強,從而以更快吸附速率聚合[41-42]。
Kuhn等[43]研究發現乳清蛋白乳液在較低壓力(20 MPa)下均質化后粒度減小,乳液顆粒呈窄尺寸單峰分布,形成穩定的亞微米乳液,可以阻止液滴聚集和抑制脂質氧化。當壓力增加到80 MPa時,乳液顆粒分布呈雙峰型,表明液滴發生聚結。當增加均質化循環次數時,形成的高分子質量聚集體有利于增加乳液黏度和初級氧化產物含量。Yan等[44]研究發現高壓均質化能夠增加乳清蛋白乳液的亮度,淡化乳液的顏色,改善乳清蛋白的起泡特性及穩定性,增加乳液的糖度。Bouaouina等[45]發現高壓均質使乳清蛋白聚集體發生解聚,造成分子內的疏水基團暴露,能夠增強乳清蛋白疏水作用,增加乳清蛋白界面黏度,增強起泡性及泡沫穩定性。
1.2.4 動態高壓微射流對乳清蛋白物理改性的影響
動態高壓微射流是近年來才興起的高壓均質技術,通過高頻振動、空穴爆炸、強烈剪切及連續操作等改變大分子結構,影響蛋白質的構象,從而改變蛋白質的性質[46]。
Zhong Junzhen等[47]發現使用動態高壓微射流處理β-乳球蛋白時,超過80 MPa會明顯改善β-乳球蛋白致敏性,同時提高β-乳球蛋白溶液的起泡性及乳化穩定性。鐘俊楨等[48]研究了動態高壓對乳清蛋白性質的影響,結果發現動態高壓可以提高乳液起泡性及泡沫穩定性。壓力升至120 MPa后,加大剪切速率,乳清蛋白溶液出現剪切稀化現象。
1.3 微波處理對乳清蛋白物理改性的影響
微波是一種頻率在300~3 000 MHz的電磁波。微波作用蛋白質時,蛋白質分子內的極性側鏈和偶極分子發生高頻振蕩,從而改變蛋白質的二級結構,使β-折疊的含量上升,α-螺旋的含量下降[49-50]。
邢紹平[51]研究微波對乳清蛋白凝膠質構特性的影響時發現,當溫度60 ℃、功率500 W、時間60 s、蛋白質量分數18%、酸堿中性時乳清蛋白凝膠的質構特性最佳。Kaya等[52]在微波參數為700 W、2 450 MHz條件下對乳清蛋白膜的影響進行了研究,結果發現5 min就可以實現乳清蛋白膜的干燥,而傳統室溫下干燥需要18 h,微波處理不僅縮短了干燥時間,同時使膜的斷裂伸長率和拉伸強度增加,因此微波處理可以改善膜的彈性等和機械強度。
1.4 超聲波處理對乳清蛋白物理改性的影響
超聲波是一種頻率在20~500 kHz的聲波。超聲處理可以使蛋白質三級結構展開,使具有熒光發色團的氨基酸在進入蛋白質的疏水區域后發生相互作用[53],二級結構中α-螺旋轉化為β-折疊[54],進而影響蛋白質的構象。
Stanic-Vucinic等[55]發現高強度超聲可以提高表面疏水性并改變β-乳球蛋白的二級結構。Zisu等[56-57]探究了超聲對乳清蛋白理化特性的影響,結果發現超聲處理顯著增加了熱誘導的乳清蛋白凝膠強度,提高了乳清蛋白溶液的持水性和凝膠強度。Chandrapala等[58]研究了超聲處理后乳清蛋白的熱性質和結構的變化,結果表明乳清蛋白經5 min超聲處理后,變性焓值降低,長時間的超聲處理會導致蛋白質重新聚集,從而影響乳清蛋白的聚合度。
1.5 超臨界二氧化碳流體處理對乳清蛋白物理改性的影響
超臨界二氧化碳因其高效、綠色的特點被廣泛應用于食品加工等方面[59]。可用于分離乳清蛋白,改善其品質和風味[60]。超臨界二氧化碳處理能夠改變乳清蛋白的結構和構象,使β-折疊含量增加,α-螺旋含量減少[61]。
Xu Duoxia等[61]發現經30~60 ℃、20 MPa超臨界二氧化碳處理1 h,分離乳清蛋白溶液的濁度與粒度增加。在60 ℃下用超臨界二氧化碳處理的分離乳清蛋白熒光強度增加,表明疏水區域暴露,蛋白已部分變性。Afizah等[62]發現90 ℃下超臨界二氧化碳處理變性的蛋白質對1-苯胺基-萘-8-磺酸鹽的親和力增強,對反式-十八碳四烯酸的親和力減弱,表明蛋白質結構發生變化。Mustapha等[63]在室溫下進行濃縮乳清蛋白的水分散實驗,結果顯示,超臨界二氧化碳處理后的濃縮乳清蛋白表面疏水性增強,稠度增加,乳液具有假塑性及良好的熱穩定性,顆粒的分散性增強。
1.6 低溫等離子體處理對乳清蛋白物理改性的影響
低溫等離子體技術是一種氣態原子和衍生物質激發產生的用于食品殺菌和滅酶的新興物理加工技術[64]。低溫等離子體的自由基和其他活性成分可以從等離子體內部產生[65],無需使用溶劑,是一種綠色技術。低溫等離子體改性過程中,一方面可以直接或間接在分子表面引入惰性官能團,利用H2、N2、Ar、NH3、CO和O2等非聚合性氣體等離子體與分子表面相互作用,在分子表面形成自由基或—COOH、—NH2和—OH等官能團,這些基團可以連接或鍵合其他分子或聚合物,進而獲得所需的表面性能;另一方面,低溫等離子體可以直接利用其產生的離子、電子、光子、自由基以及激發態分子等活性粒子促使分子直接聚合,使得有機分子的共價鍵打開,實現等離子體聚合[66]。
Zhang Hao等[67]研究發現等離子體會引發蛋白二級結構的改變以及肽鏈的聚合。等離子體作用的增強會導致β-折疊和隨機序列含量增加,α-螺旋含量減少。在等離子體作用下蛋白質功能性質發生改變,該結果有助于理解等離子體改性蛋白質的作用機制,并從分子角度提供了理論解釋。
2 酶法改性
酶法改性是通過蛋白質和某種酶發生相互作用,導致蛋白質交聯或水解,蛋白結構發生改變,進而改善蛋白質的功能性[68]。對乳清蛋白進行酶法改性的方式主要有兩種,酶法水解和酶法交聯。乳清蛋白經酶法水解后多肽鏈降解,能夠實現乳清蛋白分子內或分子間的重新連接,進而改善功能特性。酶法交聯的實質是人為地引入交聯鍵使乳清蛋白發生類蛋白質反應,產生流變學性質較好的物質[69]。
2.1 酶法水解
乳清蛋白含有許多天然的免疫調節肽,其是乳清蛋白一級序列的一部分,這些肽可以在腸道消化過程中釋放,也可以通過體外酶水解產生特異性和非特異性免疫應答。乳清蛋白的多肽骨架通過蛋白酶分解后穩定性得到增強[64]。用于水解的蛋白酶專一性很強,不同蛋白酶具有不同的水解位點[70]。
2.1.1 堿性蛋白酶對乳清蛋白酶法水解的影響
堿性蛋白酶是一種非特異性蛋白質肽鏈內切酶,作用底物十分廣泛[70]。堿性蛋白酶可以作用于羧基側鏈上的所有疏水性和芳香族氨基酸羧基端的酰胺鍵,催化蛋白質分子內的肽鍵水解產生具有較小分子質量的肽,這個過程中蛋白分子內的抗原結合位點被破壞,蛋白質的過敏性得到有效改善[71]。與其他蛋白酶水解乳清蛋白的效果相比,堿性蛋白酶具有更好的水解效果,更高的水解速率[72],且β-乳球蛋白僅能夠被堿性蛋白酶徹底水解[71],這是因為乳清蛋白在酸性和中性環境下溶解效果不好,但在堿性環境下具有良好的溶解性。
劉利軍等[73]利用響應面分析法獲得了堿性蛋白酶水解乳清蛋白的最佳條件,在pH 8.5、反應溫度55 ℃、水解時間3 h條件下,水解度可達19.34%。沈小琴[74]和Wroblewska[75]等的研究也證實了堿性蛋白酶能夠有效降低乳清蛋白的抗原性。不同蛋白酶處理的乳清蛋白抗原性具有明顯差異,經堿性蛋白酶處理后,α-乳白蛋白的抗原性甚至降低了99.72%,β-乳球蛋白抗體的抗原性也降低了50.02%[74]。因此可以將該方法應用于低敏牛奶的制備。
2.1.2 中性蛋白酶對乳清蛋白酶法水解的影響
中性蛋白酶是一種催化蛋白水解的內肽酶。中性蛋白酶主要酶解疏水性高分子氨基酸的羧基端肽鍵,獲得低分子質量肽,但中性蛋白酶的水解特異性不強,能夠在中性、弱酸或弱堿環境下酶解蛋白質,最適pH值范圍為6.0~7.5[76]。中性蛋白酶水解乳清蛋白的效果不如堿性蛋白酶[70],為了使乳清蛋白得到良好的水解效果,一般采用雙酶復合法(堿性蛋白酶復合中性蛋白酶)進行同步酶解。
由于中性蛋白酶水解乳清蛋白的效果不明顯,目前大部分工作還停留在探究中性蛋白酶水解方法和優化水解條件上。徐洪軍等[76]利用甲醛滴定法測定中性蛋白酶酶解后β-乳球蛋白氨基酸態氮的含量,得到中性蛋白酶處理β-乳球蛋白的最優條件:水解溫度50 ℃、水解時間6 h、pH 7.2。吳明樓等[77]以中性蛋白酶水解乳清蛋白制備乳清蛋白水解液,對水解乳清蛋白工藝條件進行了正交試驗優化,最終水解度可達20.31%。韓仁嬌等[78]探尋了乳清蛋白的雙酶水解技術,優化了β-乳球蛋白水解工藝,結果發現55.2 ℃條件下同時添加F中性蛋白酶與G中性蛋白酶,β-乳球蛋白水解率可達(58.99±0.02)%,其中51.76%是分子質量分布在1 000~180 u之間的肽段,游離氨基酸相對含量為2.34%,明顯優于市售的同類乳清蛋白產品。
2.1.3 地衣芽孢桿菌蛋白酶對乳清蛋白酶法水解的影響
地衣芽孢桿菌蛋白酶是一種芽孢桿菌屬細菌分泌的胞外蛋白酶。地衣芽孢桿菌蛋白酶水解乳清蛋白后形成由小聚集體組成的微粒狀態軟凝膠[79-80]。有研究表明β-乳球蛋白水解產生的聚集體由一系列中等大小的肽(2~6 kDa)組成,這些肽通過非共價鍵(主要是疏水和靜電相互作用)連接在一起[80],使乳清蛋白形成聚集體,改善乳清蛋白的凝膠性,提高乳清蛋白的凝膠速率和凝膠強度。
Otte等[81]利用比濁法、體積排阻色譜法、動態光散射法和流變學法揭示了地衣芽孢桿菌蛋白酶誘導乳清蛋白聚集和凝膠的現象,結果表明地衣芽孢桿菌蛋白酶水解乳清蛋白導致了肽聚集體的形成,并在40 ℃、pH 7.0下形成顆粒狀凝膠。純化的β-乳球蛋白制劑水解后也會形成聚集體,并且在質量濃度低至70 mg/mL條件下仍然能夠形成凝膠。Otte等[82]鑒定了在中性條件下地衣芽孢桿菌蛋白酶水解β-乳球蛋白過程中形成聚集體的肽,結果表明聚集體由6~7個主要肽組成,其中4個肽被初步鑒定,分別為β-乳球蛋白的f75-89、f75-108、f135-157和f135-158。β-乳球蛋白f135-158肽段的正電荷和負電荷簇與疏水區域交替,這表明聚集是通過疏水相互作用和靜電作用形成的。
2.1.4 胃蛋白酶對乳清蛋白酶法水解的影響
胃蛋白酶是一種由胃黏膜細胞分泌出的胃蛋白酶原激活得到的外肽酶。胃蛋白酶催化蛋白氨基端或羧基端芳香族氨基酸(酪氨酸、色氨酸和苯丙氨酸)的肽鍵[83],對氨基酸序列要求很高,特異性非常強,尤其是pH值在1.3附近時,只酶解多肽鏈內部苯丙氨酸的肽鍵。胃蛋白酶屬于酸性蛋白酶,最適pH值為3,在中性或堿性環境下活性喪失,而乳清蛋白在酸性環境下溶解度較差,且胃蛋白酶具有強特異性,導致其水解效果極差。含苯環的芳香族氨基酸很多都是疏水氨基酸,當胃蛋白酶作用乳清蛋白時,會暴露疏水性氨基酸末端,增加最終產物中疏水性氨基酸含量,進而提高乳清蛋白的疏水性[70]。由于胃蛋白酶是外肽酶,造成分子內肽鍵得不到充分水解,大量過敏位點被保留,不能有效降低蛋白質抗原性,所以胃蛋白酶對β-乳球蛋白(主要過敏原蛋白)的水解作用不強[74]。
許女等[84]研究了胃蛋白酶對乳清蛋白抗氧化活性的影響,發現在2 h內水解產物的總還原能力和1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力均隨時間的延長而增強,并都在2 h達到最大值。Pintado等[85]發現胃蛋白酶可以快速水解α-乳白蛋白,但水解β-乳球蛋白的速度很慢。賈建等[86]優化了胃蛋白酶水解乳清蛋白的條件,得到最佳水解條件為酶解時間187 min、溫度40.5 ℃、pH 2.5,未優化時的水解度不足10.00%,優化后水解度高達16.98%。
2.1.5 胰蛋白酶對乳清蛋白酶法水解的影響
胰蛋白酶是一種從動物胰臟提取的外肽酶[74]。只催化精氨酸或賴氨酸羧基端肽鍵,得到以精氨酸或賴氨酸為C-末端殘基的肽段,胰蛋白酶作為最常用的蛋白水解酶,催化特異性也最強。胰蛋白酶和胃蛋白酶性質相似,都屬于外肽酶,但胰蛋白酶對乳清蛋白的作用效果稍強,胰蛋白酶同樣不易水解β-乳球蛋白,不能有效降低其抗原性。酶解過程中乳清蛋白的疏水性較穩定,這是由于胰蛋白酶的特異性催化位點是堿性氨基酸(精氨酸和賴氨酸)羧基端肽鍵,水解產物中疏水氨基酸的含量不高,疏水性不會發生較大變化。
Chobert等[87]用胰蛋白酶處理乳清蛋白,結果發現乳清蛋白水解產物在所有pH值下的溶解度均高于對照乳清蛋白,在堿性環境下乳化能力增強,水解產物的乳化活性遠高于乳清蛋白。Guo等[88]研究了β-乳球蛋白對胰蛋白酶水解的敏感性,結果發現β-乳球蛋白溶液在90~100 ℃下熱處理5 min或10 min可以增強胰蛋白酶對蛋白的水解程度,這是因為天然β-乳球蛋白致密的球狀結構對胰蛋白酶具有抗性,而加熱處理使蛋白質構象發生變化,使乳清蛋白更易于水解。高學飛等[89]探究了胰蛋白酶水解乳清蛋白的最優條件,通過建立水解參數與乳清蛋白水解度之間的回歸模型,得到最佳水解條件為水解時間12 h、溫度52.3 ℃、初始pH 8.37、乳清蛋白質量分數6%。
2.1.6 木瓜蛋白酶對乳清蛋白酶法水解的影響
木瓜蛋白酶是一種從木瓜果實中提取得到的純天然生物酶。木瓜蛋白酶是僅有一條單鏈的內切酶,共含有212個氨基酸,同時具有酯酶和蛋白酶的活性,底物特異性十分廣泛[90]。木瓜蛋白酶可以水解多肽、酰胺以及酯中的賴氨酸、精氨酸和甘氨酸羧基端的肽鍵,對多種物質具有很強的水解能力,如蛋白、多肽、酰胺、酯等,除此之外,其還能夠將蛋白水解物合成蛋白類物質。木瓜蛋白酶在酸性、中性和堿性條件下均能水解乳清蛋白,其對乳清蛋白抗原表位的破壞效果僅次于堿性蛋白酶,具有很好的抗原性。為使乳清蛋白獲得最大水解度,一般利用木瓜蛋白酶和堿性蛋白酶進行雙酶解,這是由于堿性蛋白酶是非特異性的蛋白質肽鏈內切酶,且作用底物十分廣泛,能夠水解所有羧基端具有疏水性或芳香族的氨基酸,而木瓜蛋白酶與堿性蛋白酶催化的肽鍵具有互補性,從而能夠最大程度地水解乳清蛋白。
Kim等[91]研究了木瓜蛋白酶對乳清蛋白水解的影響以及水解產物肽的鐵結合能力,結果發現乳清蛋白中的主要抗原部分β-乳球蛋白在50 ℃下60 min內可被完全水解,水解產物的鐵溶解度為87%。Weerasinghe等[92]發現乳清蛋白可以抑制木瓜蛋白酶的活性,使木瓜蛋白酶的最低殘留活性為8.7%,乳清蛋白中的高分子質量成分比低分子質量成分抑制效果更明顯,然而乳清蛋白中的主要成分β-乳球蛋白和α-乳白蛋白對木瓜蛋白酶沒有抑制作用。曲杜娟等[93]發現經木瓜蛋白酶處理的乳清蛋白酶解物對于酸奶的發酵有明顯的促進作用,酶解物中小于5 000 u的肽段可能有利于乳酸菌的生長繁殖,添加酶解物可以明顯增加貯藏期酸奶的表觀黏度。
2.1.7 無花果蛋白酶對乳清蛋白酶法水解的影響
無花果蛋白酶是一種存在于無花果的乳膠及花托蛋白質中的純天然生物酶。無花果蛋白酶可以作用于多種物質(如蛋白質、多肽等的苯丙氨酸和酪氨酸)的肽鍵,其水解特異性廣泛,水解能力很強。無花果蛋白酶穩定性好,是一種耐熱性較強的蛋白酶,其內部含有—SH基團,具有凝乳作用,最適凝乳溫度高達85 ℃[94]。無花果蛋白酶和木瓜蛋白酶雖然都是植物蛋白酶,但無花果蛋白酶的適宜pH值范圍比木瓜蛋白酶更寬,木瓜蛋白酶對底物的親和性更高[95]。
肖安樂[96]利用無花果蛋白酶水解熱變性乳清蛋白,結果發現經35 h的水解,無花果蛋白酶對熱變性乳清蛋白的水解度為16.88%,乳清蛋白的乳化穩定性下降。邱業先等[97]對無花果蛋白酶水解牛血清白蛋白進行了研究,發現無花果蛋白酶對牛血清白蛋白具有水解作用。
2.2 酶法交聯
蛋白酶通過類蛋白反應使乳清蛋白發生交聯,將氨基酸從一條肽鏈轉移到另一條肽鏈上實現對肽鏈的改造,使小分子質量肽鏈轉變成分子質量高的肽鏈,增強流變性。這個過程β-乳球蛋白具有很高的參與度,能夠形成分子內或分子間交聯。
2.2.1 谷氨酰胺轉氨酶對乳清蛋白酶法交聯的影響
谷氨酰胺轉氨酶(transglutaminase,TGase)是一種轉移酶,經常被用于蛋白質的酶法改性研究。TGase主要催化酰基轉移反應,包括3 種反應機理,分別為交聯聚合、脫酰胺化和引入伯胺。以蛋白質鏈上游離氨基酸的ε-氨基、賴氨酸殘基的氨基等為受體,酰基供體為谷氨酰胺殘基上的γ-羥基酰胺基,在分子內和分子間形成ε-(γ-谷氨酰胺)賴氨酸交聯鏈[69](圖1),進而改善乳化性和起泡性等性質。
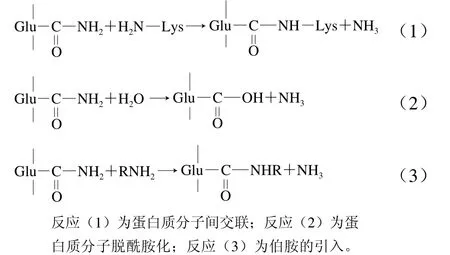
圖1 TGase催化反應示意圖[69]Fig. 1 Schematic diagram of TGase-catalyzed reactions[69]
Foegeding等[98]利用TGase使β-乳球蛋白和酪蛋白發生反應,以實現分子內或分子間的交聯,結果發現對聚合物黏度影響由高到低的因素依次為反應溫度、pH值、反應時間、加酶量,當溫度50 ℃、pH 8.00、反應時間60 min、加酶量5 U/g時,所得的聚合物黏度適宜、穩定且具有高凝膠性。Agyare等[99]研究發現TGase顯著提高了β-乳球蛋白的變性溫度,共價交聯后降低了蛋白質的表面疏水性,賴氨酰殘基上的正電荷被消除,交聯蛋白呈現U型pH值穩定性分布,在pH 4.0~4.5時具有最大濁度。Gauche等[100]的研究表明,當Tgase添加量增加到50 U/g時,聚合物含量和溶液的稠度指數增加,有利于非牛頓行為。Sayadi等[101]研究低脂伊朗白奶酪發現,將TGase加入到奶酪乳中能夠獲得更高的蛋白質回收率和硬度指數。Hernàndez-Balada等[102]向質量分數10%的分離乳清蛋白中加入明膠,結果引起體系黏度和彈性模量的同時增加,表明通過TGase處理含有少量明膠的乳清蛋白和蛋白質混合物可以開發新型生物聚合物。Truong等[103]將TGase生物素化并吸附到抗生物素蛋白親和基質上,使其與質量分數為8%的乳清蛋白溶液作用,結果表明乳清蛋白發生有限交聯,隨著作用時間的延長凝膠強度增加,該方法中酶能夠再循環利用[104]。Shao Shengnan等[105]將TGase交聯乳清蛋白后用乙醇去溶劑化制備乳清蛋白-鋅納米微粒,所得納米微粒具有較好的穩定性和較高的裝載率,可以用作遞送鋅的良好載體。
2.2.2 漆酶對乳清蛋白酶法交聯的影響
漆酶是一種單電子的氧化還原酶,屬于多酚氧化酶,含有銅元素,作用底物十分廣泛,除了可以催化氧化酚,還可以作于芳胺類化合物及其衍生物,能夠使蛋白質和氧化產物醌與酚發生交聯,增強凝膠性[106]。蛋白質與漆酶作用后形成底物自由基,與漆酶中的銅離子發生協同作用,可以將蛋白中的—SH氧化成S—S,將酪氨酸殘基氧化成醌,醌與伯胺等活性氨基發生席夫堿加成或邁克爾加成,實現蛋白質交聯[107]。
Jiang Zhanmei等[108]探究了在阿魏酸的存在下漆酶對α-乳白蛋白的催化交聯作用,結果發現經漆酶和阿魏酸處理后形成聚合物,其抗氧化活性、凝膠強度和保水能力增強,且與反應時間呈正相關。隨著反應時間的延長,漆酶催化的α-乳白蛋白-阿魏酸共軛物的粒徑明顯變大,固有熒光強度、表面疏水性、DPPH自由基清除活性和亞鐵離子還原能力顯著增加。
2.2.3 酪氨酸酶對乳清蛋白酶法交聯的影響
酪氨酸酶是一類復雜的多亞基氧化還原酶,屬于單酚氧化酶,也含有銅元素,當催化蛋白反應時,首先一元酚鄰位羥基化為二元酚,再氧化成具有較高活性的苯醌,苯醌進一步與蛋白質中的游離氨基酸和—SH發生加成反應,最終形成酪氨酸-賴氨酸、酪氨酸-半胱氨酸、二酪氨酸[109],而在交聯反應過程中必需氨基酸的含量減少[110]。有研究表明可以利用酪氨酸酶誘導α-乳白蛋白和β-乳球蛋白形成凝膠,并指出酪氨酸酶替代傳統TGase的可行性[111-112]。
Thalmann等[111]探究了咖啡酸對酪氨酸酶交聯乳清蛋白的影響,結果發現咖啡酸存在時β-乳球蛋白和α-乳白蛋白均可以發生聚合,當咖啡酸不存在時只有α-乳白蛋白發生聚合,而且反應過程中還有大于300 kDa的聚合體生成。Ercilicura等[113]使用酪氨酸酶交聯β-乳球蛋白,通過圓二色光譜、十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳、表面壓力和界面流動性分析對交聯蛋白進行了研究,結果發現常溫下酪氨酸酶不能作用于β-乳球蛋白,當溫度升高至40 ℃時,β-乳球蛋白發生交聯。
2.2.4 辣根過氧化物酶對乳清蛋白酶法交聯的影響
辣根過氧化物酶是一種利用過氧化氫氧化無機物和有機物的血紅素酶,屬于氧化還原酶,包括一條單一肽鏈和一個鐵卟輔基,發生氧化還原反應時以過氧化氫為電子受體作用底物,可以催化無機離子、雜環化合物、胺類化合物、氧化酚類和過氧化氫。
Dhayal等[114]使用過氧化氫和辣根過氧化物酶誘導α-乳白蛋白生成蛋白納米顆粒,與其他酶誘導的蛋白納米顆粒相比,由于加入了過氧化氫,可以通過控制過氧化氫加入量來調控蛋白質凝膠納米顆粒的形貌與尺寸,結果表明經辣根過氧化物酶誘導的蛋白質凝膠顆粒尺寸適中,形貌大小均勻。
3 化學改性
化學改性是利用化學試劑對蛋白質的作用,斷裂某些肽鍵或者引入帶負電荷基團、二硫基團和親水親油基團等功能性基團進行蛋白改性的方法。化學改性具有非常廣泛的應用,不僅操作簡單,改性效果也十分顯著。蛋白質的化學改性主要涉及磷酸化、糖基化(美拉德反應)、酰化、去酰胺化和酸調改性等方法。
3.1 磷酸化對乳清蛋白化學改性的影響
蛋白磷酸化是由蛋白質激酶將三磷酸鳥苷或三磷酸腺苷γ位磷酸基催化轉移到酪氨酸、蘇氨酸和絲氨酸等底物蛋白質上的過程[115]。化學磷酸化改性方法具有試劑價格低廉、磷酸化效率高、易于工業化等優點,常用的磷酸化試劑有磷酰氯、三聚磷酸鈉、磷酸、五氧化二磷、環狀磷酸三鈉等[116]。磷酸化作用實質上是蛋白質中酪氨酸、蘇氨酸和絲氨酸—OH中的O,賴氨酸ε-NH2中的N,精氨酸—CN3H4中的末端N和組氨酸C3H4N2中的1、3位N與磷酸化試劑提供的Pi發生的—C—N—Pi—或—C—O—Pi—酯化反應[117]。引入磷酸根基團增加了蛋白質的電負性和蛋白分子間的靜電斥力,使蛋白體系變得分散,分子間互相排斥,提高了溶解度,進而改善體系起泡性和乳化性[118]。
Sitohy等[119]研究了β-乳球蛋白的磷酸化作用,結果發現化學磷酸化可以破壞β-乳球蛋白的二級結構,在加熱條件下磷酸化β-乳球蛋白時其二級結構沒有發生改變,表明高溫抑制磷酸化反應。Li Canpeng等[120]對磷酸化對乳清蛋白功能特性的影響進行了探究,結果發現磷酸化是改善乳清蛋白功能特性的有效方法。核磁共振光譜結果顯示乳清蛋白的絲氨酸被磷酸化。圓二色光譜結果顯示乳清蛋白的無規卷曲結構變化很小,但乳清蛋白經磷酸化后的色氨酸熒光強度降低,表面疏水性增強。此外,磷酸化還提高了乳清蛋白的穩定性、乳化性、發泡性、吸水能力和吸油能力。
3.2 糖基化改性對乳清蛋白化學改性的影響
糖基化是利用碳水化合物中的C=O與蛋白質分子上的—NH2(主要是賴氨酸上的α-或ε-NH2)以共價鍵形式結合的一種化學改性方法[121],也稱美拉德反應。相較于其他化學改性方法,糖基化的反應條件更加溫和,較低溫度(60 ℃)下在低水分條件或水溶液中即可發生。
糖基化改性對蛋白質凝膠化的影響較為顯著,蛋白質和碳水化合物主要形成3 種類型的混合膠,分別為聯合型、鑲嵌型和相分離型。聯合型是指發生相互作用的兩種多聚物分子形成共價交聯的網絡結構,鑲嵌型是指兩種多聚物形成的凝膠網狀結構為連續狀態,相分離型是指熱力學不相容時,由于兩種多聚物之間的斥力或對溶劑的吸附性不同形成各自的凝膠結構[19]。糖基化根據反應體系是否有溶劑分為干法糖基化和濕法糖基化。
3.2.1 干法糖基化對乳清蛋白化學改性的影響
干法糖基化是在干熱條件下發生的糖基化反應。Kato等[122]首次提出了干法糖基化的概念,雖然糖基化過程需要很長的反應時間,但后續檢測反應產物十分便捷。蘆晶等[123]研究了多糖與乳清蛋白的反應,并對改性后蛋白最終的功能性質進行了研究,結果發現在45 ℃、68%的相對濕度條件下乳清蛋白與殼聚糖進行17 h的美拉德反應,糖基化產物的溶解性以及乳化穩定性得到了明顯提高。Jimenez-Castano等[124]研究了乳清蛋白中3 種蛋白質(α-乳白蛋白、β-乳球蛋白和牛血清白蛋白)與葡聚糖(分子質量10 kDa和20 kDa)的干法糖基化改性,結果發現分子質量10 kDa的葡聚糖能夠賦予乳清蛋白比20 kDa更高的凝膠強度,改性使牛血清白蛋白和β-乳球蛋白的熱穩定性以及3 種蛋白質的溶解性得到了顯著的提高。Kika等[125]在乳清蛋白中加入羧甲基纖維素,并探究了乳化穩定性的變化,結果發現加入羧甲基纖維素的乳清濃縮蛋白乳化穩定性更好。
3.2.2 濕法糖基化對乳清蛋白化學改性的影響
濕法糖基化適用于小分子的糖類反應,有反應周期短、反應速度快等優點,但也容易發生褐變[126]。Zhu Dan等[127]選擇葡聚糖進行濕法糖基化,當pH 6.5、反應時間24 h、溫度60 ℃且乳清蛋白和葡聚糖的質量分數分別為10%和30%時,可以明顯提高樣品的熱穩定性和乳化性。Chevalier等[128]將葡萄糖、阿拉伯糖、乳糖、半乳糖、鼠李糖以及核糖分別與β-乳球蛋白進行濕法糖基化反應,結果發現與對照組相比,濕法糖基化增強了乳清蛋白-糖接枝物的熱穩定性,提高了乳清蛋白-核糖接枝物與乳清蛋白-阿拉伯糖接枝物的乳化性和乳清蛋白-半乳糖接枝物與乳清蛋白-葡萄糖接枝物的起泡性,說明糖的種類和性質會影響β-乳球蛋白的功能性質。
3.3 酰化對乳清蛋白化學改性的影響
酰化是酸酐通過親電子基團(C=O)與蛋白分子的親核基團(ε-NH2)相互作用引入酸性親水基團,又利用催化劑引入長碳鏈親油基團,最終使蛋白質獲得雙極性基團,成為高分子表面活性劑。常用乙酸酐或琥珀酸酐酰化改性蛋白質,變性過程中蛋白質的ε-NH2被酰化,這個過程改變了蛋白質分子的表面凈電荷,酰化試劑與蛋白質的反應過程見圖2。利用乙酸酐進行酰化改性時,乙酸酐的中性CH3CO—與蛋白中的—NH2連接,減少了正電荷的數量,提高了溶解性;利用琥珀酸酐進行酰化改性時,琥珀酸酐的琥珀酰陰離子連到蛋白質賴氨酸中的—NH2上,代替了蛋白分子中的正電荷而增加了一個負電荷,多肽鏈伸展開,分子柔韌性增強,提高了蛋白質的持水性、持油性、乳化性和起泡性[129-130]。在蛋白質酰化改性中,琥珀酸酐酰化更常用,其作用效果更顯著。
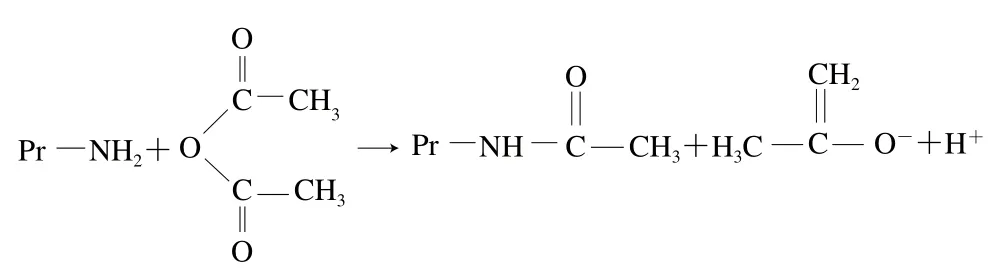
圖2 酰化試劑與蛋白質的反應過程Fig. 2 Reaction route between acylating reagent and proteins
Thompson等[131]使用琥珀酸酐酰化改性乳清蛋白,并將其應用于即食布丁和冰激凌中,結果發現加入琥珀酸酐酰化改性的乳清蛋白使冰激凌黏度增加,凝固時間縮短且更耐融化,在不添加乳化劑和穩定性的情況下冰激凌的狀態仍能保持穩定。Stanic-Vucinic等[132]利用乙酸酐酰化和琥珀酸酐酰化改性牛血清白蛋白,牛血清白蛋白作為乳清蛋白中的重要組成部分,其結構的改變直接導致乳清蛋白理化性質的改變,結果發現酰化改性影響其二級結構和三級結構,并增加了無規卷曲和β-折疊結構的含量,使蛋白質的疏水性顯著降低。
3.4 去酰胺化對乳清蛋白化學改性的影響
去酰胺化是指把蛋白質富含酰胺基的氨基酸(谷氨酸和天冬氨酸)進行脫酰胺基作用,因此也稱為脫酰胺化。蛋白質的一級結構和二級結構不受脫酰胺改性的影響,酰胺基團大量存在于蛋白質中[133-134],主要通過—COOH中的O和H發生質子化作用,釋放亞氨基,將蛋白質中的谷氨酰胺和天冬酰胺脫去酰胺基生成谷氨酸和天冬氨酸,即—CONH2脫酰胺形成—COOH,此過程的介質一般為碳化二亞胺。蛋白質去除酰胺基團后,電負性增加,等電點降低,溶解性、起泡性和乳化性提高。蛋白脫酰胺作用除對谷氨酸和天冬氨酸有影響外,對其他氨基酸的含量和組成沒有影響[135]。
李丹等[136]通過單因素試驗探究了反應溫度、反應時間和pH值對乳清蛋白限制性脫酰胺的影響,并以脫酰胺度為評價指標確定了pH 7,溫度36 ℃,反應時間1、4、8 h條件下,乳清蛋白的脫酰胺度分別為1.5%、2.3%、2.9%;限制性脫酰胺不同程度地改變了乳清分離蛋白的理化特性,乳清蛋白脫酰胺后起泡性、乳化穩定性及對Fe3+、Zn2+的螯合能力均得到提高,且隨脫酰胺度的增大而升高。
3.5 酸調改性對乳清蛋白化學改性的影響
水溶液中的蛋白質屬于兩性離子,在其等電點處自由電荷最低,容易產生聚集,并從水溶液中沉淀出來,這時存在最低的水合度。根據這一特點,多種酸(硫酸、鹽酸、磷酸、丙酸、檸檬酸、醋酸等)都具有酸調改性的作用。在變性過程中蛋白質打開分子結構,分子更大限度地相互靠近,蛋白質發生聚集進而形成小分子聚合物。在不同pH值條件下,β-乳球蛋白形成的聚合物形狀發生不同程度的變化。β-乳球蛋白等電點約為5.1~5.3,當臨近等電點時,蛋白質分子間具有最弱的靜電作用力,參與作用的蛋白質能夠最大限度地發生碰撞,從而生成球狀微米級聚集體[22,137],當pH值超過6時產生無序形狀的聚合物,pH值調低至3時,產生纖維網狀結構的聚合物[138-139]。
在不同pH值下,乳清蛋白具有不同的凝膠性質,van Camp等[140]的研究表明當pH 2~3時濃縮乳清蛋白形成軟凝膠,pH 4~6時濃縮乳清蛋白形成凝乳狀凝固物,pH 7~9時濃縮乳清蛋白形成堅固的凝膠。酸度也會影響乳清蛋白表觀黏度,Tang Qingnong等[141]研究發現當pH值為3~7時乳清蛋白具有最低的表觀黏度,pH值為1和11時有最高的表觀黏度,表觀黏度整體呈現先下降后平緩再升高的趨勢。此外,酸度會影響乳清蛋白的穩定性,Schong等[142]發現在高于中性pH值下乳清蛋白具有最高的熱變性率。
4 乳清蛋白的基因工程改性技術
除上述物理改性、酶法改性和化學改性技術之外,近年來,還出現了一些新興的乳清蛋白改性技術,如基因工程改性。目前,乳清蛋白的基因工程改性主要是對相關基因進行定點整合轉移,并對乳清蛋白基因進行檢測與分析。然而外源基因整合機制還不是很清楚。基因工程改性方法目前尚未攻克一些技術上的問題,還處于實驗室研究階段[143-145],整個改性過程的周期漫長、見效慢。借鑒其他領域基因工程改性經驗,未來可通過基因工程改性改變乳清蛋白組成,以提高其營養價值,也可以應用于抗營養因子的研究。
5 協同改性
協同改性是指利用物理、化學、酶法中的兩種或兩種以上相同或不同手段對蛋白質進行復合改性。食品行業的快速發展對蛋白質品質有了更高的要求,蛋白質協同改性比單一手段改性更能滿足當前社會對不同功能蛋白的需求,蛋白質經協同改性后,功能性質有了進一步的提高,從而可以適應不同產品的需要。目前主要通過化學協同、酶法協同或物理酶法協同對乳清蛋白進行協同改性。
5.1 化學協同改性
化學協同主要是利用兩種化學手段改性乳清蛋白,它具有操作簡單、應用廣泛和改性效果顯著等優點,雖然蛋白質的功能性質得到了進一步的提高,但化學協同改性比單一化學改性加入的試劑更多,使得最終產品中未參與反應試劑的去除變得尤為困難,目前主要利用磷酸化和糖基化協同對乳清蛋白進行改性。Enomoto等[146]研究了磷酸化和糖基化反應在干熱條件下對α-乳白蛋白結構和功能的影響,結果發現麥芽五糖和α-乳白蛋白進行干法糖基化反應后加入焦磷酸鹽,其乳化性、熱穩定性以及在磷酸鈣溶液中的溶解性得到明顯提高。
5.2 酶法協同改性
酶法協同是利用兩種酶對乳清蛋白進行處理,酶法改性的專一性強、條件溫和、反應速度快、易于被人體消化,但價格高昂,若應用于大規模工業化生產,則需要數量龐大的低廉微生物酶。Ena等[147]利用胃蛋白酶和Corolase PP(胰酶的混合物)消除乳清蛋白的致敏性。使用來自對牛奶蛋白過敏患者的血清,通過理化和免疫學技術對水解產物進行表征,結果發現胃蛋白酶和Corolase PP的結合可完全消除乳清蛋白β-乳球蛋白和牛血清白蛋白的抗原性位點。
5.3 物理酶法協同改性
物理酶法協同改性是結合物理方法和酶法改性乳清蛋白。物理酶法協同改性優勢明顯,與化學協同改性相比較,物理酶法協同改性無毒副作用,安全性更高,與酶法協同改性相比較,其費用更低,更適合應用于大規模批量生產。因此,物理酶法協同改性成為最熱門的協同改性乳清蛋白的方法。Chicon等[148]在HHP條件下用胰蛋白酶和胃蛋白酶處理乳清分離蛋白,結果表明水解產物的抗原性和與人體免疫球蛋白的結合能力較低,水解物接近乳清蛋白等電點時可以提高熱穩定性,當pH值為7時,改性乳清蛋白的乳化性升高。Ahmadi等[149]研究發現超聲波預處理和微生物轉谷氨酰胺酶的協同作用使乳清蛋白濃縮物表現出非牛頓剪切稀化行為,能夠更好地改善乳清蛋白系統的各種性質。
6 改性乳清蛋白的性質變化
6.1 凝膠性
乳清蛋白經過一定程度的變性會產生三維網絡結構,這個過程稱為膠凝過程,常用凝膠性對其進行表征。交聯過程中二硫鍵的數量增多,疏水相互作用增強,導致凝膠性增強。增強凝膠性可以改善乳清蛋白的黏稠性、持水性以及組織狀態,在糕點和肉品制作中起到重要作用,尤其是在酸奶運輸過程中,可以有效改善脫水收縮和乳清蛋白的析出。
Spotti等[150]比較了酶解和熱處理誘導乳清蛋白凝膠化的蠕變和恢復行為,應用于蠕變數據分析的分數導數模型顯示,酶誘導凝膠比熱誘導凝膠彈性模量更大,更具彈性;但是通過顯微觀察發現酶誘導凝膠比熱誘導凝膠比具有較大的孔徑、較疏的網絡,可能是由于酶處理增加了凝膠的斷裂應變和應力[151]。da Silva等[152]的研究表明鎂離子可以改善乳清分離蛋白的凝膠性。Rabiey等[153]探究了乳清蛋白濃度對凝膠性的影響,結果發現增大乳清蛋白的濃度可以得到質地更好的凝膠。
6.2 流變性
乳清蛋白在凝膠化過程中會表現出流變特性,常用表觀黏度對其進行表征。增強流變性可以顯著改善半固體食品(如牛奶、酸奶、果醬等)的黏稠狀態,以達到良好的感官品質。
Tang Qingnong等[154]使用流變儀在穩定剪切條件下研究了乳清蛋白濃縮物溶液的流變性,結果發現在22 ℃、pH 7條件下,質量分數10%的乳清蛋白溶液表現出牛頓流體行為,10%~30%之間表現為假塑性行為,剪切稀化在乳清蛋白質量分數為35%以上時不明顯,此時老化效果更為明顯。Sa?lam等[155]研究發現兩步乳化和熱誘導結合處理能夠形成平均尺寸為0~10 μm的乳清蛋白顆粒(蛋白質量分數20%),將顆粒分散在乳清蛋白或阿拉伯膠溶液中90 ℃加熱30 min,當使用質量分數1%阿拉伯膠作為穩定劑時,熱處理后沒有觀察到溶液黏度的變化,當使用α-酪蛋白酸鹽或乳清蛋白作為穩定劑時,在低剪切狀態下溶液黏度增加,在高剪切狀態下觀察到溶液增稠。由于溶脹顆粒的尺寸在加熱后增加,熱處理沒有顯著改變顆粒的ζ電位,結果表明顆粒的溶脹在分散體的熱穩定性和流變性質中起重要作用。
6.3 溶解性
蛋白質溶解性是指蛋白質在溶劑中的溶解能力。親水性強的蛋白質分子更有利于溶解。乳清蛋白的溶解性提高,起泡性和乳化性也會相應提高,而起泡性和乳化性在食品加工中的作用非常顯著。
Klarenbeek等[156]發現乳清分離蛋白結構受加熱的影響,溫度為60 ℃時會影響乳清分離蛋白的起泡性和溶解性,且這種影響是可逆的。Jambrak等[157]研究了超聲對乳清蛋白溶解性的影響,利用超聲分別處理乳清蛋白水解物15 min和30 min,結果發現經超聲處理后pH值無明顯變化。超聲對乳清蛋白在高溫下的溶解性和發泡性等功能特性具有顯著影響,且處理15 min的效果優于處理30 min的效果。
6.4 起泡性及泡沫穩定性
起泡性是指蛋白質產品攪打起泡的能力,其泡沫維持穩定的能力稱為泡沫穩定性。乳清蛋白在起泡過程中會被吸附到氣-液界面,形成一層膜,界面張力降低,產生的許多小氣泡群會最終形成泡沫。乳清蛋白的起泡性可以賦予食品精美的形態和良好的口感。
Phillips等[158]發現加熱和pH值會影響乳清分離蛋白的起泡性,pH值為5時未受熱乳清蛋白的泡沫穩定性最好。趙艷麗等[159]研究發現離子強度會影響體系表面張力和起泡性。Ching等[160]為改善乳清蛋白的起泡性能,研究了超聲對100、150、200 g/kg乳清蛋白懸浮液起泡性等的影響。結果發現經超聲處理的200 g/kg乳清蛋白懸浮液的起泡性提高了18%,泡沫穩定性提高了35%,稠度指數提高了18%,儲能模量提高了17%,損耗模量提高了26%,黏度提高了10%。與未處理的乳清蛋白相比,使用超聲處理的樣品懸浮液泡沫的分布更加均勻,細小氣泡的數量最多增加46%。
6.5 乳化性及乳化穩定性
乳化性是指蛋白中的油和水形成乳化液的能力,維持穩定乳化性的能力稱為乳化穩定性。乳清蛋白含有親水基團和疏水集團,由于親水基團分布于蛋白質表面,使乳清蛋白具有很好的水溶性。在乳化的過程中,油相為蛋白質的疏水區,水相為蛋白質的親水區,均質時,脂肪球和乳清蛋白分子相互依附,形成十分穩定的蛋白/脂肪膜,同時避免了脂肪球產生聚集現象,從而實現均相乳液的目的。牛奶、蛋糕等許多食品的生產制作過程中需要添加良好乳化性能的乳化劑,使水相和油相均勻成乳液,并保持穩定的狀態,防止在短時間內發生沉淀。
耿浩[22]研究了熱處理濃縮乳清蛋白聚合物和分離乳清蛋白聚合物的乳化性和乳化穩定性,結果發現熱處理濃縮乳清蛋白聚合物和分離乳清蛋白聚合物比未處理乳清蛋白的乳化性低,乳化穩定性高,85 ℃處理濃縮乳清蛋白聚合物和分離乳清蛋白聚合物的乳化性和乳化穩定性比90 ℃處理高。Jacob等[161]研究了兩種酸性肽酶制劑(Maxipro AFP和蛋白酶AP-30L)對乳清蛋白乳化性的影響。結果發現乳清蛋白水解產物的乳化性增強,但兩種肽酶制劑水解產物之間未發現乳化特性的差異。Moussier等[162]研究了溶劑和加工方式對乳清蛋白乳化特性的影響,將乳清蛋白溶解在純凈水或滲透液中,然后對其進行熱處理、機械處理和動態高壓處理(16、100、350 MPa),結果發現,熱處理和350 MPa的動態高壓使乳化性能發生了顯著的變化,但是機械處理僅引起了很小的變化。
7 結 語
隨著社會經濟的快速發展,人們的生活水平和消費水平得到顯著提高,對于食品的種類和質量有了新的要求。乳清蛋白作為一種優質蛋白,可通過對其加工改性有針對性地提高某些功能性質,但由于單一技術對乳清蛋白的改性效果有限,應用仍然受到限制,研究乳清蛋白新產品和新工藝刻不容緩。綜合現階段的研究進展,可以將兩項甚至多項技術結合處理乳清蛋白,物理方法、酶法及化學方法等多項技術復合改性不僅可以使蛋白獲得更好的功能性質,還能改變傳統乳清蛋白產品的加工套路,為研發優質化、個性化食品提供新思路。未來可以集合加強人體營養攝入、維護腸道菌群健康以及調節身體機能等方面的需要研發新產品,生產消費者真正需要的健康食品。

