基于網絡藥理學探討黃精治療阿爾茨海默病的作用機制
李文達,張少婷,方 婷,朱愛華
阿爾茨海默病(Alzheimer′s disease)是一種典型的老年性疾病,臨床表現為進行性認知功能障礙及記憶力減退,伴有或不伴有精神行為癥狀。有研究顯示,至2019年全球癡呆癥高達5 000萬人,預計2050年將增加至1.52億人[1],其中阿爾茨海默病是常見的癡呆類型。阿爾茨海默病的發生與進展不但威脅老年人的健康與生活質量,同時給家庭帶來精神與經濟的壓力。目前,阿爾茨海默病發病原因尚未明確,臨床所用的一線治療藥物未改變病人預期壽命或整體進展[2]。阿爾茨海默病在中醫學中屬于“癡呆”“呆病”“健忘”等范疇,病機主要為髓海空虛、腦失所養,伴風、火、痰、瘀上擾清竅,以致神機失用,發為癡呆[3]。諸多臨床試驗表明,中醫針藥在阿爾茨海默病的治療中具備獨特優勢[4-5]。
黃精是百合科植物滇黃精、黃精或多花黃精的干燥根莖[6],最早記載于《名醫別錄》:“黃精,味甘、平,無毒,主補中益氣,除風濕,安五臟。久服輕身、延年、不饑,長久服用身體輕盈、多年不饑餓”[7]。《道藏神仙芝草經》對黃精亦有“寬中益氣,使五臟調和,肌肉充盈,骨髓堅強,其力倍增,多年不老,顏色顯明,發白更黑,齒落更生”的描述。可見黃精之用與延年益壽相關。現代藥理研究提示,黃精具有抗腫瘤、抗氧化、免疫調節、降血糖、抑菌抗炎等作用[8]。基于數據挖掘中藥治療阿爾茨海默病的復方中黃精為高頻次單藥之一[9]。
目前,關于黃精治療阿爾茨海默病的具體藥理機制尚未明確。網絡藥理學作為一種新興的綜合性系統方法,通過現代計算機技術結合生物信息學、分子生物學、藥理學、統計學等,解釋藥物與疾病相互作用的內在聯系,為中藥現代化提供了幫助[10]。本研究基于網絡藥理學,通過對黃精及阿爾茨海默病作用靶點的挖掘,探討黃精治療阿爾茨海默病的藥理作用及其可能的作用機制。
1 資料與方法
1.1 檢索數據庫 中藥系統藥理學分析平臺(TCMSP),UniProt知識庫,基因數據庫(GeneCards),人類孟德爾遺傳數據庫(OMIM),藥物數據庫(DrugBank),PubChem數據庫,Swiss Target數據庫,Cytoscape 3.7.1軟件,String 11在線軟件,Metascape數據庫。
1.2 方法
1.2.1 黃精藥物成分及靶點的獲取 通過TCMSP(https://tcmspw.com/tcmsp.php)[11],檢索關鍵詞“黃精”,獲取中藥黃精含有的全部活性成分,并對檢出的活性成分進行ADME篩選,設定兩個閾值:口服生物利用度(oral bioavailability,OB)≥30%及類藥性(drug-like,DL)≥0.18,最終獲得黃精的主要活性成分,整理至Excel表格中。
在TCMSP數據庫中選擇“Related Targets”一欄,檢索各個主要活性成分對應的靶點,并利用UniProt知識庫 (https:www.uniprot.org/)[12]將篩選出的靶點蛋白名轉化為相應的基因名;同時在PubChem數據庫(https://pubchem.ncbi.nlm.nih.gov/)[13]獲取成分的SMILES號,并在Swiss Target平臺(http://swisstargetprediction.ch/)[14]預測藥物靶點,選擇概率≥0.12的靶點,將數據匯總,建立黃精活性成分靶點數據集。
1.2.2 阿爾茨海默病靶點與交疊靶點的獲取 通過OMIM數據庫(https://www.omim.org/)[15],GeneCards數據庫(https://www.genecards.org)[16]及DrugBank數據庫(https://www.drugbank.ca)[17]3個平臺,檢索關鍵詞“Alzheimer′s disease”,查找阿爾茨海默病相關的靶基因。下載表格并進行匯總去重,建立阿爾茨海默病靶點數據集。將所得的黃精活性成分靶點進行去重整理,與疾病基因靶點進行對比,得到藥物-疾病交疊靶點數據集,并繪制Venn圖。
1.2.3 藥物-活性成分-靶點-疾病網絡的構建 將藥物靶點、交疊靶點及活性成分、疾病之間交互關系數據導入Cytoscape 3.7.1[18]軟件,構建藥物-活性成分-靶點-疾病網絡,并利用“Network analyser”功能對網絡進行拓撲分析。其中每個節點(node)代表藥物、疾病、活性成分或靶點蛋白,邊(edge)代表節點間的相互作用,節點的度值(degree)代表與該節點連接邊的數目,即在該網絡中的重要程度。
1.2.4 靶蛋白相互作用網絡的構建 利用String在線軟件(https://string-db.org/)[19]導入黃精治療阿爾茨海默病的潛在作用靶點,選擇物種為“Homo sapines”進行檢索,取置信度設置為high confidence(0.7),將網絡數據導入Cytoscape軟件繪制中藥-疾病靶點蛋白-蛋白相互作用(PPI)。
1.2.5 基因本體(GO)功能富集分析和京都基因與基因組百科全書(KEGG)通路富集分析 將共有靶點基因信息導入Metascape數據庫(https://metascape.org/)[20],設置參數input as species:H.sapiens;analysis as species:H.sapiens,對關鍵靶蛋白分別進行生物過程(biological process,BP)、細胞組成(cellular component,CC)、分子功能(molecular function,MF)的GO功能富集分析及KEGG通路富集分析。
2 結 果
2.1 黃精藥物成分及靶點信息 在TCMSP數據庫中檢索得到黃精活性成分共38個,根據OB值和DL篩選后得到活性成分12個,詳見表1。TCMSP平臺獲得主要活性成分靶點149個,其中HJ1為12個,HJ2為3個,HJ3為38個,HJ4為37個,HJ5為19個,HJ6為15個,HJ7為16個,HJ8為8個,HJ9為1個,HJ10為0個,HJ11為0個,HJ12為0個。經Swiss Target平臺補充,共得到潛在基因靶點329個。

表1 黃精主要活性成分
2.2 阿爾茨海默病疾病靶點與交疊靶點信息 在OMIM、GeneCards、DrugBank數據庫共獲得與阿爾茨海默病密切相關的疾病靶點9 846個,其中GeneCards檢索到9 554個基因,DrugBank檢索到85個基因,OMIM檢索到534個基因。選取GeneCards與疾病相關度≥10的基因靶點后將3個平臺數據匯總并去重后得到疾病靶點929個。經數據平臺收集黃精藥物靶點共329個,去除無驗證基因的活性分子,9種活性分子共作用于173個基因靶點。將兩者對比取交集,獲得疾病-藥物交疊靶點共60個,Venn圖見圖1。

圖1 藥物-疾病靶點Venn圖
2.3 中藥-活性成分-靶點-疾病網絡的分析 利用Cytoscape 3.7.1軟件構建藥物-活性成分-靶點-疾病網絡,由71個節點、174條邊組成,詳見圖2。根據網絡節點度值和中介中心度進行分析,活性成分居前5位的節點分別是黃芩素(baicalein),度值95,中介中心度0.41;4,5′-二羥基黃酮(4′,5-dihydroxyflavone),度值80,中介中心度0.28;β-谷甾醇(beta-sitosterol),度值52,中介中心度0.22;(2R)-7-羥基-2-(4-羥基苯基)苯并四氫吡喃-4-酮[(2R)-7-hydroxy-2-(4-hydroxyphenyl)chroman-4-one],度值33,中介中心度0.06;甘草素(liquiritigenin),度值29,中介中心度0.05。黃精的多種活性成分作用于多個靶基因,體現黃精治療阿爾茨海默病的多靶點特征。
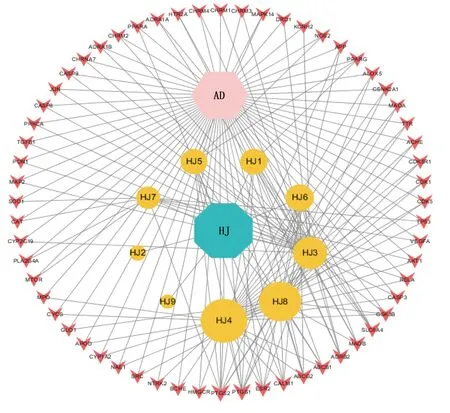
圖2 中藥-活性成分-靶點-疾病網絡圖(AD為阿爾茨海默病;HJ為黃精。粉色六邊形代表阿爾茨海默病,藍色八邊形代表黃精,黃色圓形代表黃精的有效成分,橘色不規則四邊形代表藥物的潛在靶點)
2.4 PPI蛋白互作網絡分析 利用String平臺與Cytoscape軟件構建黃精與阿爾茨海默病交疊靶點的PPI網絡圖,詳見圖3。共包含60個節點、186條邊,平均度值為6.2,其中,節點為靶點蛋白,邊為各蛋白間互作關系。PPI網絡圖表明這些靶點相互聯系,且多方面協同作用治療阿爾茨海默病。節點連接邊數越多的代表其在網絡中越重要,通過網絡拓撲學分析,其中高于平均度值的靶蛋白共有21個,分別為淀粉樣β前體蛋白(APP)、轉錄因子AP-1(JUN)、細胞腫瘤抗原p53(TP53)、絲氨酸/蘇氨酸-蛋白激酶1(AKT1)、原癌基因酪氨酸蛋白激酶(SRC)、轉錄因子p65(RELA)、半胱氨酸天冬氨酸蛋白酶-3(CASP3)、前列腺素G/H合酶2(PTGS2)、血管內皮生長因子A(VEGFA)、絲裂原活化蛋白激酶14(MAPK14)、過氧化氫酶(CAT)、毒蕈堿乙酰膽堿受體M(CHRM1)、半胱氨酸天冬氨酸蛋白酶-8(CASP8)、絲氨酸/蘇氨酸-蛋白激酶MTO(MTOR)、一氧化氮合酶2(NOS2)、細胞色素C(CYCS)、過氧化物酶體增殖物激活受體γ(PPARG)、半胱氨酸天冬氨酸蛋白酶-9(CASP9)、糖原合成酶激酶-3β(GSK3B)、5-羥色胺受體2A(HTR2A)、細胞色素P 450 2C19(CYP2C19);度值分別為23,22,20,19,14,13,12,12,12,10,10,9,9,9,8,8,8,8,7,7,7。以上可能為黃精治療阿爾茨海默病的關鍵靶點。

圖3 交疊靶點的PPI網絡圖
2.5 共有靶點GO富集分析及KEGG通路富集分析 將藥物-疾病共有靶點導入Metascape數據庫進行GO富集分析及KEGG通路富集分析。GO生物途徑(biology process,GO-BP)分析共獲得1 277個條目,按照P值取前10個條目,分別是血液循環、細胞對氮化合物的反應、老化、對有毒物質的反應、肽鏈絲氨酸磷酸化、神經元死亡、對銨離子的響應、節律過程、生長調節、對營養水平的反應。GO細胞成分(cellular component,GO-CC)分析共獲得73個條目,按照P值取前10個條目,分別是突觸后、膜筏、細胞器囊腔、細胞質核周區、線粒體包膜、核包絡、神經肌肉接頭、過氧化物酶體、血小板α顆粒腔、溶質液泡。GO分子功能(molecular function,GO-MF)分析共獲得78個條目,按照P值取前10個條目,分別是G蛋白偶聯胺受體活性、血紅素結合、銨離子結合、蛋白質同聚活性、泛素蛋白連接酶結合、蛋白激酶活性、磷酸酶結合、腎上腺素能受體活性、半胱氨酸型內肽酶參與凋亡信號通路的研究、轉錄因子結合。橫軸按P值排列,縱軸表示包含的基因數目,詳見圖4。KEGG通路分析共254條,按P值取前20條通路分別為卡波西肉瘤相關皰疹病毒感染、5-羥色胺能突觸、鈣信號通路、阿爾茨海默病、可卡因成癮、血管內皮生長因子信號通路、松弛素信號通路、環腺苷3′,5′-單磷酸(cAMP)信號通路、長壽調節途徑、磷脂酰肌醇3-激酶/蛋白激酶B(PI3K/Akt)信號通路、心肌細胞的腎上腺素能信號、帕金森病、有絲分裂動物、間隙結、阿米巴、癌組織中的微RNA、腺苷酸活化蛋白激酶(AMPK)信號通路、腎細胞癌、膽汁分泌、細胞周期。詳見圖5。
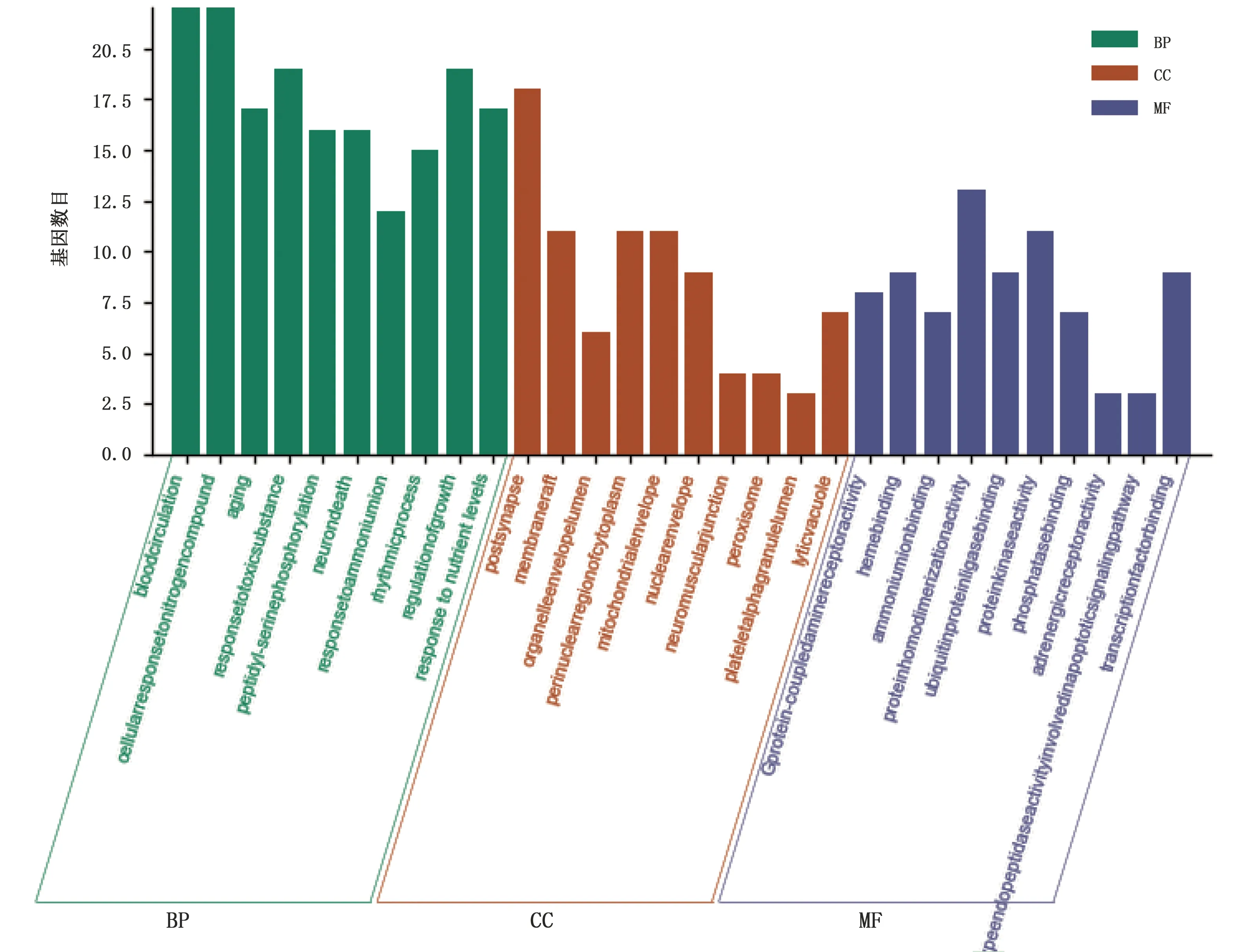
圖4 GO功能富集分析

圖5 KEGG通路富集分析
3 討 論
本研究通過網絡藥理學方法,以黃精為研究對象,探討其治療阿爾茨海默的作用機制。根據類藥性及口服生物利用度共篩選出12種黃精的藥物成分,其中9種具有對應的靶點,主要包括黃酮類[liquiritigenin、baicalein、3′-methoxydaidzein、(2R)-7-hydroxy-2-(4-hydroxyphenyl)chroman-4-one、4′,5-dihydroxyflavone]、皂苷類[diosgenin、(+)-syringaresinol-O-beta-D-glucoside]及植物甾醇類(sitosterol、beta-sitosterol)。有研究發現,甘草素(liquiritigenin)具有抗炎、參與酶反應、抗菌、抗氧化、抗精神抑郁等作用[21]。黃芩素(baicalein)具有抗炎、抗氧化、抗衰老、保護線粒體、清除自由基、免疫調節的功能[22-23]。β-谷甾醇(beta-sitosterol)具有清除自由基、抗氧化、抗炎、免疫調節、抗焦慮、抑制自主活動等作用[24-25]。薯蕷皂苷(diosgenin)具有抗炎、抗骨質疏松、心臟保護、抗氧化營養神經等作用[26]。
由PPI獲得關鍵靶點21個,其中富集程度較高的前6種分別是APP、JUN、TP53、AKT1、SRC、RELA。APP即淀粉樣β前體蛋白(amyloid-beta precursor protein),其變異導致蛋白質異常表達及剪切途徑改變,致使Aβ蛋白增加及代謝異常,從而沉積形成老年斑,進一步誘發神經原纖維纏結、神經元細胞缺失等。APP是導致家族性阿爾茨海默病神經病理學表現的因果基因,也是阿爾茨海默病中淀粉樣蛋白假說的核心[27-28]。JUN是轉錄因子AP-1(transcription factor AP-1)組的一員,通過細胞周期調節因子的功能和表達控制細胞存亡[29]。TP53即細胞腫瘤抗原p53(cellular tumor antigen p53)具有參與調控細胞周期、細胞凋亡、糖代謝及作為轉錄因子調節晝夜節律的功能[30],同時與記憶喪失、神經變性相關[31]。AKT1是3種被稱為AKT激酶的緊密相關的絲氨酸/蘇氨酸蛋白激酶之一,具有多種功能,包括調控機體的新陳代謝、血管生成、影響突觸可塑性和神經元存活等,在神經退行性疾病中發揮重要作用[32]。原癌基因酪氨酸蛋白激酶(SRC)主要參與基因轉錄、免疫反應、細胞黏附、細胞周期進展、凋亡、遷移和轉化[33]。轉錄因子p65(RELA)與炎癥、免疫、分化、細胞生長、腫瘤發生和凋亡等生物學過程相關[34]。通過分析發現這些靶點與阿爾茨海默病密切相關,且主要富集于神經變性、細胞凋亡等方面。
GO功能富集分析顯示,黃精可調控血液循環、細胞反應與凋亡、衰老、節律等生物過程。KEGG通路富集分析顯示,黃精通過多條途徑影響阿爾茨海默病的發生發展。其中5-羥色胺能突觸通路(serotonergic synapse)共12個基因富集,包括ALOX5、APP、CASP3、CYP2C19、HTR2A、MAOA、MAOB、PLA2G4A、PRKCA、PTGS1、PTGS2、SLC6A4。5-羥色胺是中樞神經系統調節多種生理功能的遞質之一,其通路涉及較多基礎和高級大腦功能,通過海馬體和前額葉皮層影響認知,其活性降低導致認知下降并伴有阿爾茨海默病的精神行為變化[35-36]。鈣信號通路(calcium signaling pathway)共有12個基因富集,通過調控突觸可塑性變化,影響學習和記憶;通過調節神經元興奮性,影響信息處理和認知;鈣信號轉導機制失調可能影響阿爾茨海默病的發生發展[37-38]。血管內皮生長因子信號通路(VEGF signaling pathway)共8個富集基因,VEGF信號級聯可激活血管生成、神經營養和細胞保護過程,抑制腦淀粉樣血管病變,促進神經細胞存活等影響阿爾茨海默病進程[39]。松弛素具有保護心肌、擴張血管、血管重塑及抗纖維化的作用,松弛素通路(relaxin signaling pathway)引起多種靶組織細胞中PI3K、cAMP增加[40]。有研究表明,高表達的PI3K/Akt可有效對抗Aβ誘導的細胞毒性,減少細胞凋亡,逆轉Aβ誘導的Tau蛋白磷酸化[41]。cAMP參與細胞生長和分化、基因轉錄和蛋白表達的調控,同時cAMP/蛋白激酶a(PKA)信號調節與突觸可塑性變化和認知行為相關[42]。
綜上所述,黃精通過多成分、多靶點、多途徑治療阿爾茨海默病。網絡藥理學發現新的富集程度高的靶點基因和新通路,為全面認識與治療疾病和中醫藥現代化拓寬了渠道。本研究為黃精治療阿爾茨海默病提供依據,也為臨床治療阿爾茨海默病及新型藥物的開發提供了思路。

