基于網絡藥理學和分子對接技術探討參附注射液治療休克的分子機制
董 妍,馬曉昌,于盼盼,李 春,施保柱
參附注射液作為傳統方劑參附湯的現代用藥形式,最早見于宋代嚴用和的《濟生方》,參附注射液是由紅參、附片提取制成的中藥注射劑,主要治療陽氣暴脫的厥脫癥(感染性休克、心源性休克、低容量性休克等),也可用于陽虛(氣虛)所致的驚悸、怔忡、喘咳、胃疼、泄瀉、痹癥等[1]。現代藥理研究發現,參附注射液可提高組織氧攝取和氧利用,改善血流動力學,但作用機制未明確[2-3]。網絡藥理學結合了系統生物學、多向藥理學、計算生物學、網絡分析等多學科技術和內容,從多靶點研究角度出發,實現藥物作用綜合網絡分析,其整體性、系統性特點與中藥及方劑的多成分、多途徑、多靶點協同作用的原理一致[4]。本研究基于網絡藥理學和分子對接探討參附注射液治療休克的分子機制。
1 資料與方法
1.1 參附注射液相關靶點篩選 通過中醫藥系統藥理學平臺[5](TCMSP,https://tcmspw.com/tcmsp.php)尋找2味中藥化學組成成分,根據口服生物利用度(oral bioavailability,OB)≥30%且類藥性(drug-likeness,DL)≥0.18的2個藥代動力學(ADME)屬性值進行活性成分的初步篩選以獲得活性化合物及其作用的蛋白質靶點,并根據已發表的文獻報道補充未預測到的活性化合物的已知靶點。篩選結束后,作為標準化蛋白質靶點信息,統一在UniProt蛋白質數據庫(https://www.uniprot.org)將化合物作用的蛋白質靶點進行規范。
1.2 休克相關靶點篩選 以“shock”“circulation shock”“休克”為關鍵詞,挖掘基因數據庫(GeneCards,https://www.genecards.org)、人類孟德爾遺傳數據庫(OMIM,http://www.omim.org)、治療靶點數據庫(TTD,http://bidd.nus.edu.sg/group/cjttd)中治療休克的潛在靶點,合并3個數據庫疾病靶點后,刪除重復數值得到休克相關的靶點。
1.3 參附注射液-休克成分靶點蛋白-蛋白相互作用(PPI)網絡構建 為明確參附注射液相關靶點與休克靶點間的相互作用,采用Cytoscape 3.7.1軟件功能構建PPI,并整合提取其交集網絡進行拓撲結構分析。以網絡節點中的拓撲結構特征值“連接度(degree)”為指標,選擇大于其中位數2倍以上的節點作為關鍵候選靶點;提取分析這些候選節點網絡關系,計算每個節點的“連接度”“介度(betweenness)”“緊密度(closeness)”“最近公共祖先(LAC)”“鄰域連接度(nighborhood connectivity)”,共5個拓撲結構特征值并進行二次篩選,最終選擇上述5個特征值均大于其相應中位數的節點作為關鍵靶點。進而將交集靶點提交至STRING 11.0數據庫(https://string-db.org)構建PPI網絡模型[6]。居前10位靶點基因通過Cytoscape 3.7.1軟件進行可視處理。
1.4 靶點通路的注釋和分析 通過DAVID數據庫(https://david.ncifcrf.gov)[7]對上述預測得到的關鍵靶點信息進行基因本體(GO)富集分析及京都基因與基因組百科全書(KEGG)通路注釋分析。將參附注射液有效成分對應的關鍵靶點直接映射到通路上,通過藥物靶點富集得到的通路是藥物發揮主要調節作用的重要途徑,由此得到參附注射液治療休克的相關生物學過程及代謝通路信息。應用在線繪圖軟件微生信(http://www.bioinformatics.com.cn)進行繪圖。
1.5 成分-靶點-通路網絡圖的構建 運用Cytoscape 3.7.1構建參附注射液成分-休克靶點-通路網絡圖,利用Cytoscape 3.7.1內置工具分析有效成分及靶點的網絡拓撲參數,包括連接度、介度及緊密度等,并根據網絡拓撲學參數判斷核心靶點及發揮藥效的主要活性成分。
1.6 成分靶點分子對接 分子對接是通過匹配原則,計算并預測配體與受體的相互作用模式,選取參附注射液主要活性成分,從PubChem數據庫(https://pubchem.ncbi.nlm.nih.gov/)下載化合物的3D結構并轉換格式,從PDB數據庫(https://www.rcsb.org/)下載靶點蛋白的分子結構PDB格式文件。通過PyMol軟件去水分子及自身配體,并運用AutoDock軟件去水、加氫后進行分子對接。
2 結 果
2.1 參附注射液成分靶點獲取
2.1.1 活性化合物的篩選 通過TCMSP網站檢索到紅參、附子中化合物共139個,其中74個來自紅參、65個來自附子。以OB≥30%且DL≥0.18,篩選出活性化合物共25個,其中4個來自紅參,21個來自附子。參附注射液中主要活性化合物基本信息見表1。
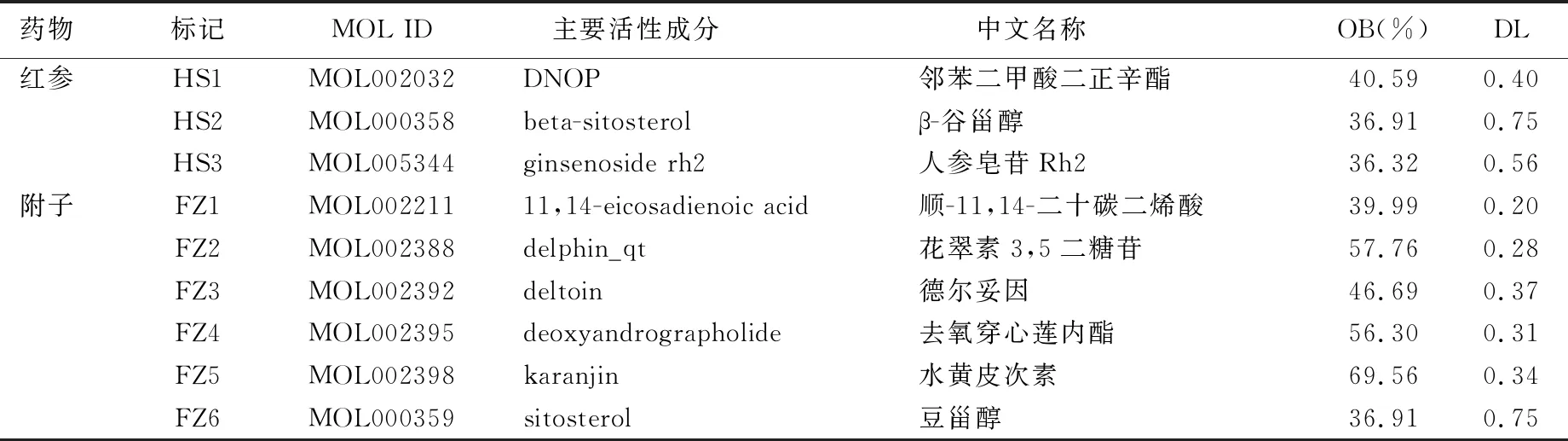
表1 參附注射液中主要活性化合物基本信息
2.1.2 參附注射液成分-靶點網絡 對獲得的有效成分結合UniProt數據庫確認并轉換,其中紅參共55個靶點、附子共30個靶點,合并后刪除重復靶點,最終獲得57個。將參附注射液的候選化合物與對應的靶蛋白導入Cytoscape 3.7.1軟件構建“成分-靶點”網絡,詳見圖1。圖中八邊形為靶點基因,三角形為化學成分,共57個靶點、94條邊,代表了成分與靶點之間的作用關系。體現了參附注射液多成分、多靶點的整體協同作用。
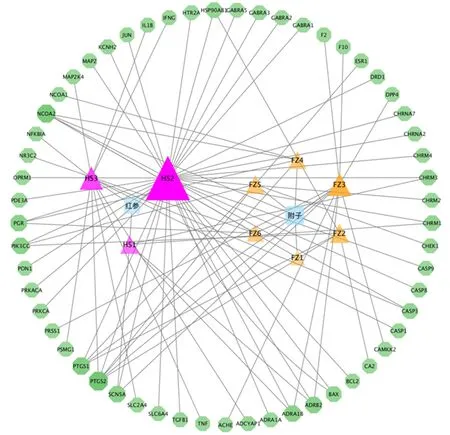
圖1 參附注射液成分-靶點網絡(節點的大小、顏色與節點的度值成正比)
2.2 休克相關靶點獲取 從GeneCards數據庫獲得休克相關靶點8 858個。根據經驗設定Score大于中位數的目標靶點為休克的潛在靶點,通過GeneCards所得休克靶點Score最大值為66.57,最小值為0.14,中位數為0.80,故設定Score≥0.80的靶點為休克的潛在靶點,根據目標靶點數量再次進行中位數篩選,直至取得目標靶點。結合OMIM數據庫(200個)、TTD數據庫(1個)篩選、補充相關靶點,合并后刪除重復值,最終得到休克相關靶點1 375個。將篩選的參附注射活性成分靶點與休克相關靶點取交集,得到參附注射液成分-休克共同靶點30個,應用在線繪圖軟件微生信繪制Venn圖,詳見圖2。
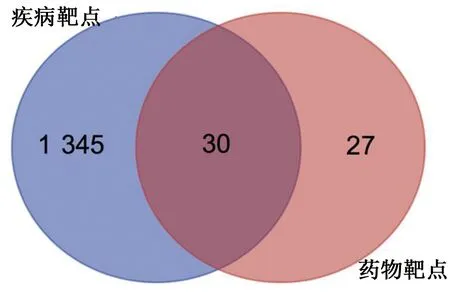
圖2 藥物-疾病靶點Venn圖
2.3 參附注射液成分-休克相關靶點PPI網絡的構建 將靶點提交至Cytoscape 3.7.1軟件構建成分、疾病靶點的PPI,結果發現共2 990個藥物預測靶點及12 674個休克治療靶點具有PPI作用,其中包括2949個重疊靶點。取2個蛋白互作網絡的交集靶點并計算每個點的拓撲結構特征值,得到整個網絡節點“連接度”的中位數為26,因此選擇≥2倍的中位數“連接度≥52”的節點作為候選靶點,共篩選到822個候選靶點;對候選靶點的相互作用信息進行提取分析,并以“連接度”“介度”“緊密度”“最近公共祖先”“鄰域連接度”大于其相應中位數為篩選條件進一步選擇合適的節點,即連接度≥89,介度≥324.438,緊密度≥0.516,最近公共祖先≥17.661,鄰域連接度≥126.366,共得到參附注射液治療休克的關鍵靶點146個,詳見圖3。將全部節點關系信息導出并導入Cytoscape 3.7.1軟件,對連接度居前10位的基因進行篩選,并構建PPI網絡核心基因圖,詳見圖4。
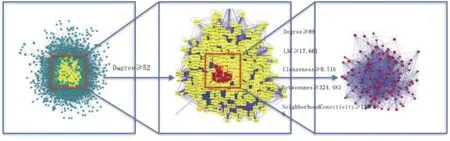
圖3 參附注射液治療休克的關鍵靶點篩選流程圖
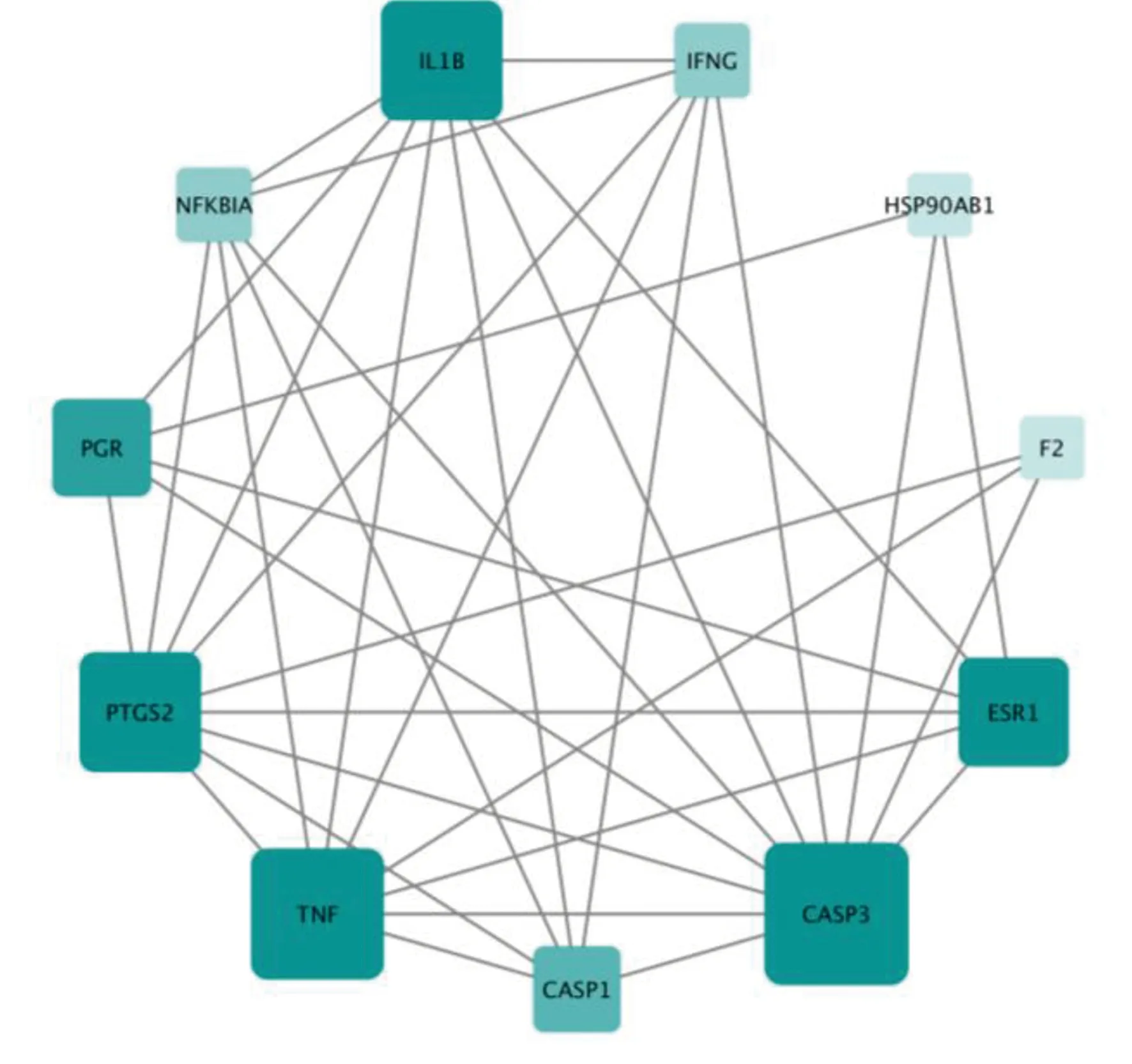
圖4 網絡核心基因網絡圖(連接度居前10位)(節點大小、顏色與節點的度值成正比)
2.4 靶點功能與通路的富集分析 利用DAVID數據庫中GO功能富集分析得到GO條目273個(P<0.05),其中生物過程(BP)條目207個,細胞組成(CC)條目21個,分子功能(MF)條目45個,對連接度居前10位的信號通路采集相關信息,運用在線繪圖軟件微生信進行富集分析繪圖,詳見圖5。KEGG通路富集篩選得到86條信號通路(P<0.05),涉及pathways in cancer、hepatitis B、influenza A、chagas disease、TNF signaling pathway等信號通路,對連接度居前10位信號通路進行信息匯總,詳見表2。通過在線繪圖軟件微生信進行繪圖,詳見圖6。
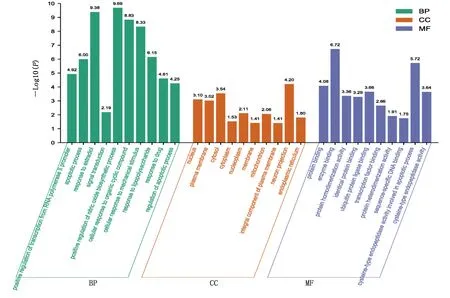
圖5 GO功能富集分析柱狀圖
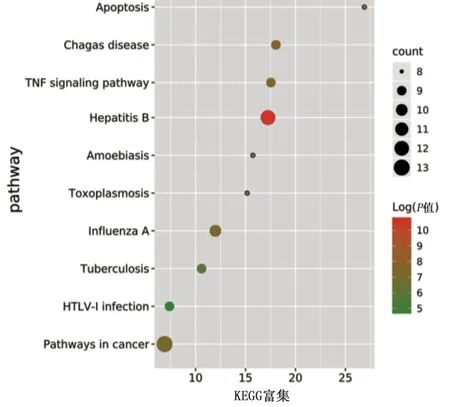
圖6 KEGG通路富集分析氣泡圖
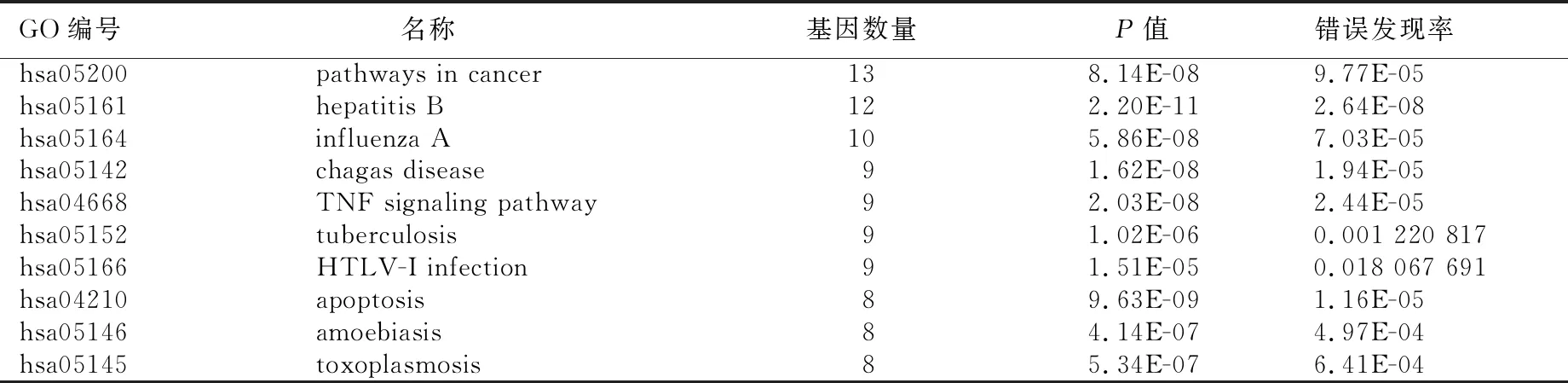
表2 KEGG富集分析連接度居前10位的通路
2.5 “成分-靶點-通路”網絡構建 將參附注射液治療休克的57個關鍵靶點蛋白及對應的8個潛在成分與KEGG信號通路富集分析居前10位信號通路制作“成分-靶點-通路”網絡關系表,并導入Cytoscape 3.7.1軟件,構建參附注射液治療休克的“成分-靶點-通路”網絡圖,三角形為成分,八邊形為通路名稱,棱形為靶點名稱,詳見圖7。參附注射液的主要有效成分通過pathways in cancer、hepatitis B、influenza A、TNF signaling pathway等通路,作用于磷酸肌醇3-激酶CG(PIK3CG)、核轉錄因子κB1A(NF-κB1A)、半胱天冬氨酸蛋白酶-3(CASP3)等靶點,發揮治療休克的功能,體現了參附注射液多成分-多靶點-多通路治療作用特點。
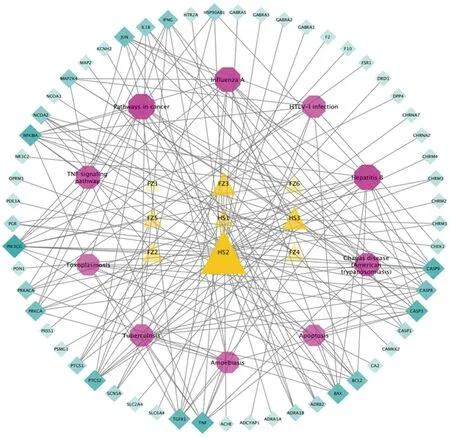
圖7 參附注射治療休克成分-靶點-通路網絡圖(節點大小、顏色與節點度值成正比)
2.6 參附注射液主要成分與關鍵靶點進行分子對接 為了闡述參附注射液治療休克的潛在靶點與對應活性成分之間的結合活性,將參附注射液活性成分分別與PIK3CG、CASP3和NF-κB1A進行分子對接,一般認為分子對接結合能<0表示配體與受體可自發結合,但對于高結合性分子的界定尚無統一標準,根據文獻報道,結合能≤-5.0 kJ/mol,小分子配體與受體結合較好[8]。詳見圖8~圖13、表3。
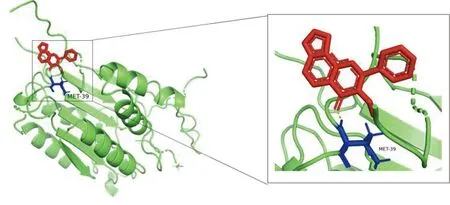
圖8 Karanjin-CASP3分子對接結果
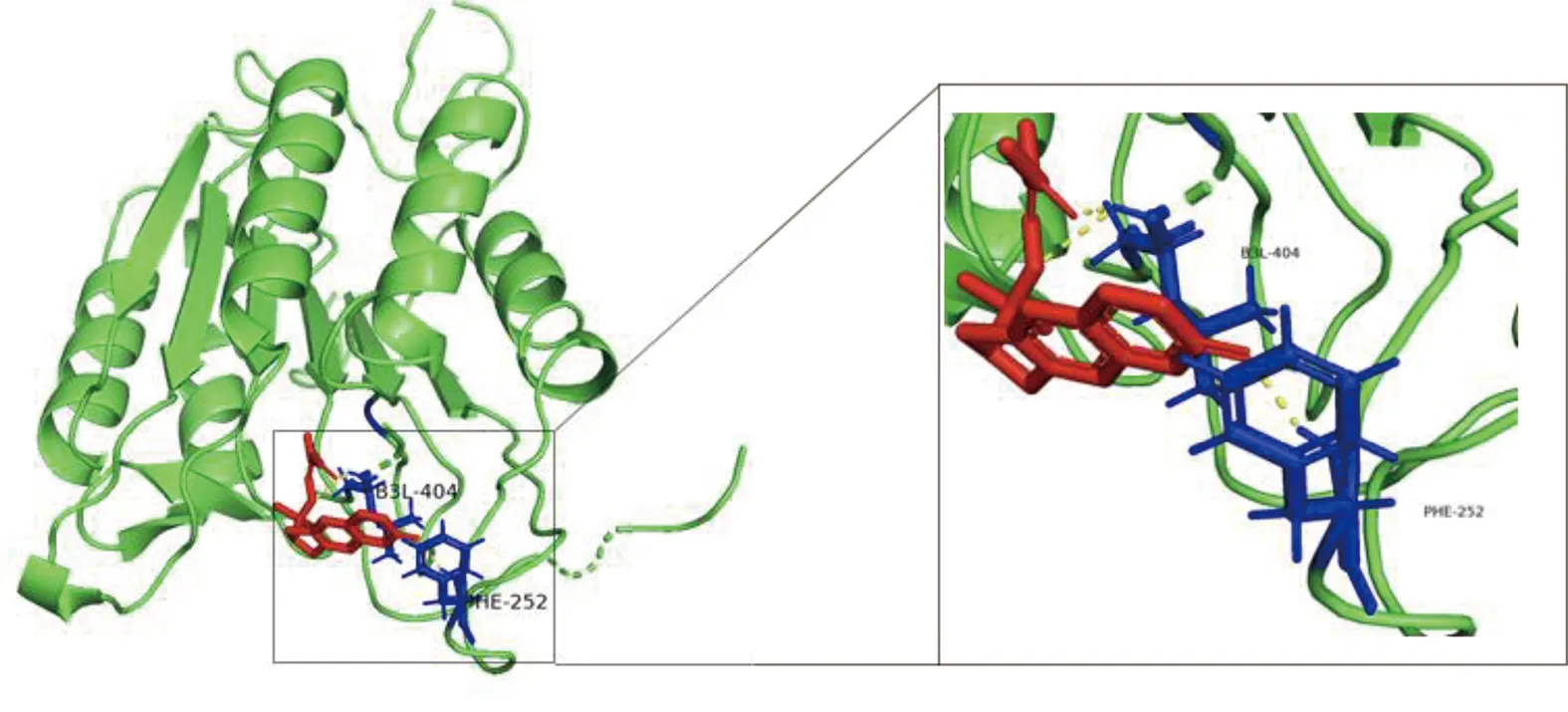
圖9 Deltoin-CASP3分子對接結果
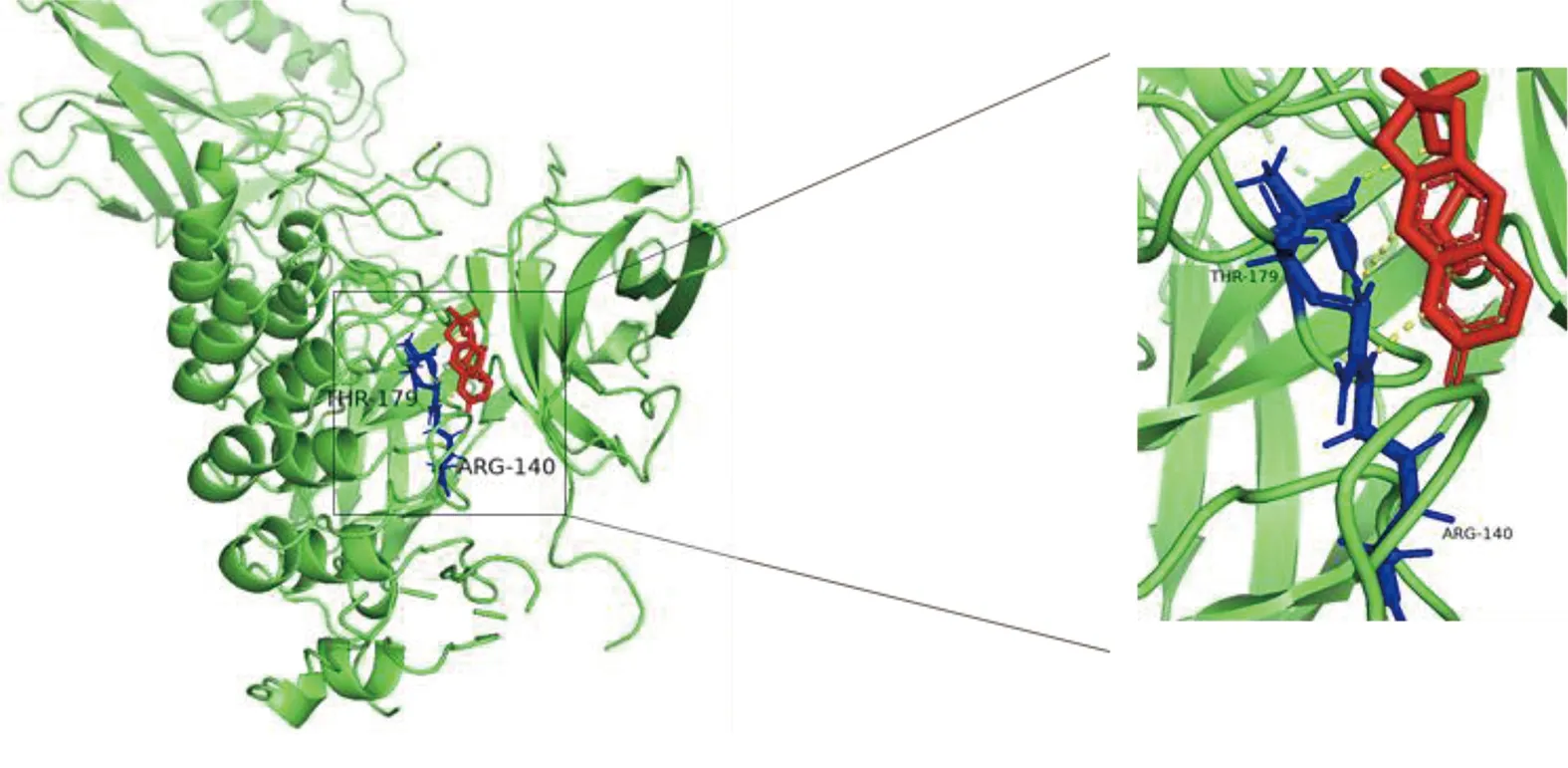
圖10 Deltoin-NF-κB1A分子對接結果
圖11 Karanjin-NF-κB1A分子對接結果
圖12 Deltoin-PIK3CG分子對接結果
圖13 Karanjin-PIK3CG分子對接結果
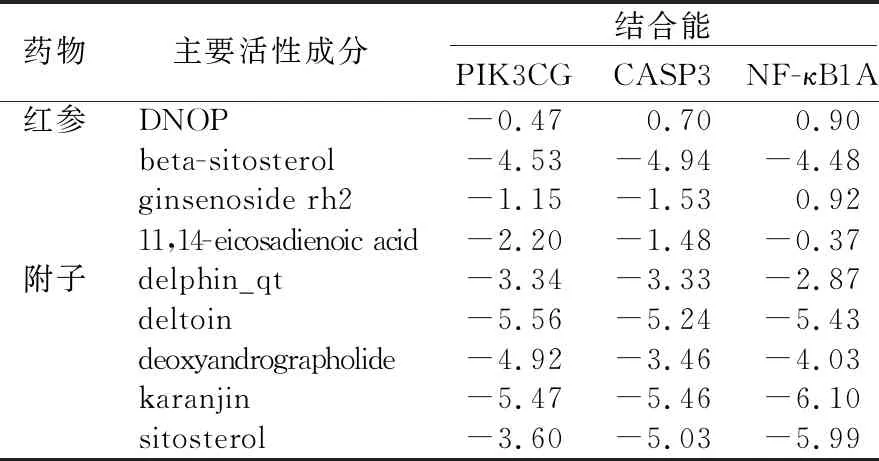
表3 參附注射液主要活性成分分子對接結果 單位:kJ/mol
3 討 論
休克是指在各種強烈致病因子作用下,機體出現有效循環血量急劇減少,組織灌注嚴重不足,甚至出現器官功能障礙[9]。有研究顯示,能量代謝障礙、過度炎癥反應、氧自由基損傷、血管低反應性、凝血功能紊亂是休克的主要機制,其中炎癥反應是休克進一步發生發展的重要原因之一[10]。休克發生后,微循環灌注減少,發生廣泛的組織缺氧,刺激機體炎癥細胞活化,產生大量炎性因子,涉及內毒素的直接攻擊、細胞黏附分子過表達、絲裂原活化蛋白激酶通路活化等多種機制[11]。
參附注射液作用廣泛,通過調節血壓和心率、保護心肌細胞、改善微循環及血液流變學、降低炎性因子表達等達到抗休克的目的。《參附注射液急重癥臨床應用專家共識》推薦針對膿毒性休克病人,在血管活性藥物基礎上加用參附注射液以穩定血壓,減少血管活性藥物用量[12]。現代藥理研究發現,參附注射液主要含有烏頭類生物堿和人參皂苷類,還含有少量的有機酸、核苷、氨基酸、多糖及金屬元素等[13],可降低超敏C反應蛋白、白細胞介素-6及腫瘤壞死因子-α水平,提高白細胞介素-10含量,達到促炎/抗炎因子趨于平衡,有效控制休克時炎癥反應[14],還可抑制大鼠心肌組織核轉錄因子-κB活化及腫瘤壞死因子-α蛋白表達,發揮抗炎作用[15]。
本研究通過網絡藥理學方法初步篩選出參附注射液治療休克的活性成分為β-谷甾醇、人參皂苷Rh2、去氧穿心蓮內酯、豆甾醇等。β-谷甾醇可明顯降低組胺誘發的小鼠毛細血管通透性增加,可能抑制前列環素E2、緩激肽、組胺、5-羥色胺等炎癥介質活性,發揮抗炎作用[16]。人參皂苷Rh2是紅參中的特有皂苷,具有抗氧化和抗炎的作用。Rh2通過抑制核轉錄因子-κB活化減輕機體炎癥狀態[17]。豆甾醇可降低結腸組織炎性因子白細胞介素-1、白細胞介素-6、單核細胞趨化蛋白1和環氧合酶2的mRNA表達[18]。穿心蓮內酯能抑制核轉錄因子-κB、環氧合酶2,降低細胞黏附中E-選擇素產生、抑制細胞間黏附分子1,最終起到抗炎效果[19]。
通過PPI與通路的富集分析發現,pathways in cancer (hsa05200)、hepatitis B(hsa04066)、influenza A(hsa05164)等是參附注射發揮抗休克治療作用的主要信號通路。pathway in cancer信號通路中包括核轉錄因子-κB、CAPS3、HSP90AB1、JUN等基因,hepatitis B信號通路包含PIK3CG、IL-1β、CASP3、TNF、CASP9等基因。CASP3是執行相關胱天蛋白酶中參與細胞凋亡的重要執行因子,是常見的被激活的凋亡相關蛋白酶[20]。腫瘤壞死因子-α刺激白細胞介素和趨化因子,誘導白細胞在炎癥部位大量聚集,還可與靶細胞上受體結合啟動信號轉導通路,從而誘導炎癥反應。腫瘤壞死因子-α可促進蛋白水解酶和氧自由基釋放,加速炎癥進展[21]。白細胞介素-1β具有激活白細胞介素-1信號通路和髓樣分化因子依賴的核轉錄因子-κB通路,正反饋作用促進白細胞介素-1等促炎性細胞因子轉錄,誘導機體發生炎癥反應[22]。
核轉錄因子-κB是炎癥過程中腫瘤壞死因子-α信號轉導的關鍵調節因子,腫瘤壞死因子觸發多種途徑的激活,包括核轉錄因子-κB和絲裂原活化蛋白激酶途徑[23]。磷酸肌醇3-激酶(PI3K)參與免疫、炎癥和過敏反應。調節白細胞向炎癥部位的趨化性和對化學引誘劑的反應[24]。基因靶點主要富集在PIKCG、核轉錄因子-κB、CAPS3,故與參附注射液主要成分進行分子對接驗證。對接結果顯示:Karanjin(水黃皮次素)、Deltoin(德爾妥因)與PIKCG、核轉錄因子-κB、CAPS3結合能≤-5.0 kJ/mol,小分子配體與受體結合較好,可能是參附注射液發揮抗休克作用主要活性成分。德爾妥因可抑制炎癥反應[25],水黃皮次素能降低腫瘤壞死因子α產生,顯著抑制核轉錄因子-κB表達,并明顯抑制腫瘤壞死因子α誘導的巨噬細胞產生一氧化氮和活性氧,并對枯草芽孢桿菌和大腸桿菌細胞生長有一定的抑制作用[26-27]。
綜上所述,基于網絡藥理學分析結果,認為參附注射液中的活性成分β-谷甾醇、去氧穿心蓮內脂、水黃皮次素、豆甾醇、人參皂苷rh2,主要通過pathways in cancer(hsa05200)、hepatitis B(hsa04066)、influenza A(hsa05164)等通路作用于PIK3CG、NF-κB1A、CAPS3等靶點,發揮抗炎、抗休克等作用。分子對接結果表明:水黃皮次素、德爾妥因與PIKCG、NF-κB1A、CAPS3結合力較強,可能是抑制休克炎癥反應的主要活性成分。本研究存在一些不足:有效成分相關靶點尋找和確認方法需優化,進一步驗證結論開展動物實驗研究。

