長時程亞低溫治療對重度顱腦損傷患者腦損傷標志物及氧化應激指標的影響
杜延平,梁建廣,王玉海,金東,何新俊,吳春富
1.無錫市中醫醫院神經外科,江蘇無錫214001;2.解放軍904醫院神經外科,江蘇無錫214044
前言
重型顱腦損傷是由于外力作用于頭部所致,具有起病急、病情變化快等特點,是導致神經功能障礙的主要因素[1]。重型顱腦損傷出現致殘、短期內死亡等不良預后者高達50%[2]。亞低溫療法是指采用物理及藥物干預的方式將患者體溫降低至目標水平,近年來逐漸應用于心外科及神經外科患者的輔助治療,特別對于重型顱腦損傷患者,亞低溫療法有利于降低顱內壓、減輕腦水腫、改善由嚴重創傷應激反應引起的機體高代謝狀態,發揮腦保護作用,降低繼發性腦損傷發生風險[3-4]。雖然,目前亞低溫用于輔助治療重度顱腦損傷患者的療效已經得到證實,然而在亞低溫時程選擇方面仍存在爭議[5-6]。為此,本研究對62 例重度顱腦損傷患者進行回顧性分析,從凝血功能、腦損傷情況、氧化應激程度、并發癥以及短期預后等方面比較不同時程亞低溫療法的臨床療效,以期為亞低溫療法的時程選擇積累數據。
1 資料與方法
1.1 研究對象
選取2017年1月~2019年1月期間無錫市中醫醫院收治的62例重度顱腦損傷患者。納入標準:(1)有明確顱腦外傷史;(2)經CT、MRI 確診為重度顱腦損傷;(3)受傷至入院時間≤4 h;(4)格拉斯哥昏迷評分(GCS)≤8 分;(5)年齡18~80 歲;(6)患者家屬簽署知情同意書。排除標準:(1)入院時腦死亡;(2)傷后存活時間<1 周;(3)合并除顱腦外傷外其他重大外傷;(4)合并惡性腫瘤;(5)高血壓腦出血、血管瘤破裂、腦梗死及癲癇患者;(6)凝血功能異常患者。根據治療方式將62 例患者分為短時程亞低溫治療組(對照組,n=30)和長時程亞低溫治療組(觀察組,n=32)。對照 組 中男18 例、女12 例,年齡35~80 歲,平均(55.27±11.34)歲,受傷至入院時間(2.86±1.02)h,入院時GCS 評分(5.27±1.89)分,受傷部位為硬膜下血腫、腦挫裂傷、硬膜外血腫及彌漫性軸索損傷,分別為16、8、4、2 例,合并高血壓、糖尿病患者分別為7、8例;觀察組中男19 例、女13 例,年齡37~79 歲,平均(55.80±12.11)歲,受傷至入院時間(2.79±1.15)h,入院時GCS 評分(5.33±1.90)分,受傷部位為硬膜下血腫、腦挫裂傷、硬膜外血腫及彌漫性軸索損傷,分別為14、9、6、3 例,合并高血壓、糖尿病患者分別為9、7例。兩組患者一般資料差異均無統計學意義(P>0.05),具有可比性。
1.2 方法
1.2.1 治療方法兩組患者入院后立即清創、止血,根據影像學檢查結果確定手術部位,行開顱血腫清除術與(或)去骨瓣減壓術,術后監測患者生命體征,并給予常規止血、抗感染、脫水、抗炎、維持電解質平衡、降低顱內壓、營養神經以及抑酸護胃等基礎對癥治療,若患者出現呼吸困難應行氣管插管或氣管切開以輔助呼吸。觀察組采取長時程亞低溫治療:采用RC-2000亞低溫治療儀(冰帽+冰毯,北京禾和春科技有限公司)對患者進行降溫,儀器由全電腦控制,智能化高,采用進口感溫管,溫度控制可靠靈敏,具有降溫速度快、噪音低、環保、控溫、顯示直觀、工作可靠等性能。通過內置傳感器監測毯帽溫度,降溫速度1.0~1.5 ℃/h,肛溫目標為33 ℃~35 ℃,持續5 d,泵入氯丙嗪、苯磺酸阿曲庫銨、異丙嗪各200 mg用于肌松及鎮靜處理;復溫,升溫速度為每4~6 h 升高1 ℃,肛溫目標36.5 ℃~37.5 ℃;停用肌松劑、鎮靜劑、撤下呼吸機及亞低溫治療儀。對照組采取短時程亞低溫治療,肛溫降至32 ℃~34 ℃后持續2 d,其余治療步驟同觀察組。
1.2.2 觀察指標(1)凝血功能指標:分別于治療前、治療后第6 天(即觀察組完成治療后次日),采用STA-Compact 型全自動血凝儀(法國, Stago)測定兩組患者外周靜脈血凝血酶原時間(PT)、凝血酶時間(TT)、活化部分凝血酶原時間(APTT)及D-二聚體(D-D)水平。(2)腦損傷標志物:分別于治療前、治療后第6 天,采用酶聯免疫吸附試驗(ELISA)測定兩組患者外周靜脈血髓鞘堿蛋白(MBP)、神經元特異性烯醇化酶(NSE)、S100 蛋白(S-100B)水平,ELISA 試劑盒購自武漢默沙克生物科技有限公司,操作步驟嚴格按照說明書進行。(3)氧化應激指標:分別于治療前、治療后第6 天,采用TBA 比色法測定兩組患者外周靜脈血丙二醛(MDA)、超氧化物歧化酶(SOD)水平,檢測試劑盒購自北京百奧萊博科技有限公司,操作步驟嚴格按照說明書進行。(4)并發癥:記錄兩組患者術后30 d 內顱內血腫、胃腸動力減弱、泌尿系感染、肺部感染、應激性潰瘍等并發癥發生情況。(5)昏迷時間、30 d致殘率及30 d病死率。
1.3 統計學處理
數據分析采用SPSS23.0 軟件進行,統計數據符合正態分布。計量資料用均數±標準差表示,比較采用t檢驗;計數資料用[n(%)]表示,比較采用χ2分析。P<0.05為差異有統計學意義。
2 結果
2.1 兩組患者治療前后凝血功能指標比較
治療前,兩組患者PT、TT、APTT 及D-D 水平差異均無統計學意義(P>0.05);治療后第6 天時,兩組患者血清PT、TT、APTT水平均高于治療前(P<0.05),且觀察組高于對照組(P<0.05);治療后第6 天時,兩組患者血清D-D水平均低于治療前(P<0.05),且觀察組低于對照組(P<0.05)。詳見表1。

表1 兩組患者治療前后凝血功能比較(xˉ± s)Tab.1 Comparison of coagulation function between two groups of patients before and after treatment (Mean±SD)
2.2 兩組患者治療前后腦損傷標志物水平比較
治療前,兩組患者血清MBP、NSE、S-100B 水平差異無統計學意義(P>0.05);治療后第6 天時,兩組患者血清MBP、NSE、S-100B 水平均低于治療前(P<0.05),且觀察組低于對照組(P<0.05),見表2。
表2 兩組患者治療前后腦損傷標志物水平比較(± s)Tab.2 Comparison of brain injury marker levels before and after treatment in two groups (Mean±SD)
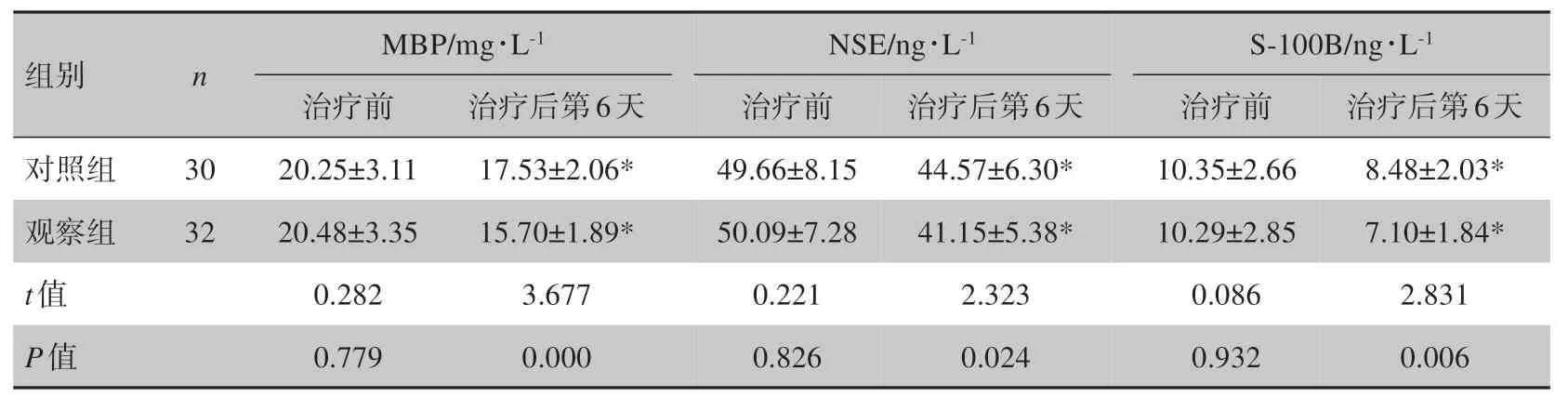
表2 兩組患者治療前后腦損傷標志物水平比較(± s)Tab.2 Comparison of brain injury marker levels before and after treatment in two groups (Mean±SD)
*表示與同組治療前比較,P<0.05
組別對照組觀察組t值P值n 30 32 MBP/mg?L-1治療前20.25±3.11 20.48±3.35 0.282 0.779治療后第6天17.53±2.06*15.70±1.89*3.677 0.000 NSE/ng?L-1治療前49.66±8.15 50.09±7.28 0.221 0.826治療后第6天44.57±6.30*41.15±5.38*2.323 0.024 S-100B/ng?L-1治療前10.35±2.66 10.29±2.85 0.086 0.932治療后第6天8.48±2.03*7.10±1.84*2.831 0.006
2.3 兩組患者治療前后氧化應激指標比較
治療前,兩組患者血清MDA、SOD 水平差異無統計學意義(P>0.05);治療后第6 天時,兩組患者血清MDA、SOD 水平均低于治療前(P<0.05),且觀察組低于對照組(P<0.05),見表3。
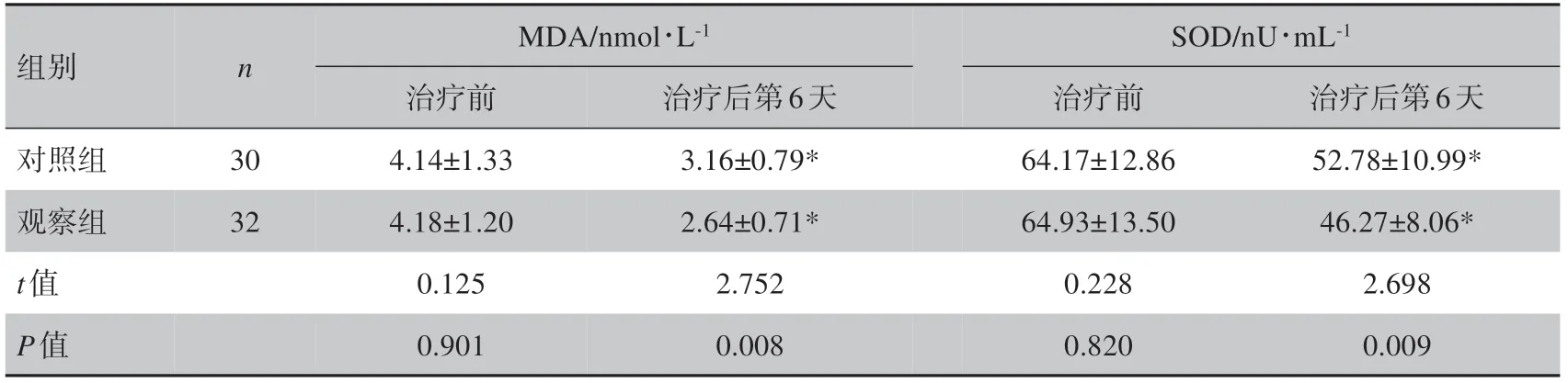
表3 兩組患者治療前后氧化應激指標比較(xˉ± s)Tab.3 Comparison of oxidative stress indexes between two groups of patients before and after treatment (Mean±SD)
2.4 兩組患者并發癥發生情況
對照組中出現顱內血腫、胃腸動力減弱、泌尿系感染、肺部感染、應激性潰瘍的患者分別為2、7、4、2、3例,觀察組中分別為1、8、3、3、1例,兩組患者并發癥發生率差異無統計學意義(P>0.05)。
2.5 兩組患者昏迷時間、30 d致殘率及30 d病死率比較
觀察組患者昏迷時間較對照組縮短,差異具有統計學意義(P<0.05);觀察組患者30 d致殘率及30 d病死率均低于對照組,但兩組間差異無統計學意義(P>0.05)。詳見表4。

表4 兩組患者昏迷時間、30 d致殘率及30 d病死率比較Tab.4 Comparison of coma duration,30-day disability rate,and 30-day mortality rate between two groups
3 討論
3.1 亞低溫及治療時程選擇
重度顱腦損傷是指嚴重的顱腦外傷,GCS 評分為<8 分,是危重病醫療領域的一個重大且具有挑戰性的疾病[7]。一般來說,重度顱腦損傷分為兩個獨立的時期:原發性腦損傷和繼發性腦損傷,原發性腦損傷是指腦實質(組織、血管)在創傷過程中發生的物理性損傷,若沒有及時采取有效治療措施,患者可能在隨后的幾小時至幾天內,引發繼發性腦損傷[8]。亞低溫是目前用于重型顱腦損傷輔助治療的重要方式之一,其溫度范圍從32 ℃到35 ℃[9]。研究證實亞低溫狀態下損傷腦組織的氧代謝率下降,從而降低氧自由基及毒性代謝產物的釋放量,減輕由腦組織水腫而引發的繼發性腦損傷[10]。此外,亞低溫可調解腦血流量,有效阻斷Ca2+內流,抑制興奮性氨基酸等物質釋放,促進神經元泛素的合成,阻斷神經元凋亡途徑,進而保護神經功能。亞低溫治療儀通過與患者身體接觸進行熱量交換,進而達到控制患者體溫的目的[11]。目前臨床中用于重型顱腦損傷治療選擇較多的亞低溫時程為2 d,而此類患者發病后5 d內為最佳治療時期[12],故本研究主要采用短時程(2 d)、長時程(5 d)兩種方案對患者進行治療。
3.2 不同時程亞低溫對凝血功能指標的影響
顱腦損傷可引起激活凝血系統,使機體處于高凝狀態,誘導纖溶亢進,使顱內血栓形成風險增加,不利于患者預后[13-14]。本研究發現觀察組患者治療后血清PT、TT、APTT 水平高于對照組,D-D 水平低于對照組,提示觀察組患者凝血功能更優,這是由于亞低溫治療有效緩解了顱腦損傷所誘導的高凝纖溶機體異常,而長時程亞低溫治療在凝血功能改善方面效果更優,可能是由于其長期抑制凝血因子與凝血酶釋放,并阻止凝血酶原過度激活。李鴻煒等[15]提出相較于短時程,長時程亞低溫療法有利于緩解重型顱腦損傷患者血液高凝狀態,與本研究結果一致。
3.3 不同時程亞低溫對腦損傷及氧化應激的影響
腦組織損傷是重度顱腦損傷患者的主要表現,因此評估其損傷程度可直接反映臨床效果。本研究中觀察組患者治療后血清MBP、NSE、S-100B、MDA、SOD水平均低于對照組,提示觀察組患者氧化應激反應受到一定程度抑制,且腦損傷程度更輕微,分析原因是由于亞低溫治療對自由基生成進行了抑制,降低腦代謝水平及腦組織氧化程度,較少腦組織氧耗[16-17],因此兩組患者腦損傷及氧化應激指標均較治療前有所改善,而長時程亞低溫改善程度更大可能是由于患者腦挫傷水腫程度于創傷后3 d 到達高峰,而短時程亞低溫療法于2 d 后開始復溫,因此與長時程亞低溫相比,短時程亞低溫對與腦挫傷水腫引起的繼發性腦損傷的保護功能較小。李鴻煒等[15]也得出了長時程亞低溫有利于進一步降低重度顱腦損傷患者術后NSE 水平的結論;李志剛等[12]同樣認為,過短時間的亞低溫治療對于繼發性腦損傷的預防效果較小。彭越等[18]將不同時程亞低溫與靜脈溶栓療法相結合,發現長時程亞低溫有利于改善患者神經功能及SOD、MDA含量,與本研究結果一致。
3.4 不同時程亞低溫對并發癥及短期療效的影響
本研究中兩組患者顱內血腫、胃腸動力減弱、泌尿系感染、肺部感染、應激性潰瘍等并發癥發生率及30 d致殘率和30 d病死率差異無統計學意義(P>0.05),提示長時程亞低溫治療并未增加并發癥發生風險,同時也對短期療效無明顯影響,與余菲等[19]提出的“長時間與短時間亞低溫治療組患者,短時間內死亡率及并發癥發生率差異無統計學意義”這一結論相同。王松凡等[6]也提出,長時程亞低溫治療雖然可改善患者預后,但并不能降低其短期病死率。
綜上所述,長時程亞低溫治療有利于改善重度顱腦損傷患者凝血功能,降低腦損傷標志物水平及氧化應激損傷,縮短昏迷時間,且不增加并發癥發生風險,值得在臨床中推廣應用。

