基于生物信息學篩選尿毒癥差異基因及中藥預測
林帥軍,楊忠杰,榮曉哲,杜躍亮,王瑞,于曉濤
(漯河市第一人民醫院,河南 漯河 462005)
在全球范圍內有超過200 萬人是慢性腎臟病(chronic kidney disease,CKD)患者[1]。尿毒癥(uremia)是指與慢性腎臟病(CKD)患者全身器官功能障礙相關的各種臨床綜合征,導致許多蛋白質結合和水溶性代謝物(稱為尿毒癥溶質)在血漿中積聚、多器官功能障礙和腸道菌群失調等[2]。
目前尿毒癥的主要治療手段是腎移植或血液透析,由于腎源稀少,大部分患者選擇透析治療。血液透析可清除慢性腎衰竭患者體內毒素,使患者生存質量顯著提升,但是長時間的血液透析不僅會出現并發癥,還會影響患者的預后[3]。但是血液透析對于凈化患者體內內源及外源性毒素的具有較好效果,但并不能改善患者的腎功能[4],而中醫藥不僅可改善患者的生存質量,調節腎臟血液循環,提高腎小球濾過率,并且提高了患者的腎功能,因此可被用于輔助治療慢性腎衰竭患者[5]。
近年來基因芯片技術與高通量技術可測量人類基因組內多個基因的表達變化,被廣泛應用于疾病過程和生物功能障礙的分子途徑的闡明以及藥物治療靶點的篩選[6-7]。本研究利用基因表達數據庫(GEO)檢索尿毒癥基因芯片,對數據進行分析并篩選尿毒癥組與正常組的差異表達基因,通過構建差異基因蛋白互作網絡進而發現關鍵基因,對關鍵基因進行GO 功能分析和KEGG 通路分析,明確關鍵基因主要涉及通路,依托Coremine Medical 數據庫篩選以關鍵基因為靶點的潛在治療中藥,以期為尿毒癥的分子機制及潛在治療中藥提供新研究思路及理論依據。
1 資料與方法
1.1 數據提取
從基因表達數據庫(https://www.ncbi.nlm.nih.gov/geo/)下載編號為GSE37171 的基因片段原始數據[8]。該數據集包括年齡在18至75歲之間、臨床穩定等待腎移植、未接受免疫抑制藥物治療的5 期腎病患者75 個和40 個正常人外周血的基因芯片數據,該片段平臺為GPL570[HG-U133_Plus_2]Affymetrix Human Genome U133 Plus 2.0 Array。
1.2 數據處理
基于R 語言(https://www.r-project.org/)“limmar”包對尿毒癥患者外周血和正常人外周血樣品中每個探針進行數據歸一化,對于一個基因對應多個探針的,合并多個探針并取其平均值,對樣本標準化的結果采用箱式圖和主成分分析圖查看。
1.3 差異基因
通過R 語言中與GPL570 平臺相對應“hgu133plus 2. db”包將探針轉換成基因名稱,并且以log2(fold change)的絕對值> 1 和調整的P< 0.05 為篩選標準,篩選差異表達基因(DEGs),負數代表下調,正數代表上調,利用R語言“ggpubr”和“pheatmap”包制作差異表達基因的火山圖和熱圖。
1.4 篩選關鍵基因
利用String數據庫[9](https://string-db.org/)以medium confidence>0.4為篩選條件對DEGs進行蛋白質相互作用(PPI)分析,利用Cytoscape 軟件(version3.7.2)的CytoHubba 插件對PPI 互作網絡進行差異基因篩選以獲得關鍵基因,具有高degree 的蛋白更傾向于是關鍵蛋白,因此以degree 對節點進行排名綜合篩選關鍵基因。
1.5 關鍵基因的功能注釋
利用DAVID 數據庫(https://david.ncifcrf.gov/)對關鍵基因進行基因功能富集分析。使用kobas 數據庫(http://kobas.cbi.pku.edu.cn/)[10]以P< 0.05 作為顯著性富集篩選標準對關鍵基因進行KEGG 通路富集分析。
1.6 基于Coremine Medical數據庫的中藥篩選
將關鍵基因導入Coremine Medical 數據庫(http://www.coremine.com/)中,基因和對應藥物映射以P<0.05篩選具有潛在治療作用的中藥。
2 結果
2.1 數據預處理
對GSE37171 的基因片段原始數據過濾后最終獲取20864 個基因表達水平數據。樣本標準化箱式圖結果顯示腎病患者和正常人外周血樣本中位數在一個水平線上,說明樣本間歸一化程度好,見圖1A。PCA 圖顯示uremia 和正常組外周血樣本表達基本能夠區分,見圖1B。
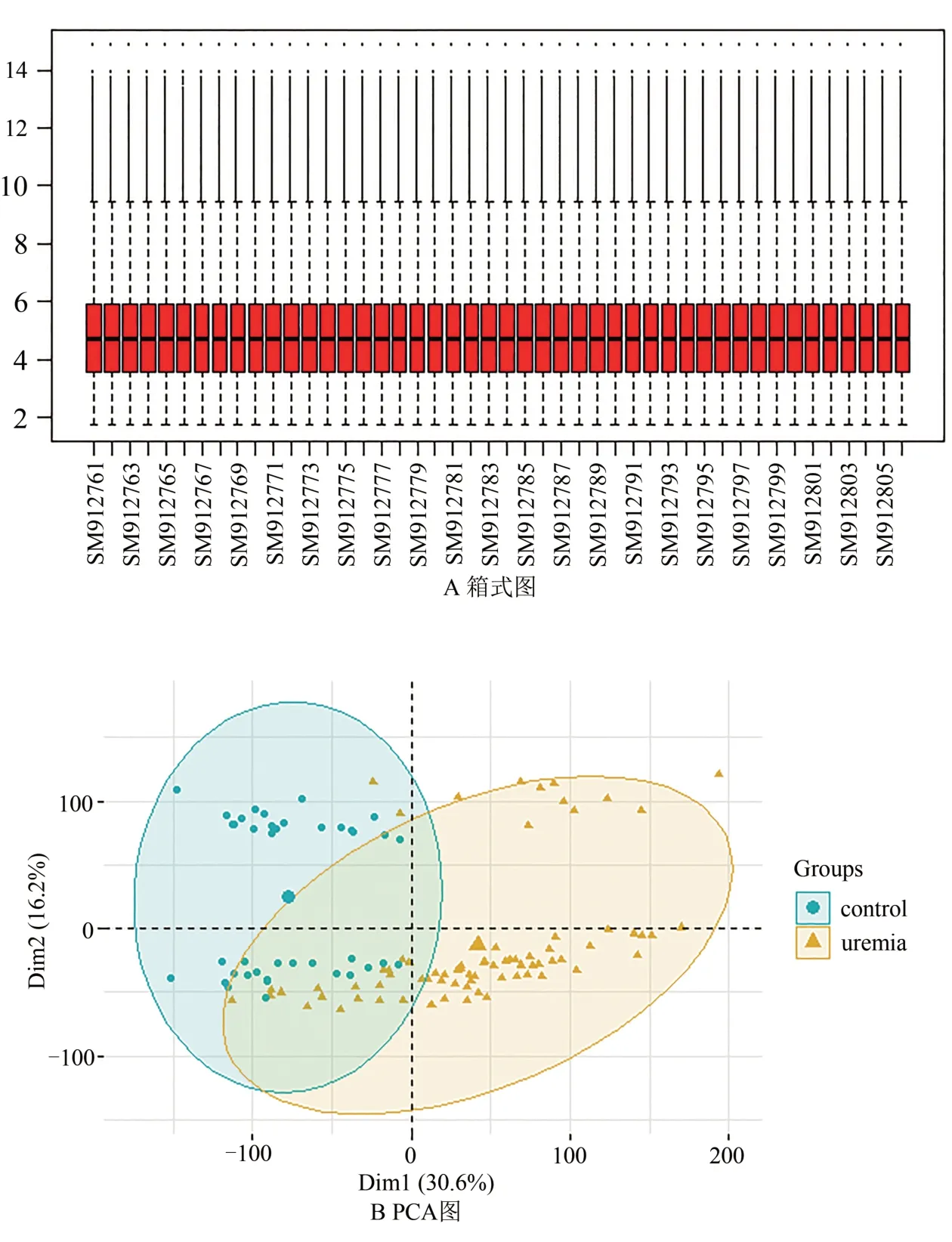
圖1 GSE37171數據質量分析
2.2 差異基因結果
對GSE37171 的基因片段原始數據探針轉化后,以log2(Fold change)的絕對值> 1 和調整的P< 0.05為篩選標準,總共得出571 個差異表達基因,其中包括526 個上調基因和45 個下調基因,差異表達基因的火山圖見圖2;下調和上調最顯著40 個基因的聚類熱圖見圖3。
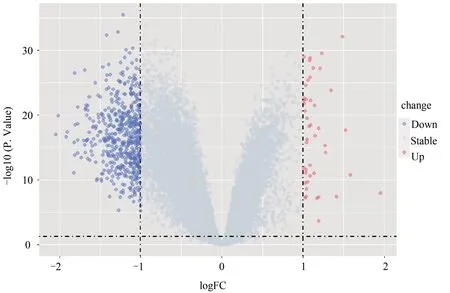
圖2 DEGs火山圖
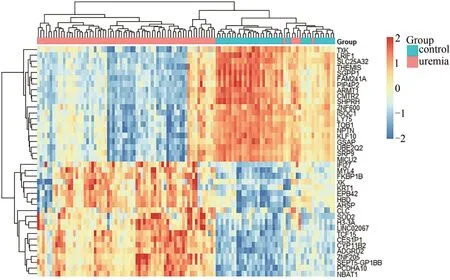
圖3 DEGs聚類熱圖
2.3 差異表達基因的PPI 網絡模塊分析及關鍵基因篩選
基于STRING 數據庫的PPI分析得到了uremia組顯著差異基因的PPI網絡,總共543個節點,1 258個互作關系。基于Cytoscape的CytoHubba插件對PPI網絡各個節點基因進行評分排序,得到網絡中的核心節點基因。使用Degree 算法計算出的15 個關鍵基因為EP300、UBE2D1、SIRT1、PPP2CA、RANBP2、SMARCA5、DHX15、TLR4、UBE2E2、SRSF2、UBE2E1、RBBP4、DDX5、YWHAZ和CDKN1B,數據見表1,關鍵基因模塊見圖4。
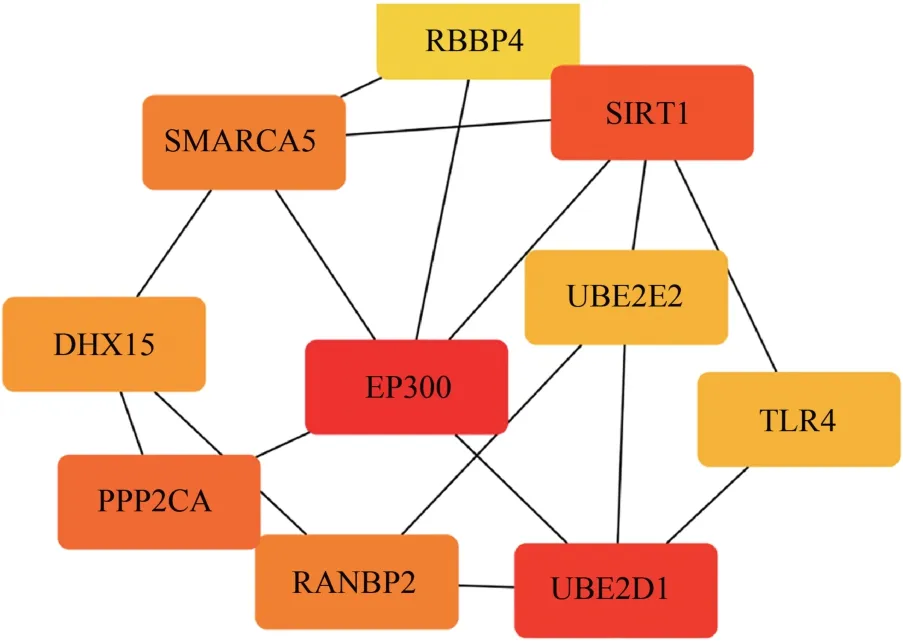
圖4 關鍵基因互作關系網絡
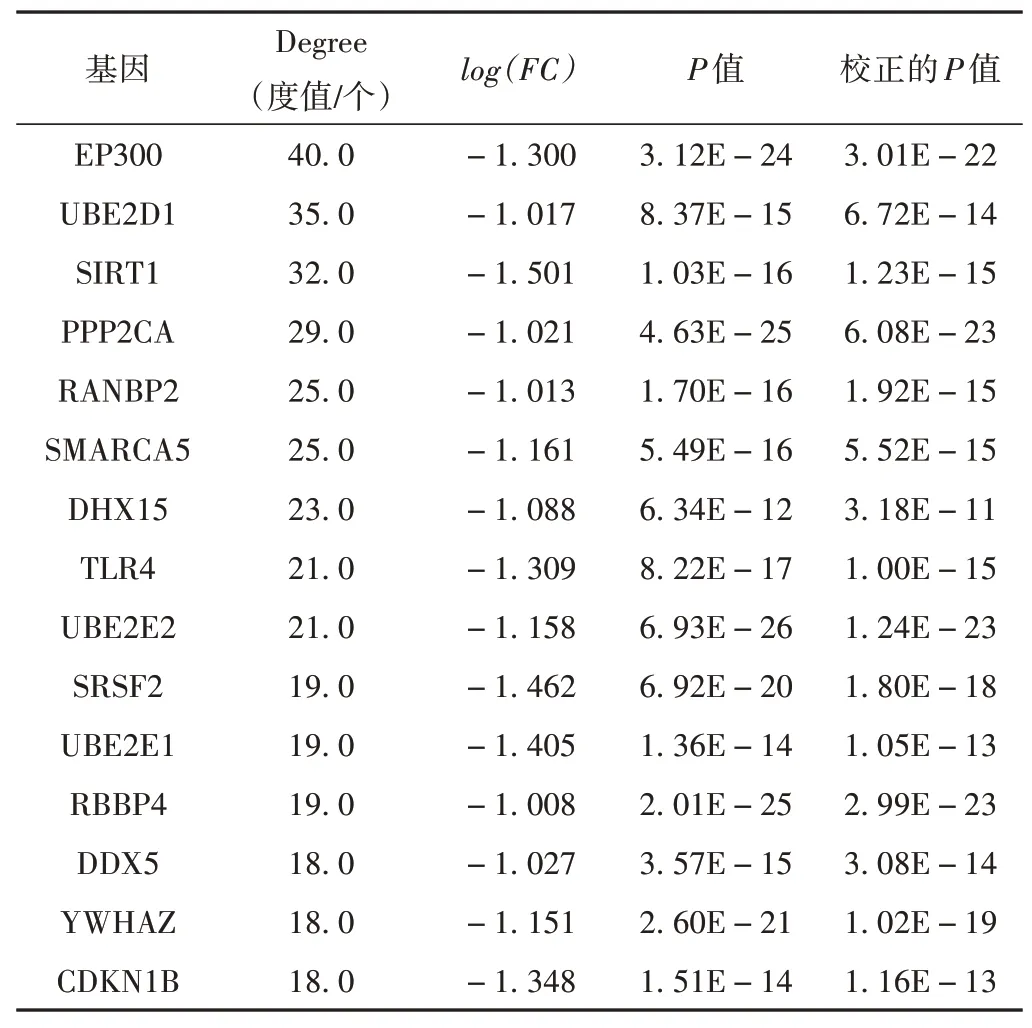
表1 差異表達基因中Degree排名前15的基因
2.4 關鍵基因GO功能富集和KEGG通路分析
使用DAVID 對關鍵基因進行GO 分析。GO 分析結果顯示差異基因主要參與的生物過程(BP)為K48蛋白連接泛素化、細胞對熱反應的調節、細胞生長的負調控、ISG15-蛋白結合、RNA 拼接;細胞成分(CC):核漿、核、NURF 復合體、染色質沉默復雜、ESC/E(Z)復合體;分子功能(MF):蛋白結合、泛素結合酶活性、ISG15轉移酶活性、組蛋白結合、ATP結合。見圖5。
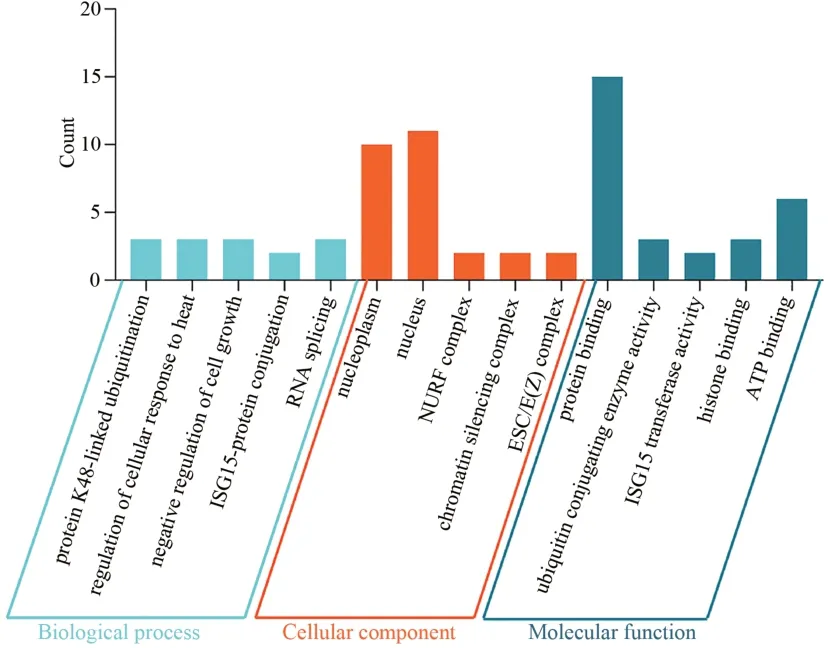
圖5 關鍵基因的GO 富集分析
Kobas富集分析(P<0.05)共篩選出15條通路,涉及PI3K-Akt 信號通路、HIF-1 信號通路、細胞周期、FoxO 信號通路、剪接體、泛素介導的蛋白水解途徑、乙型肝炎、小分子核糖核酸在癌癥、人類乳頭瘤病毒感染、TGF-beta信號通路、胰高糖素信號通路、AMPK信號通路、卵母細胞減數分裂、Hippo信號通路和細胞衰老等,通路見圖6。
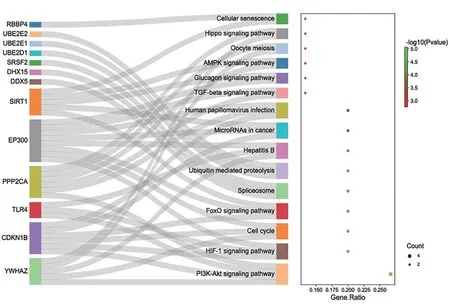
圖6 關鍵基因KEGG 富集通路圖
2.5 關鍵基因治療中藥預測結果
將10 個關鍵基因映射到Coremine Medical 數據庫,以P< 0.05 為條件篩選治療Uremia 的潛在中藥,得到黃芪、鉤藤、黃芩、人參、積雪草等多味中藥,見表2。

表2 關鍵基因相關中藥預測表
3 討論
3.1 尿毒癥患者和健康人之間的差異表達基因
尿毒癥預后差、花費高,目前糖皮質激素、免疫抑制藥物及透析治療尚存在不良并發癥,而中醫藥在辨證論治的基礎上,整體調治慢性腎病已取得明顯的療效。各種慢性腎病的病理基礎是腎小球硬化、腎間質纖維化和腎動脈硬化,而在慢性腎病發展過程中,腎組織的炎癥反應及其相關的組織損傷是導致其進展至終末期腎病尿毒癥的重要因素。
研究顯示健康和疾病中的腎功能中EP300的靶基因可作為未來實驗研究的靶基因,以闡明將差異DNA甲基化與腎功能聯系起來的潛在基因調控機制[11]。沉默信息調節因子1(silent information regulator 1,SIRT1)表達受到抑制,可造成小鼠腎小球系膜細胞凋亡。研究表明,SIRT1 通過調節腎臟細胞的氧化應激狀態,抑制腎臟細胞凋亡和腎臟炎癥反應,從而緩解糖尿病腎病[12]。Toll 樣受體4(Toll‐like receptors,TLR4)屬Toll 樣受體家族,是一種膜型模式識別受體,TLR4活化后可誘導IL-6、IL-8 等多種炎性因子基因并促進趨化因子分泌、巨噬細胞表型轉化及氧化應激,是腎纖維化的重要介質[13-14]。
3.2 關鍵表達基因的功能與缺氧和炎癥信號通路密切相關
腎纖維化是具有多種病因的進行性慢性腎病的常見病理標志。作為終末期腎病的最終共同途徑,缺氧在腎纖維化發展過程中起著關鍵作用[15]。研究顯示缺氧誘導的腎纖維化中的EMT與PI3K/Akt通路的激活關系密切,抑制PI3K激活通過減弱ECM 的積累,而抑制Akt導致梗阻性腎病中肌成纖維細胞標志物的減少[16-17]。
缺氧誘導因子(HIF)是腎臟疾病各種病理生理過程中缺氧適應反應的主要介質,HIF 可直接誘導缺氧腎小管上皮細胞中基質調節因子的表達,例如膠原蛋白I、纖溶酶原激活劑抑制劑1(PAI1)、內皮素-1(ET-1)、結締組織生長因子(CTGF)、基質金屬肽酶2(MMP-2)和金屬蛋白酶1 組織抑制劑(TIMP1),可增加間質膠原蛋白的產生并減少ECM的降解[18-19]。
3.3 相關中藥可能是尿毒癥預防及治療的潛在藥物
研究顯示黃芩苷可以通過抑制miR-141過表達,促進Sirt1表達水平上升以緩解高糖小鼠腎小球系膜細胞的凋亡,進而治療糖尿病腎病[20]。研究顯示漢黃芩素能夠通過抑制糖尿病腎病大鼠腎組織TLR4蛋白表達水平,減輕大鼠腎組織氧化應激損傷及炎癥反應,進而恢復腎小球形態及功能,顯著改善糖尿病腎病的腎功能[21]。益腎膠囊(黃芪、當歸等組成)可上調SOCS-3而抑制TLR4 與IL-6 表達,從而降低糖尿病腎病的炎癥反應[22]。中藥可通過調控炎性因子及其信號通路而干預慢性腎病的發展,后期通過科學完整的藥物篩選平臺必將產生安全有效的治療慢性腎病的中藥制劑。
通過對尿毒癥基因芯片的數據挖掘及生物信息學分析,發現尿毒癥的差異表達基因,篩選得到15個關鍵基因,分析得到關鍵基因主要參與的信號通路及其功能,發現黃芪、鉤藤、黃芩、人參、積雪草等可能是其潛在的治療中藥。所篩選的關鍵基因及中藥可為后續尿毒癥分子機制及其治療藥物的研究研究提供理論依據,未來需進一步通過實驗來驗證關鍵基因及相關中藥的治療作用。

