適用于光催化耦合工藝的耐紫外優勢菌篩選及鑒定
張彥龍, 侯 悅, 榮 欣, 張多英, 井立強
(1.黑龍江大學 農業微生物技術教育部工程研究中心, 哈爾濱 150500;2.黑龍江大學 生命科學學院 黑龍江省普通高校微生物重點實驗室, 哈爾濱 150080;3.黑龍江大學 建筑工程學院, 哈爾濱 150080; 4.黑龍江大學 化學化工與材料學院功能無機材料化學教育部重點實驗室 國家級催化技術國際聯合研究中心, 哈爾濱 150080)
0 引 言
光催化氧化法是基于半導體光催化原理,以光為能量,將有機物降解為二氧化碳和水的方法[1]。TiO2是最常用的一種半導體催化劑,近年來,還發展出了基于二氧化鈦的可見光光催化劑,如SiO2-TiO2、Ag-TiO2、N-TiO2和Er3+∶YAlO3/TiO2等[2-5];以及鉍(Bi)系化合物、混合價態錳氧化物/磷酸銀光催化劑,如Bi12O17Cl2、Mn3O4/MnO2-Ag3PO4等[6-7]。已有報道發現,光催化技術雖然可以高效轉化污染物,但很難達到完全礦化,加之投入成本較高,在實際應用中還是受到一定的限制[8]。此外,光催化氧化法的光照催化氧化周期較長,處理效果也難以滿足實際處理的要求[9]。
光催化生物耦合(Intimated coupling of photocatalysis and iodegradation, ICPB)技術借助于多孔載體,將難降解污染物的光催化產物由載體表面傳質至內部,并被生物進一步降解礦化[10]。ICPB同步解決了單一光催化技術對有機物礦化不完全,以及單一生物降解技術無法對難降解有機物起作用的問題[11]。徐政雪研究發現,ICPB體現了單獨紫外光光催化(UPC)與單獨生物降解(B)協同作用的特點,解除了苯酚對微生物的抑制,16 h在紫外光激發下的直接耦合體系(UPCB)中苯酚的去除率為67.7%[8]。Zhou等以海綿為載體,在光催化劑TiO2中同時摻雜Er3+和YAlO3,研究了UPCB對苯酚降解的影響。該工藝對苯酚的去除率為67.2%,進一步顯示了光催化和生物降解的協同作用[4]。盡管ICPB技術存在許多優點,但經紫外光照射后,附著于載體外部的生物膜容易受到損傷,并且紫外光可能對載體內部的生物膜也產生不利影響,例如導致生物膜脫落、損傷微生物細胞、產生可溶性微生物產物等[12]。紫外輻射(Ultraviolet, UV)是指波長介于100~400 nm的光輻射,254 nm波長的紫外光會使DNA鏈上相鄰的嘧啶堿基發生共價交聯,造成嘧啶二聚體損傷,激發堿基發生各種化學反應,導致堿基修改、丟失或改變遺傳信息[13],破壞細菌、病毒等微生物的細胞結構,造成細菌死亡[14]。因此,UV254是滅菌、消毒最常用的波長。有研究表明,在波長為254 nm紫外光照射下,納米光催化劑TiO2對大腸桿菌及金黃色葡萄球菌的殺菌效果較好,作用30 min后去除率可以分別達到97.8%和99.4%[15]。而一般TiO2光催化反應在300~388 nm波長條件下受到激發[16],使H2O、O2發生氧化還原反應生成·OH及超氧離子O2-[17]。TiO2受激發的最佳波長為365 nm。有研究發現選用波長為365 nm的紫外燈作為激發光源催化納米TiO2絲網時,空氣消毒器開機作用30 min對空氣中自然菌的平均消亡率為81.64 %;選用波長為254 nm的紫外燈作為激發光源催化納米TiO2絲網時,該空氣消毒器開機作用30 min對空氣中自然菌的平均消亡率為93.96 %[18]。由此可見,UV254及UV254+TiO2是微生物生長最不利的條件。
為提高ICPB生物降解性能和微生物的紫外光耐受能力,本文在UV254及UV254+TiO2的條件下,經分離、篩選獲得耐紫外光的優勢菌,對菌株進行16S rRNA初步鑒定,確定其最佳生長溫度、最適pH及滲透壓,分析紫外光對優勢菌生長的影響,并在UV365+TiO2的條件下構建ICPB工藝,驗證優勢菌對難降解有機物的去除效果。本結果旨在為ICPB技術提供菌種資源,對提高光催化生物降解直接耦合技術處理難降解有機物效率及應用具有一定意義。
1 材料與方法
1.1 試驗材料
1.1.1 菌種來源
本試驗菌株篩選自哈爾濱市農科院試驗田表層土壤。
1.1.2 培養基
(1) 富集分離培養基:0.3 g·L-1土壤浸出液,10%TiO2,無機鹽溶液。
(2) 無機鹽溶液:MgSO47H2O 0.01 gL-1, K2HPO40.05 gL-1, NaCl 0.01 gL-1,MnSO44H2O 0.01 g·L-1,FeSO40.01 gL-1。
以上所有培養基在配制過程中需調節pH為6.9~7.0。如需配制固體培養基,只需向以上培養基中加入18 gL-1的瓊脂,在101 ℃的高壓滅菌鍋內滅菌30 min即可。
1.2 試驗方法
1.2.1 菌株篩選
從哈爾濱農科院試驗田取300 mg表層土壤,土壤有機質含量、速效磷、速效鉀含量狀況優良,堿解氮含量較高,呈弱酸性。將300 mg土壤置于燒杯中,加入蒸餾水至1 L,攪拌均勻后靜置,靜置后的上清液即為土壤浸出液。向土壤浸出液中加入10%TiO2制備富集分離培養基(MgSO47H2O 0.01 gL-1, K2HPO40.05 gL-1NaCl 0.01 gL-1,MnSO4·4H2O 0.01 gL-1,FeSO40.01 gL-1),pH調節至6.9~7.0,在35 ℃、UV254紫外燈照射及磁力攪拌下富集3 d。培養后進行梯度稀釋,涂布于富集固體培養基中,在35 ℃、UV254紫外燈照射條件下恒溫培養。待長出單菌落后,選取單一菌落進行劃線分離。選取長勢良好的菌株用于腐殖酸降解試驗。
1.2.2 腐殖酸降解試驗
腐殖酸是經微生物轉化、合成后積累形成的一類有機物質,屬于難降解有機物[19]。腐殖酸廣泛存在于地表水、地下水、黑臭水體和垃圾滲濾液等,在飲用水中是天然有機污染物,在污水中是難降解有機物。選擇腐殖酸用于本文試驗材料,主要考慮以下幾個方面:(1)腐殖酸的污染物特性;(2)對微生物無毒害作用;(3)分解后可為微生物生長提供碳源和氮源。因此,本文選取腐殖酸作為難生物降解大分子有機物的代表物,來測定菌株對難降解有機物的去除效果。將分離的1 mL菌劑接種于含有0.5 gL-1腐殖酸的無機鹽溶液中,在UV254紫外條件下處理24 h,將相同濃度的腐殖酸溶液放置暗處理作為對照,測定降解前后的和
1.2.3 菌株的形態特征研究
將分離、純化后的典型單一菌落接種到LB固體培養基,在UV254紫外燈照射條件下,于35 ℃恒溫培養箱中培養24 h,觀察菌落的形態、大小、顏色、表面狀況、是否有光澤等。通過革蘭氏染色方法觀察菌株的革蘭氏染色特征[20],通過掃描電鏡(SEM)觀察菌體的形態特征和尺寸大小[21]。
1.2.4 菌株的16S rRNA基因鑒定
將菌株接種至LB固體培養基,在最適溫度下培養16~24 h,將菌落收集后,應用細菌基因組回收試劑盒,根據操作指南提取細菌基因組DNA。通過生工生物公司對菌株T4的16S rRNA進行測序,獲得菌株的基因序列號。采用BLAST在線工具(https://blast.ncbi.nlm.nih.gov/),將獲得的16S rRNA序列結果與NCBI GenBank數據庫中的已知模式菌株進行同源性對比,將同源性對比結果相似度最高的菌株16S rRNA序列下載,并利用MEGA 7.0軟件[22],采用Neighbour-Joining法構建系統發育樹[23],系統發育樹中其他物種的16S rRNA基因序列由NCBI的GenBank獲得。
1.2.5 碳源利用特性試驗
將菌體置于基礎培養基中,在最適溫度下培養24~48 h,用無菌棉簽收集菌體于滅菌的生理鹽水中,調節菌液濃度至OD550為0.5,混合均勻使之形成均一的菌懸液。在GN Ⅲ板的各個孔中加入200 μL菌懸液,置于菌株的最適溫度下培養2 d,記錄試驗結果,分析菌株對碳源的利用情況。若孔中的菌液由無色變為紫紅色則為陽性,無變化則為陰性[24]。
1.2.6 優勢菌的最佳生長條件
1.2.6.1 菌株最適生長溫度
配制pH為7的LB固體培養基,于101 ℃的高壓滅菌鍋中滅菌30 min后,將處于對數生長期的菌株接種于上述培養基中。初步在較大的溫度范圍(4 ~45 ℃)內設置8個溫度梯度,分別為4、10、15、20、25、30、35和45 ℃,在UV254紫外條件下培養24 h后,觀察菌株形態,通過觀察菌株四區生長狀態判斷菌株T4的最佳生長溫度。
1.2.6.2 菌株最適pH
配制LB液體培養基,調節培養基pH分別為4、5、6、7、8、9、10,將菌株接種至上述培養基中,在30 ℃、160 rmin-1、UV254紫外條件下培養24 h,測定菌液在600 nm波長下的吸光度(OD600)值,確定菌株的最佳pH。
1.2.6.3 菌株最適滲透壓
配制pH為7的LB液體培養基,調節培養基中NaCl的含量分別為0%、0.5%、1%、2%、3%、4%、5%、7%、8%和10%,將菌株接種至上述培養基中,在30 ℃、160 rmin-1、UV254紫外條件下培養24~48 h。培養24 h后,如菌液出現渾濁,則利用紫外分光光度計測定菌液OD600值;如菌液未出現渾濁,則繼續培養至48 h,再測定菌液的OD600值,確定菌株的最適滲透壓以及可適應的滲透壓范圍。
1.2.7 紫外光對菌株生長的影響
將配制好的LB液體培養基滅菌后,取7 mL置于10 mL的離心管中,取單菌落接種于上述離心管中混勻。分別取1 mL混勻后的菌液于錐形瓶中,在30 ℃、160 rmin-1、暗條件和30 ℃、160 rmin-1、UV254紫外條件下培養至對數生長期,于0、0.5、2、4、8、11、24和29 h取樣,測定菌液的OD600值。以時間為橫坐標、吸光度值為縱坐標繪制生長曲線。
1.2.8 優勢菌強化的ICPB工藝的處理效果
按照1%的接種量,將菌株T4接種于含有聚氨酯海綿(填充量為30%)的LB液體培養基中,過夜培養。反復培養3次,使聚氨酯海綿被菌液充滿,在UV365+TiO2條件下構建ICPB工藝,加入0.1 gL-1腐殖酸250 mL,在好氧條件下處理24 h后,測定處理效果。
1.2.9 分析方法


(3) TOC:利用日本島津公司TOC-VCPN型TOC檢測儀測定總有機碳,具體操作按照濕法氧化法[28]進行,分別測定總碳(TC)含量和總無機碳(TIC)含量,兩者差值即為TOC 。
(4) OD:利用紫外分光光度計測定菌液的OD600值。
(5) COD:采用《水和廢水監測分析方法》中的快速密閉催化消解法(含光度法)[26]進行COD測定。
2 結果與討論
2.1 耐紫外光優勢菌的篩選
通過富集、分離、純化的方法,以腐殖酸為碳源,在35 ℃、紫外TiO2條件下篩選出三種菌,編號分別為T1、T2和T4。向含有腐殖酸的水溶液中分別添加T1、T2、T4三種菌,取上清液并測其亞硝酸鹽、氨氮,TOC的變化情況,結果如圖1所示。腐殖酸中含量最多的是碳元素(50%~60%),其次為氧(30%~35%),再其次為氫(4%~6%)和氮(2%~4%)[29]。對T1、T2、T4進行TOC測定,降解24 h后,三株菌對腐殖酸均有去除作用。其中T4和T1去除效果較好,T1的去除率達到60%左右,其次為T4,去除率達到50.4%,二者均高于對照組(9.16%)。經生物降解之后,體系中氨氮濃度有所升高,主要原因是腐殖酸中含有2%~4%的氮元素,腐殖酸經過降解、礦化,微生物的脫氨基作用使腐殖酸中的氮以氨氮的形式釋放。對三株菌的亞硝酸鹽進行測定,經T1和T2降解后,亞硝酸鹽濃度升高,超過了1.3 mg·L-1,而經T4降解后,亞硝酸鹽濃度最低。亞硝酸鹽含量過高會引發生物急性中毒和高鐵血紅蛋白癥等,亞硝酸鹽的代謝產物N-亞硝基化合物也具有強烈的致癌性[30]。因此,鑒于T4降解腐殖酸后亞硝酸鹽生成量最低,最終將T4作為降解腐殖酸的優勢菌株。
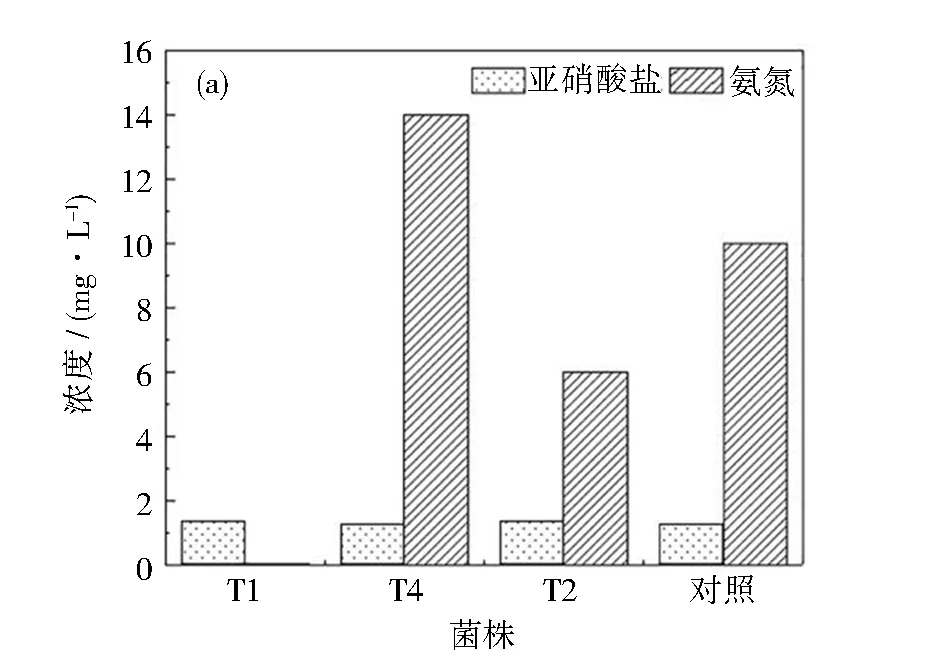
圖1 耐紫外光的優勢菌對腐殖酸的降解效果:(a)硝酸鹽、氨氮濃度變化;(b)TOC濃度變化Fig.1 Degradation effect of dominant bacteria resistant to ultraviolet light on humic acid: (a) changes of nitrate and ammonia nitrogen concentrations; (b) changes of TOC concentrations
2.2 優勢菌的初步鑒定
2.2.1 形態特征
通過四區平板劃線法將純化后的單菌落接種于LB固體培養基中,待長出單菌落后,通過肉眼觀察的方式記錄菌落形態特征,結果如圖2(a)所示。培養12 h后的菌落呈圓形,不光滑,中間凸起,邊緣有菌環且顏色較淺,有芽孢。新形成的菌落呈乳白色,老齡菌落顏色較深,呈淡黃色。菌株革蘭氏染色結果如圖2(b)所示,T4為革蘭氏陽性細菌。通過掃描電鏡觀察菌株T4的細胞并測量菌體大小,結果如圖2(c)所示,菌株T4的大小為(2.58~7.60) μm×(1.06~1.37) μm。

(a)
2.2.2 菌株的16S rRNA鑒定
對菌株T4進行16S rRNA基因測序,將獲得的T4菌株16S rRNA基因序列提交至NCBI的Genbank中獲得序列號為MN587976。將序列結果與NCBI中BLAST進行比對,發現與模式菌株BacillusaryabhattaiB8W22(EF114313)相似度為98.65%,與芽孢桿菌屬的其他相關菌株具有93.54%(B.paramycoidesMCCC 1A04098)~98.45%(B.megateriumATCC 14581)的相似度。將菌株T4與芽孢桿菌屬其他菌種構建系統發育樹,結果如圖3所示。T4與其他菌種均未顯示較高的同源性,相似度不到99%,由此推測菌株T4可能為芽孢桿菌屬的新菌種。
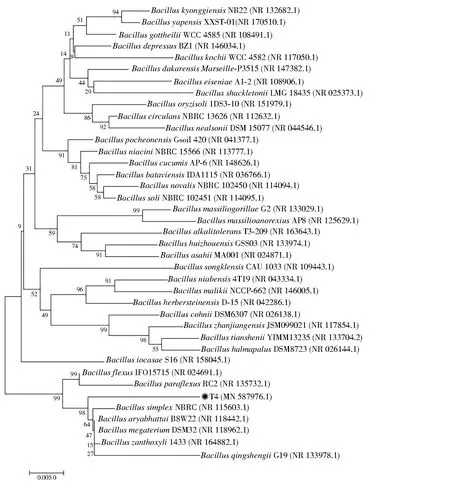
圖3 基于16S rRNA基因序列構建的菌株T4系統發育樹Fig.3 Phylogenetic tree of strain T4 based on 16S rRNA gene sequences
2.3 優勢菌的碳源利用特征
通過BIOLOG細菌自動鑒定系統,對菌株T4的碳源利用情況進行研究,并與其親緣關系較近的阿氏芽孢桿菌BacillusaryabhattaiB8W22T和巨大芽孢桿菌BacillusmegateriumMTCC428T[31-32]進行對比分析,結果如表1所示。

表1 菌株T4與阿氏芽孢桿菌Bacillus aryabhattai B8W22T和巨大芽孢桿菌 Bacillus megaterium MTCC428T [31-32]碳源利用對比分析Table 1 Comparative analysis of carbon utilizing characteristics among strain T4, Bacillus aryabhattai B8W22T and Bacillus megaterium MTCC428T [31-32]
碳源利用試驗陽性結果指的是,菌株T4可以利用該碳源進行生長;而陰性結果則說明菌株不能利用該碳源進行生長。根據BIOLOG試驗結果得知,菌株T4可利用的碳源有D-葡萄糖、麥芽糖、海藻糖、龍膽二糖、蔗糖、D-松二糖、水蘇糖、棉籽糖、β-甲基-D-葡萄糖苷、N-乙酰氨基葡萄糖、D-果糖、水蘇糖、丙氨酸、L-谷氨酸、L-乳酸、果膠、丙酸,不能利用D-山梨糖醇,對半乳糖、蜜二糖、D-甘露醇、D-甘露糖、丙酸鹽、纖維二糖和葡萄糖酸鈉微弱利用。從表中數據可知,菌株T4可以利用葡萄糖、蔗糖、果糖、麥芽糖和海藻糖,說明T4對大分子有機物降解能力較強,這也是T4對腐殖酸降解能力較強的原因之一。菌株T4與BacillusaryabhattaiB8W22T和BacillusmegateriumMTCC428T[31-32]相比存在差異,說明菌株T4與對比菌株親緣關系較遠。
2.4 優勢菌的最適生長條件
2.4.1 最佳溫度
通過固體培養基培養的方式,確定菌株T4的最佳生長溫度,并與BacillusaryabhattaiB8W22T、BacillusmegateriumMTCC428T[31-32]進行對比分析。通過四區平板劃線的方式,將菌株接種于不同培養溫度下的LB培養基中,24 h后觀察菌株的生長狀態,結果如表2所示。由表可知,菌株T4可以在10~45 ℃條件下生長,最佳生長溫度為35 ℃。BacillusaryabhattaiB8W22T生長在10~37 ℃;BacillusmegateriumMTCC428T可以在20~37 ℃條件下生長,最佳生長溫度為37 ℃;BacillusthuringiensisATCC 10792可以在10~45 ℃條件下生長,最佳生長溫度為30 ℃[31-32]。由此可見,菌株T4與其他菌種相比,具有一定的耐熱性,可以適應相對較高的溫度。
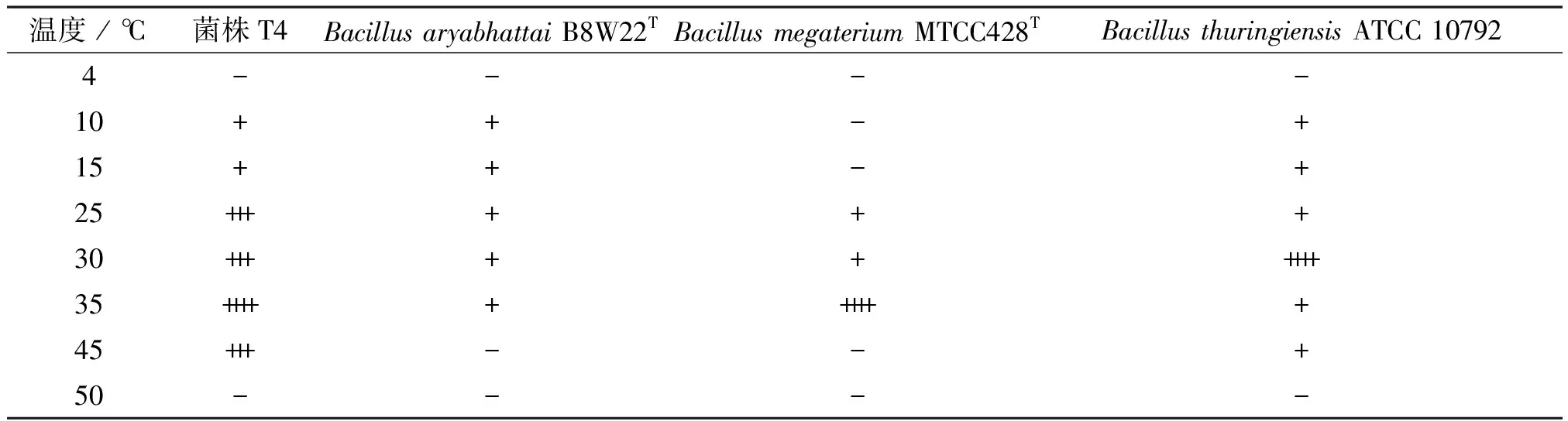
表2 菌株T4、阿氏芽孢桿菌Bacillus aryabhattai B8W22T、巨大芽孢桿菌Bacillus megaterium MTCC428T 和Bacillus thuringiensis ATCC 10792的生長溫度范圍[31-32]Table 2 Growth temperatures of strain T4, Bacillus aryabhattai B8W22T, Bacillus megaterium MTCC428T and Bacillus thuringiensis ATCC 10792 [31-32]
2.4.2 最佳生長pH
將菌株T4分別接種至不同pH的LB培養基中,于30 ℃、UV254紫外光照射條件下培養24 h。利用紫外分光光度計測得菌株T4的OD600值,結果如圖4(a)所示。發現菌株可以在pH為5~9范圍內生長,當pH為5時,OD值為1.39,當pH為7時,達到最大OD值1.72,因此,菌株的最佳生長pH為7。隨著pH的繼續升高,吸光度值呈現下降的趨勢,說明堿性環境不利于菌株T4的生長。而菌株BacillusaryabhattaiB8W22T和BacillusmegateriumMTCC428T可以在pH為6~10范圍內生長[31],以上結果說明與其他菌株相比,菌株T4更耐酸性環境。
2.4.3 最佳生長滲透壓
將菌株T4分別接種于不同含量NaCl的LB液體培養基,培養24 h后測定菌液的OD600值,結果如圖4(b)所示。當培養基中不添加NaCl時,OD值為1.39,當NaCl含量為0.5%時,OD值達到最大值1.71。當NaCl超過4%后,菌株T4在24 h內未見明顯生長,因此繼續培養48 h,測定OD600值。結果表明,菌株T4的生長范圍為0%~10% NaCl,當 NaCl濃度超過4%,生長趨緩,說明高濃度NaCl抑制菌株T4的活性,最高滲透壓為10%時,仍可生長,說明菌株T4具有一定的耐鹽性。


圖4 pH (a)和滲透壓(b)對菌株T4生長的影響
2.5 紫外光對菌株T4生長的影響
生長曲線反映了細菌在不同培養條件下所表現出的生長規律和繁殖特點[33]。紫外光對菌株T4生長變化的影響如圖5所示。由圖可知,菌株T4在30 ℃、160 rmin-1培養條件下經歷遲緩期、對數期、穩定期和衰亡期4個時期,符合細菌的生長規律。由圖中菌株生長曲線可知,受紫外光照射,0~4 h為細菌T4的遲緩期,4~24 h為對數生長期,24~29 h為平穩期,29 h后進入衰亡期。在非紫外光照射條件下,0~11 h為菌株T4的遲緩期,11~24 h進入對數生長期,24~29 h為平穩期,29 h后進入衰亡期。由此可見,紫外光照射縮短了菌株T4的遲緩期,快速進入對數生長期。紫外光照射會破壞微生物細胞膜和DNA結構,對細胞生物膜造成損傷[34]。然而在本文中,T4沒有產生損傷,尤其在24 h前生長速度尤為明顯,可能是經紫外光照射后,LB培養基中大分子的多糖、肽鏈等被打開,使培養基中可利用的碳源增多,促進了菌體生長[35]。而在29 h后吸光度值的降低說明溶液中營養物質不為菌株的生長提供持續的碳源,最終進入衰亡期。此外,T4是芽孢桿菌,芽孢是其抵抗不良環境而產生的休眠體,細胞壁結構相對比較致密,這也可能是其對紫外線具有極強抵抗能力的原因之一[36]。
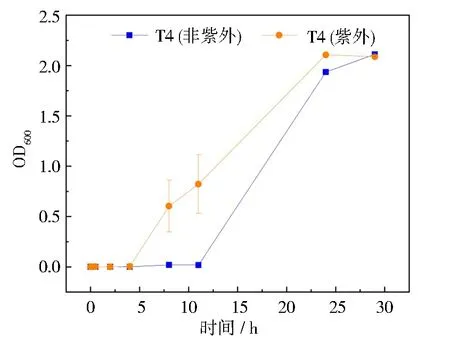
圖5 紫外光對菌株T4生長的影響Fig.5 Effect of ultraviolet light on the growth of strain T4
2.6 優勢菌強化的ICPB工藝驗證
載體是ICPB工藝的重要組成部分之一,常見的載體有纖維素載體、陶瓷載體、聚氨酯海綿和聚氨酯泡沫[10,37]。本試驗以聚氨酯海綿為載體,將菌株T4接種于含有聚氨酯海綿的LB液體培養基中,過夜培養(聚氨酯海綿填充量為30%),反復培養3次,使聚氨酯海綿被菌液充滿,在UV365+TiO2條件下構建ICPB工藝,進行光催化耦合降解驗證試驗,結果如表3所示。經優勢菌強化的ICPB工藝在處理24 h后氨氮值有所升高,這與之前菌株篩選結果一致(圖1),證實存在微生物的脫氨基作用。經優勢菌強化的ICPB對COD去除率為30.23%,低于UV254+TiO2的腐殖酸去除效果,原因可能是UV365+TiO2的光氧化作用相較于UV254的光解作用弱,無法更有效地將腐殖酸的環狀結構分解,限制了微生物的降解作用。

表3 優勢菌ICPB工藝的生物降解驗證試驗結果Table 3 Verifying experiment results of biodegrading efficiency by bio-enhanced ICPB with predominant bacteria
3 結 論
從農田表層土壤中分離出耐紫外光、可降解腐殖酸的優勢菌株T4,對獲得的優勢菌進行16S rRNA基因鑒定和生理生化特征分析,并確定了紫外光對優勢菌生長的影響。將優勢菌用于ICPB工藝,驗證了其在光催化體系下對難降解有機物的處理效果,具體結論如下:
(1) 菌株T4可以與紫外光(UV254)以及光催化(UV365+TiO2)耦合,分解難生物降解有機物。
(2) 優勢菌T4為桿菌,大小為(2.58~7.60) μm×(1.06~1.37) μm,革蘭氏陽性,無鞭毛,16S rRNA基因與芽孢桿菌屬的菌種相似度最高,為98.65%,且與其他菌種的進化親緣關系較遠,推測優勢菌T4為芽孢桿菌屬的新菌種。
(3) 菌株T4的生長范圍為10~45 ℃,最適溫度為35 ℃;pH范圍為5~9,最適pH為7;滲透壓范圍為0%~10%,最適滲透壓是0.5%;菌株T4具有耐高溫、耐酸性環境和高滲透壓的特點。
(4) 菌株T4可以利用的碳源有D-葡萄糖、麥芽糖、海藻糖、龍膽二糖、蔗糖、D-松二糖、水蘇糖、棉籽糖、β-甲基-D-葡萄糖苷、N-乙酰氨基葡萄糖、D-果糖、水蘇糖、丙氨酸、L-谷氨酸、L-乳酸、果膠和丙酸。對二糖和多糖的利用能力較強,說明優勢菌T4可以分泌降解多糖的胞外酶,有利于處理難降解有機物。
(5) 紫外光促進了優勢菌在LB培養基中的生長,縮短了適應期的時間,主要原因可能是紫外光分解培養基中的有機物,使其更易被菌株T4利用,且菌株T4具有芽孢,耐受性更強。

