自由基級聯反應調控策略在重大疾病防治中的應用
畢鄭妍, 劉艷嵐,2
(1.湖南大學 化學化工學院, 長沙 410082; 2.湖南大學 分子科學與生物醫學實驗室化學/生物傳感與化學計量學國家重點實驗室 湖南省適配體工程中心, 長沙410082)
0 引 言
1956年,Harman提出衰老的自由基學說,認為衰老過程中的退行性變化是由細胞正常代謝過程中產生的有害自由基導致的。自由基主要是機體內氧化還原反應過程的中間產物,也可由外界紫外線照射和電離輻射等因素誘發產生。其反應活性高,可使細胞中的多種物質發生氧化,損害生物膜,還能夠使蛋白質和核酸等大分子交聯或變性,甚至引起DNA損傷導致突變,從而誘發癌癥的發生和發展。
在正常生理情況下,體內自由基不斷產生,同時也受人體內抗氧化防御系統(如氧化物歧化酶和維生素等)的嚴格調控,從而維持自由基代謝平衡,保持人體各種機能的正常運行。然而,內防御機制失衡或者外界的一些有害刺激常引起自由基平衡失調,導致自由基的過度積累,對各種生物分子(如DNA、脂質和蛋白質)造成損害,以及招募許多炎癥介質,進而引發衰老、自身免疫性疾病、心血管和神經退行性疾病等許多氧化應激相關疾病。此外,自由基的過度增加與癌癥的發生和惡化也密切相關。因此,從自由基穩態調節方向入手治療相關疾病是一種行之有效的策略。
本文首先概述了自由基在體內的產生和代謝,隨后對自由基的兩種調控機理及本課題組在相關疾病治療方面的工作進行介紹,最后展望了該領域發展的方向和可能面臨的挑戰。
1 自由基簡介
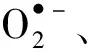
1.1 自由基的產生和代謝
1.1.1 反應活性氧(Reactive oxygen species, ROS)


1.1.2 反應活性氮(Reactive nitrogen species, RNS)


1.2 自由基級聯信號調控與疾病治療
自由基是把雙刃劍,體內自由基穩態失調會導致細胞損傷和機體病變,因此,利用抗氧化劑清除自由基維持氧化還原穩態至關重要;此外,有效利用自由基也可以殺害癌細胞進行癌癥治療。盡管癌細胞微環境自由基水平較高,獨特的自防御機制也導致其具有較高的耐受能力,但當產生的自由基水平超過細胞承受能力時,仍然可以有效殺死癌細胞,基于此原理的化學動力療法在癌癥治療領域備受矚目。
1.2.1 自由基與氧化應激
ROS和RNS都是體內重要的自由基,在生物體內作為代謝產物和信號分子,在正常的細胞代謝和受到環境刺激時產生[13-14]。這些物質通常含有孤對電子,容易與其他分子發生氧化還原反應[15],參與調節人體內各種生理過程[16-17],也有助于對抗病原體及其誘導的感染[18]。通常,由于過量ROS/RNS具有顯著的細胞毒性,這種氧化過程受到細胞抗氧化防御機制的嚴格控制。當ROS、RNS和抗氧化防御之間的平衡被破壞時,就會產生氧化應激,導致氧化還原穩態失調,可通過急性ROS/RNS生產過剩或慢性ROS/RNS積累表現出來。由于ROS和RNS受到不同信號的調控,其過量產生將導致細胞內信號的級聯改變,引起多種細胞功能障礙,如能量代謝功能失調、細胞信號和細胞周期控制的改變、細胞運輸機制受損、免疫激活或抑制以及炎癥[19],甚至誘發細胞死亡等對機體造成損害的連鎖反應,因此,與許多疾病的發生和發展密切相關[10]。
目前,氧化應激相關疾病治療和自由基調控主要分為兩個方面:一方面,過量的自由基引起氧化損傷,導致神經退行性疾病和多種代謝性疾病等,因而利用抗氧化劑增加自由基清除能力,可以消除自由基信號異常并抑制疾病發展,這被稱為抗氧化治療;另一方面,自由基的產生與癌癥的發生和發展密切相關,癌細胞微環境相比正常細胞通常具有更高的自由基水平,這種不同的氧化還原調節機制引導了一個新的治療方向,即產生更多的自由基使其超過癌細胞耐受水平而殺死癌細胞,稱為促氧化治療。
1.2.2 抗氧化治療

近年來,抗氧化納米材料由于具有諸多優勢引起了廣泛關注[2],包括:(1)可以顯著提高天然抗氧化劑的抗氧化穩定性及其藥物動力學,保護這些試劑免受環境氧化/還原和酸的侵蝕;(2)許多納米材料本身具有酶活性,相比于天然酶和小分子來說具有更高的催化效率和更強的環境耐受性;(3)對多種自由基,特別是次級ROS/RNS,具有強大的清除能力,可提供更廣泛有效的抗氧化防御;(4)可以通過功能集成,合成多功能、診療一體化抗氧化納米藥物,有望實現個性化治療。大量研究證明,納米材料在體內和體外都具有強大的抗氧化和抗炎活性,但抗氧化納米材料的臨床開發仍處于早期階段。在未來的臨床應用研究中,仍需從給藥途徑、體內生物相容性、藥代動力學、生物分布與代謝以及最終病理后遺癥的表達等方面深入評估現有和新興的大量抗氧化納米材料。
1.2.3 促氧化治療
癌癥的一大重要特征是,癌細胞含有更多的ROS和RNS等自由基,并且對自由基水平升高更為敏感,這引起了人們的廣泛關注[21]。傳統化療藥物如阿霉素(DOX)和As2O3,其促氧化治療機制是在癌細胞中特異地產生ROS殺死癌細胞。然而,目前大多數化療藥物和放療都具有不可避免的副作用。精確和特異性調節癌細胞中ROS及其他自由基水平順理成章地成為提高治療效果同時減少副作用的關鍵。因此,腫瘤微環境(Tumor microenvironment, TME)這一與靶向策略密切相關的重要因素得到了深入研究。TME的主要特征是弱酸性、缺氧、血管異常、過氧化氫和谷胱甘肽生產過剩、消耗大量營養物質等[22-23]。基于此,復旦大學步文博課題組提出了一種將TME和Fenton反應相結合的新的治療方法——化學動力治療(Chemodynamic therapy, CDT)[24],通過Fenton反應可以生成?OH特異性靶向癌細胞,反應機理如式(1)和式(2)所示。實現高效的Fenton反應需要兩個關鍵條件,即大量的H2O2和最適的pH(2~4)。
Fe2++ H2O2→Fe3++?OH + OH-
(1)
Fe3++ H2O2→Fe2++ HO2+ H+
(2)
與其他癌癥治療策略如化療、放療、光熱治療(PTT)、光動力療法(PDT)和聲動力療法(SDT)相比,CDT的優勢包括:特異性更高、不受外場穿透深度的限制、對正常組織副作用較低、生成更高水平的ROS以及無設備限制、非多藥耐藥,在臨床上顯示出良好的發展前景[25]。然而,TME的pH(6.5~6.8)和H2O2濃度等難以滿足Fenton反應的需要。為了克服這一障礙,目前的研究主要集中在設計不同的納米材料[26-28]、原位降低反應的pH[29-30]、原位生成H2O2[31]或消耗GSH[32],以及引入物理場和化學場等方面,以期顯著提高Fenon反應效率,進而增強CDT療法的功效。
針對抗氧化和促氧化方法調控自由基級聯信號的機理和現狀,本課題組研究開發了新的材料和方法以促進相關疾病治療的發展,包括將抗氧化黑色素納米材料用于缺血性腦損傷和人工DNA編碼器用于特定治療肥胖疾病;以及利用非晶態氧化鐵RNA干擾納米平臺和適體-前藥偶聯物解決了化學動力療法面臨的部分問題并成功應用于促氧化癌癥治療。
2 自由基清除與抗氧化治療
2.1 抗氧化黑色素納米顆粒的抗氧化機制及其在缺血性腦中風方面的防御研究
缺血性腦損傷的機制眾說紛紜,近年來廣受關注的自由基學說認為自由基通過攻擊細胞膜上的多聚不飽和脂肪酸(PUFA)引發一系列反應,造成細胞損害和死亡。在正常生理狀態下,人體內存在自由基代謝酶等內源性抗氧化劑,使自由基處于穩態,不易引起損傷。但是腦部缺血后增多的自由基會大量消耗抗氧化劑,導致抗氧化防御系統不能及時清除自由基,引起氧化應激損傷。因此,清除腦部由于栓塞過程導致的過量自由基被認為是保護腦損傷的一個重要手段。
人體內的天然抗氧化劑具有一定的局限性,如無法及時響應突然升高的自由基水平、不存在特定靶向次級ROS/RNS的內源性酶等,一系列抗氧化納米材料由于其抗氧化穩定性以及對次級ROS/RNS(如?OH和ONOO-)強大的清除能力等諸多優勢引起了研究人員廣泛的興趣,但其對人體健康具有潛在的不良影響,如對免疫細胞的激活和存在基因毒性;大多數抗氧化納米材料具有較差的生物相容性,這對其應用于治療腦部損傷造成了阻礙,目前并沒有抗氧化劑通過臨床驗證能夠安全有效地保護缺血腦免受氧化損傷。

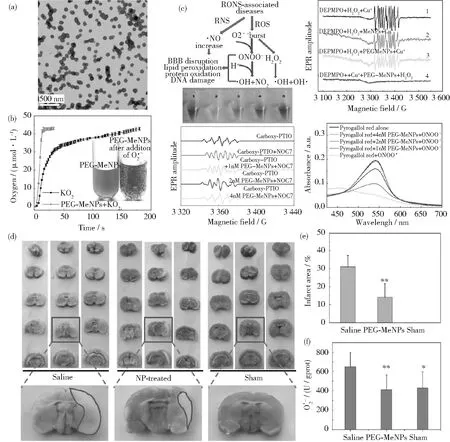
圖1 (a)PEG-MeNPs的TEM圖像;(b) 有/無PEG-MeNPs時100 μmol·L-1 KO2溶液中O2生成量,插圖是加入KO2 前后的PEG-MeNPs溶液;(c) RONS代謝示意圖及PEG-MeNPs清除?OH, ?NO, ONOO-的作用;(d)不同組 (Saline:生理鹽水組,NP-treated:PEG-MeNPs處理組,Sham:假手術組)對應2,3,5-氯化三苯基四氮唑(TTC)染 色腦切片的代表圖;(e、f)三組相應的梗死面積和腦組織中水平(與生理鹽水對照組相比,*p < 0.05, **p < 0.01)。引自參考文獻[35]Fig.1 (a) TEM image of PEG-MeNPs; (b) O2 production from the KO2 solution (100 μmol·L-1) with vs. without PEG-MeNPs, the inset is the digital picture of the PEG-MeNPs solution before vs. after addition of KO2; (c) Schematic illustration of RONS metabolism and ?OH, ?NO, ONOO- scavenging effect of PEG-MeNPs; (d) Representative images of TTC-stained brain slices from different groups. The corresponding (e) infarct areas and (f) levels in brain tissues of the three groups (*p < 0.05 and **p < 0.01 vs. saline control). Reprinted with permission from reference [35]
2.2 人工DNA編碼器的構建用于調控自由基級聯反應和肥胖治療
肥胖是一種多因素的慢性代謝性疾病,可增加糖尿病、高血壓、非酒精性脂肪肝、癌癥以及心血管和神經系統疾病等多種疾病的患病風險,被認為是世界范圍內最嚴重的公共健康問題之一。肥胖病理學的最新進展表明,由代謝組織中各種活性氧和活性氮(RONS)的產生和積累引起的氧化應激是肥胖發病和進展的共同特征和核心機制之一。這種不平衡的氧化還原穩態協調級聯適應性免疫反應,包括活化常駐白細胞和招募炎癥細胞,釋放炎性因子和更多的自由基,從而導致氧化損傷和炎性反應加劇的惡性循環,進一步促進脂肪形成并誘發許多并發癥[36]。顯而易見,選擇性調節氧化應激有望成為治療肥胖相關疾病的一個通用方法。
在正常生理狀態下,人體內存在的抗氧化網絡能夠嚴格控制自由基級聯反應(FRC),通過復制-轉錄-翻譯(對應信息的發射、傳播和接收)等分子通訊過程表達抗氧化劑,維持細胞氧化還原平衡,保護細胞免受氧化損傷[37-38]。然而,這種由基因組介導的分子通訊受到耗時、信息傳遞不充分、無法解碼一些高活性自由基(?OH)等限制,不能有效和及時地解碼肥胖疾病發生時復雜的FRC,因此,開發新的實時自由基解碼器至關重要。然而到目前為止,臨床上還沒有抗氧化劑被用于治療與肥胖相關的疾病。
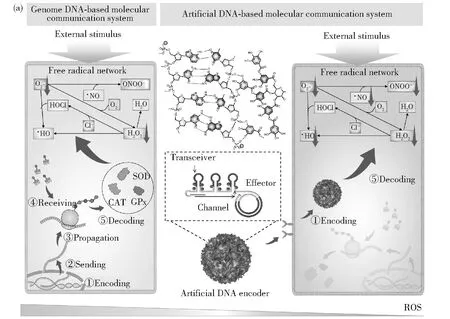
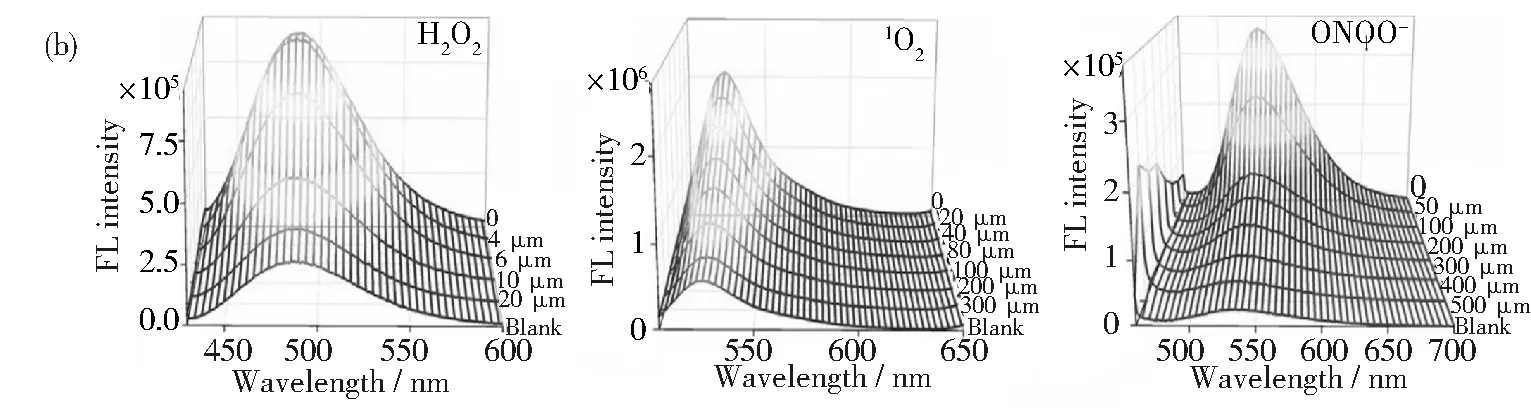
針對基因組介導的分子通訊過程面臨的問題,本課題組提出了一種基于DNA框架結構的人工DNA編碼器,用于調控脂肪化過程中自由基級聯反應,如圖2(a)所示。考慮到對肥胖疾病特定和靶向治療的有效性和必要性,選擇一個能特異性識別脂肪細胞的適配體序列作為接收器,單寧酸(TA)作為效應器。TA是一種天然的小分子,具有廣泛的生物學功能,包括抗氧化和抗炎癥。利用滾動循環復制(RCR)和密集包裝驅動的DNA組裝方法,合成了能夠解碼多種復雜自由基級聯信號的人工DNA編碼器TADN[39]。在RCR過程中,通過適配體介導的分子識別,收發器模塊使編碼器能夠主動感知環境壓力下FRC失調的目標細胞。一旦被識別,內部即時可用的效應器直接作用于失調的FRC以清除過量的自由基,而不需要耗時的復制-轉錄-翻譯過程來產生抗氧化酶。另外,相比基因組DNA編碼產生的酶,該人工DNA編碼器對各種自由基具有更廣泛的清除活性如圖2(b)所示,而且基于DNA框架的通道可以有效防止惡劣環境對效應器活性的負面影響,從而保障通信的穩定。此外,驗證了人工DNA編碼器在體內的主動傳感和驅動作用。結果表明,該編碼器可以通過重組由脂肪生成驅動的失調FRC和代謝,同時阻礙自由基與炎癥網絡之間的有害通訊,協同抗肥胖治療,如圖2(c)~圖2(e)所示。
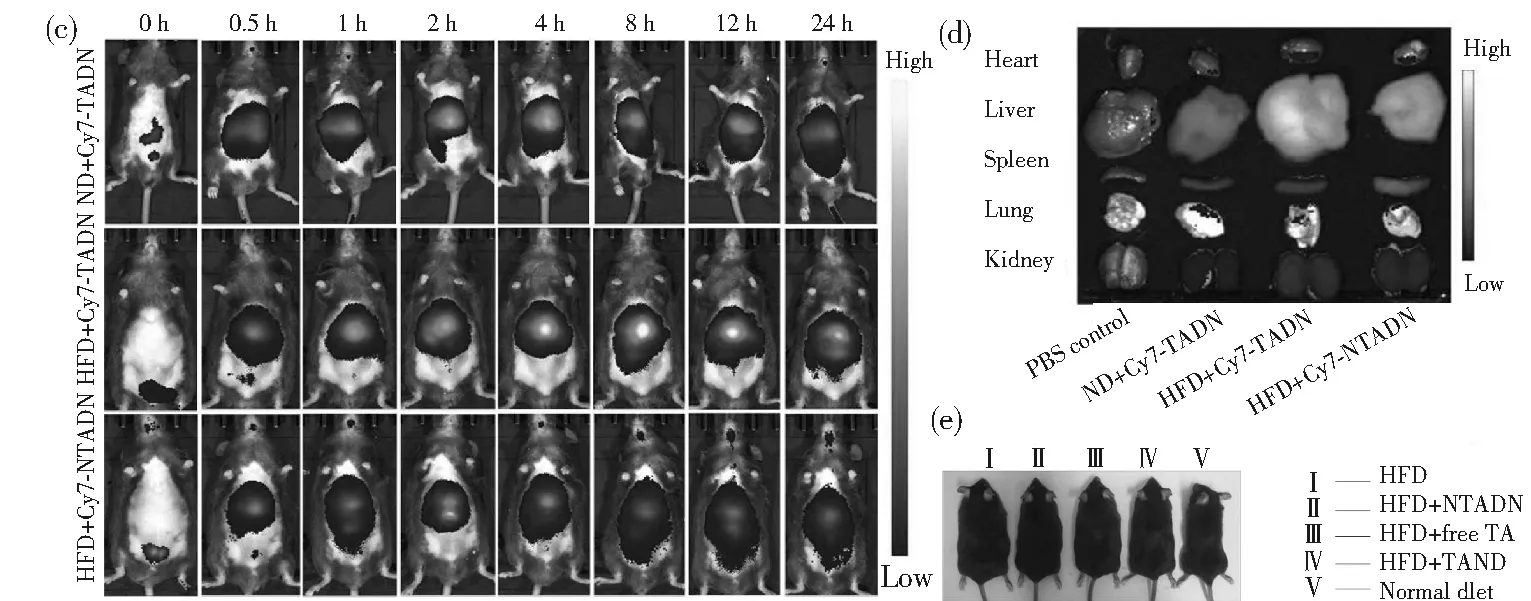
圖2 (a) 基于DNA框架的人工DNA編碼器的結構示意圖、基于自然基因組DNA系統和人工DNA編碼器介導自由 基級聯(FRC)的潛在分子通訊機制;(b)TADN對H2O2、1O2和ONOO-清除作用的熒光分析;(c) 靜脈注射 TADN或非靶向NTADN人工DNA編碼器后,正常飲食(ND)或HFD(高脂飲食)小鼠的時間依賴性全身熒光 成像和(d)不同器官的熒光成像;(e)靜脈注射PBS、TADN、非靶向NTADN或游離TA的典型ND/HFD小鼠的 圖片。引自參考文獻[39]Fig.2 (a) Schematic illustration of the structure of the DNA framework-based artificial DNA encoder and the underlying molecular communication mechanisms mediated by natural genome DNA-based system and the artificial DNA encoder towards the free radical cascade (FRC); (b) Fluorescence analysis of the scavenging efficacy of TADN towards H2O2, 1O2, and ONOO-; (c) Time-dependent whole-body fluorescence imaging of normal diet (ND) or HFD-fed mice after intravenous injection of TADN or NTADN artificial DNA encoder; (d) Fluorescence imaging of different organs harvested from these three groups in panel (b); (e) Digital picture of representative ND/HFD-fed mice that received iv injection of PBS, TADN, NTADN, or free TA. Reprinted with permission from reference [39]
3 放大自由基級聯信號用于癌癥治療
與上述自由基調控機理相反,基于Fenton反應機理的化學動力療法,通過產生高毒性自由基來殺死惡性細胞,這種促氧化療法在癌癥治療上也備受關注。越來越多的證據表明,與正常細胞相比,許多類型的癌細胞都表現出ROS水平的升高[21]。由于細胞內自由基的產生增加或對自由基的清除能力下降,會導致氧化還原穩態被破壞,這種內在的氧化應激常常被視為惡性事件,癌細胞的異常生長也與活性氧及其他自由基的增加有關。然而,由于過度水平的自由基應激對細胞有毒,外源性藥物誘導產生自由基時,氧化應激增加的癌細胞可能更容易受到傷害。因此,通過氧化還原調節自由基水平可能是一種選擇性殺死癌細胞而不會對正常細胞造成顯著毒性的方法。
3.1 RNA干擾策略用于放大自由基反應及癌癥靶向治療
在特異性調節癌細胞自由基穩態上,CDT展現了良好的前景。目前,CDT方法主要依賴于內源性過氧化氫(H2O2)通過經典的Fenton或Haber-Weiss化學轉化為高毒性羥基自由基[7]。然而,由于有效的化學反應需要強酸性,以及腫瘤H2O2不足和上調抗氧化防御以對抗自由基引起的氧化損傷,CDT的抗癌效果受到極大的限制。因此,研究人員開發了很多策略,對pH和H2O2等腫瘤微環境進行調節以滿足CDT反應的需要。
腫瘤微環境的重要特征之一是缺氧,在缺氧狀態下,癌細胞的代謝途徑可能會重塑,通過平衡生物合成過程和快速生產大量的ATP以支持細胞增殖,因而在原發性和轉移性腫瘤中會觀察到有氧糖酵解或“瓦伯格效應”[40]。糖酵解的高速率引起乳酸的過量生成,這導致單羧酸轉運體(MCTs)的上調[41],與該過程相關的主要是MCT4,其控制乳酸/H+的流出,維持穩定的細胞內pH并誘導細胞外環境的微酸化(pH 6.5~6.8)。MCT4表達升高與許多癌癥的轉移、血管生成、預后不良和復發有關[42]。因此,假設沉默MCT4基因可以阻止癌細胞內乳酸的外排,使細胞內pH降低,從而增強Fenton反應效率。
結合RNAi策略,開發了一個非晶態氧化鐵納米顆粒(AIO NPs)平臺(圖3(a)和圖3(b))有效遞送靶向MCT4的小干擾RNA(siRNA),用于沉默MCT4的表達[29]。AIO NPs對siRNA的有效封裝避免其與酶接觸而被降解,同時利用AIO NPs酸性響應特點釋放鐵離子,與癌細胞內的H2O2通過類Fenton反應產生高反應性和毒性的?OH,促進內涵體逃逸并顯著加劇腫瘤細胞的氧化應激,進而導致細胞凋亡。更重要的是,MCT4基因沉默后可以誘導癌細胞內的H2O2含量上升,結合細胞內由于MCT4沉默導致的乳酸積累,Fenton反應的效率大幅度提高,從而高效地殺傷癌細胞。
在荷瘤小鼠模型中,通過將NPs靜脈注射到PC3荷瘤小鼠中,檢測了AIO RNAi NPs的體內基因沉默效果。圖3(c)~圖3(e)表明,與NP(siControl)處理組相比,NP(siMCT4)處理小鼠的MCT4表達得到顯著抑制。此外,類Fenton反應引起氧化損傷對腫瘤抑制起到了協同作用,從而顯著抑制了腫瘤的生長。同時,氧化鐵NPs還具有MRI造影的功能,從而實現了對AIO RNAi NPs腫瘤積聚的無創可視化如圖3(f)所示。總體來說,該AIO RNAi NPs具有體積小、基因沉默高效、腫瘤積累高、腫瘤組織穿透深、生物相容性好以及MRI介導的腫瘤積累跟蹤等特點,有望為各種惡性腫瘤的治療提供有價值的工具。
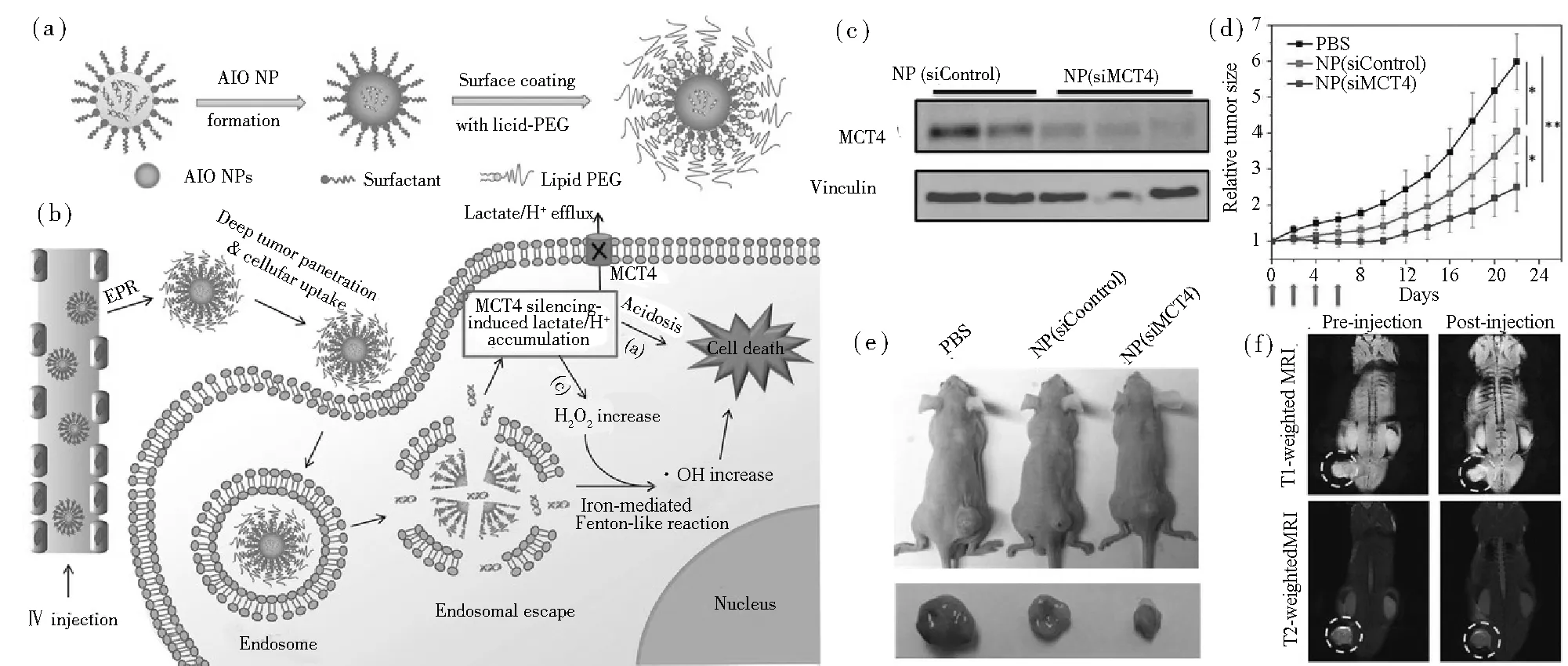
圖3 (a)AIO RNAi NPs的形成和(b)多重功能的示意圖;(c) Western blot分析NP(siControl)與NP(siMCT4)對PC3荷瘤小鼠MCT4表達的影響;(d) PBS、NP(siControl)或NP(siMCT4)治療后PC3異種移植小鼠腫瘤生長(*p<0.05和**p<0.01 vs. PBS對照);(e) 三組荷瘤小鼠和腫瘤組織的代表性圖片;(f) 靜脈注射AIO RNAi NPs后PC3荷瘤小鼠全身T1、T2加權MRI圖像。引自參考文獻[29]
3.2 生物正交適體-前藥結合膠束用于非H2O2和pH依賴性癌癥化學動力治療
如上所述,傳統的Fenton反應由于受到反應速率的限制,通常需要大量的H2O2和較低的pH (2~4)[44],而腫瘤內環境自身達不到如此高的要求。除了在上述工作中通過增加H2O2含量及降低細胞內pH來提高Fenton反應效率外,設計一個H2O2和pH非依賴的化學動力學療法也是提高其抗腫瘤效果的另一個重要途徑。因此,本課題小組設計了一種自由基前藥和核酸適體偶聯物(ApPdC),首次將生物正交反應引入化學動力療法,實現了Fe2+可激活的有毒碳自由基的原位釋放和放大,靶向殺死腫瘤細胞且不依賴腫瘤的酸性或H2O2[32]。
如圖4(a)所示,在ApPdC中利用適配體AS1411特異性識別癌癥中過表達的核仁素,并引入正交化學和前藥設計,首先合成人工前藥堿基——金剛烷穩定的四氧六烷單體(“T”)作為疏水尾部,適配體作為親水端,通過自組裝作用成功制備了一個剛性的、多組分的ApPdC納米膠束。所得到的ApPdC納米膠束在生理條件下是不活躍的,然而它們在癌細胞受體介導的攝取后,引起級聯的生物正交反應。本設計引入與人工前藥堿基選擇性共給藥的血紅素hemin,從而實現Fe2+的自供應并能有效地激活前藥。在癌細胞中,hemin中的配位Fe3+可以被細胞內還原劑(如GSH)還原為Fe2+-配位血紅素,而后前藥堿基T被亞鐵血紅素(Fe2+)/游離Fe2+激活,通過單電子轉移釋放毒性自由基。在活化過程中,過氧化物被裂解后通過生物正交化學觸發氧自由基的產生,不穩定的氧自由基通過C—C β斷裂重排成C中心自由基,誘導癌細胞發生凋亡。圖4(b)證實了ApPdC膠束的活化及C中心自由基的形成。
實驗表明,ApPdC膠束具有良好的特異性識別和位點選擇性激活機制,如圖4(c)所示。此外,由于血紅素的減少導致細胞內谷胱甘肽的消耗,可顯著降低腫瘤細胞的抗氧化能力,從而進一步促進毒性C中心自由基的抗癌作用,如圖4(d)所示。也驗證了ApPdC膠束協同治療癌癥的潛力,顯然,Ap-6G-H-“T”比不含血紅素的Ap-6G-“T”更能有效抑制細胞增殖和生長,而且與單T膠束相比,Ap-6G-2“T”也展現了高效選擇性治療腫瘤的潛力。
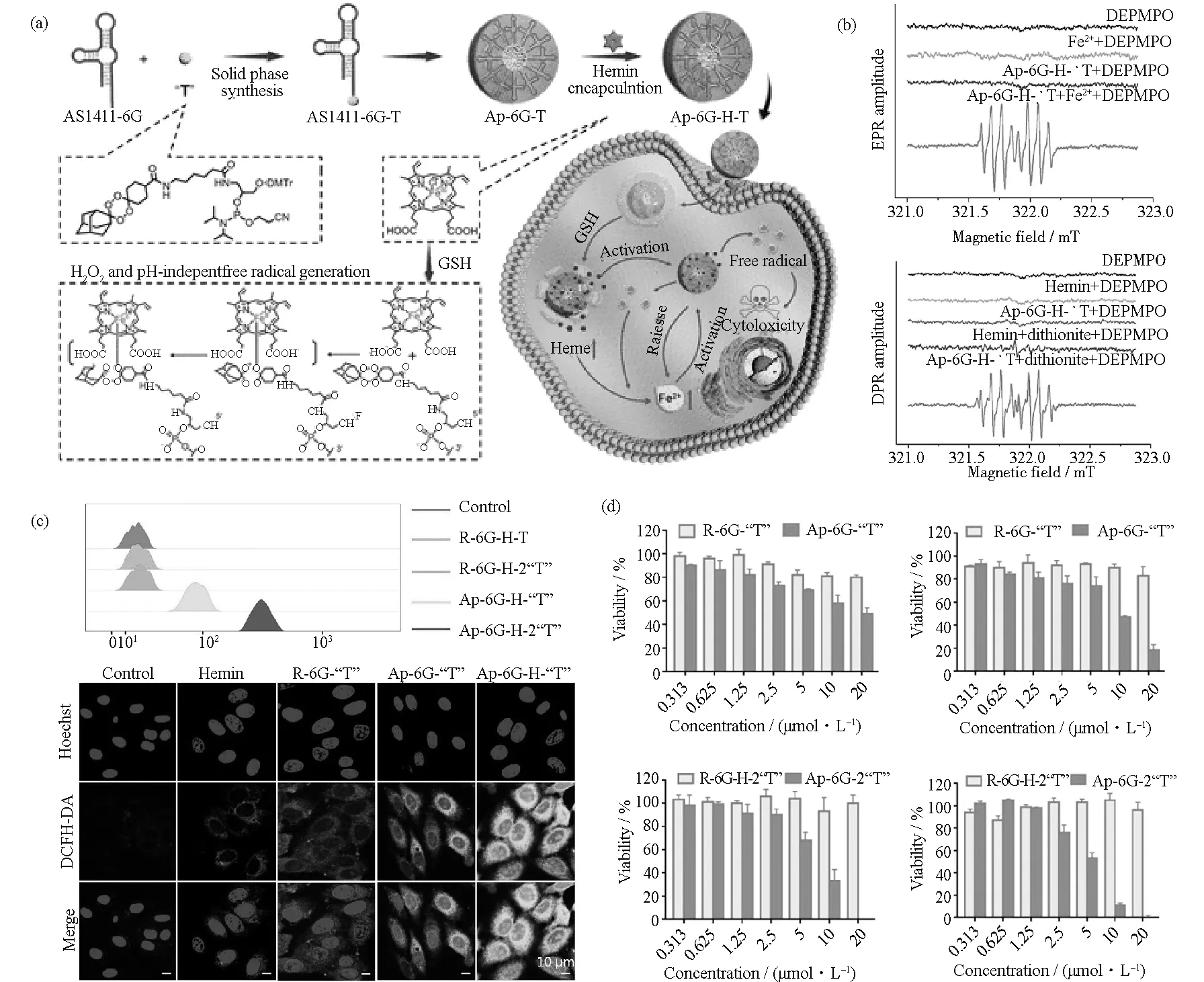
圖4 (a) ApPdC膠束的合成及在癌細胞中自循環和原位擴增產生有毒自由基的示意圖;(b) 以DEPMPO為自旋俘獲劑,測定“T”在二亞硫酸鈉誘導血紅素還原產生Fe2+(上圖)或血紅素(Fe2+)(下圖)活化下自由基的生成;(c) 不同處理下HepG2肝癌細胞中自由基水平的流式細胞術分析(上圖)和共聚焦熒光成像(下圖);(d) Ap-6G-“T”、Ap-6G-H-“T”、Ap-6G-2“T”、Ap-6G-H-2“T”及相應的非靶向樣品處理HepG2細胞的細胞活性。引自參考文獻[32]
設計的ApPdC膠束能夠實現TME雙靶向和自我循環,在癌細胞中原位擴增產生有毒自由基,顯示了很好的治療效果,但仍需要進一步的研究,如體內藥代動力學和ApPdC膠束的抗癌效果,以更好地說明它們在癌癥治療中的潛力。此外,盡管ApPdC膠束旨在靶向獨特的癌細胞代謝以最小化副作用,但未來還需要更多的研究來評估其對正常細胞或組織的長期安全性。另外,由于鐵代謝失調和易受氧化應激影響是癌癥的共同特征,本研究可以為開發新型有效的專門治療多種晚期癌癥的ApPdC奠定基礎。
4 總結與展望
自由基在生物體中擔任重要功能,其過量產生會導致脂質、蛋白質和DNA等生物分子發生變形和失活。自由基的增加也與癌細胞的異常生長有關,可能在癌癥的開始和發展中扮演重要角色。此外,過量自由基導致的氧化應激可能誘發很多其他疾病,如腦中風和神經退行性疾病,因此,維持自由基穩態對保障細胞正常功能至關重要。當氧化應激發生時,由于人體內抗氧化機制無法平衡自由基的產生與消除,往往需要利用一些外源的抗氧化劑進行抗氧化治療。然而,由于過高水平的自由基應激也可能殺害細胞,癌細胞氧化應激增加時可能更容易受到外源性藥物誘導產生的自由基的損傷。因此,促氧化療法也是一種調節自由基水平特異性殺死癌細胞的有利選擇。
在抗氧化納米材料的合理設計上,需要繼續探索和優化合成途徑,使材料具有更強、更穩定的體內抗氧化活性,并且高效、高選擇性地調節氧化還原微環境靶位點,使全身副作用最小化;為達到顯著的臨床效益,還需深入了解不同疾病的氧化還原病理和抗氧化納米材料的詳細抗氧化機制,以及進行廣泛的臨床前研究,為開發設計抗氧化納米材料提供關鍵信息。迫切需要明確自由基在調節特定生物事件的分子機制,以及氧化應激相關疾病的動力學進展。開發新的和更具有臨床相關性的體外或體內動物模型也是自由基研究領域的一大熱點,可對不斷涌現的抗氧化納米技術進行強有力的評價。
對于促氧化療法的發展,一方面,針對自由基的產生,亟待開發新的材料來調節腫瘤微環境以滿足需要,或者利用現有的環境開辟新的自由基產生機制;另一方面,由于涉及氧化還原調控和應激反應的因素很多,癌細胞的氧化還原變化非常復雜,單純使用自由基生成劑并不一定產生足夠的腫瘤殺傷性能。在持續的內源性氧化應激下,許多癌細胞能夠很好地適應這種應激并導致內源性抗氧化劑性能增強。為了有效殺死癌細胞并克服與氧化還原適應相關的耐藥性,了解癌細胞中復雜的氧化還原變化及其潛在機制是很重要的。同時,將促氧化試劑與傳統的化療或放療等治療方式相結合,有望顯著增強癌癥治療效果。
綜上所述,自由基調控是一種新型的、具有廣闊發展前景的疾病防治策略。期待著上述挑戰在可預見的未來得到解決,早日實現抗氧化和促氧化技術在預防和治療人類重大疾病方面的臨床應用。

