尿酸、D-二聚體與同型半胱氨酸預(yù)測血液透析患者PTA后動靜脈內(nèi)瘺再狹窄的價值
吳呂偉 葉永玲 季青 黃公才 張德忠
良好的血管通路是尿毒癥患者進行血液透析的基本保證。經(jīng)皮腔內(nèi)血管成形術(shù)(percutaneous transluminal angioplasty,PTA)是改善動靜脈內(nèi)瘺狹窄的首選方式[1]。然而,許多患者在經(jīng)過PTA治療后,動靜脈內(nèi)瘺狹窄會再次發(fā)生,隨其發(fā)展會使內(nèi)瘺失去功能,最終導(dǎo)致內(nèi)瘺透析失敗。研究發(fā)現(xiàn),尿酸(uric acid,UA)、D-二聚體(D-Dimer,DD)及同型半胱氨酸(homocysteine,HCY)等實驗室檢測指標可能為急性冠狀動脈綜合征患者經(jīng)皮冠狀動脈介入術(shù)后再次狹窄的獨立預(yù)測因素[2]。UA、DD及HCY對維持性血液透析患者PTA后動靜脈內(nèi)瘺再次狹窄的預(yù)測價值鮮見報道。本研究通過監(jiān)測維持性血液透析患者PTA術(shù)前血清UA、DD及HCY水平,觀察其對動靜脈內(nèi)瘺再狹窄發(fā)生的影響,現(xiàn)報告如下。
1 資料與方法
1.1 臨床資料 選擇2019年3月至2021年2月在本院行PTA治療的維持性血液透析動靜脈內(nèi)瘺狹窄的患者105例。其中,男63例,女42例;年齡平均(45.48±11.61)歲;原發(fā)病為糖尿病腎病37例,慢性腎小球腎炎25例,高血壓腎損害21例,梗阻性腎病14例,狼瘡性腎炎7例,缺血性腎病1例。(1)納入標準:以自體動靜脈內(nèi)瘺進行血液透析;成功行首次PTA,且動靜脈內(nèi)瘺狹窄符合PAT指征[3]。(2)排除標準:具有嚴重的肝功能、凝血功能障礙;服用抗血小板藥物;具有腫瘤、免疫系統(tǒng)疾病;患有全身或局部嚴重感染。
1.2 PTA手術(shù) 患者取仰臥位,內(nèi)瘺側(cè)肢體外旋外展,局部麻醉后,以距內(nèi)瘺狹窄處5 cm以上血管為穿刺點,在超聲引導(dǎo)下置入導(dǎo)管鞘,推注低分子肝素,置入球囊導(dǎo)管,推送到狹窄部位;連接壓力泵,增加壓力使球囊逐漸緩慢擴張,維持30 s,減壓至球囊回縮,重復(fù)2~3次,評估手術(shù)效果;擴張效果滿意后,結(jié)束手術(shù),加壓包扎止血15~20 min。PTA成功標準: 動靜脈內(nèi)瘺處的泵控血流量≥250 mL/min;殘余狹窄≤30%;術(shù)后即可進行有效的血液透析治療。所有患者的PTA均由同一組醫(yī)師完成。
1.3 研究方法 (1)資料收集:收集所有患者的臨床資料及實驗室數(shù)據(jù)。(2)分組:根據(jù)PTA后患者是否再次發(fā)生動靜脈內(nèi)瘺狹窄,分為再狹窄組(21例)和通暢組(84例)。(3)實驗室指標檢測:于患者行PTA前1天的早晨,采集外周空腹靜脈血,進行UA、DD、HCY等指標檢測。
1.4 統(tǒng)計學(xué)方法 采用SPSS19.0統(tǒng)計軟件。計量資料以(±s)表示,采用t檢驗;計數(shù)資料以[n(%)]表示,采用χ2檢驗;危險因素采用非條件Logistic 回歸分析;預(yù)測價值分析采用受試者工作特征(ROC)曲線。以P<0.05為差異有統(tǒng)計學(xué)意義。
2 結(jié)果
2.1 兩組的一般資料及實驗室檢查指標比較 結(jié)果顯示,兩組患有糖尿病的比率以及血尿酸、D-二聚體、同型半胱氨酸等指標水平比較,差異均有統(tǒng)計學(xué)意義(P<0.05)。見表1。
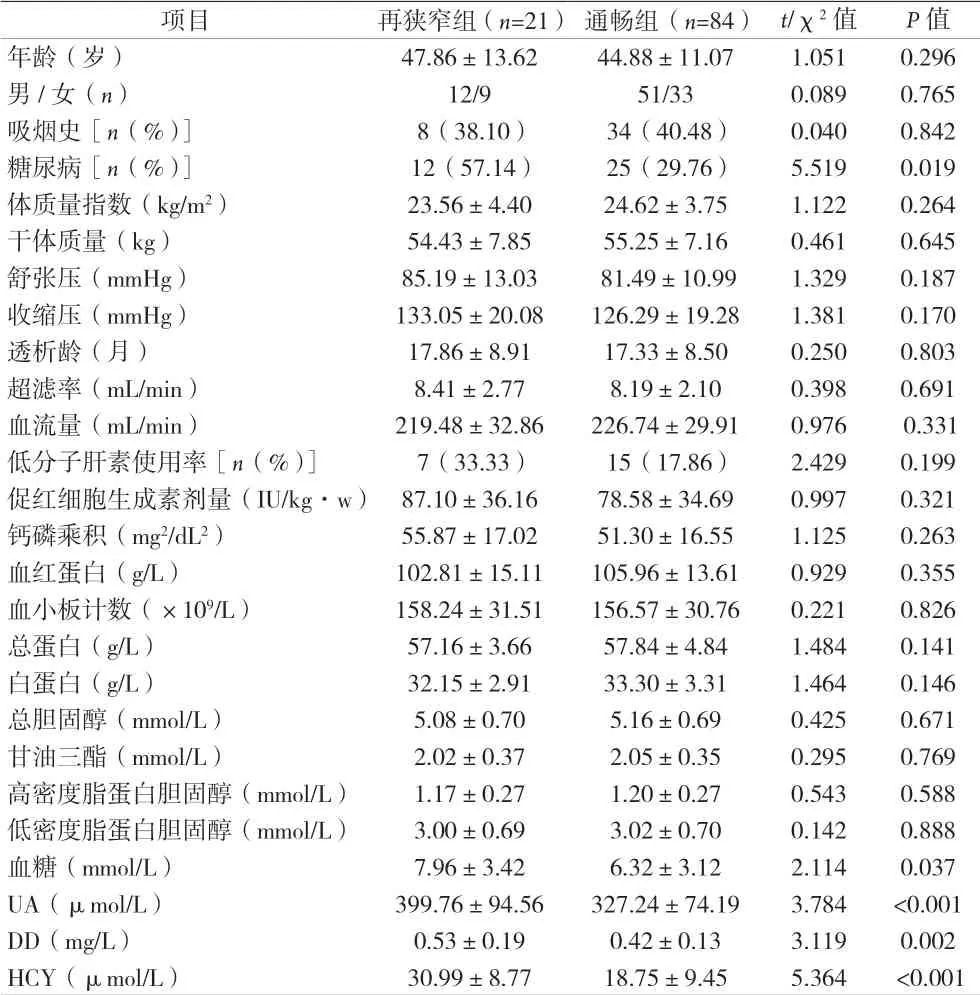
表1 兩組的一般資料及實驗室檢查指標比較
2.2 PTA后動靜脈內(nèi)瘺再次狹窄的多因素Logistic回歸分析 結(jié)果顯示,尿酸、D-二聚體、同型半胱氨酸是PTA后動靜脈內(nèi)瘺再次狹窄的高危因素。見表2。
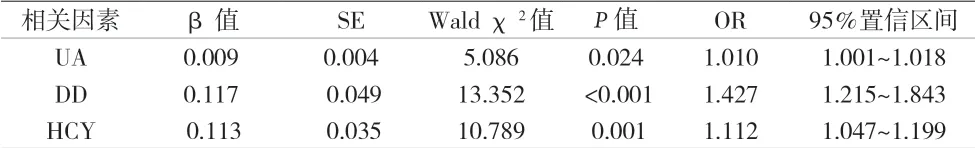
表2 PTA后動靜脈內(nèi)瘺再狹窄的Logistic回歸分析
2.3 DD、UA、HCY及三者聯(lián)合檢測對PTA后動靜脈內(nèi)瘺再次狹窄的預(yù)測價值 DD、UA、HCY及三者聯(lián)合檢測ROC曲線下面積分別為0.735、0.668、0.821和0.879,均具有較高的敏感度和特異度。見表3與圖1。

表3 DD、UA、HCY及三者聯(lián)合檢測預(yù)測PTA后動靜脈內(nèi)瘺再次狹窄的效能評價
3 討論
動靜脈內(nèi)瘺是進行維持性血液透析的主要血管通路,動靜脈內(nèi)瘺狹窄或血栓形成是常見的并發(fā)癥。以PTA保持動靜脈內(nèi)瘺通暢,具有操作時間短、手術(shù)創(chuàng)傷小、成功率高、血管資源節(jié)約、術(shù)后即用等優(yōu)點[5]。PTA后內(nèi)瘺再次狹窄時常發(fā)生,是內(nèi)瘺失功的重要原因之一。動靜脈內(nèi)瘺原狹窄部位血管發(fā)生損傷,促使內(nèi)膜增生和血栓形成,是造成再次狹窄的主要因素[6],而導(dǎo)致血管損傷、內(nèi)膜增生和血栓形成的因素眾多。研究發(fā)現(xiàn),2型糖尿病患者普遍存在胰島素、氯吡格雷抵抗,患者體內(nèi)血小板黏附、聚集作用增強,容易形成內(nèi)瘺血栓[7]。本研究發(fā)現(xiàn),PTA后動靜脈內(nèi)瘺再狹窄組的糖尿病比率以及血DD、UA、HCY等指標水平均明顯高于通暢組(P<0.05)。多因素Logistic回歸分析顯示,尿酸、D-二聚體、同型半胱氨酸等指標是PTA后動靜脈內(nèi)瘺再狹窄的高危因素,說明再狹窄組患者在PTA前體內(nèi)的UA、DD及HCY水平均較高,DD水平升高會促進患者體內(nèi)呈現(xiàn)高凝狀態(tài)和微血栓形成。PTA后動靜脈內(nèi)瘺再狹窄發(fā)生的可能機制有:(1)血小板在UA的刺激下生成增加,黏附、聚集增強,促進血管內(nèi)血栓形成;高UA水平時,尿酸鹽結(jié)晶析出并在血管壁沉積,導(dǎo)致內(nèi)瘺血管內(nèi)壁損傷。(2)HCY通過損傷血管內(nèi)皮而改變內(nèi)皮細胞基因表型,使纖溶酶原激活物的結(jié)合位點發(fā)生變化,導(dǎo)致內(nèi)皮細胞的促凝血活力升高,最終形成內(nèi)瘺血栓,動靜脈內(nèi)瘺狹窄再次發(fā)生。另外,本研究結(jié)果未顯示出糖尿病會影響PTA后動靜脈內(nèi)瘺再狹窄的發(fā)生,可能與納入的研究對象中合并糖尿病的病例數(shù)偏少有關(guān)。
綜上所述,DD、UA和HCY作為預(yù)測PTA后動靜脈內(nèi)瘺再狹窄的實驗室指標,而且三者聯(lián)合檢測的預(yù)測價值更高。

