去甲基化酶ALKBH5在乳腺癌中表達的臨床病理意義
李文仿 龍彬彬 姚方輝 趙宗彬 張華
近年來,乳腺癌的發病率呈上升趨勢,已位居女性惡性腫瘤的首位[1]。闡明乳腺癌發生發展的分子生物學機制對提高其診治水平具有一定意義[2]。N6—甲基腺苷(N6-methyladenosine,m6A)修飾RNA是近期腫瘤進展研究的熱點。m6A修飾是真核生物mRNA常見的甲基化修飾,參與真核生物mRNA的運輸、剪切、翻譯等過程[3-4]。m6A修飾通過甲基化酶、去甲基化酶及甲基化識別酶等調控mRNA甲基化,參與膀胱癌、胃癌等惡性腫瘤進展[5-6]。去甲基化酶AlkB同源蛋白5(AlkB homologue 5,ALKBH5)與甲基化轉移酶14(METTL14)、Wilms瘤相關蛋白(Wilms tumor 1 associated protein,WTAP)形成mRNA甲基化修飾復合體,是mRNA的m6A甲基化修飾主要調控單位,通過調控腫瘤基因表達,在惡性腫瘤進展中發揮作用[7]。本研究主要探討乳腺癌組織中ALKBH5的表達及臨床意義。
1 材料與方法
1.1 臨床資料 收集2017年5月至2018年9月在本院進行乳腺癌手術切除石蠟標本90例,乳腺增生組織石蠟標本20例,以及相應乳腺癌患者的臨床資料、免疫組化指標、病理檢查結果等。
1.2 siRNA轉染 轉染試劑Lipofection2000,購自Invitrogen。ALKBH5 siRNA序列由上海生工合成,序列為siRNA1:5′-GCAGC AAGGCAGTCT TTA AGT-3′,無 效 干擾RNA沒有相應的mRNA作用靶點(siRNA NC),序列為5′-UUCUCCGAACGUG UCACGU-3′。ALKBH5的siRNA按照轉染Lipofection2000說明,轉染乳腺癌細胞MDA-MB231。
1.3 RNA提取 收集細胞并裂解,每6 cm培養板的細胞中加入1 mL Trizol溶液,將細胞轉移到無RNA酶離心管中。抽提:加入1/5體積的三氯甲烷,劇烈震蕩1 min,充分混合后,室溫靜置 3 min;37 ℃,12 000 r/min離心10 min;將上層RNA層轉移至新的無RNA 酶離心管。沉淀:加入等體積異丙醇,混勻,室溫靜置10 min;4 ℃,12 000 r/min離心10 min,可在底部觀察到沉淀的RNA,棄上清保留沉淀。洗滌:輕輕加入1 mL現用現配的75%乙醇,上下顛倒洗滌沉淀及管壁;4 ℃,12 000 r/min離心5 min,棄上清保留沉淀,室溫干燥。溶解:加入適量的DEPC處理水,溶解RNA;測量RNA濃度,用瓊脂糖凝膠電泳檢驗所提RNA。
1.4 RT-PCR Prime 5.0軟件設計并經過Blast檢測,引物序列如下:GAPDH:5′-ACCCAGAAGACTGTGGGGATGG-3′,5′-TCTAGAC GGCAGGTCAGGTC-3′;ALKBH5的 引物 序 列 為:5′-CGGCGAAGG CTACACACT TACG-3′,5′-CCACCAGCTTTTGGATCACCA - 3′。qRT-PCR:取1μg的RNA模板,設置RT反應程序為42 ℃、60 min,70 ℃、10 min。Q-PCR反應以Bio-Rad CFX96儀進行擴增,條件如下:預變性采用95 ℃條件下作用30 s,循環1次;循環擴增次數為38次,95 ℃下作用10 s,60 ℃作用20 s,最后70 ℃延伸10 s。
1.5 MTT實驗 10%血清培養細胞,以每孔1000個細胞接種96孔板,每孔體積200 μL,培養3天,每孔加入MTT溶液(5 mg/mL,用PBS配置,PH值為7.4)20 μL,繼續孵育4 h,小心吸棄培養液上清。每孔加入150 μL DMSO,震蕩10 min,使結晶物充分溶解。選擇490 nm波長,在酶聯免疫監測儀上測定各孔吸光值,以時間為橫坐標,吸光值為縱坐標,繪制細胞生長曲線圖。
1.6 免疫組化法 取4μL厚石蠟切片二甲苯脫蠟,加熱枸櫞酸鈉溶液抗原修復液至98 ℃,持續15 min修復抗原,內源性抗原封閉采用山羊血清工作液15 min。兔抗人ALKBH5單克隆抗體(1:100)4 ℃過夜,生物素化二抗37 ℃孵育20 min,加入顯色溶液顯色[8]。蘇木素復染1 min,60 ℃烤片3 h,脫水,透明,中性樹膠封片。染色結果采用半定量方法評估染色結果,“-”代表無染色,“+”代表<25%染色,“++”代表25%~50%細胞染色,“+++”代表>50%細胞染色。“-、+”代表陰性,“++、+++”代表陽性。
1.7 Western Blot法 采用RIPA裂解緩沖液(50 mM Tris-HCl,pH 7.4,150 mM NaCl,1%脫氧膽酸鈉,1%Triton X-100,0.1%SDS;上海碧云天生物技術有限公司)裂解細胞。全蛋白以每孔50μg上樣進行SDS-PAGE電泳。采用PBS稀釋相應一抗至1:1000濃度,于37 ℃搖床上孵育過夜,HRP標記的二抗繼續孵育300 min。通過ECL試劑在用化學圖像發光系統檢測蛋白表達。
1.8 細胞克隆實驗 MDA-MB231細胞常規消化并計數,將細胞以500個/孔接種于6孔板中,輕輕晃動培養板使細胞分散均勻,37 ℃細胞孵箱培養。每4~5天換液1次,培養10天。吸凈培養板中的培養基,用PBS溶液清洗2次,4%多聚甲醛固定30 min,然后用0.1%結晶紫溶液2 mL染色20 min。PBS清洗3次以上,自然風干。以>50個細胞計為1個克隆,克隆形成率=(陽性克隆數/接種細胞數)×100%,計算每組細胞的克隆形成率。
1.9 統計學方法 采用SPSS 17.0統計軟件。計量資料以(±s)表示,采用獨立樣本t檢驗。以P<0.05為差異有統計學意義。
2 結果
2.1 ALKBH5在乳腺癌組織中表達 采用SP免疫組化法檢測ALKBH5在乳腺癌及乳腺增生組織中表達,ALKBH5主要定位于細胞核,胞漿及細胞膜均無ALKBH5表達,見圖1。乳腺癌組織中ALKBH5表達的陽性率為57.8%(52/90),乳腺增生組織中ALKBH5表達的陽性率為25.0%(5/20),差異有統計學意義(χ2=7.042,P=0.008)。

圖1 ALKBH5在乳腺癌/增生組織中的表達(免疫組化×400)
2.2 乳腺癌中ALKBH5表達與臨床病理特征分析 ALKBH5表達與乳腺癌患者的年齡、性別、組織學分級、激素受體及腫瘤分期情況均無關(P>0.05)。ALKBH5高表達與乳腺癌患者的腫瘤大小(P=0.024)、淋巴結轉移(P=0.028)密切相關。見表1。
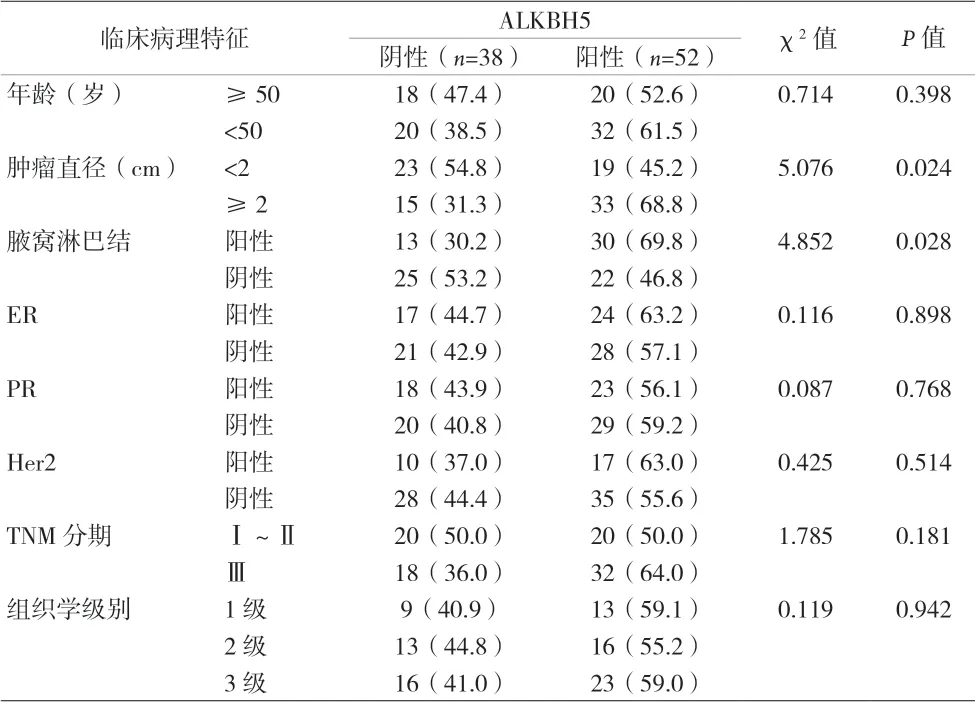
表1 乳腺癌組織中的ALKBH5表達與臨床病理特征分析[n(%)]
2.3 基因敲除ALKBH5抑制乳腺癌MDA-MB231細胞增殖 將 si-ALKBH5分別轉染至MDA-MB231細胞后,Q-PCR及Western Blot提示siRNA-ALKBH5明顯抑制乳腺癌中ALKBH5的mRNA及蛋白表達(P<0.05)。應用MTT觀察細胞增殖情況,顯示ALKBH5-siRNA轉染組MDA-MB231細胞增殖在24 h、48 h及72 h明顯受到抑制而克隆形成實驗提示,ALKBH5-siRNA轉染組MDA-MB231細胞克隆明顯受到抑制。見圖2。

圖2 敲除ALKBH5抑制乳腺癌MDA-MB231細胞增殖
3 討論
m6A是一種信使RNA的甲基化修飾,是一個動態可逆的修飾過程,由特異性的甲基化酶和去甲基化酶共同協調[9]。m6A修飾的核心甲基化轉移酶復合體包括METTL3、METTL14和WTAP,另外一類酶是去甲基化轉移酶,主要功能是清除mRNA上的甲基化修飾,包括FTO、ALKBH5等[6,10]。m6A在惡性腫瘤的生長、侵襲和轉移中所起的調控作用已引起重視。研究發現,m6A修飾參與胃癌、淋巴瘤等多種腫瘤進展[11-12],ALKBH5參與骨肉瘤等多種惡性腫瘤進展[4,13],但ALKBH5在胰腺癌中卻發揮抑癌作用,說明ALKBH5在不同癌組織中作用機制不同[14-15]。本研究發現,乳腺癌中ALKBH5表達增高,與患者淋巴結轉移及腫瘤的大小有關,提示乳腺癌中ALKBH5有重要的生物學意義。
ALKBH5調控腫瘤進展的機制與促進靶基因mRNA去甲基化修飾有關,在胰腺癌中高表達與預后較差有關[15]。ALKBH5通過去甲基化修飾FOXM1的mRNA,可明顯促進FOXM1表達,促進膠質瘤細胞干性[16]。缺氧乳腺癌細胞干性HIF-1表達,可促進ALKBH5表達,進而影響通過mRNA去甲基化,促進多能性基因NANOG的表達,參與乳腺癌干性進展[17]。ALKBH5在卵巢癌中發揮抑制自噬作用,敲除ALKBH5抑制卵巢癌細胞增殖、遷移和侵襲,其機制與ALKBH5激活EGFR-PIK3CA-AKT -mTOR信號通路,并可穩定BCL2的mRNA及促進BCL2與Beclin1結合[18]。ALKBH家族也通過調控tRNA的去甲基化修飾,ALKBH3也可促進惡性腫瘤進展[19]。本研究發現,乳腺癌中ALKBH5表達增高,表明ALKBH5也可能通過調控相關靶基因表達,影響乳腺癌惡性進展。通過進一步敲低乳腺癌細胞MDA-MB231中ALKBH5,發現能抑制乳腺癌細胞的增殖,提示ALKBH5可能是乳腺癌中發揮增殖促進作用,但具體機制需要進一步闡明。
綜上所述,ALKBH5在乳腺癌組織中異常高表達,與患者的淋巴結轉移、腫瘤直徑較大有關。乳腺癌中ALKBH5可能是一個新的重要的治療靶點。

