C反應蛋白/白蛋白比率在接受動脈化療栓塞術結合射頻消融術肝癌患者中的預后評估價值*
譚婉燕,曹卉,余紅露,鄭君,沈瑩
430077 武漢,華中科技大學同濟醫學院附屬梨園醫院 消化內科(譚婉燕、曹卉、余紅露、鄭君),老年病科(沈瑩)
肝細胞癌(hepatocellular carcinoma,HCC)是全球發病率排名第6位、死亡率排名第4位的消化道惡性腫瘤,嚴重威脅人類健康[1]。目前,外科手術仍是HCC最佳的治療方式[2-3]。然而,某些患者在確診時已屬晚期或肝功能較差,失去了外科手術的機會。目前,動脈化療栓塞(transarterial chemoembolization,TACE)聯合射頻消融術(radiofrequency ablation,RFA)被推薦作為不可切除HCC的主要治療方法[4-5],但患者的整體預后仍然不佳[6]。因此,尋找能早期預測患者預后不良的生物標志物,將患者進行合理分層并制定個體化治療方案,對改善不可切除HCC患者的臨床結局具有積極意義。近年來,系統性炎癥-免疫反應已被證實與腫瘤進展和轉移密切相關[7]。作為重要的炎癥—免疫評估指標,C反應蛋白/白蛋白比率(C-reactive protein/albumin ratio,CAR)已被報道與多種不同類型癌癥患者的預后密切相關,其值升高提示預后不良[8]。然而,關于CAR在接受TACE聯合RFA治療HCC患者中的預后評估價值尚無報道。因此,本研究旨在通過回顧性分析在我院接受治療的HCC患者的臨床預后資料,以探究CAR對接受TACE聯合RFA治療HCC患者的預后評估價值。
1 資料和方法
1.1 研究對象
選取于2012年1月至2014年10月在華中科技大學同濟醫學院附屬梨園醫院接受TACE+RFA治療的98例HCC患者為研究對象。HCC的診斷依據為美國肝臟研究協會標準[9]:即經組織病理活檢或2種顯示典型HCC特征的影像學技術確診。納入標準為:1)HCC初診患者;2)C反應蛋白和白蛋白水平檢測時限為在治療前1周內;3)臨床預后資料完整。排除標準為:1)有臨床證據表明伴發其他系統腫瘤、感染或炎癥狀態的患者;2)TACE+RFA治療后接受了化療的患者。本研究獲得我院醫學倫理委員會批準,所有患者均簽署知情同意書。
1.2 臨床病理資料收集
所有納入患者的臨床病理資料均從患者的保存病歷中獲取,包括性別、年齡、最大腫瘤直徑(cm)、腫瘤數目、肝功能Child-Pugh分級、血清甲胎蛋白水平(ng/dL)、治療前的C反應蛋白和白蛋白水平、以及是否有肝硬化及門靜脈癌栓。其中,CAR定義為治療前基線水平的CAR水平。
1.3 治療方法
TACE:1)選擇性行腸系膜上動脈造影以評估腫瘤的病理特征,包括大小、數量、形狀和腫瘤的供血動脈;2)使用選擇性/超選擇性技術,將之前放置在肝動脈部位的柔性同軸微導管選擇性地插入腫瘤供血動脈中;3)放置微導管后,將吡柔比星(15 mg/m2)、羥基喜樹堿(8 mg/m2)和碘油(5~10 mL)的混合物經導管注入;4)用栓塞材料(如明膠海綿顆粒或聚乙烯醇顆粒)栓塞血管,直到腫瘤供血動脈血流完全停滯。為減輕相關副反應,在接受TACE治療前提前預防性使用止吐等藥物。
RFA:RFA采用內部冷卻電極進行,電極末端約2 cm或3 cm暴露在外。局部麻醉后,在CT引導下將電極針經皮導入腫瘤中,射頻治療直到腫瘤完全消融,并密切注意避免接觸肝內的大血管和肝內膽管。患者在接受TACE術后1周內接受RFA治療。
1.4 隨訪
以患者確診當日為隨訪起點,采用電話隨訪、門診復診或住院病歷資料的方式進行隨訪,隨訪截止時間為2019年10月31日。記錄納入患者的生存狀態、死亡時間等資料,所有納入患者均有5年隨訪數據。本研究的主要終點是總生存期(overall survival,OS),定義為自HCC確診之日至死亡或最后一次隨訪的時間間隔。
1.5 統計學分析
采用SPSS 22.0統計學軟件進行數據分析。分類變量組間比較采用χ2檢驗,連續變量組間比較采用Mann-WhitneyU檢驗。采用受試者工作特征曲線(receiver operating characteristic,ROC)確定CAR的最佳臨界值。采用Kaplan-Meier分析和log-rank檢驗計算累積生存率并繪制生存曲線。采用單因素分析探究影響HCC患者OS的危險因素,有統計學意義的風險因素(P<0.05)納入Cox比例風險模型進行多因素分析,探究影響患者OS的獨立危險因素,以P<0.05為差異有統計學意義。
2 結 果
2.1 一般資料
在納入的98例HCC患者中,男性75例(76.5%),女性23例(23.5%);中位年齡為62歲(36~78歲);患者接受TACE和RFA治療的中位周期數分別為3(1~10)次、3(1~15)次;患者外周血中C反應蛋白和白蛋白的中位基線水平分別為0.31(0.02~22.16) mg/dL、4.5(3.2~5.2) g/dL。根據圖1A所示,根據每位患者基線的C反應蛋白和白蛋白水平,計算對應的基線CAR值。并進一步利用ROC曲線確定CAR的最佳臨界值,結果表明,CAR的最佳臨界值為0.038(特異性:63.64%,靈敏度:72.41%,AUC:0.705,P=0.027),見圖1B。根據此臨界值,將患者分為2組:CAR高水平組(n=40)和CAR低水平組(n=58)。
2.2 CAR水平與肝癌患者臨床病理特征的關系
臨床病理特征相關性分析表明,基線CAR高水平與較大的腫瘤直徑、較多的腫瘤數目、較差的Child-Pugh分級及肝硬化顯著相關(均P<0.05),而與患者的性別、年齡、AFP水平及門靜脈癌栓無顯著相關性(均P>0.05,表1)。
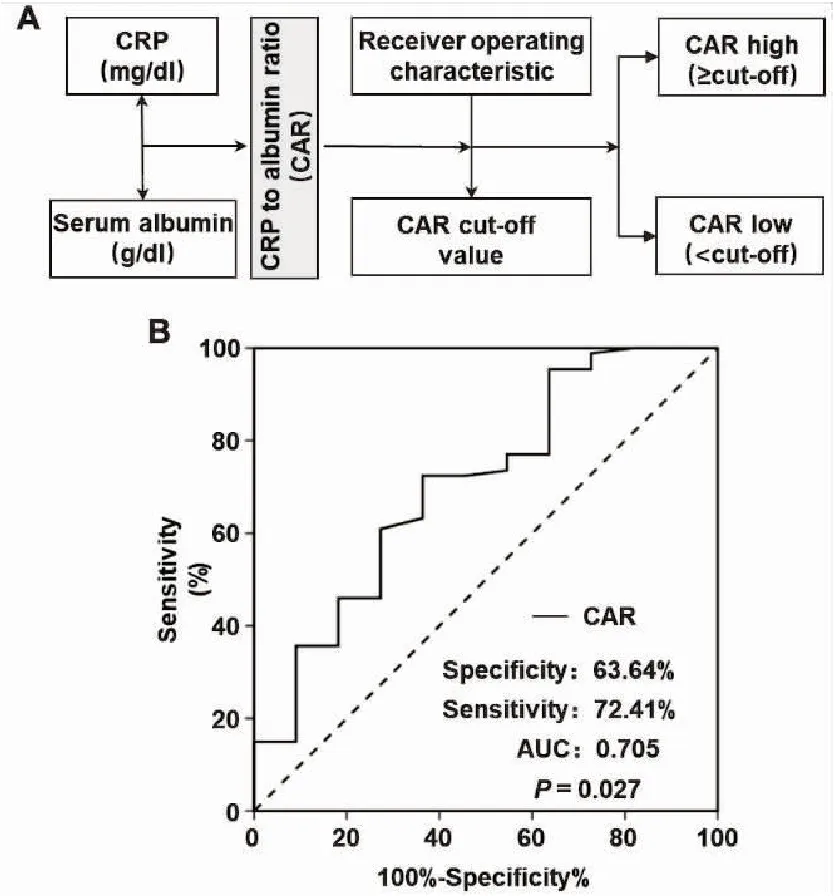
圖1 CAR計算模式圖及利用ROC曲線確定其最佳臨界值
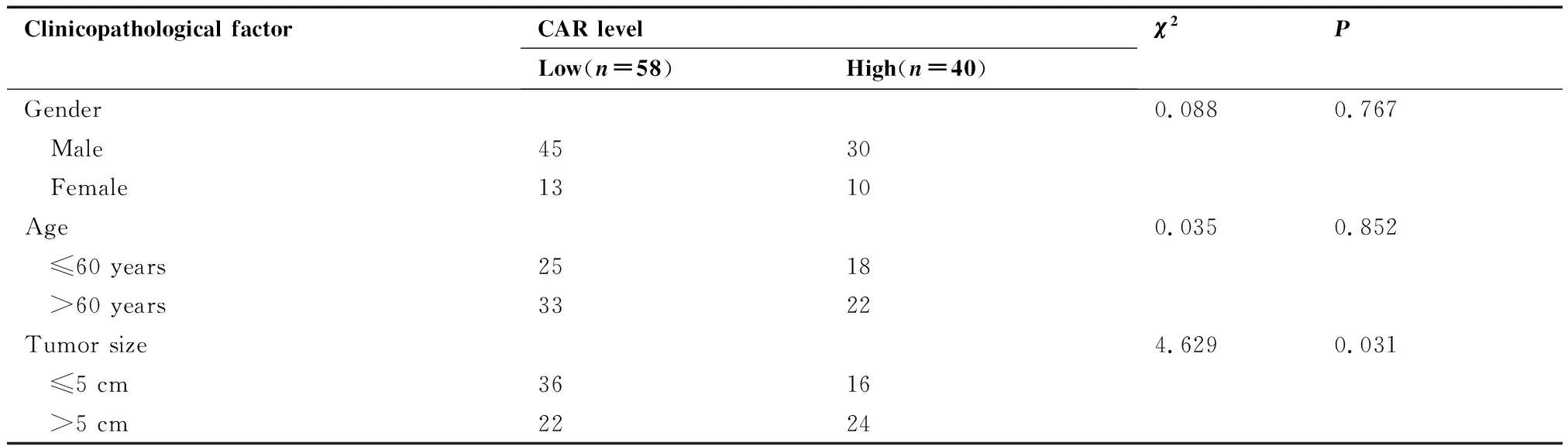
表1 肝細胞癌患者CAR水平與臨床病理特征的關系/例
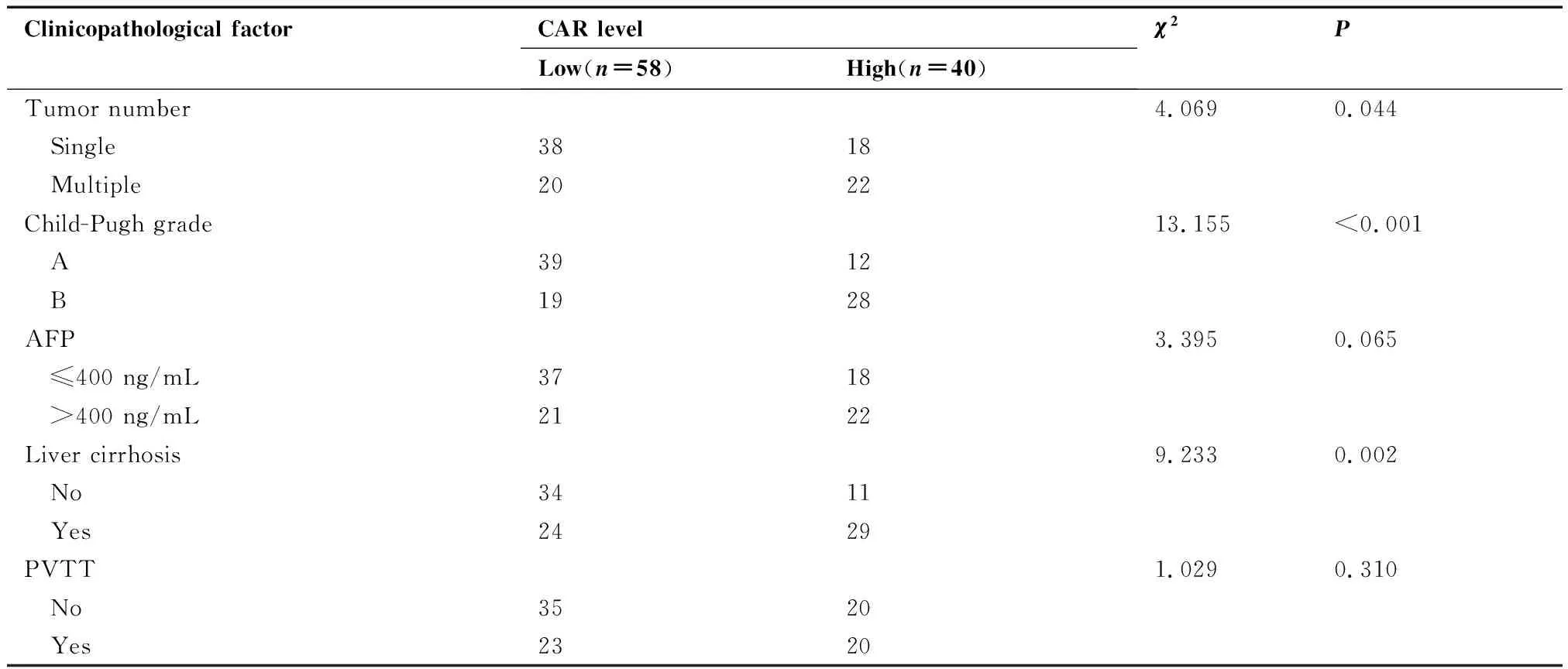
Clinicopathological factorCAR levelLow(n=58)High(n=40)χ2 PTumor number4.0690.044 Single3818 Multiple2022Child-Pugh grade13.155<0.001 A3912 B1928AFP3.3950.065 ≤400 ng/mL3718 >400 ng/mL2122Liver cirrhosis9.2330.002 No3411 Yes2429PVTT1.0290.310 No3520 Yes2320
2.3 CAR水平與肝癌患者OS的關系
在隨訪周期內,97例患者死亡,1例存活,死亡率為98.98%。Kaplan-Meier生存分析及Log-rank檢驗結果顯示,與低基線CAR水平患者相比,高基線CAR水平患者的中位OS顯著縮短(24個月vs13個月,P=0.002;圖2)。進一步單因素回歸分析結果提示,腫瘤直徑、Child-Pugh分級、肝硬化、門靜脈癌栓和CAR水平與患者的OS相關(均P<0.05);將單因素分析腫瘤有意義的因素納入多因素Cox回歸分析,結果證實,CAR水平(HR:2.411,95%CI:1.126~5.163,P=0.024),Child-Pugh分級(HR:1.186,95%CI:1.149~2.871,P=0.011),肝硬化(HR:1.465,95%CI:1.142~2.305,P=0.034)及門靜脈癌栓(HR:3.073,95%CI:1.161~6.472,P=0.005)是影響接受TACE和RFA治療HCC患者OS的獨立因素(表2)。
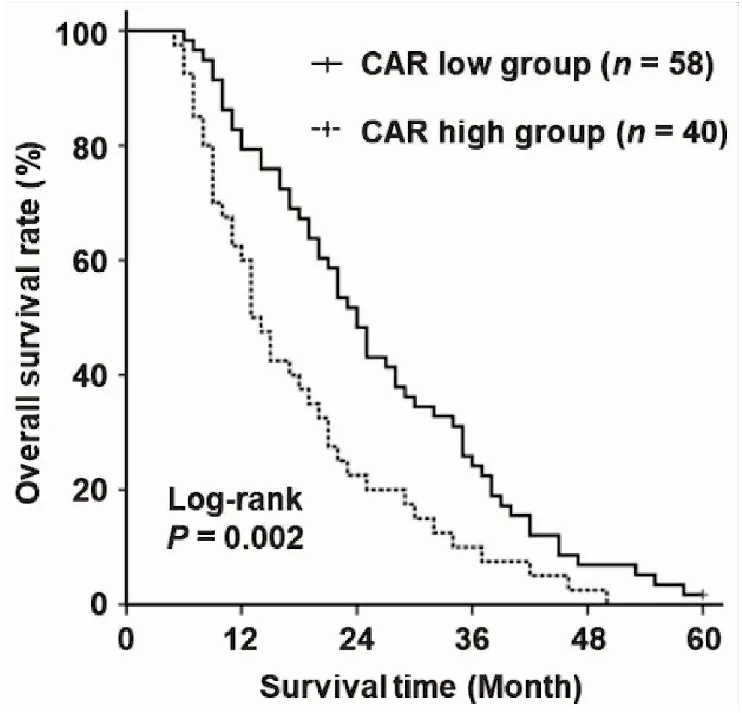
圖2 基線CAR水平與肝細胞癌患者總生存期的關系
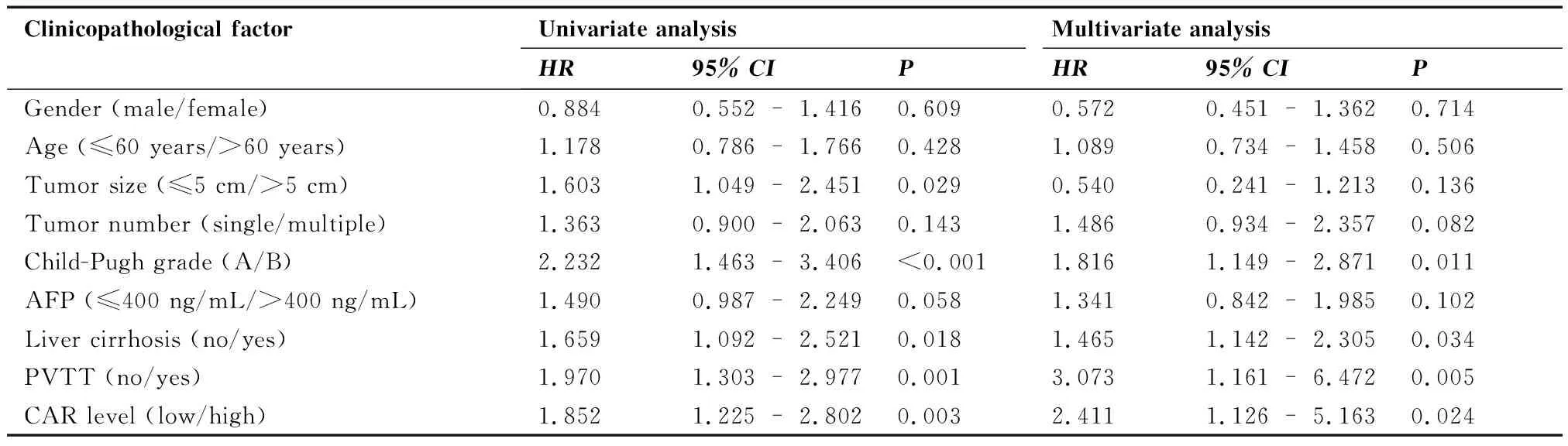
表2 影響肝細胞癌患者總生存期相關風險因素的單因素和多因素分析
3 討 論
炎癥是惡性腫瘤的標志之一,可誘導免疫細胞處于耗竭狀態,從而為腫瘤細胞的免疫逃逸創造有利條件,導致腫瘤進展[7]。相關研究表明,慢性炎癥可通過增加生長因子、促血管生成因子及細胞外基質調節因子的產生,促進惡性腫瘤生長和轉移[10]。CAR作為一個炎癥相關標志物,最早被用于膿毒癥患者的預后[11]。近年來,隨著研究者對慢性炎癥在惡性腫瘤中重要作用的認識加深,CAR在惡性腫瘤中的生物標志物功能也逐漸被揭示。當前,CAR已被證實與多種惡性腫瘤的分期、惡性進展及預后密切相關,然而,其在HCC中的預后價值仍需探索。
在本研究中,我們首次評估了基線CAR水平在接受TACE聯合RFA治療的HCC患者中的預后價值。結果表明,較高的基線CAR水平與腫瘤直徑、腫瘤數目、Child-Pugh分級及肝硬化等不良臨床病理因素呈顯著正相關;進一步的生存分析提示,CAR是影響接受TACE和RFA治療HCC患者OS的獨立因素,基線CAR水平較高患者的OS顯著縮短。本研究結果與既往相關研究結果相符。Xu等[12]通過回顧性分析III期臨床研究的數據發現,術前CAR水平是預測接受胃癌根治術患者早期復發和化療獲益的良好指標,由CAR和TNM分期組成的風險評估模型具有更好的預后預測能力和臨床應用價值;Ishizuka等[13]研究表明,在接受手術治療的結直腸癌患者中,基線CAR水平與患者的年齡、性別、腫瘤位置、大小、腫瘤類型、淋巴脈管浸潤、CEA水平及TNM分期顯著相關,單因素及多因素分析證實,CAR是影響患者OS的獨立預后因素。而在接受手術治療的早期HCC中,CAR的預后評估價值也得到了證實。Shimizu等[14]研究發現,在Child-Pugh A級接受肝切除的HCC患者中,術前CAR高水平與較差的無復發生存期和OS相關,且是影響患者OS的獨立預后因素;類似地,另一項研究也提示術前CAR水平是接受根治性手術HCC患者無腫瘤生存的獨立預后指標[15]。此外,Oh等[16]探究了術后CAR在HCC中的預后價值,結果表明,無論是接受腹腔鏡或者開腹手術,術后CAR水平均是影響HCC患者術后復發率和死亡率的風險因素。結合既往研究及當前研究結果表明,無論是術前還是術后CAR水平,均是預測HCC患者預后的良好指標,且與患者接受的治療方式無關。當然,上述推測仍需未來大規模、高質量的臨床研究去加以證實。
目前,關于CAR促進HCC進展的機制尚不明確。C反應蛋白作為在IL-6刺激下由肝臟分泌的一種急性期蛋白,在臨床上被視為一種重要的炎癥指標。既往研究表明,IL-6可通過促進STAT3磷酸化來介導腫瘤相關巨噬細胞的M2型極化或直接抑制腫瘤細胞的凋亡和促進其增殖,進而促進腫瘤進展[17]。此外,研究者在乳腺癌模型中研究表明,C反應蛋白可通過與腫瘤細胞上的整合素α2亞基結合增強腫瘤細胞的侵襲能力,進而發揮直接的促腫瘤作用[18]。因此,目前的研究尚不能確定,C反應蛋白對腫瘤的促進作用是通過直接影響腫瘤細胞,還是為IL-6介導的腫瘤進展的下游作用。有趣的是,少數的臨床前研究結果卻發現,C反應蛋白可通過抑制腫瘤細胞的上皮—間質轉化和腫瘤相關巨噬細胞的M2型極化,進而發揮抗腫瘤作用[19-20]。另一方面,血清白蛋白作為患者營養評估的一個指標,其水平降低提示營養不良,與腫瘤患者的免疫反應受損密切相關,為腫瘤細胞的轉移提供了有利條件[21]。在未來,需要更多的研究去探索CAR影響腫瘤進展的潛在機制。
本研究存在以下不足:1)本研究為單中心回顧性研究,研究結論的證據級別不足;2)研究納入樣本量較少,從一定程度上降低了結論的說服力。關于CAR作為預后標志物的潛力,更需要未來大規模、前瞻性、多中心的臨床研究去加以驗證,以協助為不同患者制定個體化的治療策略。盡管如此,本研究結果表明CAR作為一種簡單、廉價的生物標志物,可用于預測接受TACE聯合RFA治療的HCC患者的預后。
作者聲明:本文全部作者對于研究和撰寫的論文出現的不端行為承擔相應責任;并承諾論文中涉及的原始圖片、數據資料等已按照有關規定保存,可接受核查。
學術不端:本文在初審、返修及出版前均通過中國知網(CNKI)科技期刊學術不端文獻檢測系統的學術不端檢測。
同行評議:經同行專家雙盲外審,達到刊發要求。
利益沖突:所有作者均聲明不存在利益沖突。
文章版權:本文出版前已與全體作者簽署了論文授權書等協議。

