核糖蛋白替代魚粉對大菱鲆幼魚生長性能、腸道消化酶活性、免疫能力及血清生化指標影響*
郝甜甜 王際英 ① 潘金敏 楊 輝 李寶山 沈鈺博 劉財禮 王成強 黃炳山
(1. 山東省海洋資源與環境研究院 山東省海洋生態修復重點實驗室 山東 煙臺 264006;2. 煙臺市三維飼料有限公司 山東 煙臺 264006;3. 上海海洋大學 水產科學國家級實驗教學示范中心農業農村部魚類營養與環境生態研究中心 水產動物遺傳育種中心上海市協同創新中心 上海 201306)
隨著水產養殖業的快速發展,我國北方重要的海水魚養殖經濟品種鲆鰈類產量不斷上升,2019年產量達12.8萬t (農業農村部漁業漁政管理局, 2020)。大菱鲆(Scophthalmusmaximus)是鲆鰈類養殖的主要品種之一,在歐洲及東亞具有較高的消費需求市場,其配合飼料所需蛋白質較高,而魚粉作為其配合飼料中的主要優質蛋白源,約占飼料成本的60%~80%(梅琳等, 2015; 賈高旺等, 2019),這是制約大菱鲆產業發展的重要瓶頸。為降低養殖成本,提高大菱鲆產業的健康發展,有必要尋找替代魚粉的蛋白源。動物性蛋白源由于蛋白質含量較高、氨基酸含量較豐富,且富含多種動物所需的維生素和礦物質(陳水春等,2008),成為近年來魚粉替代蛋白源的研究重點。
核糖蛋白是一種新型生物分子的免疫蛋白,經特殊工藝加工包裝而成的一種粉末狀動物蛋白。核糖蛋白除了含有人們所熟知的肽、氨基酸等成分,還含有一些未知的生長因子,如促生長因子和免疫因子等。研究表明,核糖體在生物體內的主要功能為合成各種蛋白質以調節生物的生命活動,而大部分核糖蛋白在核糖體中的作用是輔助多肽鏈的合成,甚至可以執行核糖體外的功能(田媛等, 2011)。而多肽在生物機體中具有促生長、刺激消化酶分泌和增強機體免疫能力的作用(Kotzamaniset al, 2007),且因其安全無毒副作用被廣泛應用于畜牧及水產飼料中。然而,核糖蛋白作為富含多肽及免疫活性物質的營養性添加劑,還未見其在水產飼料中的應用報道。鑒于此,實驗以大菱鲆為研究對象,在其飼料中添加核糖蛋白替代部分魚粉,研究其對大菱鲆生長性能、消化酶活性、非特異性免疫指標和生理生化指標的影響,以期為核糖蛋白在大菱鲆配合飼料中的應用提供參考。
1 材料與方法
1.1 實驗飼料
本研究所用核糖蛋白由山東省煙臺市三維飼料有限公司提供,其加工工藝為新鮮豬脾臟經過低溫勻漿,細胞破碎處理,提取其有效成分,經過特殊工藝包被,220℃高溫噴霧干燥(有效成分:核糖≥1.0 g/kg;多肽≥14 g/kg)。以核糖蛋白分別替代基礎飼料中0 (D1組,作為對照組)、0.5% (D2組)、1% (D3組)、2% (D4組)、3% (D5組)和 4% (D6組)的魚粉,配制6組實驗飼料(粗蛋白為49%、粗脂肪為10.50%),魚粉和核糖蛋白營養成分見表1。制作飼料時,將所有飼料原料過80目篩,按比例稱重,逐級擴大均勻,經螺旋擠壓機加工成直徑為3.0 mm的硬顆粒飼料,自然風干儲存于-20℃冰箱備用。實驗飼料組分及營養水平見表2。

表1 魚粉和核糖蛋白的主要營養成分含量(%,干物質基礎)Tab.1 Main nutritional component contents of fish meal and ribose protein (%, dry weight basis)
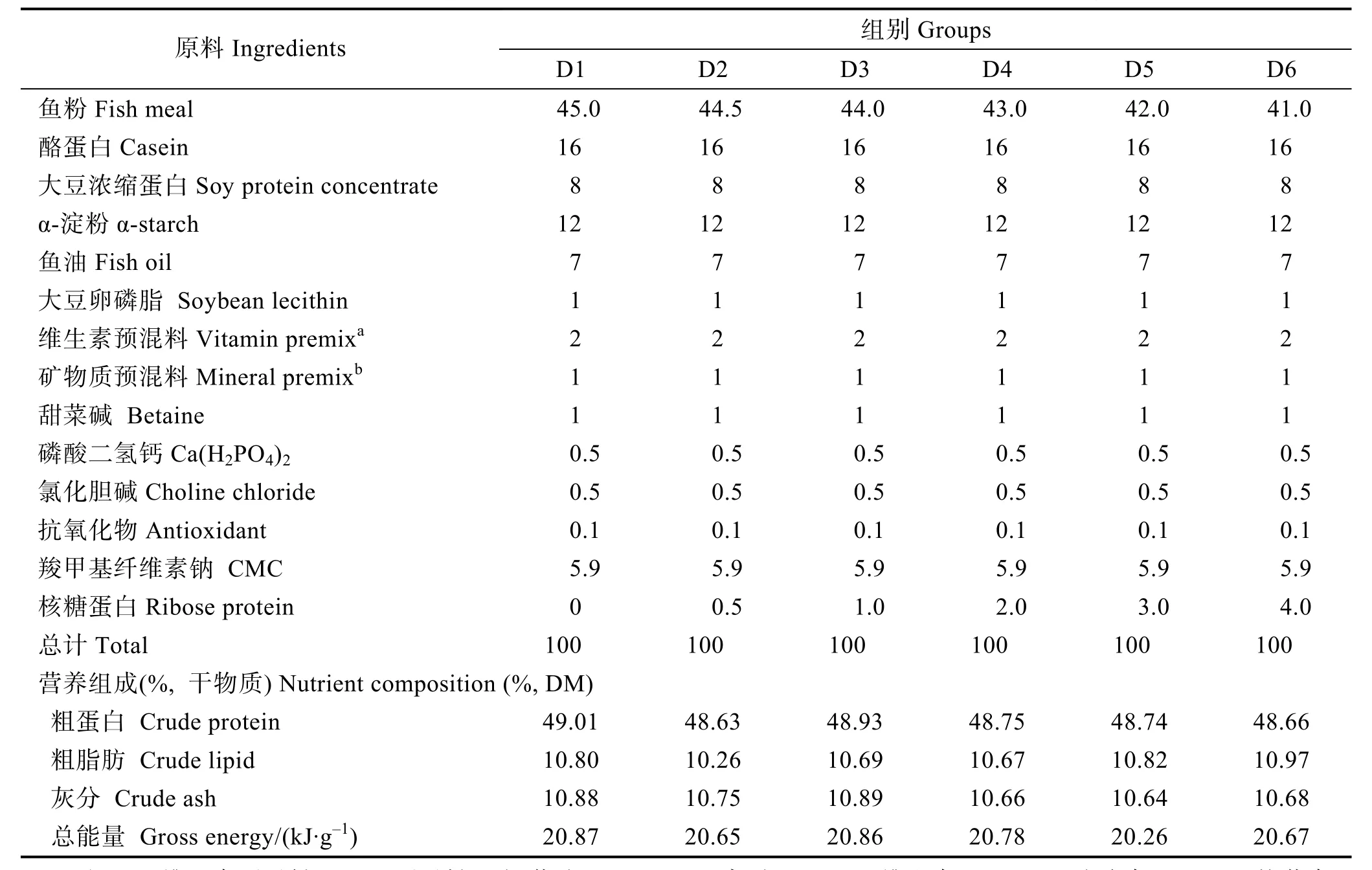
表2 飼料配方和主要營養成分組成(%, 干重)Tab.2 Formulation and proximate chemical composition of the tested diets (%, dry weight basis)
1.2 實驗用魚和實驗條件
實驗用大菱鲆購自山東蓬萊宗哲養殖有限公司,養殖實驗在山東省海洋資源與環境研究院全封閉水循環系統進行。實驗魚用基礎飼料(D1)暫養14 d,循環水養殖,連續充氣。暫養結束后,禁食24 h,挑選健康無病,規格均一的大菱鲆幼魚[初始體重為(24.00± 0.30) g]隨機分為6組,每組3個重復(30尾/重復),共540尾,放養于18個綠色圓柱形塑料養殖桶中。每天投喂2次(08:00、17:00),日投喂量為魚體重的1.2%~1.5%,據攝食情況調整投喂量,投喂結束后,統計殘餌量。整個實驗期間,微水流循環水養殖,控制水溫為(16±1)℃,pH為7.8~8.0,鹽度為 27~28,溶解氧(DO)>6 mg/L,氨氮<0.01 mg/L,亞硝酸鹽<0.01 mg/L。養殖周期為 56 d。
攻毒實驗:實驗結束后,每桶取10尾魚進行攻毒實驗。將純化的鰻弧菌(Vibrio anguillarum)于28℃,200 r/min 震蕩培養箱中培養 10 h,至 OD600 nm約 0.5,4℃,8000 r/min離心10 min,收集菌體沉淀,用無菌 PBS稀釋,至 OD600 nm為 1左右,每尾注射 100 μL的鰻弧菌(1×107CFU)進行攻毒,分別放入室內塑料桶內,保證充足供氧,每2 h觀察1次,撈出死魚,于48 h統計累積死亡率。
1.3 樣品采集
養殖實驗結束時,禁食24 h,以桶為單位稱重,記錄每桶實驗魚的尾數和質量,計算成活率、增重率和飼料系數。每桶隨機選擇15尾幼魚,丁香酚麻醉,尾靜脈采血,之后取內臟團稱重,然后分離肝臟稱重,計算臟體比和肝體比。血樣4℃靜置4 h,4000 r/min離心10 min,取血清。將所有樣品保存于-20℃,待測。
1.4 測定指標與方法
1.4.1 生長指標 成活率(survival rate, SR, %)=100×存活尾數/30
增重率(weight gain rate, WGR, %)=100×(均末體質量-均初體質量)/均初體質量
特定生長率(specific growth rate, SGR, %/d)=100×(ln均末體質量-ln均初體質量)/56
蛋白質效率(protein efficiency ratio, PER, %)=100×(終末體質量-初始體質量)/(攝食量×飼料粗蛋白含量)
飼料系數(feed conversion ratio,FCR)=攝食量/ (終末體質量-初始體質量)
肥滿度(condition factor, CF)=100×體質量/體長3
臟體比(viscerosomatic index, VSI, %)=100×內臟團重量/體質量
腸體比(intestinesomatic index, ISI, %)=100×腸道重量/體質量
血清類胰島素生長因子(IGF-1)、生長激素(GH)采用上海酶聯ELISA試劑盒測定。
1.4.2 實驗飼料常規成分的測定 飼料中水分采用105℃恒重法測定(GB/T6435-2006),粗蛋白采用凱氏定氮法測定(GB/T6432-2018),粗脂肪采用索氏抽提法測定(GB/T6433-2006),粗灰分采用灰化法測定(GB/T6438-2007),能量采用氧彈儀燃燒法測定(IKA,C6000, 德國),飼料及原料氨基酸含量參照《GB/T 18246-2019》中方法處理,上機液采用全自動氨基酸測定儀(Hitachi L-8900, 日本)測定分析。
1.4.3 血清酶活性測定 總蛋白(TP)、白蛋白(ALB)、溶菌酶(LZM)、堿性磷酸酶(ALP)和超氧化物歧化酶(SOD)均采用南京建成試劑盒進行測定;血清總膽固醇(TCHO)、甘油三酯(TG)、低密脂蛋白膽固醇(HDL-C)、高密度脂蛋白膽固醇(LDL-C)和血糖(GLU)均采用南京建成試劑盒微板法測定;血清白介素 β1(IL-1β)、干擾素 γ (IFN-γ),腫瘤壞死因子(TNF-α)均采用上海酶聯ELISA試劑盒測定。
1.4.4 腸道消化酶活力 腸道胰蛋白酶(trypsin)、α-淀粉酶(α-Amylase)和脂肪酶(lipase)均采用南京建成試劑盒進行測定。
1.4.5 攻毒實驗 測定累積死亡率,計算公式如下:累積死亡率(cumulative mortality rate, %)=100×(病死魚尾數/初感染魚尾數)
1.5 數據分析
采用SPSS 17.0軟件對所得數據進行單因素方差分析(one-way ANOVA),差異顯著,則采用Duncan進行多重檢驗,顯著水平為0.05,統計數據以平均值±標準差(Mean±SD)表示。
2 結果
2.1 核糖蛋白替代魚粉對大菱鲆幼魚生長性能的影響
由表3可知,隨著飼料中核糖蛋白替代魚粉比例的升高,增重率、特定生長率和蛋白質效率均呈現先上升后下降的趨勢,而飼料系數則呈相反趨勢。幼魚增重率、特定生長率和蛋白質效率最高值均出現在D3組,顯著高于對照組(P<0.05);飼料系數在D3組達到最低值,顯著低于D1組(P<0.05),但與其他組之間差異不顯著(P>0.05)。隨著飼料中核糖蛋白替代魚粉水平的增加,幼魚肥滿度呈先上升后下降趨勢,D2和D3組與對照組無顯著差異(P>0.05),D4~D6組顯著低于對照組(P<0.05)。各組間幼魚成活率、臟體比和腸體比無顯著差異(P>0.05)。
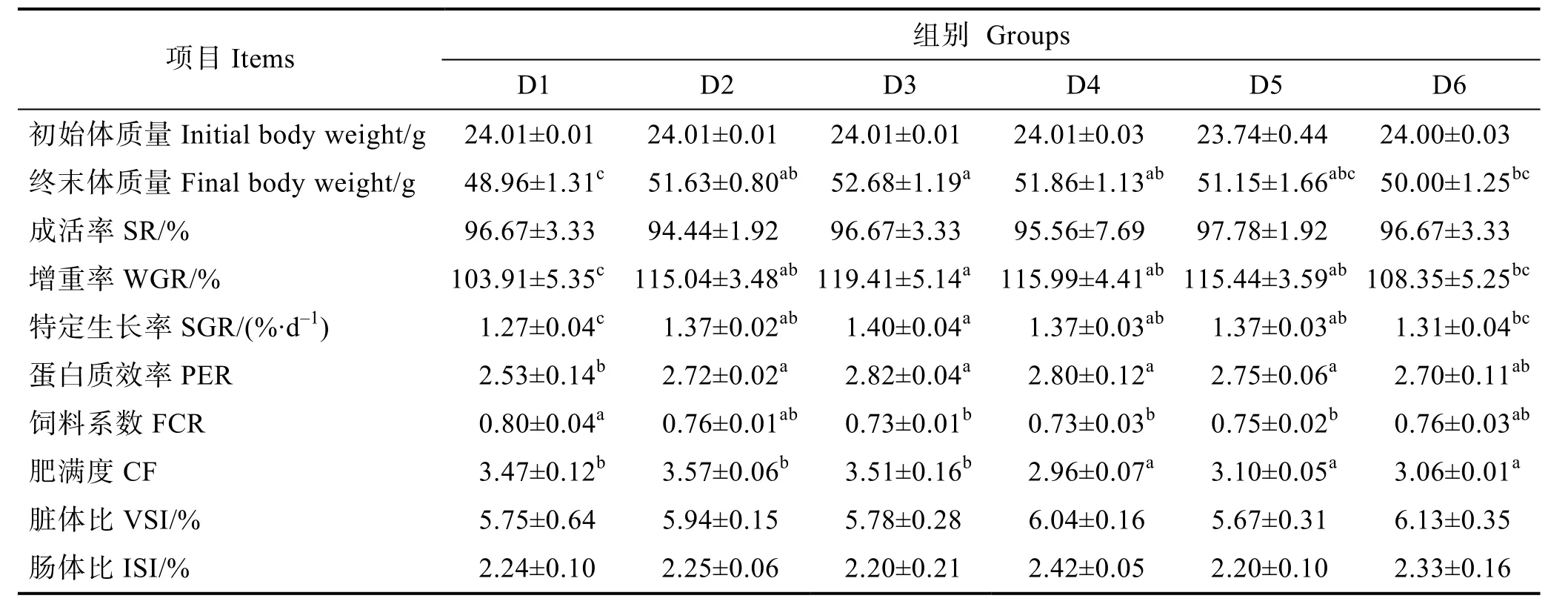
表3 核糖蛋白替代魚粉對大菱鲆幼魚生長性能的影響Tab.3 Effects of partial replacement of fish meal by ribose protein on growth performance of juvenile turbot
由圖1和圖2可知,幼魚血清IGF-1和GH含量均在D3組達到最高值,顯著高于其他組(P<0.05)。

圖1 核糖蛋白替代魚粉對大菱鲆幼魚血清IGF-1的影響Fig.1 Effects of partial replacement of fish meal by ribose protein on serum IGF-1 content juvenile of turbot

圖2 核糖蛋白替代魚粉對大菱鲆幼魚血清GH的影響Fig.2 Effects of partial replacement of fish meal by ribose protein on serum GH content of juvenile turbot
2.2 飼料中添加不同水平核糖蛋白對大菱鲆幼魚腸道消化酶活力的影響
由表4可知,腸道胰蛋白酶和α-淀粉酶活力均在D4組達到最高值,與對照組差異顯著(P<0.05)。與對照組相比,核糖蛋白替代魚粉后降低了幼魚脂肪酶活性(P<0.05),在D6 組達到最低值,顯著低于對照組(P<0.05)。

表4 核糖蛋白替代魚粉對大菱鲆幼魚腸道消化酶活力影響Tab.4 Effects of partial replacement of fish meal by ribose protein on digestive enzyme activities in intestinal of juvenile turbot
2.3 核糖蛋白替代魚粉對大菱鲆幼魚免疫能力的影響
由表5可知,幼魚血清TP含量在D3組出現最高值,與對照組差異顯著(P<0.05);血清GLB含量在D2組顯著高于對照組(P<0.05);各組間ALB含量和總超氧化物歧化酶(T-SOD)活性無顯著差異(P>0.05);LZM活性在D1~D5組顯著高于D6組(P<0.05);D2~D6組血清 ALP活性顯著高于對照組(P<0.05)。幼魚血清IL-β1含量在D2組達到最高值,顯著高于對照組(P<0.05);IFN-γ含量在D3和D5組與對照組無顯著差異(P>0.05),但其他組均顯著低于對照組(P<0.05);飼料中添加核糖蛋白顯著增加了幼魚血清TNF-α濃度(P<0.05),其中在D2組達到最高值。
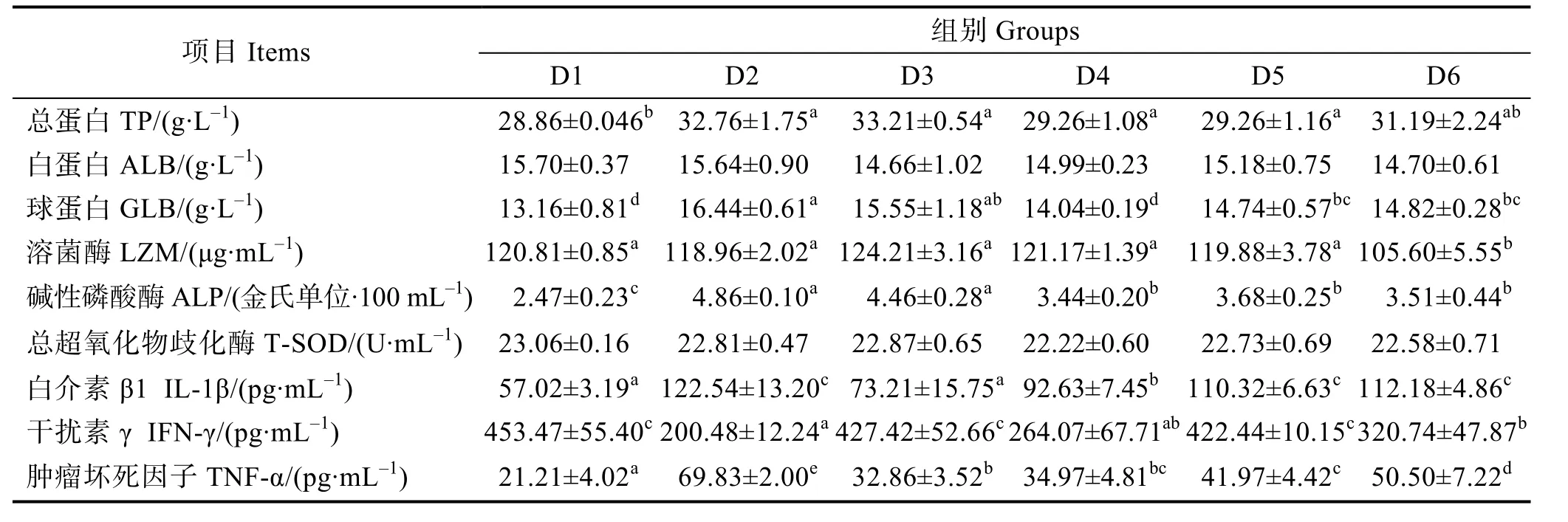
表5 飼料中添加不同水平核糖蛋白對大菱鲆幼魚血清免疫能力的影響Tab.5 Effects of partial replacement of fish meal by ribose protein on serum immune indices of juvenile turbot
2.4 飼料中添加不同水平核糖蛋白對大菱鲆幼魚生化指標的影響
由表6可知,幼魚血清總膽固醇含量在D3組達到最高值,與對照組無顯著差異(P>0.05),但顯著高于D4~D6組(P<0.05);隨著飼料中核糖蛋白含量的增加,幼魚血清甘油三酯呈下降趨勢,在D6組達到最低值,顯著低于對照組(P<0.05);血清低密度脂蛋白膽固醇含量在D5組達到最低值,顯著低于對照組(P<0.05);高密度脂蛋白膽固醇含量在 D4組達到最高值,顯著高于對照組(P<0.05);血糖含量呈先上升后下降趨勢,在D3組達到最高值,顯著高于其他各組(P<0.05)。
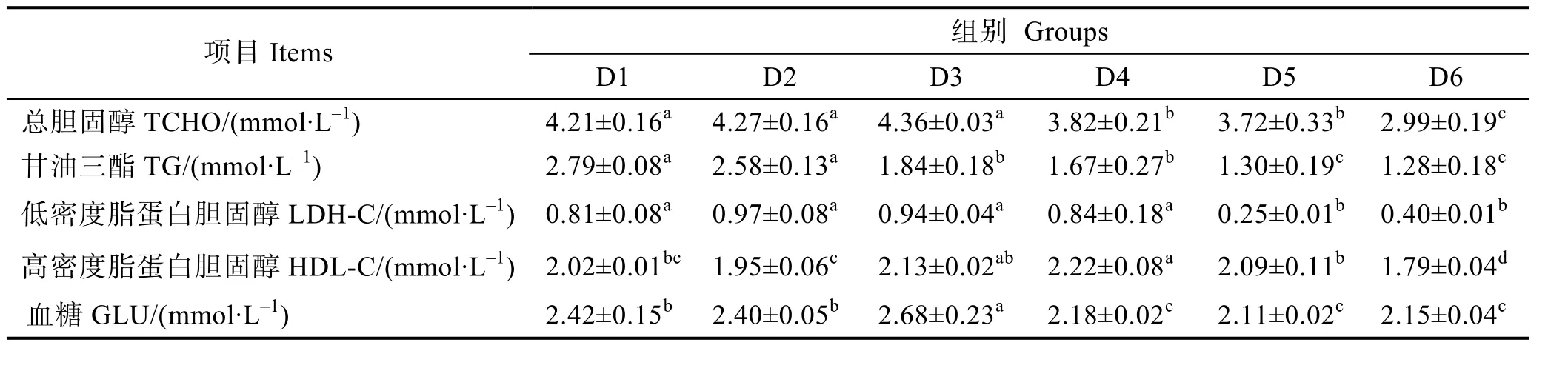
表6 飼料中添加不同水平核糖蛋白對大菱鲆幼魚血清生化指標的影響Tab.6 Effects of partial replacement of fish meal by ribose protein on serum biochemical indices of juvenile turbot
2.5 飼料中添加不同水平核糖蛋白對大菱鲆幼魚累積死亡率的影響
在大菱鲆幼魚飼料中添加核糖蛋白替代不同比例魚粉喂養大菱鲆幼魚 56 d后,進行鰻弧菌注射感染實驗,感染48 h各實驗組累積死亡率統計結果見圖 3。各組感染之后,在12 h即出現死亡情況,在24 h 內死亡率急劇增加,36 h 減緩,48 h 即達到平穩。與對照組相比,D2組累積死亡率達56.45%,達到最低值,顯著低于對照組和其他實驗組(P<0.05)。
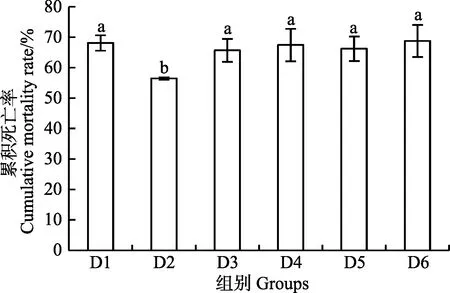
圖3 核糖蛋白替代魚粉對大菱鲆幼魚累積死亡率的影響Fig.3 Effect of fishmeal replacement by ribose protein on cumulative mortality rate of juvenile turbot
3 討論
3.1 核糖蛋白替代魚粉對大菱鲆幼魚生長性能及形體指標的影響
本研究發現,核糖蛋白替代大菱鲆幼魚飼料中1%魚粉可提高幼魚增重率、特定生長率和蛋白質效率,降低飼料系數,說明添加適量核糖蛋白替代魚粉可以增加魚體內蛋白質的合成與沉積,促進營養物質的利用率和魚體的生長,這可能與核糖蛋白中的多肽能增加蛋白質吸收速率,提高蛋白質消化率有關(馮健等, 2004)。這與家禽副產品多肽(Yigitet al,2006)、家禽副產物酶解肽(賈高旺等, 2019)等在大菱鲆中的應用有相似的結果。另有研究表明,在果蠅(Drosophilamelanogaster)核糖體重要基因表達因子不足或缺失會降低核糖體的數量和蛋白質的合成,從而導致果蠅生長發育緩慢(Jorgensenet al, 2002),說明核糖體對動物機體蛋白質的合成、生長發育具有重要的作用(Marygoldet al, 2007)。在本研究中,大菱鲆飼料中添加1%核糖蛋白提高了幼魚的生長性能,這可能與增加了魚體核糖體重要基因的表達量有關,具體機理還需進一步驗證。但當核糖蛋白添加水平高于1%時,其增重率、特定生長率、蛋白質效率均受到顯著抑制,可能是低分子量的多肽產生過多氨基酸,使腸道中的氨基酸轉運系統飽和造成的,也可能是核糖蛋白中的肽類與其他原料中的氨基酸吸收不同步造成的(路晶晶等, 2018),這與在海鱸魚(Dicentrarchus labrax) (Cahuet al, 1999)的研究結果一致。
肥滿度、臟體比和腸體比是衡量魚體能量狀態的重要指標,增加攝食營養物質和能量均會引起肥滿度、臟體比和腸體比的升高(Daudpotaet al, 2016)。本研究中,隨著飼料中核糖蛋白替代魚粉比例的增加,肥滿度呈先上升后下降趨勢,這表明飼料中添加適量的核糖蛋白替代魚粉可以改善魚體的營養狀況,這與本研究中生長指標相一致;大菱鲆幼魚腸體比和臟體比在添加組均稍高于對照組,但無顯著差異,可能與核糖蛋白中的有效成分影響了魚體的肝臟和腸道代謝有關(Boza et al, 2000)。
類胰島素生長因子是一種生長內分泌激素,能增加機體或細胞對氨基酸的攝取和利用,促進蛋白質和RNA的合成,促進肌肉生長(孫偉等, 2011)。本研究中,隨著核糖蛋白替代魚粉比例的增加,魚體類胰島素生長因子在1%組與對照組無顯著差異,其他替代組均顯著低于對照組。研究表明,在花鱸(Lateolabrax japonicus) (Men et al, 2014)、軍曹魚(Rachycentron canadum) (Luoet al, 2013)、金頭鯛(Sparusaurata)(Gómez-Requenia et al, 2004)飼料中添加動、植物蛋白替代魚粉會導致魚體類胰島素生長因子基因表達量下降,這是由飼料營養組分不同造成的(Hevr?y et al,2011),這也有可能是本研究中,核糖蛋白替代魚粉降低了大菱鲆幼魚血清IGF-1濃度的原因之一。生長激素在動物的生長發育過程中起決定性的作用,生長激素通過由垂體分泌的生長因子刺激合成并釋放出IGF-I作用于靶細胞進而促進機體的生長(王連生等,2016)。本研究表明,飼料中添加核糖蛋白替代魚粉降低了血清中生長激素含量,與血清中IGF-I濃度變化趨勢一致,表明飼料中添加核糖蛋白替代魚粉降低了血清GH和IGF-I濃度,從而降低了魚體的生長,但添加適量核糖蛋白替代魚粉(1%組)可提高幼魚血清GH和IGF-I濃度,這對魚體生長及降低魚粉添加量都具有一定的意義。
3.2 核糖蛋白替代魚粉對大菱鲆幼魚腸道消化酶活力的影響
本研究發現,核糖蛋白適量替代魚粉對大菱鲆腸道胰蛋白酶、淀粉酶和脂肪酶活性均有顯著影響,但能提高幼魚胰蛋白酶和淀粉酶活性,降低脂肪酶活性。這與一些肽類物質在草魚(Ctenopharyngodon idella) (馮健等, 2004)、美洲黑石斑魚(Centropristis striata) (邱金海等, 2009)等研究結果類似。推測其作用機理與多肽蛋白可刺激魚體腸道中開放型細胞分泌激素調節消化酶的分泌有關(李加兒等, 2015)。但在核糖蛋白替代量為 4%時顯著降低了腸道胰蛋白酶活性,說明隨著核糖蛋白替代魚粉比例的增加,核糖蛋白能使腸道胰蛋白酶活性呈先上升后下降的趨勢。此外,飼料中添加核糖蛋白替代魚粉降低了幼魚脂肪酶的活性,其機理可能是核糖蛋白中某些有效成分下調了魚體脂肪代謝相關基因表達,影響了脂肪的消化吸收及轉運代謝過程(田許等, 2019)。綜上,適量的核糖蛋白替代魚粉可提高大菱鲆幼魚的消化能力,但高劑量的核糖蛋白替代魚粉將影響大菱鲆的消化能力,表現為胰蛋白酶和脂肪酶活力降低,其深層機制還需要進一步的研究。
3.3 核糖蛋白替代魚粉對大菱鲆幼魚免疫能力的影響
本研究中,飼料中添加核糖蛋白適量替代魚粉顯著提高了幼魚血清總蛋白、球蛋白、溶菌酶含量和堿性磷酸酶的活性,說明飼料中添加一定量的核糖蛋白替代魚粉可以增加魚體的非特異免疫能力,與凡納濱對蝦(Litopenaeus vannamei) (劉麗波等, 2010)、中華鱉(Trionyx Sinensis) (張海琪等, 2013)研究一致。推測其機理是:一、核糖蛋白里面有效成分多糖可通過激活NF-κB途徑來激活魚體的免疫功能(錢隆等,2019);二、核糖蛋白中的有效成分多肽具有抗菌、抗病毒和增強魚體免疫力的作用。
白介素-1β是白細胞介素1的一種亞型,是一種重要的炎癥和免疫原性細胞因子,在誘發炎癥、造血及免疫調節代謝等過程中發揮重要作用(高珊等,2014; Bird et al, 2002)。腫瘤壞死因子作為重要的炎癥因子,在抵抗細菌和病毒感染以及清除被感染的細胞等方面發揮著重要的作用(田佳音等, 2020)。本研究表明,飼料中添加核糖蛋白替代魚粉顯著提高了幼魚血清白介素-1β和TNF-α含量,均在0.5%替代組達到最高值,表明飼料中添加核糖蛋白可以提高幼魚的免疫能力,與小鼠(樊乃境等, 2020)研究結果一致。
3.4 核糖蛋白替代魚粉對大菱鲆幼魚血清生化指標的影響
本研究表明,飼料中添加核糖蛋白替代大菱鲆幼魚飼料中2%~4%的魚粉可降低血清中總膽固醇和低密度脂蛋白含量,說明核糖蛋白替代魚粉對大菱鲆幼魚脂代謝有一定的影響。若脂類在體內運輸發生障礙,則會造成血清中總膽固醇等指標的上升(路晶晶等, 2018),替代組血清中總膽固醇和低密度脂蛋白含量較對照組下降,表明核糖蛋白可以促進血清中脂質的代謝,加速脂代謝產物的清除,也有可能是核糖蛋白中的一些活性物質可以調控魚體脂肪代謝相關基因表達,從而影響血清脂肪代謝酶活變化,但具體調控受核糖蛋白成分劑量影響(張秀媛等, 2019)。血糖含量是反應生物碳水化合物代謝水平的重要指標,一般魚體攝食積極,血糖濃度較高,則表明魚體健康狀況良好(Almeida et al, 2005)。本研究表明,幼魚血清血糖濃度隨核糖蛋白替代水平變化呈先上升后下降趨勢,與本研究中生長趨勢相一致。在1%替代組顯著高于對照組,表明飼料中核糖蛋白替代1%魚粉具有一定的攝食誘食性。但當核糖蛋白替代量在2%~ 4%時,幼魚血清血糖含量顯著低于對照組,與其他動物蛋白源替代魚粉可降低魚體血糖濃度結果一致(曹曉莉等, 2020)。
3.5 核糖蛋白替代魚粉對大菱鲆幼魚累積死亡率的影響
鰻弧菌是海水魚常見的代表性致病菌之一,通常可引起大菱鲆發生弧菌病。因此,可采用攻毒感染后的累積死亡率來判斷大菱鲆幼魚的抗病力強弱(郝甜甜等,2014)。在本研究中,攻毒后大菱鲆幼魚死亡高峰期出現在12~24 h,36~48 h出現減緩并趨于穩定。研究表明,飼料中添加0.5%核糖蛋白替代魚粉顯著降低了幼魚的累積死亡率,提高了免疫保護率,與本研究中的血清免疫指標白介素-1β和TNF-α的變化趨勢一致。Wu等(2013)研究表明,多肽類可以通過下調腸道炎癥因子含量或者抑制 NF-κB信號通路來減輕炎癥反應。本研究中,添加適量核糖蛋白替代魚粉可能是通過改善腸道健康來發揮抗炎作用從而達到提高免疫保護率的作用,具體機理還需進一步驗證。另有研究表明,水生動物在受到細菌感染時,可通過提高機體的白細胞數目和溶菌酶含量來增強機體免疫能力(Liu et al, 2020; Zhanget al, 2020;敖秋梔等,2020)。在本研究中,0.5%替代組幼魚累積死亡率達到最低值,溶菌酶活性達到最高,表明核糖蛋白替代適宜比例的魚粉可通過提高魚體溶菌酶活性來增加魚體免疫能力(Zhou et al, 2010)。
4 結論
在本研究條件下,以生長性能為基礎,綜合考慮消化和免疫等指標,核糖蛋白替代大菱鲆幼魚飼料中魚粉的適宜比例為1%。

