長穗偃麥草EeSKOR啟動子的克隆及功能分析
張 勇,田小霞,鄭明利,毛培春,孟 林
(北京市農林科學院草業花卉與景觀生態研究所,北京 100097)
鉀(K+)在植物生長發育中起關鍵作用。植物通過根系從土壤中吸收所需的K+,然后將其分配到不同的器官,以滿足正常的生長發育[1-6]。植物體內K+的遠距離分布和動態平衡主要由位于質膜上的各種K+通道介導。根據這些通道蛋白的序列、結構和功能可分為4類,即Shaker、TPK、Kir-like和GNGC鉀通道[2, 5-7],其中,Shaker 型K+通道的研究最為透徹。Shaker型K+通道對底物K+的親和常數約為幾十毫摩爾,是典型的低親和高通量K+通道,對植物K+營養效率起重要作用[2-4, 6]。根據電壓依賴性和K+在跨膜過程中運動方向的不同,Shaker型K+通道可分為3種類型,即包括內向整流通道、外向整流通道和弱整通道(雙向整流通道)。SKOR是典型的外向整流K+通道[7-8],該通道負責K+通過根部木質部的長距離運輸。在擬南芥(Arabidopsisthaliana)中,SKOR通道生理功能的分子機制研究更為詳細,即AtSKOR主要位于根的中柱軸薄壁細胞中,負責將K+釋放到木質部汁液中,從而通過植物蒸騰作用轉移至地上部分,實現K+離子遠距離運輸;同時發現AtSKOR通道功能的缺失會使地上部K+含量降低50%左右,影響植物生長發育。近年來,SKOR在水稻(Oryzasativa)[8]、甜瓜(Cucumismelo)[9]、小花堿茅(Puccinelliatenuiflora)[10]和霸王(Zygophyllumxanthoxylum)[11]中得到了廣泛的研究,進一步證實了SKOR基因在維持植物體內K+穩態方面發揮關鍵作用,特別是植物在缺鉀、干旱和鹽脅迫條件下均能誘導SKOR基因表達。
啟動子位于基因的轉錄起始位點附近,為不同的轉錄因子提供不同的結合位點,這進一步促成RNA聚合酶進行基因轉錄[12-13]。不同的啟動子元件用于結合激活物或阻遏物,從而充當順式調節元件[14]。啟動子作為控制基因轉錄的開關,已成為研究基因功能的新方向。通過分析啟動子順式作用元件,可預測該基因可能具備的功能。
長穗偃麥草(Elytrigiaelongata)具有很強的抗旱耐鹽性,是小麥的近緣種,已成為改良小麥重要的野生基因庫[15],同時也是改良鹽堿土壤的理想草本植物之一。先前的研究中我們通過cDNA末端快速擴增(RACE)方法獲得了長穗偃麥草SKOR基因,鹽脅迫能誘導EeSKOR轉錄,表明EeSKOR在維持植物K+的穩態、改善植物的耐鹽性方面起著重要作用[16]。然而SKOR基因是否在長穗偃麥草生長發育中發揮其他的功能尚未知曉。本研究利用熱不對稱交錯PCR(Tail-PCR)的方法克隆了長穗偃麥草EeSKOR啟動子序列,分析該啟動子干旱誘導(PEG)、脫落酸(ABA)、水楊酸(SA)等響應元件,分析不同脅迫處理下長穗偃麥草EeSKOR的表達模式,為進一步系統研究EeSKOR功能提供理論參考。
1 材料和方法
1.1 材 料
實驗所用擬南芥野生型Columbia-0(Col-0)購自ABRC (ArabidopsisBiological Resource Center) 生物公司,長穗偃麥草(PI 531747)種子由美國國家植物種質資源庫(The U. S. National Plant Germplasm System, NPGS)提供,并參照周妍彤等[17]描述的組織培養方法獲得長穗偃麥草組培苗,生根后的組培苗置于光照16 h/8 h(白天/黑夜)、26 ℃的人工氣候室培養。
1.2 方 法
1.2.1EeSKOR啟動子的克隆以長穗偃麥草基因組DNA為模板,根據已獲得的EeSKOR基因cDNA序列,設計下游特異性套嵌引物EeSKORsp1、EeSKORsp2、EeSKORsp3(表1);使用染色體步移試劑盒(TaKaRa),按孫君[18]所用的程序進行巢式PCR。第3輪PCR獲得單一條帶,PCR產物膠回收后連入PMD20-T載體,繼而轉化大腸桿菌DH5α感受態細胞,經菌液PCR鑒定,選擇陽性菌液送至北京博睿興科生物公司測序。
1.2.2EeSKOR啟動子順式作用元件分析及表達載體構建測序結果經拼接、比對,獲得正確的EeSKOR啟動子序列,利用啟動子在線分析軟件PlantCARE和PLACE對啟動子順式作用元件進行對比分析。并根據已知的啟動子序列設計酶切引物(表1)進行PCR,分別使用Hind Ⅲ和XbaⅠ酶消化植物表達載體pBI121-GUS和PCR產物,經純化回收后構建EeSKOR啟動子驅動GUS基因表達的植物表達載體,重組植物表達載體pEeSKOR∷GUS繼而轉化農桿菌GV3301。
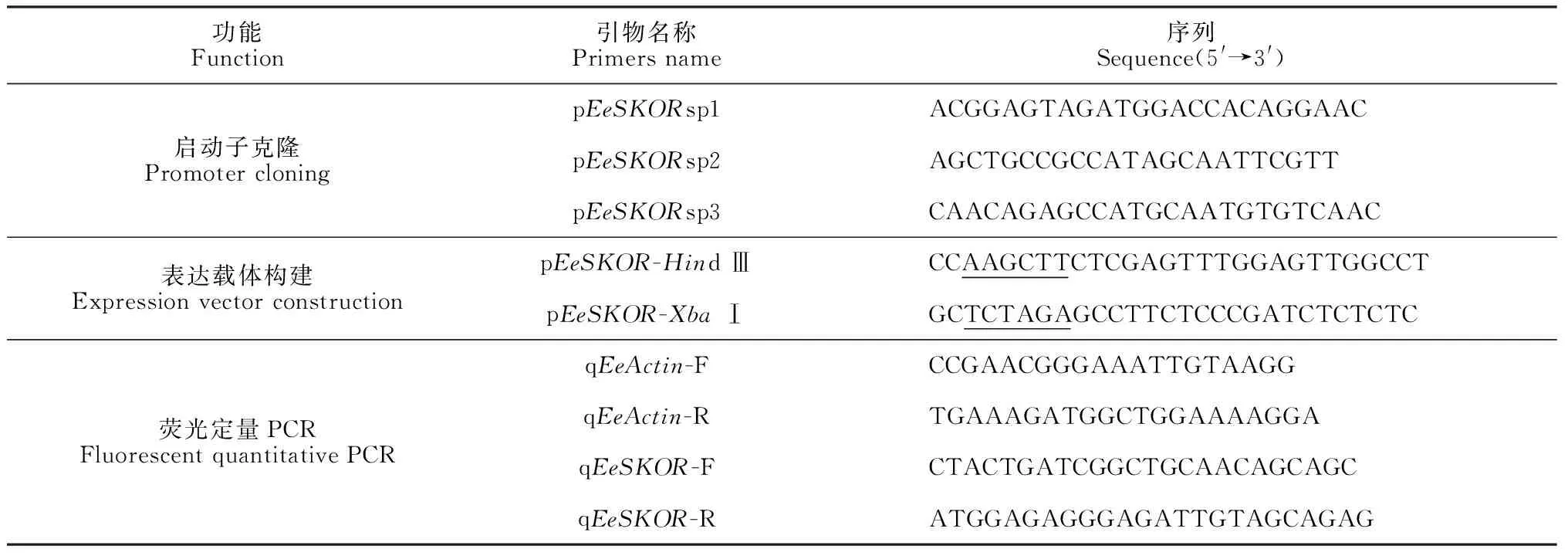
表1 本研究所用的引物序列及用途
1.2.3 農桿菌瞬時轉化擬南芥及GUS染色將含有pEeSKOR∷GUS的農桿菌接種至添加有相應抗生素的LB培養基中,于28 ℃震蕩培養至OD600值0.8,參照郭勇等[19]擬南芥瞬時轉化的方法轉化擬南芥。
GUS染色液的制備:200 mmol/L的磷酸緩沖液50 mL(pH 7.0),5 mmol/L的K3[Fe(CN)6]溶液10 mL,5 mmol/L的K4[Fe(CN)6] 溶液10 mL,100 mmol/L的Na2EDTA溶液10 mL,0.1 mL Triton-100,加入60 mg X-GLUC用蒸餾水定容至100 mL。將浸染后的擬南芥轉移至GUS染色液,37 ℃避光培養24 h。待培養完畢,棄染色液,用95%酒精脫色,觀察染色結果并拍照。
1.2.4 實時定量PCR檢測長穗偃麥草EeSKOR基因表達分別用10%聚乙二醇(PEG)、100 mmol/L氯化鈉(NaCl)、0.1 mmol/L脫落酸(ABA)和0.5 mmol/L水楊酸(SA)處理長穗偃麥草組培苗,分別取不同處理時間(0、12、24和72 h)長穗偃麥草的根,提取RNA,反轉錄成cDNA,以長穗偃麥草Actin為內參基因,使用qEeSKOR定量引物按照王琳等[20]描述的qPCR反應程序檢測EeSKOR基因的表達量,每個樣品3次技術重復,3次生物學重復。
2 結果與分析
2.1 EeSKOR啟動子克隆
通過3輪熱不對稱PCR分析,獲得約1 000 bp單一條帶(圖1,A)。該電泳條帶經膠回收,連入克隆載體。菌液PCR結果表明,該條帶已成功連接至T載體(圖1,B)。測序結果與EeSKOR基因cDNA序列比對,我們獲得了EeSKOR基因起始密碼子上游798 bp啟動子序列,命名為pEeSKOR。經NCBI網站比對分析顯示,pEeSKOR序列與中國春小麥(Triticumaestivum)、預測的節節麥(Aegilopstauschii)和預測的野生二粒麥(Triticumdicoccoides)基因存在部分高度相似序列。
2.2 啟動子作用元件分析
將pEeSKOR上傳至PLACE和PlantCARE網站對啟動子元件進行分析(圖2和表2)。該啟動子含有特異轉錄因子結合位點(MYB、MYC和BoxⅢ等)、植物激素響應元件(ABRE和TGA-element)、光響應元件(GAG-motif、CATT-motif和LAMP-element等)、組織特異的啟動元件(CAT-box、RY-element和CCGTCC-box)、脅迫響應順式元件(MBS、ARE和W box等)和核心啟動元件(TATA box和CAAT box)。
A. EeSKOR 啟動子擴增:1—3分別代表1—3輪PCR產物;B. EeSKOR 啟動子克隆載體PCR鑒定:1—6代表不同的樣品;—代表陰性對照圖1 EeSKOR啟動子克隆 A. Amplified EeSKOR promoter:1-3 represents 1-3 rounds of PCR products respectively;B. PCR identification of EeKSOR promoter cloning vector:1-6 represent different samples;— represents negative controlFig.1 Cloning of EeSKOR promoter

轉錄起始位點G標記為“+1”, 上游位置為負;黑體代表起始密碼子圖2 EeSKOR啟動子序列及調控元件The nucleotide at position “+1” is the transcription start site, the upstream of which are negative position; Bold represents the start codonFig.2 Sequence and regulatory elements of EeSKOR promoter
2.3 啟動子表達載體構建及轉化
采用雙酶切的方法,將pEeSKOR構建到pBI121-GUS植物表達載體(圖3,A),轉化農桿菌GV3101,菌落PCR及雙酶切驗證結果表明pEeSKOR已成功整合到植物表達載體中(圖3,B-C),構建好的pEeSKOR植物表達載體命名為pEeSKOR∷GUS。
通過農桿菌介導的瞬時轉化方法,pEeSKOR驅動GUS基因在擬南芥中的表達如圖4所示,在擬南芥幼苗期的葉、葉柄和根中呈藍色(圖4,A),同樣在擬南芥生殖生長期的葉、葉柄和根觀測到GUS活性(圖4,B-E),但并未在花中觀測到GUS活性(圖4,F)。
2.4 不同脅迫處理下長穗偃麥草根中EeSKOR表達分析
啟動子元件顯示pEeSKOR含有干旱誘導、ABA和SA響應元件,利用實時定量PCR檢測PEG、NaCl、ABA和SA處理下EeSKOR在長穗偃麥草組培苗根中的表達量。如圖5所示, NaCl處理下EeSKOR的表達量在12 h處下調為正常表達水平的54%,之后恢復至正常表達水平且呈上調趨勢;PEG處理下EeSKOR基因的表達量呈上調趨勢,處理的12 h并未與正常表達水平產生差異,處理24 h和72 h分別上調為正常表達水平的2.1倍和5.9倍;ABA處理下EeSKOR的表達量低于正常表達水平,且隨著處理時間增加顯著下調;SA處理導致EeSKOR表現出先上調后下調趨勢,其在12 h上調至正常表達水平的2倍,在24 h較正常水平稍有上調(1.4倍),而在72 h顯著下調至正常表達水平的44%。
3 討 論
長穗偃麥草是小麥族禾本科偃麥草屬多年生根莖疏叢型草本植物,具有較強的抗旱耐鹽性,是改良鹽堿地的理想草本植物之一,因此深入了解其耐鹽生理機制尤為重要。外整流鉀通道蛋白基因SKOR在增強植物耐鹽性方面發揮著重要作用,充分揭示SKOR基因的功能,將有針對性地通過基因工程方法對物種進行遺傳改良;而啟動子是調控基因的時空表達開關,分析啟動子順式作用元件,可以推測基因潛在的功能。本研究通過Tail-PCR技術獲得長穗偃麥草EeSKOR起始密碼子前798 bp啟動子片段,啟動子元件分析結果顯示,該啟動子含有多種順式作用元件。如組織特異的啟動元件RY-element和CAT-box、干旱誘導元件MBS、脫落酸響應元件ABRE、水楊酸響應元件TCA-element等;而啟動子區的ABA響應元件和SA響應元件與基因參與的逆境脅迫和相應激素的信號轉導相關聯[21-24],表明EeSKOR基因的表達可能受到干旱、脫落酸和水楊酸的誘導。此外,EeSKOR啟動子還含光響應元件、厭氧反應元件、傷害與病原反應元件,表明EeSKOR可能在長穗偃麥草光響應和防御機制中起作用。
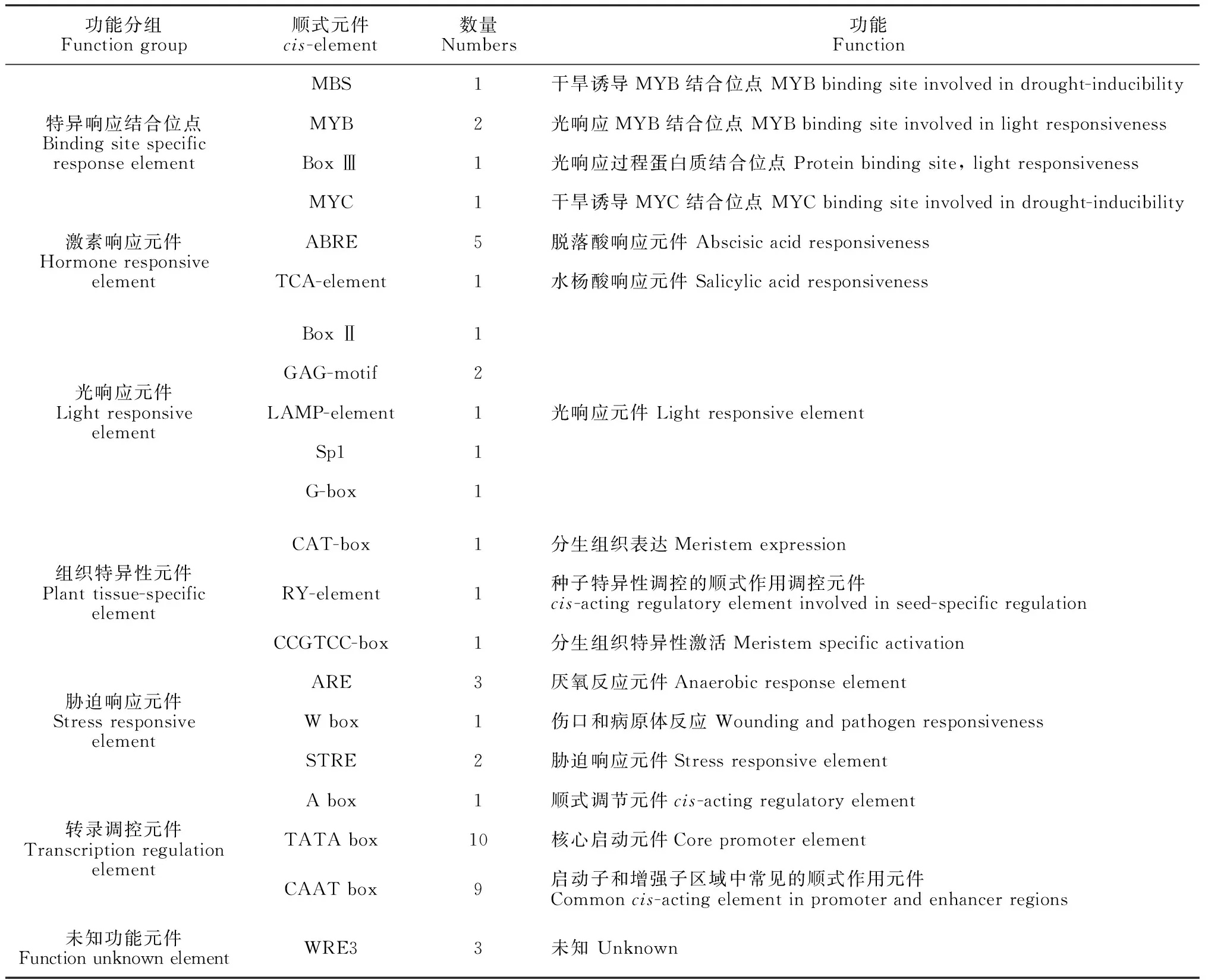
表2 EeSKOR啟動子中的順式作用元件及相關功能預測
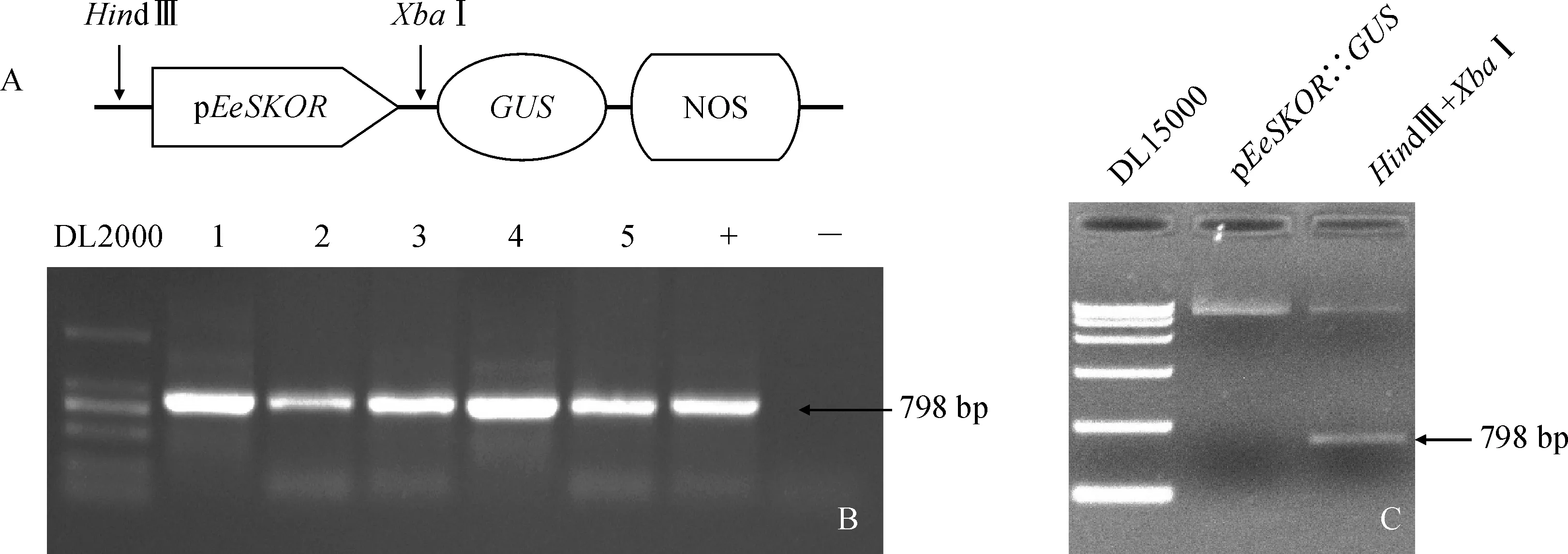
A. 表達載體示意圖;B. 表達載體菌落PCR;C. 表達載體酶切鑒定圖3 EeSKOR啟動子表達載體構建及酶切驗證A. Schematic diagram of expression vector; B. Expression vector colony PCR; C. Expression vector restriction digestion identificationFig.3 Construction of EeSKOR promoter expression vector and restriction enzyme digestion verification
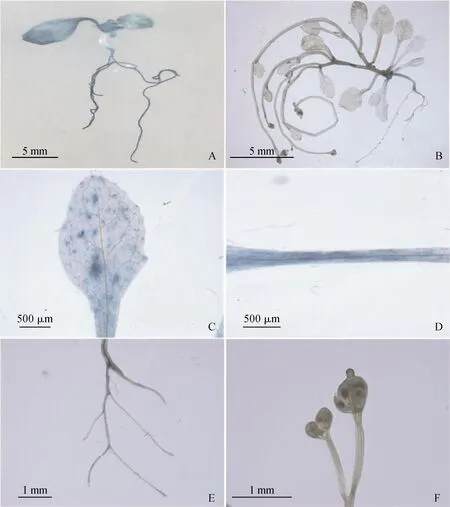
A. 幼苗期植株;B. 生殖生長期植株;C.葉片;D.葉柄;E.根;F.花序圖4 pEeSKOR∷GUS擬南芥的組織化學GUS測定A. Juvenile plants; B. Reproductive growth plants; C. Leaves; D. Petioles; E. Root; F. InflorescenceFig.4 Histochemical GUS determination of pEeSKOR∷GUS Arabidopsis thaliana
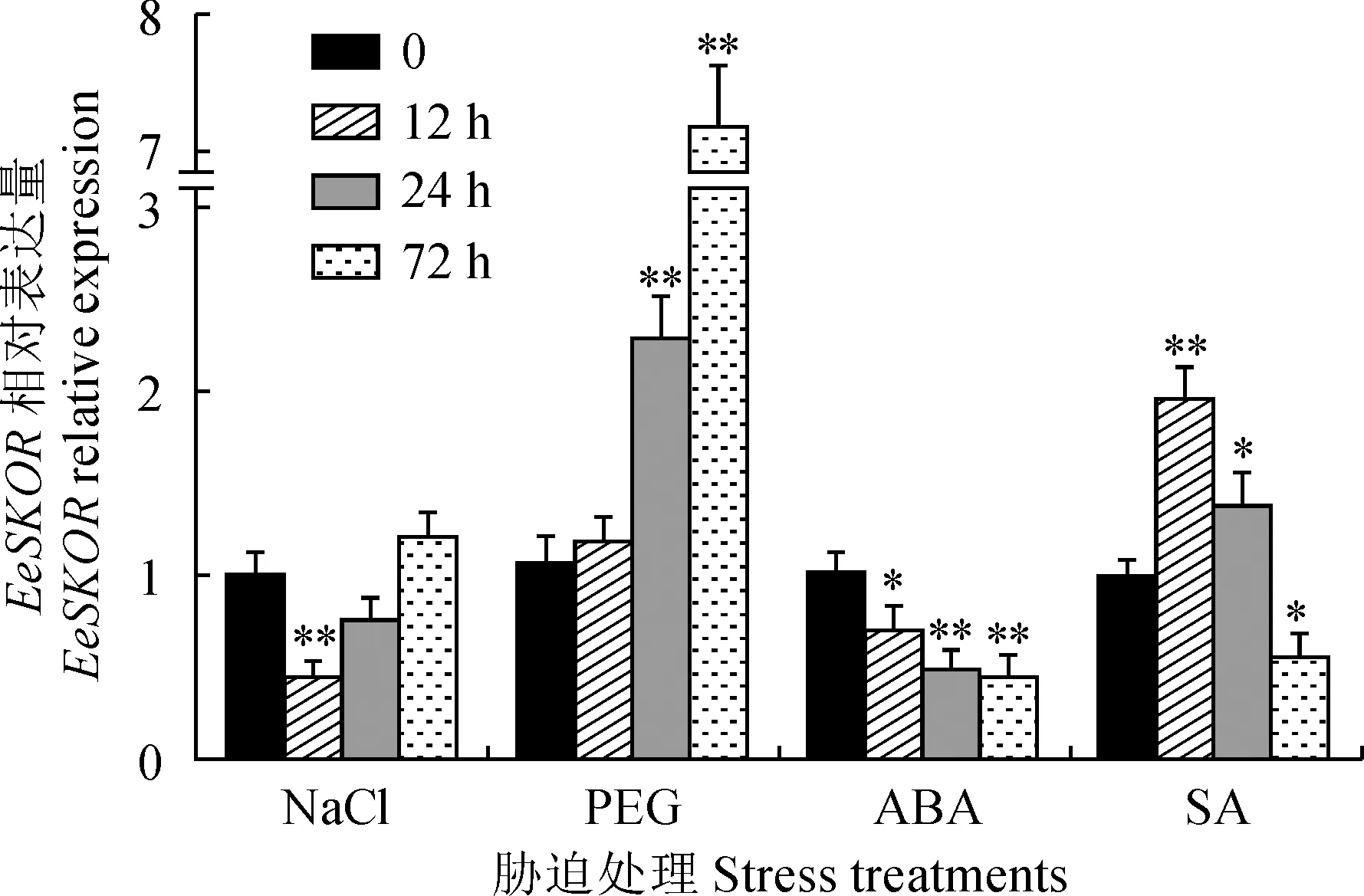
*和**分別表示處理后與未處理(0 h)間在0.05和0.01水平的差異顯著性圖5 不同脅迫處理下長穗偃麥草根中EeSKOR表達分析* and ** indicate the significance of the difference between the treated and untreated (0 h) at the levels of 0.05 and 0.01, respectivelyFig.5 Expression analysis of EeSKOR in the roots of Elytrigia elongata under different stress treatments
為了鑒定獲得的啟動子是否具備啟動轉錄活性,同時驗證EeSKOR啟動子在長穗偃麥草不同組織的表達模式。我們構建了長穗偃麥草EeSKOR啟動子驅動GUS報告基因的植物表達載體,通過農桿菌介導瞬時浸染擬南芥組織,結果顯示在幼苗和生殖生長時期,擬南芥的根、葉和葉柄均被染成藍色,且幼苗生長期的擬南芥染色程度較生殖生長期更深,表明EeSKOR可能在長穗偃麥草根、葉和葉鞘的生長發育中發揮重要作用,尤其是幼苗期。
SKOR是負責植物中K+長距離運輸的一類重要的通道蛋白,在維持植物細胞K+的穩態和抗逆性中發揮著至關重要的作用[25]。SKOR的轉錄水平極易受到各種脅迫的影響,300 mmol/L NaCl條件下,甜菜(Betavulgaris)和甜瓜根中的SKOR表達量在12、24和72 h顯著增加[9, 26], NaCl或滲透脅迫下霸王ZxSKOR在其根和莖中的轉錄水平為正常生長條件下的2.0~2.8倍[11]。基于啟動子元件分析的結果,我們檢測了NaCl、PEG、ABA和SA誘導下,長穗偃麥草根中EeSKOR的表達模式。結果顯示,NaCl處理下,EeSKOR的表達量在12 h處顯著下調后繼而恢復至正常表達水平且呈現上調趨勢,這與已報道的結果[9, 11, 25]略有差異,表明鹽處理下SKOR基因在不同物種中表達模式存在差異;PEG處理下,長穗偃麥草EeSKOR基因的表達量呈上調趨勢,且隨著時間的延長顯著上調,表明EeSKOR基因在表達模式上與其他物種SKOR具備相似的功能。高玉龍等[27]認為煙草NtSKOR1受植物激素的調控,在擬南芥[7]和灰楸樹(Catalpafargesii)[28]中SKOR的表達受到ABA的強烈抑制,我們在長穗偃麥草EeSKOR啟動子元件中發現了響應ABA的順式作用元件,在ABA處理下EeSKOR的表達量低于正常表達水平,且隨著處理時間增加顯著下調,證實了外源ABA可抑制EeSKOR表達。目前對SKOR基因的研究主要集中在干旱和鹽脅迫方面鮮有報道SKOR與水楊酸之間的關系,本研究中發現EeSKOR啟動子含有水楊酸響應元件,表明EeSKOR可能受到水楊酸的誘導,而水楊酸處理12 h和24 h后EeSKOR在長穗偃麥草根中的表達量顯著高于正常表達水平,而處理72 h的表達量顯著低于正常表達水平,呈先上調后下調的趨勢,證實了EeSKOR在長穗偃麥草響應水楊酸的過程中發揮作用。這一發現是對SKOR功能特性的重要補充,可作為探討EeSKOR基因功能的重點方向加以深入研究。

