黑果枸杞原生質體培養及植株再生
寧曉春,高思丹,楊莉娜,陳生蓉,何 濤*
(1 青海大學 生態環境工程學院,西寧 810016;2 青海省園林植物與觀賞園藝重點實驗室,西寧 810016;3 省部共建三江源生態與高原農牧業國家重點實驗室,西寧 810016;4 青海大學 農牧學院,西寧 810016)
黑果枸杞(Lyciumruthenicum),屬茄科(Solanaceae)枸杞屬(Lycium)植物,為多棘刺灌木,主要分布于西北荒漠地區,具有非常高的藥用價值、營養價值及經濟價值[1]。黑果枸杞是原花青素含量最高的天然野生果實,是最有效的原生態天然抗氧化劑[2]。果實成熟后呈紫黑色,藏藥中稱其為“旁瑪”,可清心熱,治療婦科疾病[3]。黑果枸杞果實中氨基酸種類豐富,含有7種必需氨基酸[4],對降血脂[5]、降血糖[6]、抗氧化[7]、抗腫瘤等有一定的功效。黑果枸杞抗旱性、耐鹽性較好,且高度耐貧瘠,可正常生長于沙地、鹽堿地、荒漠化地區,對水土保持、防風固沙具有重大意義[8]。近年來,隨著商業利益的驅動,野生黑果枸杞的生存空間受到嚴重威脅,野生資源遠遠滿足不了市場需求。因此,眾多學者利用人工種植、引種馴化、組織培養等方法對野生黑果枸杞的資源保護和品種改良展開研究[9-10]。
植物原生質體是去除了細胞壁的裸露細胞,在適宜培養條件下能夠細胞壁再生、分裂分化從而發育成完整植株[11]。原生質體的分離和再生在植物遺傳育種、遺傳轉化、性狀改良、分子鑒定、基因重組等領域具有重要的意義[12-14]。目前這種技術手段已成功應用于薔薇科(Rosaceae Juss.)、十字花科(Brassicaceae Burnett)、傘形科(Apiaceae)、豆科(Leguminosae sp.)、茄科(Solanaceae)等數十個科的植物中[15-19],寧夏枸杞(Lyciumbarbarum)原生質體的分離與再生已有報道[20],而與之同屬的黑果枸杞原生質體再生尚未建立成熟的實驗體系。
本研究以野生黑果枸杞無菌苗為外植體,以愈傷組織為游離材料,在獲得高產量、高活力原生質體的基礎上開展培養條件優化,并對分化得到的再生植株進行遺傳穩定性分析。此研究為原生質體水平上枸杞的生理生化和基因轉移創建了新的實驗系統,為利用體細胞雜交技術轉移野生植物抗逆遺傳性狀奠定基礎,并為枸杞優良品種的選育提供材料。
1 材料和方法
1.1 實驗材料
野生黑果枸杞(Lyciumruthenicum)采自青海省柴達木盆地都蘭縣。
1.2 實驗方法
1.2.1 愈傷組織的誘導將野生黑果枸杞種子消毒,置于不含植物生長調節劑的MS培養基中萌發,待無菌苗生長30 d后,切取葉片、葉柄及莖段作為外植體,接種于含有不同濃度2,4-二氯苯氧乙酸(2,4-D)和6-芐氨基腺嘌呤(6-BA)的MS培養基中,于24 ℃、16 h光照/8 h黑暗光周期、2 000 Lx光照強度下培養,30 d后觀察愈傷組織誘導情況。
1.2.2 原生質體的游離分別取3 g幼嫩葉片和愈傷組織(葉片、葉柄、莖段誘導得到)作為游離材料,置于10 mL酶液中(含1.5%纖維素酶,1%離析酶,0.5% 半纖維素酶,0.5 mol·L-1甘露醇,0.1% MES和0.05 mol·L-1CaCl2),在搖床上以70 r·min-1轉速25 ℃黑暗處理11 h,用150目細胞網篩過濾,洗液(含0.5 mol·L-1甘露醇,0.1% MES和0.05 mol·L-1CaCl2)洗滌,18%蔗糖純化,培養液洗滌并離心收集原生質體。
1.2.3 原生質體培養及植株再生將純化后的原生質體密度調整至104~105個·g-1左右,使用液體淺層和固液雙層兩種方式培養,培養基選用MS1和MS2(表1);24 ℃黑暗靜置培養,每2周添加1次新鮮培養基,待形成小愈傷組織后,轉移至固體培養基中培養(先弱光后正常)。30 d后,將固體培養基上生長較好的愈傷組織,轉移至含有不同濃度6-BA(0~2.0 mg·L-1)和IBA(0~0.2 mg·L-1)的MS分化培養基上,45 d后觀察不定芽的形成情況。不定芽長至2 cm左右后,移入不含植物生長調節劑的MS培養基中進行生根培養。取根系生長健壯的再生苗煉苗1周,移栽至混有營養土和蛭石(2∶1)的基質中,30 d后觀察再生植株生長情況。
1.2.4 再生植株遺傳穩定性分析(1)流式細胞儀檢測。參照高思丹等[21]的方法,以野生黑果枸杞親本植株作為參照樣本用于裂解和染色處理,植物倍性檢測試劑盒購自上海月下生物科技中心,采用美國Beckman公司的Cytoflex LX流式細胞儀,激發波長為405 nm,檢測結果用CytExpert軟件分析。
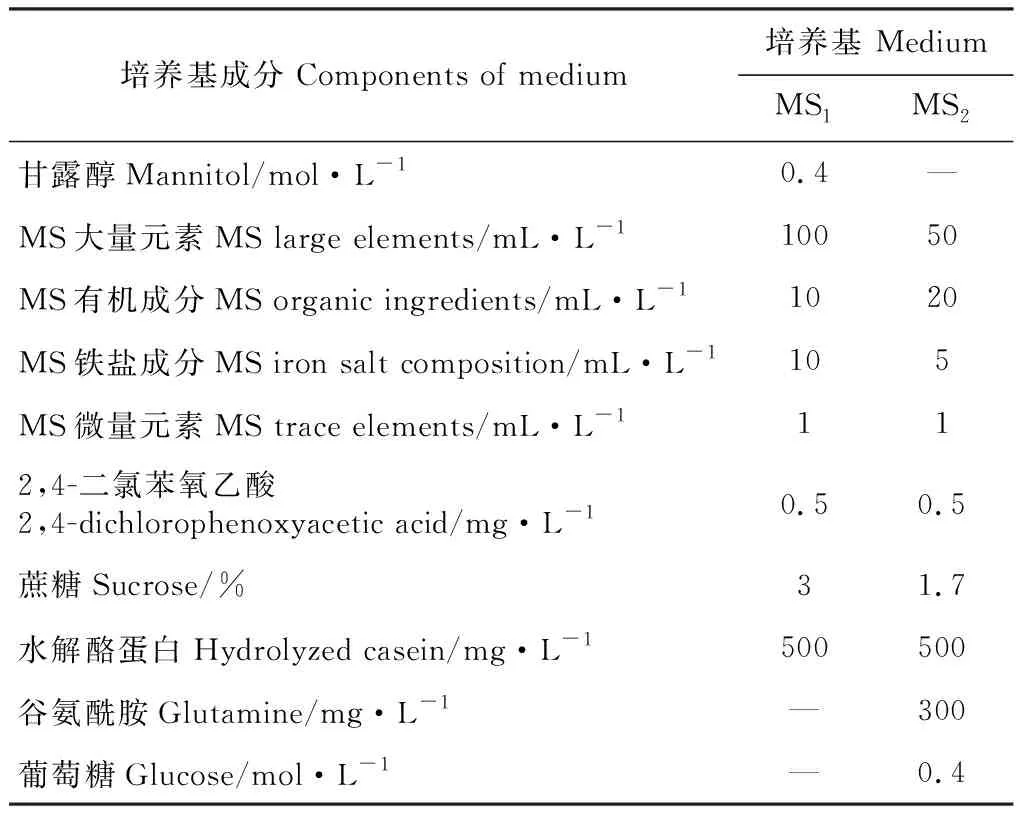
表1 原生質體培養所需培養基
(2)ISSR分子檢測。以野生黑果枸杞親本植株作為對照,隨機選取6株原生質體再生植株進行ISSR分子檢測。DNA提取采用CTAB法,引物UBC 824(TCTCTCTCTCTCTCTCG)和UBC 834(AG-AGAGAGAGAGAGAGYT)由上海生工生物工程有限公司合成,退火溫度分別為48.4和48.7℃。PCR反應程序為:94 ℃預變性5 min,94 ℃變性45 s,退火45 s,72 ℃延伸2 min,36個循環,72 ℃延伸7 min。擴增產物在1×TAE配制的1.5%瓊脂糖凝膠中進行電泳分離,電壓150 V,時間60 min。電泳結束后用凝膠成像儀拍照并分析。
1.2.5 統計分析數據處理和分析采用Excel和SAS軟件。
(1)原生質體活力檢測使用熒光雙醋酸酯(FDA)法。原生質體活力(%)=發黃綠色熒光原生質體數/視野中的原生質體總數×100%,原生質體產量(個·g-1)=(懸浮液中原生質體數/mL×總體積)/材料總鮮重(g)。
(2)倍性計算公式:待測樣本倍性=參照樣本倍性水平×(待測樣本峰熒光均值/參照樣本峰熒光均值)。
(3)ISSR只計算清晰穩定的條帶,在同一遷移率位置有譜帶記為“1”,無譜帶記為“0”,記錄譜帶構建“0,1”矩陣。
GS=2Nij/(Ni+Nj)
GS為遺傳相似系數,Nij為親本植株和再生植株中相同條帶數,Ni為親本植株條帶數,Nj為再生植株條帶數。
2 結果與分析
2.1 不同外植體愈傷組織的誘導
葉片、葉柄和莖段3種外植體在含有單一2,4-D(0.5~1.5 mg·mL-1)的MS培養基上,均可誘導出愈傷組織(表2)。葉片外植體接種2~3 d后,外植體出現卷曲(圖1,A2);15 d左右邊緣膨大,在切口周圍有愈傷組織產生(圖1,A3);25 d后,形成大量黃綠色顆粒狀愈傷組織,質地均一、松散(圖1,A4)。葉柄及莖段外植體接種后,15 d左右外植體膨大;25 d后大量愈傷組織形成,顏色較葉片愈傷組織淺,質地較松散(圖1,B4、C4)。
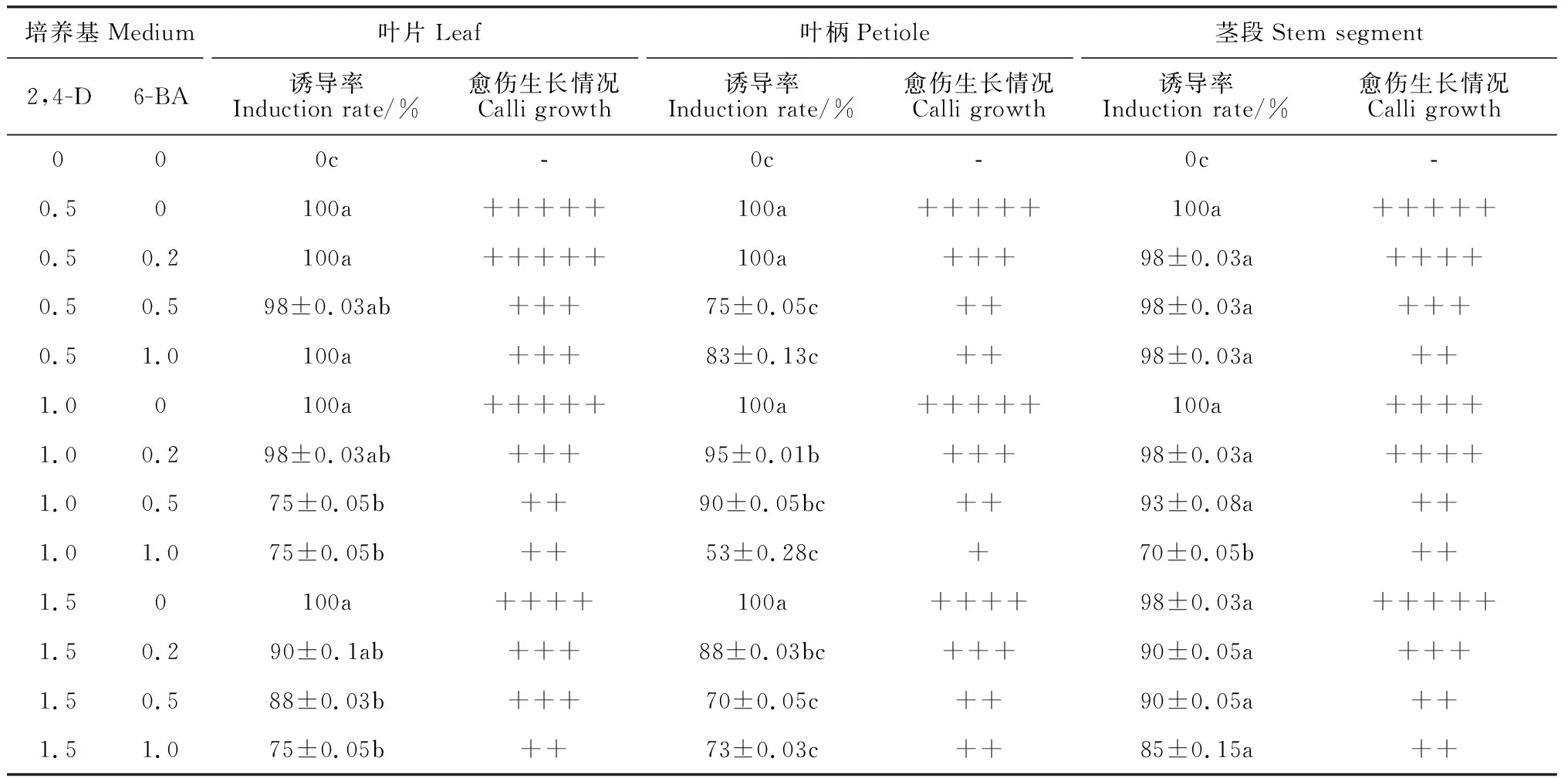
表2 不同外植體愈傷組織誘導率及生長情況
在含有2,4-D(0.5~1.5 mg·mL-1)的MS培養基中添加6-BA(0.2~1.0 mg·mL-1)后,愈傷組織的誘導率和生長情況不及只有單一2,4-D的MS培養基(表2)。在含有同一濃度2,4-D的培養基中,隨著6-BA濃度的增加,愈傷組織的誘導率下降,這一現象在葉片、葉柄和莖段外植體中均存在。在含有6-BA的MS培養基中,誘導的愈傷組織少,顏色淺,生長緩慢,質地較軟,有的褐變或水漬化(圖1)。
綜合比較,黑果枸杞葉片為誘導愈傷組織的最適外植體,含有0.5 mg·mL-12,4-D的MS培養基為誘導愈傷組織的最適培養基。在該培養條件下,愈傷組織的誘導率可達100%,愈傷組織呈黃綠色顆粒狀,質地松散,生長迅速。
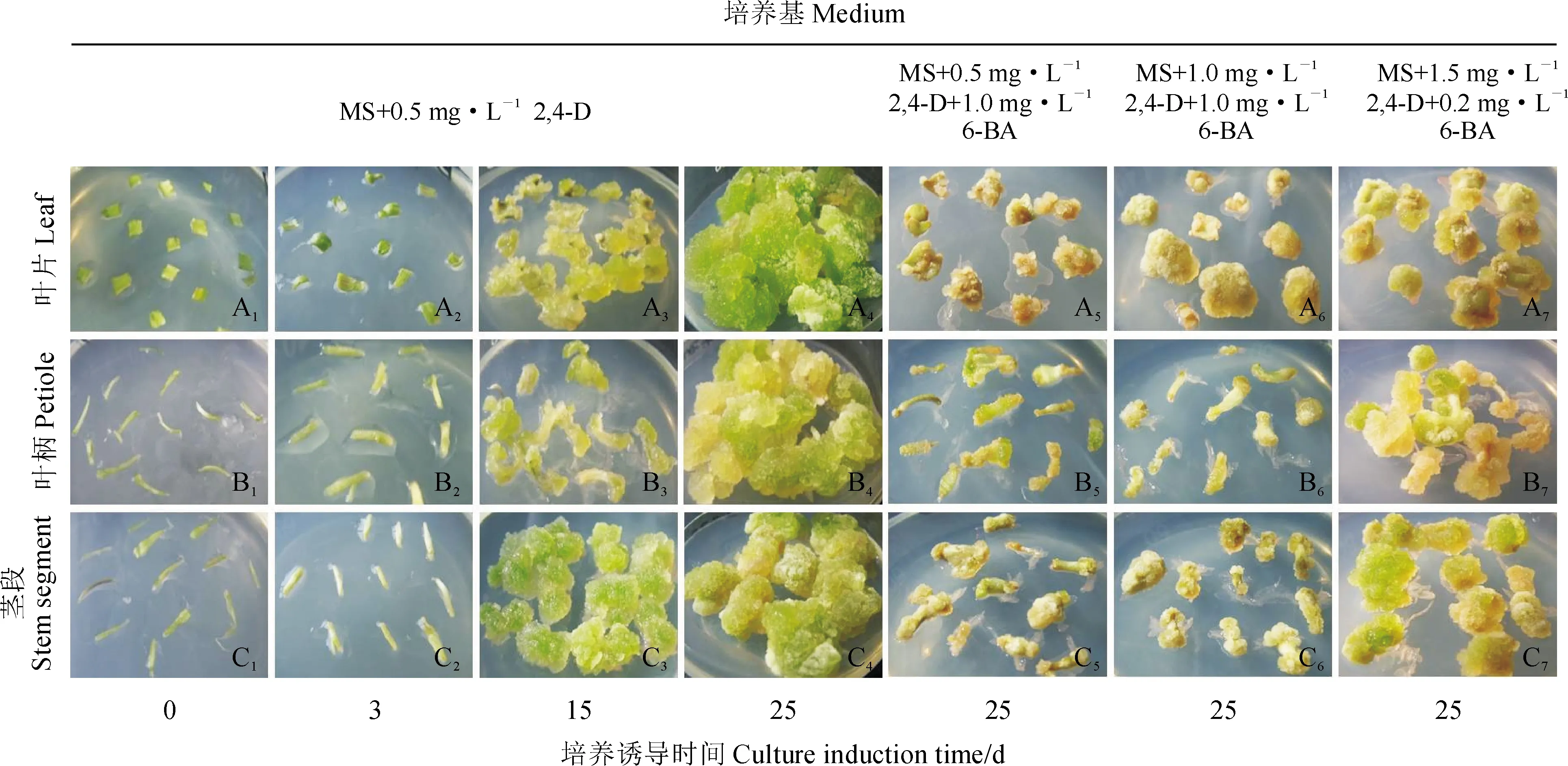
A1-A7. 葉片愈傷組織在不同培養基上處理不同天數;B1-B7. 葉柄愈傷組織在不同培養基上處理不同天數;C1-C7. 莖段愈傷組織在不同培養基上處理不同天數圖1 黑果枸杞不同外植體在不同培養基上誘導的愈傷組織A1-A7. The leaf calli were treated on different media for different days;B1-B7. The petiole calli were treated on different media for different days;C1-C7. The stem segment calli were treated on different media for different daysFig.1 Calli induced from different explants of L. ruthenicum on different media
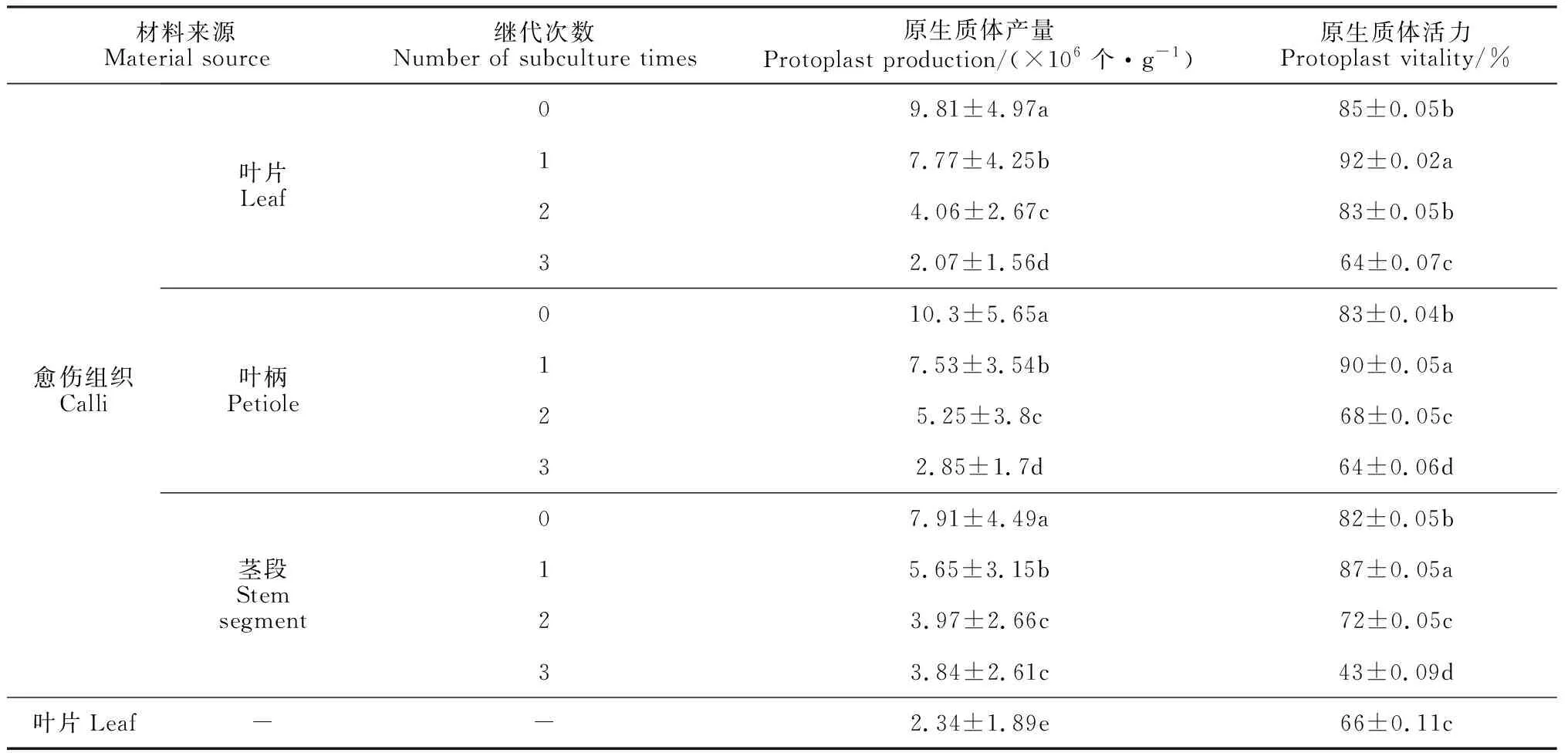
表3 不同外植體及不同繼代次數愈傷組織的原生質體產量和活力
2.2 外植體來源及愈傷組織繼代次數對原生質體游離的影響
在外植體來源上,用葉片和愈傷組織游離產生的原生質體存在顯著差異(表3)。以葉片、葉柄、莖段的愈傷組織作為外植體,繼代1次后產生的原生質體在產量和活力上均顯著高于葉片,其中葉片愈傷組織原生質體產量和活力最高,分別為7.77×106個·g-1和92%;而直接用葉片游離產生的原生質體產量只有2.34×106個·g-1,活力為66%。
在愈傷組織繼代上,葉片、葉柄、莖段的愈傷組織隨著繼代次數的增加,游離產生的原生質體產量和活力逐漸降低(表3)。繼代1次的葉片愈傷組織游離產生的原生質體產量和活力分別為7.77×106個·g-1和92%;繼代2次時,原生質體產量和活力分別下降為4.06×106個·g-1和83%;繼代3次時,原生質體產量和活力分別下降到2.07×106個·g-1和64%。綜合比較,繼代1次的葉片愈傷組織是黑果枸杞原生質體游離的最適外植體。
2.3 不同甘露醇濃度對原生質體的影響
酶液中不同甘露醇濃度對原生質體產量和活力有顯著影響(表4)。當甘露醇濃度較低時(0.3 mol·L-1),原生質體產量和活力均較低,分別只有1.44×106個·g-1和71%,且溶液中細胞團多、細胞碎片多,存在大量脫壁不全的原生質體。當甘露醇濃度為0.5 mol·L-1時,原生質體產量和活力最高,分別為7.77×106個·g-1和92%,游離產生的原生質體為規則的球形。
2.4 原生質體培養
在培養方式上,固液雙層培養優于液體淺層培養(表5)。在相同培養方式下,不同培養基(MS1、MS2)產生的培養效果也不同(表5)。以固液雙層培養為例,使用MS2培養基,2 d時出現第一次細胞分裂,培養10 d后的分裂頻率為45.9%,培養20 d后形成細胞團的比例為22.9%;而使用MS1培養基,3 d時才出現第一次細胞分裂,培養10 d后的分裂頻率為32.7%,培養20 d后形成細胞團的比例為25%。綜合比較認為,MS2-固液雙層培養適于黑果枸杞原生質體培養。在該培養方式下,培養第2天可觀察到第1次細胞分裂(圖2,D),5 d左右進行第二次細胞分裂(圖2,E),接著開始第三次細胞分裂(圖2,F),培養10 d時的分裂頻率為45.9%,14 d左右形成細胞團(圖2,G),培養20 d時形成細胞團的比例達到22.9%,此時可在培養皿中看到肉眼可見的小愈傷組織(圖2,H)。
2.5 植株再生
將培養皿中的小愈傷組織轉移至含有0.5 mg·mL-12,4-D的 MS固體培養基中(圖2,I),約30 d后形成質地松散的黃綠色愈傷組織(圖2,J);將長勢較好的愈傷組織轉移至含有1.5 mg·mL-16-BA和0.1 mg·mL-1IBA的MS分化培養基中,4周后愈傷組織分化出不定芽(圖2,K);將不定芽轉移至不含植物生長調節劑的MS固體培養基中(圖2,L),10 d左右不定芽開始生根(圖2,M);經煉苗后,將再生苗移栽至土壤基質中,再生苗可正常生長(圖2,N)。
2.6 遺傳穩定性分析
2.6.1 ISSR分子檢測對瓊脂糖凝膠電泳結果進行數據統計并分析。只對清晰條帶進行統計,UBC824引物在黑果枸杞親本植株和原生質體再生植株中共擴增出7條譜帶,其中多態性譜帶為2條(圖3,A);UBC834引物在黑果枸杞親本植株和原生質體再生植株中共擴增出9條譜帶,多態性譜帶有3條(圖3,B)。經計算,6株再生植株與親本植株之間的遺傳相似系數在0.815~0.929之間,平均遺傳相似系數為0.875,說明由原生質體培養獲得的再生植株能較好地保持親本的遺傳性狀。

表4 不同甘露醇濃度下原生質體的產量和活力
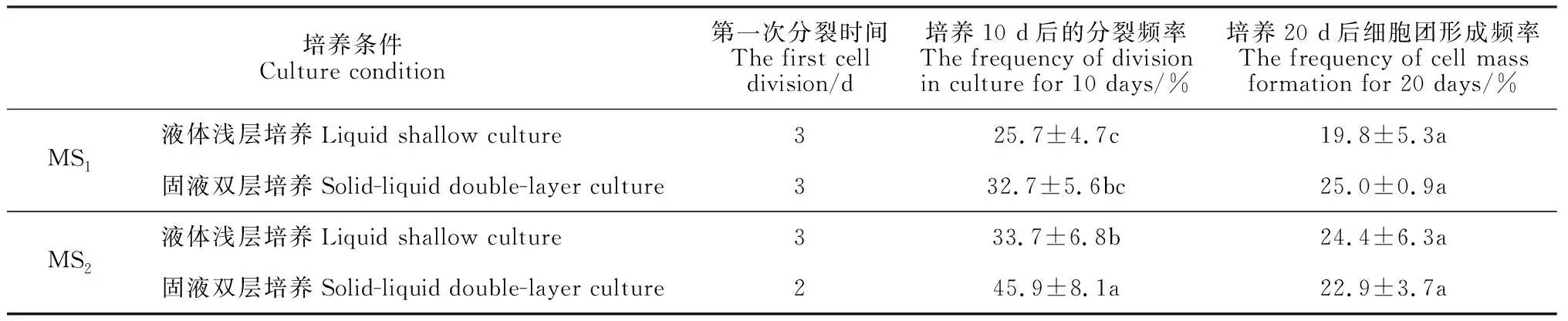
表5 不同培養條件原生質體培養
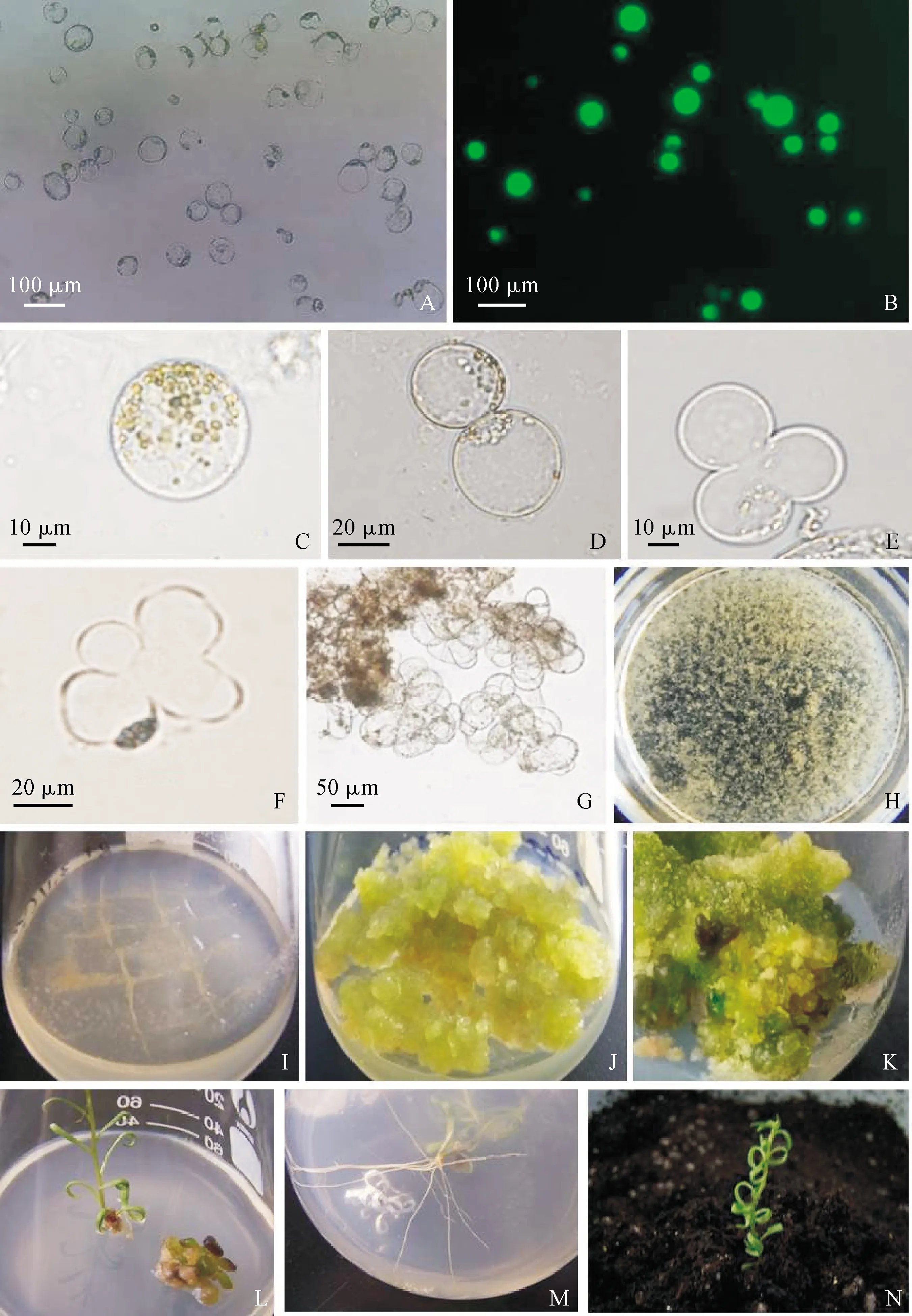
A. 黑果枸杞原生質體;B. FDA活力檢測;C. 葉片愈傷組織游離的原生質體;D. 第一次細胞分裂;E. 第二次細胞分裂;F. 第三次細胞分裂;G. 細胞團的形成;H. 小愈傷組織的形成;I. 轉移至固體培養基中的愈傷組織;J. 生長30 d的愈傷組織;K. 愈傷組織分化出不定芽;L. 原生質體再生植株;M. 再生植株生根;N. 移栽后正常生長的再生植株圖2 黑果枸杞原生質體的培養A. Protoplast of L. ruthenicum;B. Viability of freshly isolated protoplasts stained by FDA;C. Protoplast derived from leaf calli;D. The first cell division;E. The second cell division;F. The third cell division;G. Microcolony formation;H. Micro-calli formation;I. Regenerating calli transferred to the solid medium;J. Regenerating calli grown for 30 days;K. Adventitious buds differentiated by regenerating calli;L. Complete regenerated plant from protoplasts;M. Rooting of regenerated plant;N. Regenerated plants normal grow after transplantingFig.2 Protoplast culture of L. ruthenicum
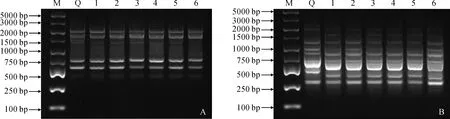
A. 引物UBC824;B.引物UBC834;M. DL5000;Q. 黑果枸杞(親本植株);1-6. 由原生質體培養獲得的再生植株圖3 野生黑果枸杞ISSR檢測結果A. Primer UBC824;B. Primer UBC834;M. DL5000;Q. L. ruthenicum (parent plant);1-6. Regenerated plant from protoplast cultureFig.3 ISSR results of L. ruthenicum
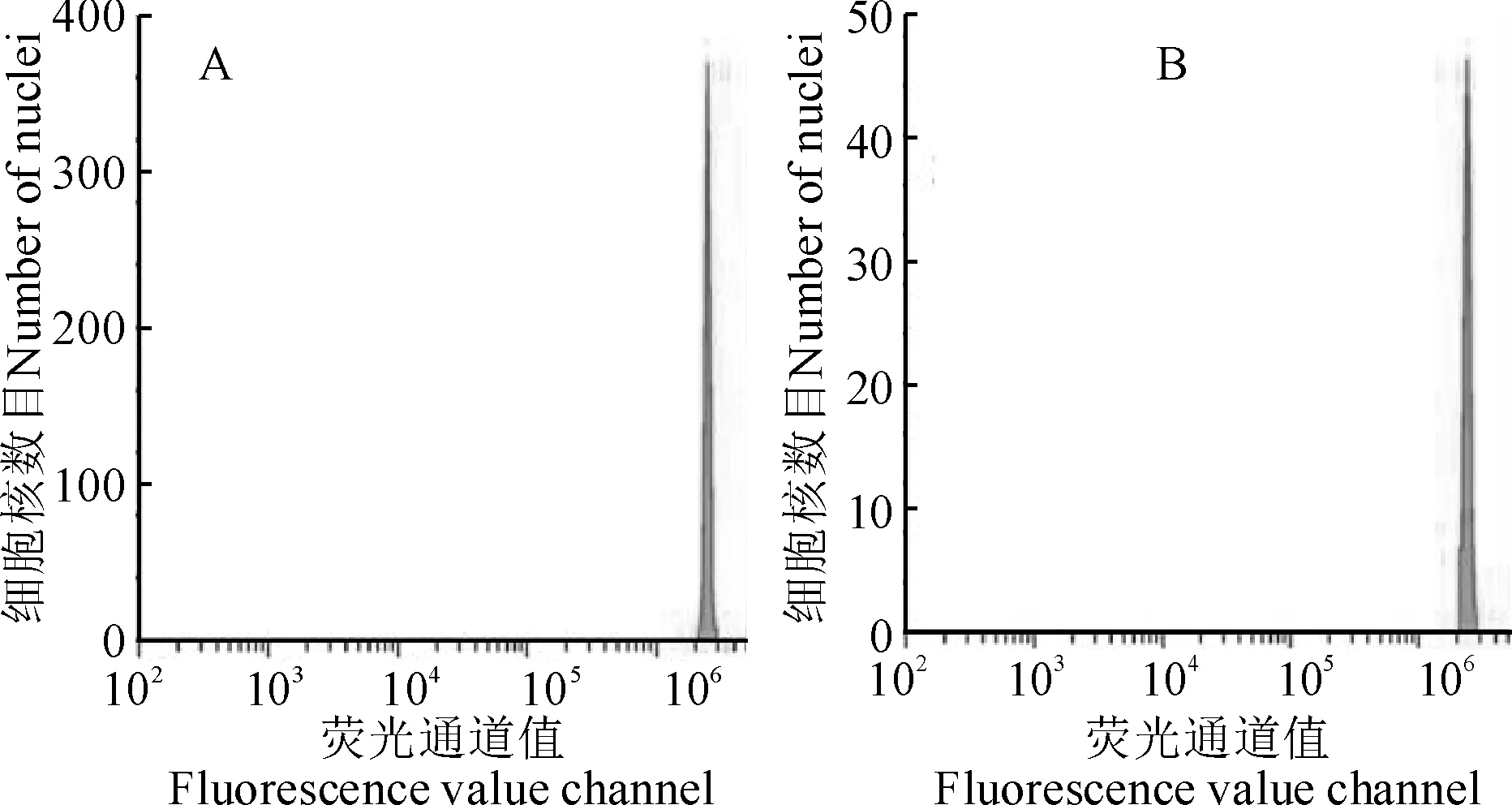
A. 親本植株(參照樣本);B. 原生質體再生植株圖4 流式細胞儀檢測結果A. Parental plant (control sample);B. Regenerated plant of L. ruthenicumFig.4 Flow cytometry test results
2.6.2 流式細胞檢測根據流式細胞儀檢測原理,峰的平均熒光強度可以反映細胞核中DNA總量的變化。結果顯示,原生質體再生植株的熒光均值為2 294 178.3,變異系數為5.67;而親本植株的熒光均值為2 387 634.8,變異系數為4.55。通過計算可知,原生質體再生植株為二倍體,與親本植株相同,在倍性上沒有發生改變(圖4)。
3 討 論
制備原生質體的材料來源是影響原生質體培養成功的關鍵因素。目前,懸浮培養或愈傷組織培養最為廣泛,相比之下,愈傷組織是建立高效原生質體分離體系的必要條件,而懸浮培養具有較高的胚胎發生能力,是極好的原生質體來源,但實驗條件要求嚴格,耗時耗力。Li等[22]首次成功建立油茶(Camelliaoleifera)懸浮培養的原生質體分離方法時是在高質量的愈傷組織基礎上進行的,Taylor等[23]發現一些品種的懸浮培養周期甚至達到10~14周,而且并不一定會獲得再生植株。本研究利用不同外植體誘導愈傷組織,在此基礎上直接分離原生質體,既縮短了培養周期,也簡便了培養方法,而且能獲得高產高效的原生質體細胞,是一種更加快捷高效的培養體系。另外,較植物本身而言,葉片組織是能夠釋放大量原生質體的寶貴材料,在原生質體培養初期為細胞密度、再生愈傷組織形成等都具有一定的貢獻。舒小娟等[24]分離葡萄(VitisviniferaL.cv.‘Heixiangjiao’)原生質體時發現葉片愈傷組織來源的原生質體產量和活力都較高;Chand等[25]分離龍葵(Solanumdulcamara)原生質體時也得出一致結論,并發現繼代3次的葉片愈傷組織產量和活力最高;本研究對比了3種不同外植體的愈傷組織,同樣發現葉片愈傷組織是分離優質原生質體的最佳材料來源,且繼代1次后的葉片愈傷組織產量和活力最高,隨著繼代次數的增加,游離得到的原生質體產量和活力逐漸降低。因此,推測愈傷組織繼代次數可影響原生質體產量和活力變化,未經繼代的初始愈傷組織因存在外植體,其愈傷組織形態多變且穩定性較差,對原生質體純化及培養形成干擾,初始愈傷組織經過1~3次繼代后逐漸穩定,且指數生長期階段的愈傷組織正處于細胞分裂旺盛期,選取該階段愈傷組織可大大提高原生質體的產量和活力,但二者存在的正相關關系還有待進一步研究證明。
原生質體培養的另一個關鍵因素是培養方法與培養基的選擇。Borgato等[26]發現利用液體淺層直接培養時,原生質體細胞壁無法再生和分裂。本研究發現液體淺層培養黑果枸杞原生質體時,細胞大多聚集于培養皿周圍,細胞團形成率相對較低,且易褐化、易污染。Yang等[27]認為雙層培養體系是棉原生質體培養的最佳方法。本研究以固液雙層的培養方法,讓原生質體在既含有液體培養基營養成分的同時又能吸收到固體培養基營養物質,同時又將次生代謝物被固體培養基所吸附,不僅迅速提高了原生質體第一次分裂時間,降低了褐化程度,而且增加了細胞的透氣性,培養效果優于單一液體淺層培養的方式。培養基成分對原生質體培養時的細胞分裂水平起關鍵作用[28],決定了離體細胞能否持續分裂并生長[29]。Xu Ziqin等[30]發現無機鹽濃度過高后原生質體在培養時出現嚴重褐變現象;Zhao Kongnan等[29]研究蕓苔屬(Brassica)原生質體時提出,添加過多氨基酸以及核苷酸等營養物質并不一定會引起原生質體的高頻率分裂,反而容易引起褐變,因此認為改良MS培養基是大多數蕓苔屬原生質體培養的最佳培養基;本研究利用MS1和MS2培養基(表1)培養黑果枸杞原生質體時改變了培養基成分,適量添加谷氨酰胺、葡萄糖等成分參與蛋白質合成及細胞代謝,有效降低了原生質體褐化,但本研究發現經過培養的原生質體分裂率保持在最高水平的狀態下時其細胞團形成率卻呈現較低水平,這可能與MS2培養基中添加的成分有很大關系,猜測黑果枸杞原生質體第一次分裂時間、培養后的分裂率及細胞團形成率都可能受MS2培養基成分的影響。
植物由親本到再生的整個過程中遺傳的完整性也十分關鍵,微小的突變很可能造成植株的遺傳變異[31]。Irene等[32]、Karp等[33]檢測原生質體培養過程中各階段DNA含量時發現愈傷增殖階段、不定芽再生階段均可能發生變異。本研究通過ISSR以及FCM技術分析再生植株時并未發現明顯變異現象,再生植株在遺傳相似系數以及倍性檢測中均與親本保持一致,但值得注意的是,高思丹等[21]研究黑果枸杞葉片再生植株時發現葉片再生植株與親本植株在DNA總量上表現出差異,這一現象在本研究結果中也有體現,推測是造成ISSR條帶部分增加或缺失的原因之一。植物體細胞發生變異一方面可培育產生新品種,另一方面為遺傳穩定性研究增加困難。遺傳穩定性研究常見的有ISSR、FCM等技術,ISSR技術在小麥(TriticumaestivumL.)、水稻(OryzasativaL.)、辣椒(CapsicumannuumL.)等多個品種的遺傳鑒定中都發揮出重要作用[34],FCM技術可清楚地體現親本植株與再生植株之間遺傳倍性的穩定性水平,可靠且快速,Jedrzejczyk等[35]、Faisal等[36]在鑒定遺傳穩定性時都用到該方法。本研究以這兩種為主要鑒定方法,發現黑果枸杞再生植株與親本植株之間有不明顯差異,再生植株由原生質體生長為完整植株的過程中,需經過細胞培養、愈傷形成以及不定芽產生等,這一系列過程都需要激素誘導,上述提到細胞在愈傷增殖階段以及不定芽再生階段都可能發生變異,因此產生這一結果可能的原因有多種,是植物激素的相互作用還是培養過程中植株本身存在的變異,需要利用細胞、分子等手段進一步研究。

