酸棗果提取物在體內外對抗生素的增效作用及機制研究
林金水,張 恒,高倩倩,王 鳳,裴永福,成娟麗*,張向前
(1 陜西省紅棗重點實驗室[延安大學],陜西延安 716000;2 延安大學 生命科學學院,陜西延安 716000)
抗生素的發現揭開了人類與病原菌戰爭的歷史,并被視為現代臨床醫學的支柱,然而隨著病原菌對抗生素耐藥性的出現,這場戰爭勝利的天平慢慢傾向病原菌,對人類健康構成了嚴重威脅[1],而2016年的聯合國首腦會議承諾將共同努力遏制耐藥菌的蔓延則更進一步說明了這個問題的嚴重性[1]。威脅人類健康的病原菌主要來自于糞腸球菌(Enterococcusfaecalis)、金黃色葡萄球菌(Staphylococcusaureus)、肺炎克雷伯菌(Klebsiellapneumoniae)、鮑曼不動桿菌(Acinetobacterbaumannii)、銅綠假單胞菌(Pseudomonasaeruginosa)、腸桿菌屬(Enterobacterspp.)和大腸桿菌(Escherichiacoli)的耐藥菌株,它們被合并簡稱為“ESKAPEE”病原體[1],具有多重耐藥性、泛耐藥性甚至全耐藥性[2-4]。而新型抗生素來源的枯竭使目前的形勢更加惡化[1,5]。這就要求我們另辟蹊徑,采用新的策略來解決這個問題。藥用植物和芳香植物被譽為生物活性化合物的儲藏庫,其提取物是解決病原菌耐藥性的有效途徑之一[1, 6-8]。這種植物提取物可以分為兩類,一是自身具有抗耐藥菌的作用,如蜀葵、山月桂、百里香和五味子等的活性提取成分對耐藥菌有良好的殺菌活性[9-10];二是本身抗菌活性不明顯,但具有顯著增強抗生素療效的作用,即抗菌增效作用[11-13]。例如,存在于蘿芙木屬植物中的吲哚類生物堿成分——利血平可通過抑制細菌細胞的Bmr外排泵來增強四環素殺菌活性[14];來源于黃連的黃連素和諾氟沙星聯合使用時,可通過抑制細菌細胞的外排泵NorA而增強諾氟沙星的殺菌作用[13];當馬齒莧的乙醇提取物和野青樹葉子的丙酮提取物或者氯仿提取物分別與紅霉素聯合使用時,都能顯著增強紅霉素對耐藥菌的殺菌能力[15-16]。此外,植物源活性提取物還可通過調節宿主的免疫能力來抵抗耐藥菌的感染,它可影響傷口愈合過程的各個階段,包括凝血、炎癥、纖維增生、上皮的形成、膠原化和傷口收縮等[17-18]。例如,南非植物馬拉馬豆中的多酚可以抑制耐藥菌的感染和促進傷口愈合[19];從谷物中提取的β-葡聚糖類具有潛在的抗感染、促進傷口愈合和免疫調節特性[20]。因此,植物提取物是抗耐藥菌活性成分重要來源之一。
酸棗[ZiziphusjujubaMill. var.spinosa(Bunge) Hu ex H. F. Chow]是鼠李科棗屬植物,酸棗果作為重要食品和/或傳統藥物具有悠久的歷史。研究表明酸棗果含有大量的生物活性化合物,如抗壞血酸、三萜酸、酚酸、氨基酸、皂苷、α-生育酚、生物堿、胡蘿卜素、腦苷脂、黃酮類化合物、多糖和礦物質成分[21]。雖然這些活性成分具有廣泛的藥理作用,如能夠增強免疫功能、抗氧化、抗炎、抗衰老、抗肥胖、抗腫瘤、抗糖尿病、護肝、抗癌和胃腸道保護等作用[22-25]。然而對于酸棗果在抗菌作用方面的關注較少。多數報道紅棗及其他品種的棗果具有抗菌作用。如來自伊朗的紅棗果乙醇提取物對枯草芽孢桿菌、金黃色葡萄球菌、大腸桿菌、銅綠假單胞菌、白色念珠菌和煙曲霉具有廣譜的抗菌活性[26];來自于阿爾及利亞蓮棗果的甲醇提取物對金黃色葡萄球菌、大腸桿菌和銅綠假單胞菌顯示出抗菌活性[27];以及來自于敘利亞蓮棗果的石油醚提取物對枯草芽孢桿菌、化膿性鏈球菌和大腸桿菌具有明顯的抑制作用[28]。而酸棗果方面僅有孫延芳等報道,分離自酸棗果的三萜皂苷具有廣譜的抗菌作用[29]。以上的研究表明棗果中普遍含有抗菌成分,而對酸棗果抗菌功能成分的研究還有待于進一步加強。
我們先前研究顯示,酸棗果的氯仿提取物具有廣譜的抗菌增效作用,并從該氯仿提取物中進一步精制得到其低極性范圍的活性組合物Fr.2a[28],發現Fr.2a不僅與多種抗生素聯用顯示出廣泛的協同抗菌作用,而且呈劑量依賴性地促進微生物生物膜的形成,降低微生物的運動性和顯著抑制牛奶中微生物的生長[28]。然而,由于Fr.2a的活性不及氯仿提取物,因此我們推測酸棗果氯仿提取物中其他極性范圍內的物質可能也具有抗菌增效活性。本研究在Fr.2a的基礎上,進一步對酸棗果氯仿提取物中其他極性范圍的抗菌増效活性物質進行分離純化,對分離到的活性物質進行組成成分鑒定、抗菌增效活性評價、抗菌增效機制研究,并探討其在制備抗皮膚耐藥菌感染藥物中的應用,旨在為酸棗果藥用產品的開發提供指導。
1 材料和方法
1.1 材料和試劑
1.1.1 主要材料酸棗果氯仿提取物(先前實驗制備[28]);銅綠假單胞菌(PseudomonasaeruginosaATCC27853)、大腸桿菌(EscherichiacoliATCC15294)、糞腸球菌(EnterococcusfaecalisATCC29212)和白色念珠菌[MoniliaalbicanCMCC(F)98001]由延安大學附屬醫院提供,耐甲氧西林金黃色葡萄球菌(Methicillin-resistantStaphylococcusaureus, MRSA)由西安交通大學基礎醫學院提供;昆明小鼠(Km)購自西安科奧生物有限公司。
1.1.2 主要培養基(1)LB培養基:NaCl 10 g/L、酵母提取物 5 g/L、胰蛋白胨 10 g/L、瓊脂粉 15 g/L,pH調至7.2,121 ℃滅菌20 min。(2)YPDA培養基:蛋白胨 20 g/L、酵母提取物 10 g/L、葡萄糖 20 g/L、腺嘌呤 0.03 g/L,pH調至6.5,115 ℃滅菌30 min。(3)高鹽甘露糖培養基:NaCl 75 g/L、蛋白胨10 g/L、D-甘露糖 10 g/L、牛肉膏 1 g/L、0.25% 酚紅、瓊脂粉 15 g/L,pH調至7.4,121 ℃滅菌20 min。
1.1.3 主要試劑胰蛋白胨、酵母提取物、TSB培養基均購自OXOID;無水乙醇、乙酸乙酯、氯仿、甲醇、石油醚均購自天津市致遠化學試劑有限公司;腺嘌呤、瓊脂粉、慶大霉素(Gentamicin Gm)、妥布霉素(Tobramycin Tob)、氨芐青霉素(Ampicillin Amp)、氯霉素(Chloramphenicol Cm)、紅霉素(Erythromycin Em)、夫西地酸(Fusidic acid Fa)、制霉菌素(Nystatin Ns)、酮康唑(Ketoconazole Kcz)、兩性霉素B(Amphotericin B Am B)購自北京索萊寶科技有限公司;堿性磷酸酶試劑盒購自南京建成生物工程研究所;紅霉素軟膏購自于新和成控股集團有限公司;莫匹羅星軟膏購自中美天津史克制藥有限公司;夫西地酸軟膏購自香港澳美制藥廠有限公司。
1.2 試驗方法
1.2.1 酸棗果氯仿提取物的分離純化及組分鑒定酸棗果氯仿提取物的制備過程按先前描述的方法執行[28]。將得到的酸棗果氯仿提取物通過硅膠柱層析技術進行分離純化,并利用GC-MS、核磁共振氫譜、紅外光譜對分離到的活性組分進行組成成分分析,酸棗果氯仿提取物的分離純化流程見圖1。稱取260 g 200~300目硅膠作為柱填料,用石油醚濕法裝入內徑為95 mm的色譜柱中,取5 g酸棗果氯仿提取物,用氯仿溶解后與95 g 100~200目的硅膠混勻,蒸干氯仿后,加石油醚濕法上樣;用石油醚、石油醚∶乙酸乙酯=100∶1、石油醚∶乙酸乙酯=10∶1、石油醚∶乙酸乙酯=1∶1、石油醚∶乙酸乙酯=1∶10、石油醚∶乙酸乙酯=1∶50、石油醚∶乙酸乙酯=1∶100、石油醚∶乙酸乙酯=1∶200、乙酸乙酯、甲醇依次洗脫,分別收集各部分洗脫相各200 mL。依次分別命名為Fr.1A、Fr.1B、Fr.1C、Fr.1D、Fr.1E、Fr.1F、Fr.1G、Fr.1H、Fr.1I、Fr.1J,旋轉蒸發濃縮后,45 ℃真空干燥洗脫液,低溫下保存。各組分抑菌試驗結果顯示抗菌増效活性成分僅存在于Fr.1G和Fr.1H。因此將 Fr.1G和Fr.1H合并且命名為Fr.A并進一步對Fr.A進行分離純化。稱取90 g 200~300目硅膠作為柱填料,用石油醚濕法裝入內徑為47 mm的色譜柱中,將樣品Fr.A用乙酸乙酯充分溶解后與20 g 100~200目的硅膠混勻,蒸干乙酸乙酯后,加石油醚濕法上樣;用石油醚,石油醚∶乙酸乙酯=100∶1、石油醚∶乙酸乙酯=10∶1、石油醚∶乙酸乙酯=1∶1、石油醚∶乙酸乙酯=1∶10、石油醚∶乙酸乙酯=1∶50、石油醚∶乙酸乙酯=1∶100、石油醚∶乙酸乙酯=1∶200、乙酸乙酯、甲醇依次洗脫,分別收集各洗脫相各100 mL。依次分別命名Fr.2A、Fr.2B、Fr.2C、Fr.2D、Fr.2E、Fr.2F、Fr.2G、Fr.2H、Fr.2I、Fr.2J,旋轉蒸發濃縮后,45 ℃真空干燥洗脫液,并在低溫保存。各組分抑菌試驗結果顯示抗菌増效活性成分僅存在于Fr.2D和Fr.2E中,故將Fr.2D和Fr.2E合并命名為Fr.B。由于繼續對Fr.B進行分離純化后得到的分離組分均無活性,因此無法對Fr.B繼續進行柱色譜分離,故確定Fr.B組分為抗菌增效活性精制物。將Fr.B送上海圭譜化工科技有限公司進行GC-MS、核磁共振氫譜和紅外光譜分析檢測。
1.2.2 酸棗果氯仿提取物分離過程中各組分的活性評價方法將過夜培養的供試菌株稀釋至1×106CFU/mL;經過柱層析分離后得到的分離組分,使用無水乙醇溶解并分別配制成濃度為2 560、1 280、640、400、320、200、160、100、80、50、40、20、1、0.55和0.25 mg/mL的母液。以最大溶解度配制慶大霉素(Gm)、妥布霉素(Tob)、氨芐青霉素(Amp)、氯霉素(Cm)、紅霉素(Em)、夫西地酸(Fa)、制霉菌素(Ns)、酮康唑(Kcz)和兩性霉素B(Am B)的母液,其中Em、Cm、Kcz用無水乙醇配制,Fa、Am B用DMSO配制,其他抗生素用無菌水配制,使用培養基將配置好的各種抗生素分別均稀釋至濃度為4 096 μg/mL的母液,過濾除菌后備用。使用一次性無菌96孔板進行藥敏實驗。對于單獨藥敏實驗,先向96孔板中每個孔加入100 μL LB或YPDA培養基,在第一個孔內加入100 μL濃度為4 096 μg/mL的抗生素,混勻后再從中吸出100 μL到第二個孔內,依次類推,使抗生素終濃度依次稀釋2倍,再向每孔中加入100 μL 濃度為1×106CFU/mL的菌液(由于各分離組分的水溶性較差,單獨藥敏實驗時先向96孔板中每孔加入100 μL LB或YPDA培養基,再向每孔中加入100 μL 濃度為1×106CFU/mL菌液,然后直接向每孔中加入10 μL各分離組分的不同濃度母液)。對于聯合藥敏實驗,在單獨藥敏實驗的基礎之上再在每孔中加入10 μL處理好的組分。設立陽性對照為100 μL菌液加100 μL培養基,陰性對照為200 μL培養基(實驗中加入的無水乙醇不影響微生物的生長及抗生素對微生物的抑制作用)。將96孔板放置于37 ℃培養箱中培養24 h,觀察結果。用“-”表示陰性,孔清亮,用“+”表示陽性,孔混濁。MIC為能夠抑制微生物生長、繁殖的最低藥物濃度,即用肉眼觀察,無微生物生長的藥物最低濃度孔。FIC[28]是指在2種或多種藥物同時使用的情況下,各種藥物的聯合用藥時的最小抑菌濃度(MIC)與單獨用藥時的MIC的比值之和。FIC≤0.5認為藥物之間具有協同作用;FIC在0.5~4.0之間則認為藥物之間無相關作用;FIC>4.0則認為藥物之間具有拮抗作用。
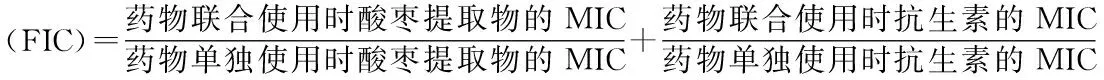
1.2.3 時間-殺傷曲線測定時間-殺傷曲線實驗改進自先前描述的方法[30]。挑取單菌落于新鮮液體培養基中(MRSA用LB液體培養基培養,白色念珠菌用YPDA液體培養基培養),37 ℃、200 r/min過夜培養。按1∶100的比例轉接入新的液體培養基中,培養至OD600為0.6,使用新鮮液體培養基稀釋菌液,使其菌液最終濃度為2.0×105CFU/mL,分別加入抗生素溶液,使得抗生素終濃度為Tob =64 μg/mL、Amp=256 μg/mL、Em=256 μg/mL、Cm=8 μg/mL、Gm=64 μg/mL、Fa=0.125 μg/mL、Kcz=4 μg/mL和Am B=1 μg/mL(此濃度為相應抗生素對MRSA或白色念珠菌的MIC)或者加入含有相同濃度的抗生素與終濃度5 mg/mL的Fr.B混合溶液,37 ℃、200 r/min搖床中培養。每隔1 h取樣100 μL,依次十倍稀釋涂布于LB或YPDA平板上,進行菌落計數,實驗設3個生物學重復。繪制時間-殺傷曲線曲線:y軸為微生物菌數CFU/mL,x軸為間隔1 h的時間。
1.2.4 Fr.B對MRSA菌株細胞壁通透性的影響細胞壁通透性實驗改進自先前描述的方法[31]。挑取MRSA單菌落置新鮮LB液體培養基中,37 ℃、200 r/min培養過夜。將MRSA菌液按1∶100的比例轉接入新的LB液體培養基中,待培養至OD600=0.6時分別設置加入終濃度為5 mg/mL Fr.B、1%紅霉素(Em)和5 mg/mL Fr.B+1% Em等3種處理,加入無水乙醇作為空白對照組。每組實驗設3個平行重復。37 ℃、120 r/min搖床中培養,每隔2 h取樣,4 500 r/min離心10 min,取上清,即為待測液。按南京建成生物工程研究所的堿性磷酸酶試劑盒操作步驟進行堿性磷酸酶酶活測定。
1.2.5 Fr.B對MRSA菌株培養液中電導率和核酸大分子含量的影響電導率和核酸大分子含量的測定實驗改進自先前描述的方法[32-33]。挑取MRSA單菌落于新鮮LB液體培養基中,37 ℃、200 r/min培養過夜。將MRSA按1∶100的比例轉接入新鮮的LB液體培養基中,當培養至OD600為0.8時,4 500 r/min離心10 min收集細胞。將收集的細胞用PBS緩沖液洗滌2次,最終用PBS懸浮并使菌液的濃度為1.0×107CFU/mL,設置加入終濃度為5 mg/mL Fr.B、1% 紅霉素(Em)和5 mg/mL Fr.B+1% Em等3種處理,以無水乙醇為空白對照組。37 ℃、120 r/min培養,每隔2 h取樣,4 000 r/min離心10 min,取上清,即為待測液。用5%葡萄糖將上清液稀釋20倍后,測定其電導率,實驗重復3次,取平均值。用酶標儀于260 nm下測定上清液中核酸大分子的吸光值,重復3次,取平均值。
1.2.6 紅霉素+Fr.B最佳配比的篩選將終濃度1%、0.1%、0.01%、0.05%、0.04%、0.03%、0.02%與0.01% 的紅霉素和終濃度5 mg/mL的Fr.B單獨或者聯合使用,對MRSA菌株進行時間-殺傷曲線的測定,從中篩選出Fr.B與紅霉素最合適的配比。
1.2.7 軟膏的制備及軟膏體內活性檢測紅霉素軟膏購自于新和成控股集團有限公司,主要成分為1%紅霉素及輔料(凡士林和液體石蠟)。軟膏制備:(1)藥物聯用軟膏的制備:稱取21 g凡士林、8 g液體石蠟,水浴加熱約至60 ℃,使基質完全熔化,并攪拌均勻。稱取1 g紅霉素溶于1 mL的無水乙醇中,稱取0.5 g Fr.B溶于1 mL的無水乙醇中,各準備2份,備用。在50 ℃時,向基質中分別加入配制好的Fr.B溶液或Fr.B+紅霉素溶液,使其紅霉素濃度為1%,Fr.B濃度為0.5%,順時針攪拌至均勻,同時將混合體系溫度降至室溫。以基質作為空白對照,基質中加入Fr.B溶液的命名為Fr.B軟膏,基質中加入紅霉素+Fr.B混合物溶液的命名為“抗霸”軟膏。將配制好的軟膏分裝。(2)單一藥物軟膏的制備及混用:稱取0.5 g Fr.B溶于1 mL的無水乙醇中,備用。稱取21 g凡士林、8 g液體石蠟,水浴加熱約至60 ℃,使基質完全熔化、并攪拌均勻。在50 ℃時,向基質中加入配制好的Fr.B溶液,使得Fr.B濃度為1%,順時針攪拌至均勻,同時將混合體系溫度降至室溫,分裝,得到1%的Fr.B軟膏。稱取21 g凡士林、8 g液體石蠟,水浴加熱約至60 ℃,使基質完全熔化、并攪拌均勻。將市場銷售的1% 紅霉素軟膏與基質1∶9混合,待基質降溫凝固,配制成0.1% 紅霉素軟膏,分裝。使用時將上述不同軟膏按1∶1比例混合,配制成基質+1% 紅霉素軟膏(含終濃度為0.5% 的Em)、基質+0.1% 紅霉素軟膏(含終濃度為0.05% 的Em)、 Fr.B軟膏+1% 紅霉素軟膏(含終濃度為0.5% 的Fr.B+0.5%的Em)、Fr.B軟膏+0.1% 紅霉素軟膏(含終濃度為0.5% 的Fr.B+0.05%的Em)。
軟膏的體內活性檢測:體內動物實驗研究獲得延安大學實驗動物科技中心批準,所有動物實驗程序均按照中國國家衛生研究院實驗室動物護理原則的指南進行。
1) 傷口感染模型建立 用昆明小鼠(Km)作為實驗動物,選取體重為25~27 g的小鼠,針對藥物聯用軟膏的處理分為8組,分別為無傷口組、傷口無感染組、傷口感染組(空白對照組)、紅霉素軟膏組(含終濃度為1% 的Em)、抗霸軟膏組(含終濃度為0.5% 的Fr.B+1%的Em)、Fr.B軟膏組(含終濃度為0.5%的Fr.B)、夫西地酸軟膏組(含終濃度為2%的Fa)、莫匹羅星軟膏組(含終濃度為2%的Mu)(每個實驗每組6只小鼠);針對單一藥物軟膏混用的處理分為7組,分別為基質組(空白對照)、紅霉素軟膏組(含終濃度為1% 的Em)、基質+1% 紅霉素軟膏(含終濃度為0.5% 的Em)、基質+0.1% 紅霉素軟膏(含終濃度為0.05% 的Em)、Fr.B軟膏組(含終濃度為0.5%的Fr.B)、Fr.B軟膏+1% 紅霉素軟膏(含終濃度為0.5% 的Fr.B+0.5%的Em)、Fr.B軟膏組+0.1%紅霉素軟膏(含終濃度為0.5% 的Fr.B+0.05%的Em)(每個實驗每組6只小鼠),飼養2周,讓小鼠適應環境。制備MRSA菌懸液:將培養至OD600=0.6時MRSA菌液,4 000 r/min離心10 min收集細胞,在PBS中洗滌2次后用PBS重新懸浮細胞并稀釋至1.0×106CFU/mL個細胞,備用。小鼠感染模型建立:使用乙醚輕微麻醉小鼠,皮下注射5%的水合氯醛(250 μL/20 g),待小鼠完全昏迷后,對小鼠背部進行剃毛,再使用6 %的硫化鈉徹底脫毛。使用鑷子夾取少量皮膚,用剪刀剪出傷口(10 mm×10 mm)。接著皮下注射0.8 mL的葡萄糖,以維持小鼠生命體征。最后將制備好的MRSA細胞懸浮液淋灑至小鼠傷口處,接觸感染2 h,建立感染模型,對小鼠傷口進行拍照記錄。
2) 動物局部治療 細菌接觸小鼠傷口感染2 h后,感染模型建立成功。接下來對小鼠進行初步治療,除無傷口組,傷口無感染組不給予任何治療外,給其他每組小鼠傷口涂抹0.1 g相應的軟膏,每天涂抹2次相應藥物至小鼠傷口處,連續涂抹5 d,并每天觀察記錄小鼠生命體征。
3) 指標測定 小鼠體重監測:每天觀察并對小鼠進行稱重,用于評價建立的小鼠模型。傷口組織菌落計數:小鼠連續給藥4 d后,對部分小鼠安樂死,用無菌剪刀剪取傷口處皮膚組織,稱重,將其懸浮在400 μL PBS中并搞碎成勻漿,采用連續十倍稀釋法稀釋勻漿液,涂布至高鹽甘露糖培養基(金黃色葡萄球菌的選擇性培養基)上,37 ℃培養箱培養48 h,菌落計數。評估傷口愈合情況:監測小鼠傷口愈合情況,分別在第0、2、6、10天拍攝小鼠傷口的照片,并用ImageJ軟件測量小鼠傷口面積的大小。第0天的傷口面積被認為是100%,每只小鼠的傷口面積被測量、記錄并計算傷口面積占第0天傷口面積的百分比。
1.3 統計分析
所有實驗至少設3個生物學平行并且獨立重復2次,所有數據均表示為平均值“±”標準偏差。用Student’s t-test(雙尾不配對)對進行顯著性分析。用GraphPad Prism version 5.00 軟件(GraphPad software Inc.; San Diego,CA,USA)進行統計學分析并作圖。P值<0.05代表差異顯著。
2 結果與分析
2.1 以抗菌增效活性為導向的酸棗果氯仿提取物的分離純化及組成成分分析
在Fr.2a的基礎上,本研究采取硅膠柱層析技術對氯仿提取物進一步分離純化。按照圖1方法依次洗脫得到了Fr.1A、Fr.1B、Fr.1C、Fr.1D、Fr.1E、Fr.1F、Fr.1G、Fr.1H、Fr.1I與Fr.1J等10個洗脫液,分別對它們進行抗菌增效活性評價。結果表明,其中僅有5 mg/mL的Fr.1G、Fr.1H可使Amp對銅綠假單胞菌的MIC由1 024 μg/mL下降至2 μg/mL,而其他組分均不能增強Amp的抑菌作用。由于單獨使用時,Fr.1G、Fr.1H對銅綠假單胞菌的MIC均為128 mg/mL,Amp對銅綠假單胞菌的MIC大于1 024 μg/mL,兩者的FIC=5/128+2/1024=0.04<0.5,從而得出Fr.1G、Fr.1H分別與Amp聯合使用時均能增強Amp對銅綠假單胞菌的抑制作用,于是將有活性的Fr.1G和Fr.1H合并,并命名為Fr.A。
對Fr.A進行硅膠柱層析分離純化,按照圖1洗脫順序依次洗脫,分別得到組分Fr.2A、Fr.2B、Fr.2C、Fr.2D、Fr.2E、Fr.2F、Fr.2G、Fr.2H、Fr.2I與Fr.2J,對這些組分依次進行體外抗菌增效活性評價。結果表明,僅有Fr.2D、Fr.2E組分能顯著增強Amp對銅綠假單胞菌的抑制作用,10 mg/mL的Fr.2D可使Amp對銅綠假單胞菌的MIC由1 024 μg/mL下降至4 μg/mL。由于單獨使用時,Fr.2D對銅綠假單胞菌的MIC為64 mg/mL,而Amp對銅綠假單胞菌的MIC大于1024 μg/mL,由此可得到FIC=10/64+4/1024=0.16<0.5;10 mg/mL的Fr.2E可使Amp對銅綠假單胞菌的MIC由1 024 μg/mL下降至1 μg/mL;由于單獨使用時,Fr.2E對銅綠假單胞菌的MIC為64 mg/mL,而Amp對銅綠假單胞菌的MIC大于1 024 μg/mL,由此可得到FIC=10/64+1/1024=0.16<0.5。上述結果表明,Fr.2D和Fr.2E均具有較好的抗菌增效活性,因此將Fr.2D和Fr.2E合并,并命名為Fr.B。由于繼續對Fr.B進行分離純化后得到的分離組分均無活性,因此無法對Fr.B繼續進行柱層析分離,故確定Fr.B組分為抗菌增效活性精制物,其產率高達44.86%,同時這也暗示Fr.B的抗菌增效活性可能是多種成分協同起作用的結果。
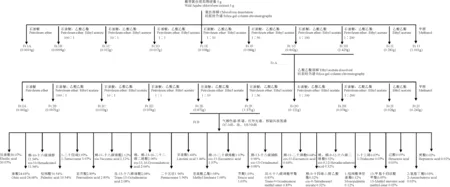
圖1 酸棗果氯仿提取物分離純化流程圖Fig.1 Flow chart of separation and purification of chloroform extracts from sour jujube fruit
為了確定Fr.B中包括哪些化學成分,本研究對Fr.B進行GC-MS組分成分分析。經過GC-MS分析可知(圖1)Fr.B中主要含有30.07% 反油酸、24.68% 油酸、11.54% 順-10-十六碳烯醇、10.54% 棕櫚酸、3.97% 1-二十四烯、2.89% 巖芹酸、2.12% 順-11-十八碳烯酸、2.08% 反-13-十八碳烯酸、2.06% 順, 順-13, 16二十二碳二烯酸、1.96% 二十五烷、1.44% 亞油酸、1.08% 亞油酸甲酯、1.07% 順-11-二十碳烯酸、1.05% 芥酸、0.98% 順-13-十八碳烯醛、0.85% 反-9-十八碳烯酸甲酯、0.64% 順-11二十烯酸、0.32% 順-9-十四碳烯-1-醇乙酸酯、0.32% 順, 順-9, 12-十六碳二烯酸、0.12% 1-棕櫚酸單甘油酯、0.07% 1-十三烯、0.05% 13-甲基十四烷酸甲酯、0.05% 己酸、0.03% 2-氨基丁酸和0.02% 庚酸等化學成分。
為了驗證GC-MS分析的結果,對Fr.B進行紅外光譜分析(圖2,A)和核磁共振氫譜分析(圖2,B)。圖2,A顯示,3 453 cm-1為羥基吸收振動吸收峰,2 923、2 853 cm-1為飽和亞甲基、甲基吸收峰,1 743 cm-1為酯基-COO-吸收峰。1 376、1 456 cm-1為CH(面內)彎曲振動吸收峰,1 688 cm-1為羰基伸縮振動吸收峰,1 158 cm-1為和羧基相連的-CR不對稱伸縮振動吸收峰。紅外光譜分析的結果說明Fr.B主要由脂肪酸類化合物組成,這與GC-MS分析的結果一致。圖2,B顯示,化學位移0.5~2.8 ppm為典型的脂肪鏈甲基亞甲基上的氫,3.8 ppm為甲酯甲氧基上的氫,4.0~4.2 ppm為和氧相連的碳上的氫,包括和羥基相連的亞甲基和次甲基上的氫,5.3 ppm為碳碳雙鍵上的氫,7.1 ppm為氘代試劑的峰,表明Fr.B主要由脂肪酸類化合物組成,這與GC-MS分析的結果一致。紅外光譜和核磁共振氫譜分析結果證明,GC-MS分析鑒定出的Fr.B的化學組成成分的結果是可靠的。
2.2 Fr.B的廣譜抗菌增效活性及其作用機制分析
前面的研究表明Fr.B能增強Amp對銅綠假單胞菌的抑制作用。為驗證Fr.B是否也能增強其他抗生素對細菌、真菌的抗菌作用。本研究將Fr.B與其他抗生素聯合使用對多種供試細菌或真菌的體外抗菌增效活性進行評價,結果如表1和表2所示。10 mg/mL Fr.B與慶大霉素(Gm)、妥布霉素(Tob)、氨芐青霉素(Amp)和紅霉素(Em)等4種抗生素分別聯合使用時,對銅綠假單胞菌和糞腸球菌的FIC均小于0.5,顯示出明顯的協同抗菌作用(Fr.B對銅綠假單胞菌和糞腸球菌的MIC均為64 mg/mL);對于大腸桿菌(Fr.B對大腸桿菌的MIC為64 mg/mL),10 mg/mL Fr.B與Tob和Em分別聯用時顯示出協同抗菌作用(FIC均小于0.5);對于耐甲氧西林金黃色葡萄球菌(MRSA)(Fr.B對MRSA的MIC為16 mg/mL),5 mg/mL Fr.B與Gm、Tob、Amp、Em、夫西地酸(Fa)和氯霉素(Cm)分別聯用時顯示出協同抗菌作用(FIC均小于0.5);對于白色念珠菌(Fr.B對白色念珠菌的MIC為64 mg/mL),5 mg/mL Fr.B與酮康唑(Kcz)和兩性霉素B(Am B)分別聯用時顯示出協同抗菌作用(FIC均小于0.5)。這些結果表明Fr.B顯示出廣譜抗菌增效活性。
通過聯合抑菌試驗發現,5 mg/mL的Fr.B能夠顯著增強多種抗生素對MRSA和白色念珠菌的抑制作用(表1和表2)。為了進一步探究Fr.B的抗菌增效活性,我們通過時間-殺傷曲線來進一步分析Fr.B與抗生素聯用對MRSA菌株和白色念珠菌的協同殺菌活性。Fr.B分別與Tob、Fa、Cm、Em、Amp和Gm等抗生素聯用時均能顯著增強它們對MRSA菌株的殺菌作用,其中對Tob、Fa、Cm、Em和Amp的増效作用尤為明顯(圖3,A);同樣, Fr.B分別與Kcz和Am B聯合使用時也均能顯著增強它們對白色念珠菌的殺菌活性(圖3,B),這與前面聯合抑菌試驗的結果相一致。這些結果表明Fr.B能協同抗生素增強其對MRSA菌株與白色念珠菌的殺菌作用。
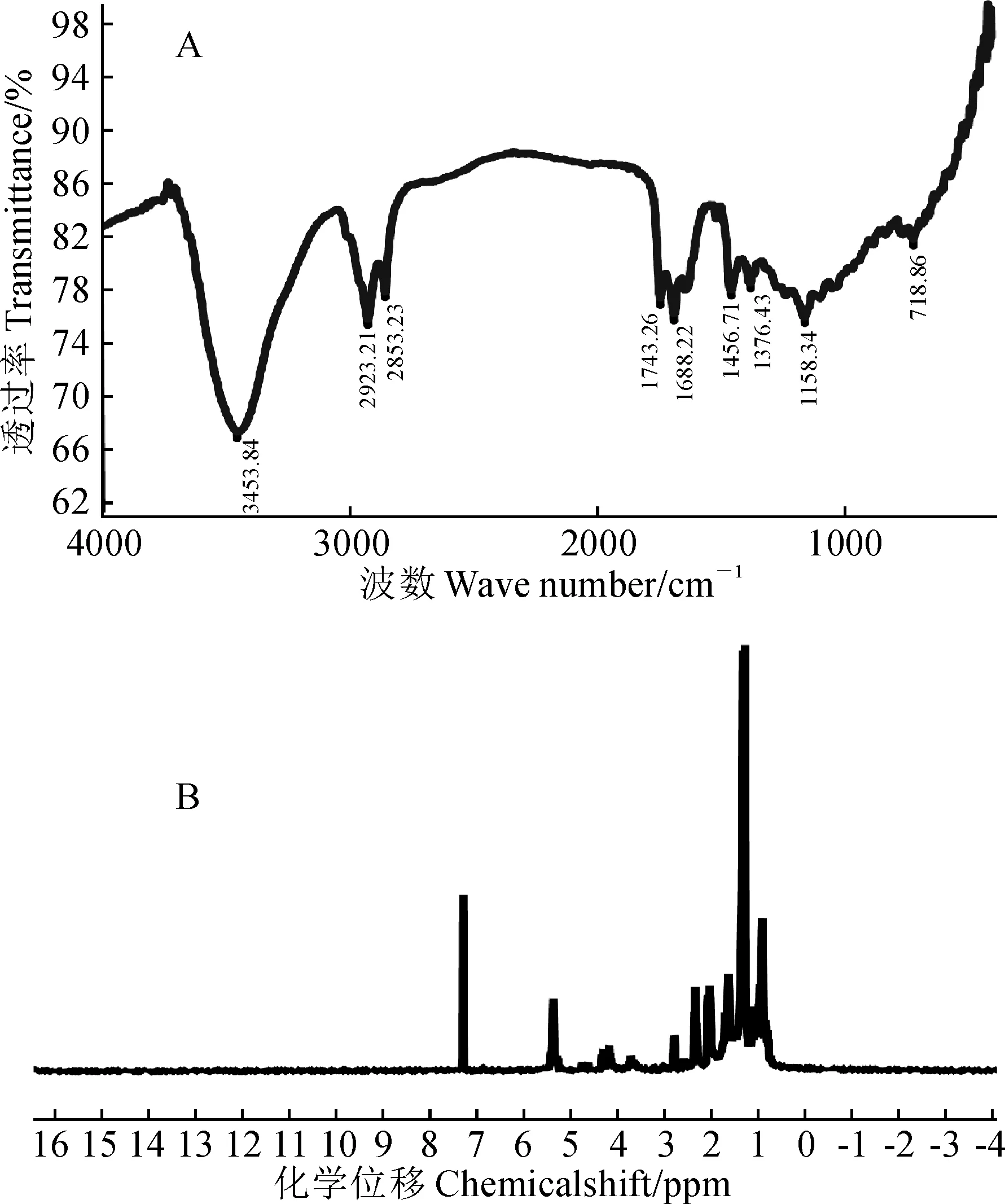
A. Fr.B的紅外光譜圖;B. Fr.B的核磁共振氫譜圖圖2 Fr.B的組成成分分析A. Infrared spectrogram of Fr.B; B. Hydrogen NMR spectrogram of Fr.BFig.2 Composition analysis of Fr.B
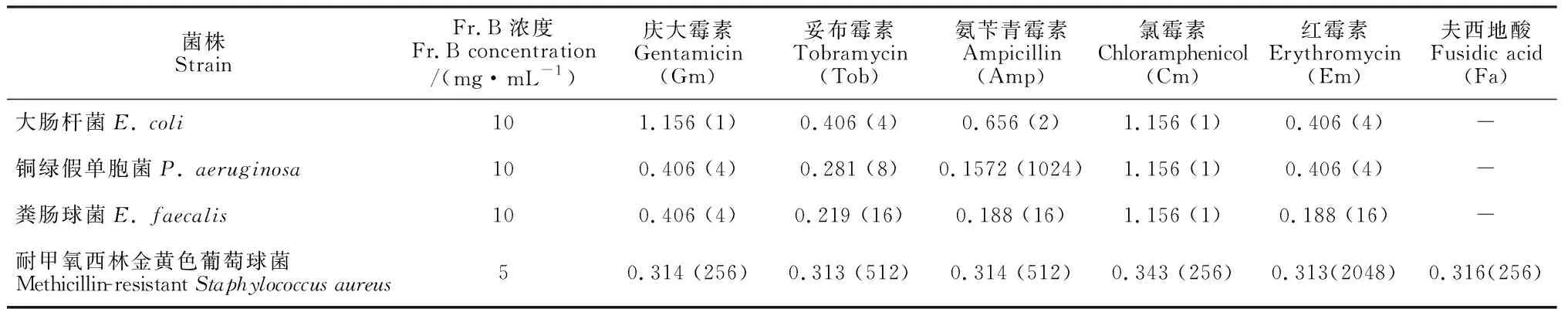
表1 Fr.B與抗生素聯合使用時對細菌的聯合抑菌指數(FIC)*

表2 Fr.B與抗生素聯合使用時對真菌的聯合抑菌指數(FIC)*
接著,本研究進一步探究了Fr.B增強抗生素療效的機制。由于已有研究報道脂肪酸可以引起微生物細胞通透性的變化[34],而我們先前GC-MS的結果顯示,Fr.B主要由脂肪酸類化合物組成,因此我們推測Fr.B可能是通過影響細胞的通透性從而起抗菌增效作用。為驗證這一假設,本研究檢測了Fr.B對MRSA菌株細胞通透性的影響。
堿性磷酸酶(AKP)正常情況下存在于細胞壁和細胞膜之間,當細胞壁通透性增大時,會通過細胞壁流出到培養液中,因此培養液中AKP的活性可以反映細胞壁的通透性。我們通過在細菌培養過程中分別加入不同試劑,以無水乙醇為空白對照,測定不同時間段培養液中AKP的活性,來判斷Fr.B對MRSA菌株細胞壁通透性的影響。結果如圖4,A所示,與對照組和Em組相比,Fr.B組和Fr.B+Em組中AKP的活性隨著時間的延長而逐步增強,并且與Fr.B組相比,Fr.B+Em組AKP活性得到進一步的提高。表明Fr.B可以增強MRSA菌株細胞壁的通透性。
培養液中電導率的大小可以反映細胞膜通透性的變化,而培養液中核酸等大分子物質含量可以反映細胞膜的破損情況。培養液電導率越大,說明細胞膜的通透性越好。培養液中核酸等大分子物質含量越高,說明細胞膜受損越嚴重。通過向培養液中分別加入不同試劑,以無水乙醇為空白對照,測定培養液中電導率和核酸分子含量。實驗結果如圖4,B所示,與對照組和Em組相比,Fr.B組和Fr.B+Em組中的電導率顯著升高,并且Fr.B+Em的電導率高于Fr.B組,表明Fr.B可以增強細胞膜的通透性。此外,我們還測定了培養液中的核酸含量,結果如圖4,C所示,相比對照組和Em組,當加入Fr.B或Fr.B+Em時,培養液中核酸分子含量顯著增大。上述結果暗示Fr.B的抗菌增效作用主要是通過破壞細胞膜和細胞壁的完整性,從而增強細胞的通透性來實現的。
2.3 Fr.B與紅霉素聯用對小鼠傷口感染模型的治療作用
2.3.1 Fr.B與紅霉素聯用制成的軟膏對小鼠傷口感染模型的治療作用許多植物源抗菌活性物質在傷口感染中均具有良好的抗菌及促進傷口愈合的作用[17-18]。而上述的試驗已經證明了Fr.B具有廣譜的抗菌増效作用,因此本研究進一步探究Fr.B與Em聯用在傷口感染中是否也具有增強抗菌及促進傷口愈合的作用。首先,本研究以MRSA為供試菌株,通過時間-殺傷曲線試驗對Fr.B與Em聯用時的有效配比進行了篩選。結果如圖5,A所示,5 mg/mL Fr.B、對照組以及單獨使用不同濃度的Em組,均對MRSA菌株的生長并未產生影響,說明MRSA菌株對它們完全耐藥,而當Fr.B分別與1%、0.1%、0.05%、0.04%、0.03% 的Em聯用時,均能顯著增強Em對MRSA菌株的殺菌作用,可是更低濃度的Em與Fr.B聯用后的抑菌效果卻明顯減弱。因此,從逆轉MRSA耐藥性的角度考慮,選定濃度在0.03%以上的紅霉素和5 mg/mL的Fr.B聯用時均可達到理想的聯合殺菌效果。
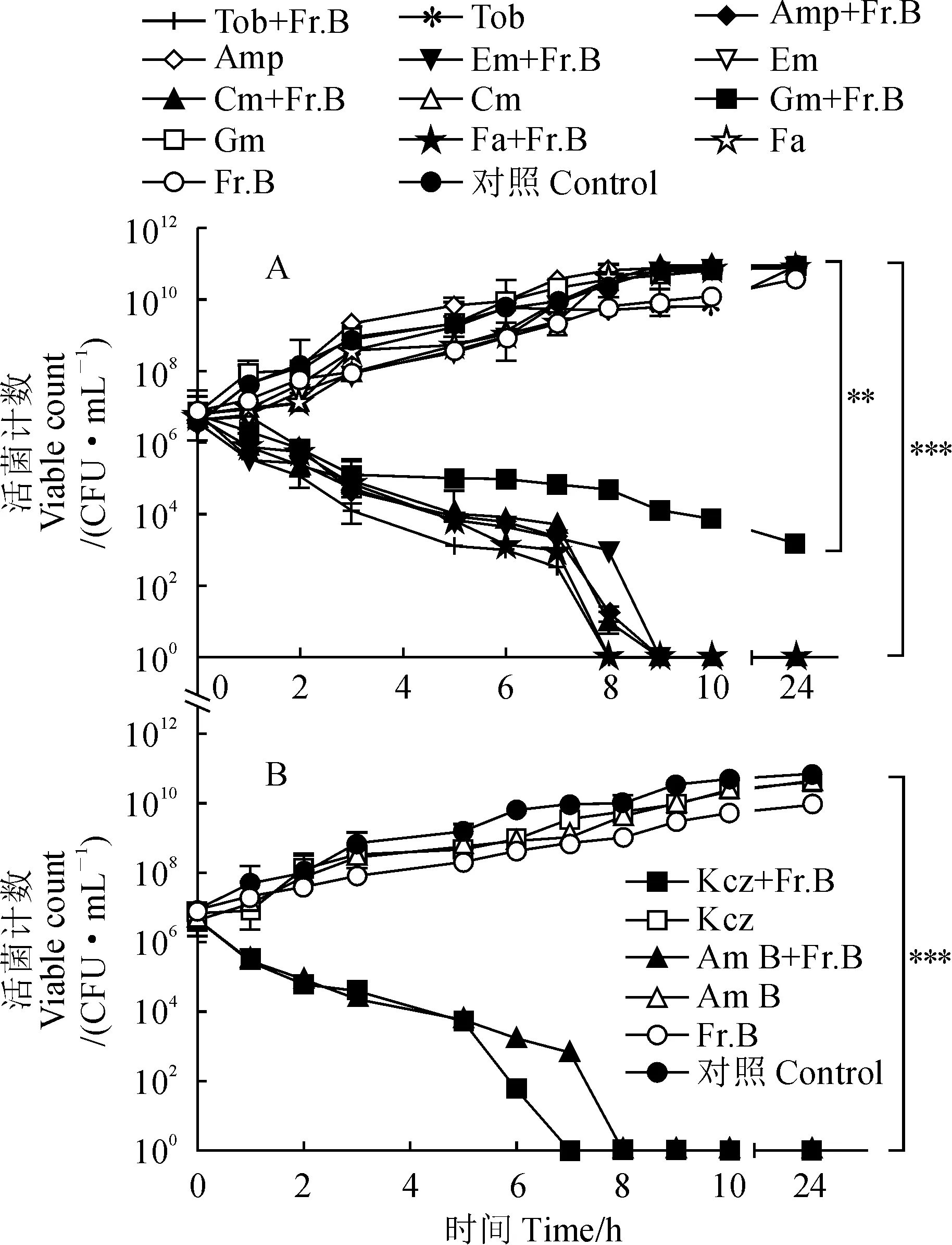
A. Fr.B與6種抗生素聯合使用對MRSA生長的影響(Tob.妥布霉素;Amp.氨芐青霉素;Em.紅霉素;Cm.氯霉素;Gm.慶大霉素;Fa.夫西地酸); B. Fr.B與2種抗生素聯合使用對白色念珠菌生長的影響(Kcz.酮康唑;Am B.兩性霉素B;**.P<0.01;***. P<0.001)圖3 Fr.B與抗生素聯用對MRSA和白色念珠菌生長的影響A. Effect of Fr.B combined with six antibiotics on the growth of MRSA (Tob. Tobramycin; Amp. Ampicillin; Em. Erythromycin; Cm. Chloramphenicol; Gm. Gentamicin; Fa. Fusidic acid); B. Effect of Fr.B combined with two antibiotics on the growth of Candida albicans(Kcz. Ketoconazole; Am B. Amphotericin B, **. P<0.01; ***. P<0.001)Fig.3 Effect of Fr.B combined with antibiotics on the growth of MRSA and Candida albicans
其次,我們以昆明(Km)小鼠為實驗動物,以MRSA為感染菌株,建立了小鼠傷口感染模型,通過監測小鼠體重的變化,來判斷小鼠傷口感染模型是否建立成功。結果如圖5,B所示,傷口感染組小鼠的平均體重顯著低于傷口無感染組小鼠的平均體重,表明小鼠傷口感染模型建立成功,保證了后續實驗的可靠性。
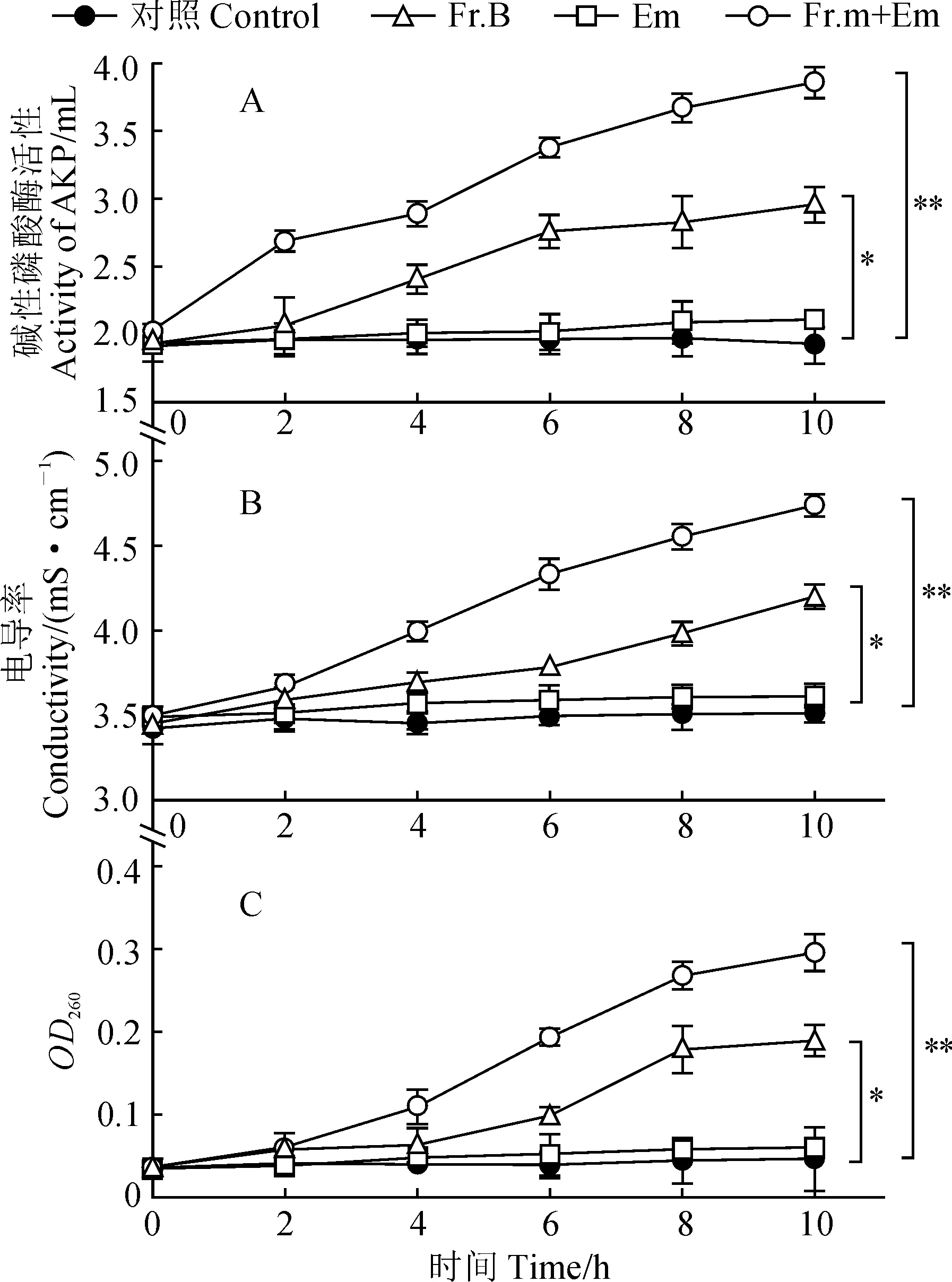
A. Fr.B對MRSA細胞壁通透性的影響;B. Fr.B對MRSA細胞膜通透性的影響;C. Fr.B對MRSA細胞膜完整性的影響。Em.紅霉素,*,P<0.05,**,P<0.01圖4 Fr.B對MRSA細胞通透性的影響A. Effect of Fr.B on cell wall permeability of MRSA; B. Effect of Fr.B on cell membrane permeability of MRSA; C. Effect of Fr.B on cell membrane integrity of MRSA. Em. Erythromycin, *. P<0.05; **. P<0.01Fig.4 Effect of Fr.B on the cell permeability of MRSA
接著,本研究利用該小鼠傷口感染模型來評估Fr.B與Em聯用制成的軟膏(命名為抗霸軟膏)對MRSA傷口感染的治療效果。結果如圖5,C和5,D所示,小鼠傷口在處理的第2天時,對照組相比于其他組,傷口有明顯腫脹的現象,其傷口大小減少至(87.78±26.16)%,同時紅霉素軟膏組與夫西地酸軟膏組傷口也觀察到輕微的腫脹現象,使用紅霉素軟膏的傷口大小減少到(71.59±13.96)%;而夫西地酸軟膏對傷口愈合能力相對較好,第2天傷口大小已經降低到(35.56±12.72)%,抗霸軟膏組和莫匹羅星軟膏組也均能夠達到與夫西地酸軟膏類似的效果,其傷口大小也分別降低至(36.51±11.90)%和(37.81±12.52)%,不同的是抗霸軟膏組和莫匹羅星軟膏組的傷口并未發現腫脹現象。另外,雖然Fr.B軟膏組傷口大小變化不大,僅減少至(72.11±14.11)%,但是其傷口表面并未發現腫脹的跡象,因此我們推測Fr.B具有消炎作用。小鼠傷口在處理的第6天時,相比空白對照組,紅霉素軟膏組傷口腫脹得到了輕微的緩解,但傷口大小并未發生明顯的變化。而使用夫西地酸軟膏治療的小鼠傷口大小在第6天減少至(17.86±3.30)%,傷口腫脹也得到了緩解。與此同時,抗霸軟膏組和莫匹羅星軟膏組傷口大小也發生明顯的變化,分別減少至(11.90±5.56)%和(14.84±0.96)%。Fr.B軟膏組的傷口雖未發生腫脹,但傷口大小僅降低至(58.16±12.87)%。在小鼠治療的第10天,抗霸軟膏組的傷口已經完全愈合,而其他組還存在大小各不相同的傷口,其中空白對照組的傷口依然還存在輕微的腫脹,其傷口大小仍為(32.04±5.93)%,紅霉素軟膏組的傷口大小為(27.01±7.56)%,夫西地酸軟膏組和莫匹羅星軟膏組的傷口也均趨于愈合,僅剩(9.20±3.79)%和(1.05±0.48)%。因此,這兩種軟膏對傷口的愈合能力強于紅霉素軟膏但弱于抗霸軟膏。這些結果表明,抗霸軟膏對MRSA傷口感染的治療效果要顯著優于紅霉素軟膏,與夫西地酸軟膏和莫匹羅星軟膏相比也有一定的優勢。
最后,我們在處理第4天時對小鼠創面進行MRSA的菌落計數。結果如圖5,E所示,空白對照組小鼠每克傷口組織的菌落數為4.38×106個;紅霉素軟膏組傷口顯示出腫脹,其每克傷口組織的菌落數相比空白對照組降低幅度不大,為2.60×105個;Fr.B軟膏對MRSA菌株本身沒有殺菌作用,因為其處理后的每克傷口組織菌落數(1.78×106個)與空白對照組相似;而夫西地酸軟膏對傷口中MRSA菌株的殺菌效果與莫匹羅星軟膏類似,表現為夫西地酸軟膏組和莫匹羅星軟膏組每克傷口組織的菌落數分別為1.35×104和1.04×104個,均優于空白對照組。與夫西地酸軟膏和莫匹羅星軟膏相比,抗霸軟膏組則顯示出更優秀的對傷口中MRSA菌株的殺菌效果,其處理后的每克傷口組織菌落數僅為4.08×103個,顯著低于其他處理組。上述結果表明,Fr.B與紅霉素聯用能顯著增強紅霉素對MRSA菌株的抗菌作用,使之獲得比夫西地酸和莫匹羅星更好的療效。
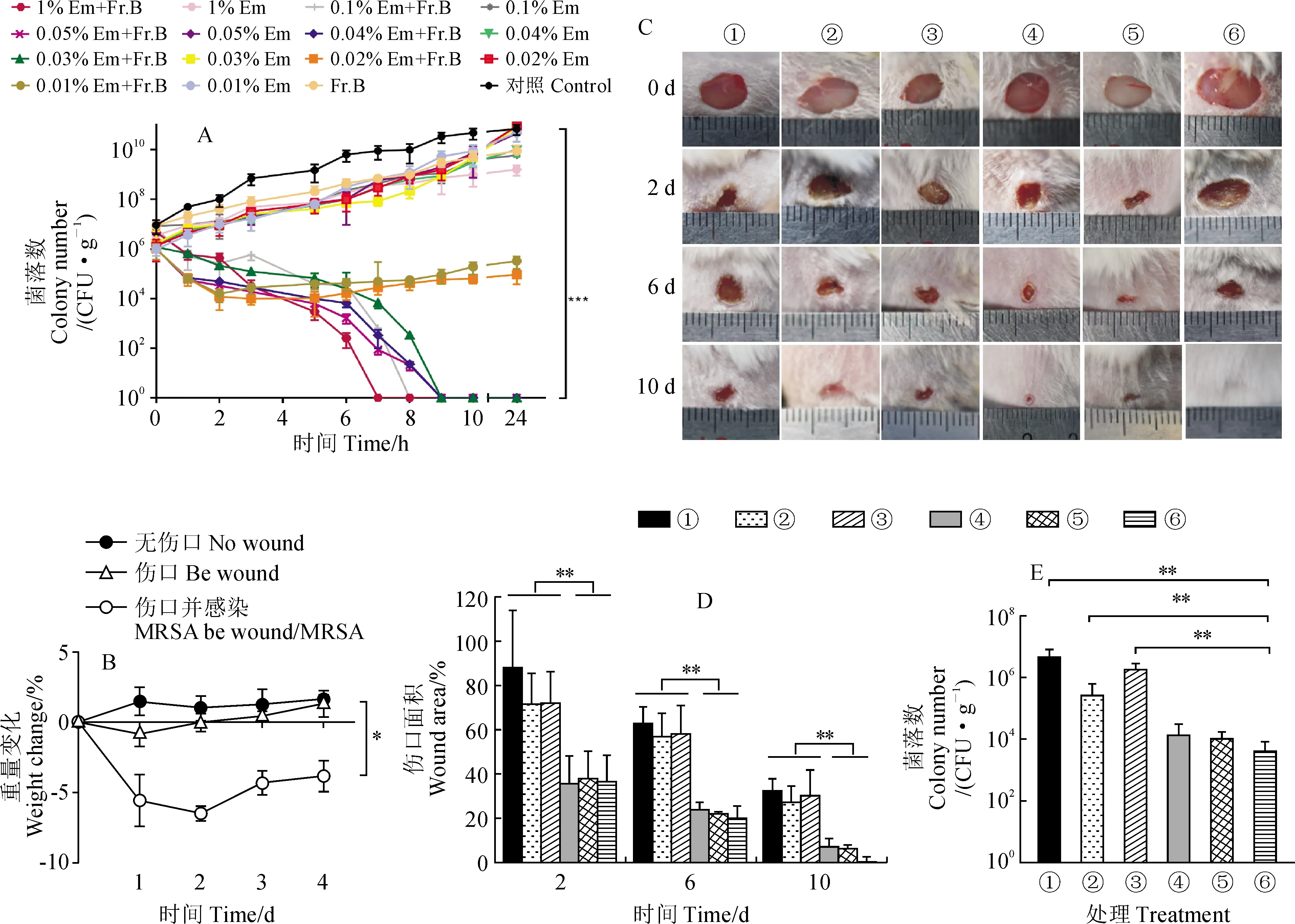
A. Fr.B和紅霉素的有效配比篩選;B. 小鼠傷口感染模型的建立;C. 不同時間間隔的小鼠傷口愈合情況(① 空白對照;② 紅霉素;③ Fr.B;④ 夫西地酸;⑤ 莫匹羅星;⑥ 抗霸);D. 不同時間點小鼠傷口愈合情況的定量分析結果;E. 不同處理下小鼠創面菌落計數。Em.紅霉素,*.P<0.05,**.P<0.01,***.P<0.001圖5 Fr.B與紅霉素聯用制成的軟膏對小鼠傷口感染模型的治療作用A. Screening of effective ratio of Fr.B and erythromycin; B. Establishment of wound infection model in mice; C. Wound healing of mice at different time intervals [① Control; ② Erythromycin; ③ Fr.B; ④ Fusidic acid; ⑤ Mupirocin; ⑥ Kangba (Ointment made from Fr.B and erythromycin)]; D. Quantitative analysis results of wound healing in mice at different time points; E. The count of bacterial colonies on the wound surface of mice under different treatments. Em. Erythromycin, *. P<0.05, **. P<0.01, ***. P<0.001Fig.5 The rapeutic effect of ointment made from Fr. B and erythromycin on mouse wound infection model
2.3.2 Fr.B軟膏與紅霉素軟膏混用對小鼠傷口感染模型的治療作用前面研究表明Fr.B與紅霉素聯用制成的抗霸軟膏對小鼠傷口感染模型的治療效果非常顯著,為了探究分別單獨制備的Fr.B軟膏和紅霉素軟膏在混用時是否也具有顯著的治療效果,本研究利用同樣的小鼠傷口感染模型來評估不同軟膏混用時對MRSA傷口感染的治療效果。結果如圖6,A和6,B所示,小鼠傷口在處理的第2天時,基質組傷口面積減少至(93.75±10.64)%,基質+1%紅霉素軟膏與基質+0.1%紅霉素軟膏的傷口面積分別減少到(84.82±10.10)%和(88.68±8.24)%,而1%紅霉素軟膏組的傷口面積減少到(66.59±16.10)%;與1%紅霉素軟膏組類似,含有Fr.B的3個處理組傷口愈合情況也比較好,結果顯示Fr.B軟膏組傷口面積降低到(68.50±5.10)%,Fr.B軟膏+1%紅霉素軟膏組和Fr.B軟膏+0.1%紅霉素軟膏組的傷口面積分別減少到(65.29±9.94)%和(66.64±8.87)%。由此可知,Fr.B具有一定的促傷口愈合作用,這與上述的研究結果一致。隨著繼續不同軟膏的混用治療,在處理的第6天可以觀察到,基質組傷口面積減少到(58.40%±7.13)%,1%紅霉素軟膏組、基質+1%紅霉素軟膏組和基質+0.1%紅霉素軟膏組的傷口面積的變化相差不大,分別減少到(49.95±15.97)%、(43.11±4.62)%、(48.66±4.72)%,與它們相比,含有Fr.B的3個處理組傷口愈合情況較好,結果顯示Fr.B軟膏組、Fr.B軟膏+1%紅霉素軟膏組與Fr.B軟膏+0.1%紅霉素軟膏組的傷口面積分別減少到(35.12±3.42)%、(26.20±7.88)%和(30.32±3.77)%,其中Fr.B軟膏+1%紅霉素軟膏組的療效最優。在處理的第10天,基質組、1%紅霉素軟膏組、基質+1%紅霉素軟膏組、基質+0.1%紅霉素軟膏組和Fr.B軟膏組的傷口面積分別減少到(33.69±2.87)%、(28.41±13.54)%、(20.04±3.15)%、(29.35±1.35)%和(20.50±1.25)%,與它們相比,Fr.B軟膏+1%紅霉素軟膏組和Fr.B軟膏+0.1%紅霉素軟膏組的傷口愈合情況更好,傷口面積分別減少到(5.42±4.49)%和(11.43±1.61)%,其中Fr.B軟膏+1%紅霉素軟膏組的療效依然最優。綜上所述,含有Fr.B的治療效果比含對照基質組的治療效果好,Fr.B軟膏+1%紅霉素軟膏比其他含有Fr.B軟膏組的治療效果好,Fr.B軟膏+紅霉素軟膏比單獨紅霉素軟膏的治療效果好。由此說明即使濃度減半,Fr.B軟膏和紅霉素軟膏的混用也比市場銷售的紅霉素軟膏有更好的治療效果。
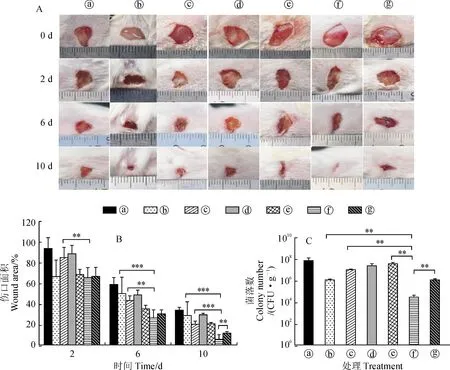
A. 不同時間間隔的小鼠傷口愈合情況(? 基質;? 1%紅霉素;?基質+1%紅霉素;?基質+0.1%紅霉素;?Fr.B;?Fr.B+1%紅霉素;?Fr.B+0.1%紅霉素);B. 不同時間點小鼠傷口愈合情況的定量分析結果;C. 不同處理下小鼠創面菌落計數。Em.紅霉素,**.P<0.01,***.P<0.001圖6 Fr.B軟膏與紅霉素軟膏混用對小鼠傷口感染模型的治療作用A. Wound healing of mice at different time intervals (? Base material; ? 1% Erythromycin; ?Base material + 1% Erythromycin; ? Base material + 0.1% Erythromycin; ? Fr.B; ? Fr.B + 1% Erythromycin; ? Fr.B + 0.1% Erythromycin); B. Quantitative analysis results of wound healing in mice at different time points; C. The count of bacterial colonies on the wound surface of mice under different treatments. Em. Erythromycin, **. P<0.01, ***. P<0.001Fig.6 The rapeutic effect of Fr.B ointment combined with erythromycin ointment on mice wound infection model
最后,我們同樣在處理第4天時對小鼠創面進行MRSA的菌落計數。結果如圖6,C所示,基質組、Fr.B軟膏組、基質+0.1%紅霉素軟膏組和基質+1%紅霉素軟膏組的小鼠每克傷口菌落數分別為7.46×107、3.82×107、2.45×107和1.04×107個,均多于1%紅霉素軟膏組每克傷口組織的菌落數1.15×106個和Fr.B軟膏+0.1%紅霉素軟膏組每克傷口組織的菌落數1.19×106個,而Fr.B軟膏與1%紅霉素軟膏的混用對小鼠傷口的治療效果最佳,其每克傷口組織的菌落數僅為2.80×104個。由此表明即使濃度減半,Fr.B也能夠顯著增強紅霉素對MRSA菌株的殺菌能力且其聯合治療的效果顯著優于原濃度的紅霉素。綜上,說明單獨制備的Fr.B軟膏與市場銷售的紅霉素軟膏按一定比例混合使用時也能獲得良好的治療效果且其療效顯著優于市場銷售的紅霉素軟膏。
3 結論與討論
本研究在Fr.2a[28]的基礎上,利用硅膠柱層析結合活性追蹤對酸棗果氯仿提取物中其他極性范圍的抗菌増效活性成分進行了分離純化。將得到具有抗菌增效活性的精制物命名為Fr.B,經GC-MS、紅外光譜和核磁共振氫譜分析發現Fr.B主要包含反油酸、油酸、順-10-十六碳烯醇、棕櫚酸等25種脂肪酸類化合物。通過Fr.B與抗生素聯合使用對供試菌株的體外抗菌增效活性分析發現,Fr.B能不同程度地顯著增強多種抗生素對銅綠假單胞菌、大腸桿菌、糞腸球菌、耐甲氧西林金黃色葡萄球菌(MRSA)和白色念珠菌的抗菌效果,其中對MRSA和白色念珠菌的抗菌增效作用尤為明顯,表明Fr.B具有廣譜的抗菌增效活性,能有效逆轉耐藥菌的耐藥性。而Fr.B的這種抗菌増效活性主要通過增強耐藥菌的細胞通透性來實現。通過小鼠傷口感染模型的體內實驗結果顯示Fr.B與紅霉素聯用能顯著增強紅霉素對MRSA菌株的抗菌作用,以逆轉MRSA菌株對紅霉素的耐藥性,從而促進MRSA感染傷口的快速愈合。
已有很多研究顯示游離脂肪酸具有殺菌活性[35-38]。例如,月桂酸對痤瘡丙酸桿菌具有抗菌活性[39];月桂酸和亞油酸對李斯特菌也具有很強的殺菌活性[40];癸酸對食源性感染有關的陰性菌,如對空腸彎曲桿菌和大腸桿菌具有很強的殺菌活性[34]。游離脂肪酸除了本身具有殺菌作用外,還具有抗菌増效作用。例如,Kitahara等發現濃度為5 μg/mL的月桂酸能增強慶大霉素或亞胺培南對3種臨床MRSA菌株的抗菌作用[41];Chan等研究顯示亞油酸和油酸可以分別協同紅霉素增強對MRSA的抗菌活性[16]。這些結果與本研究發現由脂肪酸類化合物組成的Fr.B具有廣譜抗菌增效活性的結果相一致。目前已知的游離脂肪酸的抗菌機制主要包括以下三個方面[34]:(1)增加膜的通透性和細胞的裂解;(2)破壞電子傳遞鏈和解偶聯氧化磷酸化;(3)抑制膜結合酶活性和養分吸收。本研究發現由脂肪酸類化合物組成的Fr.B主要通過增強細胞的通透性,從而可能因此增強抗生素對耐藥菌的抗菌作用,這與前人提出的游離脂肪酸的抗菌機制相符合。Fr.B除了具有廣譜的抗菌增效活性外,本研究在小鼠傷口感染模型的體內實驗中發現Fr.B還具有消炎和促進傷口愈合的作用,這也與其他研究報道脂肪酸具有調節傷口炎癥反應,并促進傷口愈合的結果[42-43]相一致。Cardoso等發現脂肪酸可通過抑制傷口處一氧化氮的產生而加速小鼠傷口愈合[42]。同樣,在大鼠傷口愈合的炎癥期,脂肪酸可以誘導血管內皮生長因子α(VEGF-α)和白細胞介素-1β(IL-1β)的產生以及刺激炎癥2 α/β (CINC-2α/β)中細胞因子誘導的中性粒細胞趨化因子的產生,從而起促炎作用而加速傷口的愈合過程[43]。綜上,作為植物天然提取物的Fr.B,因其能夠有效逆轉耐藥菌的耐藥性,而顯著增強抗生素在治療耐藥菌引起的傷口感染中的療效,所以其具有被開發成治療皮膚耐藥菌感染的輔助性藥物的潛力。
致謝:特別感謝西安交通大學基礎醫學院的劉成程副教授為本研究提供了耐甲氧西林金黃色葡萄球菌(MRSA)菌株。

