纖維素酶輔助提取茶多糖的工藝研究
周曉紅,陳潔冰,羅 智,陳帥江,彭潤芝,刀 彤
(1. 湖南城市學院 材料與化學工程學院,湖南 益陽 413000;2. 黑茶金花湖南省重點實驗室,湖南 益陽 413000)
茶多糖是茶葉中存在的一種多糖類復合物,多為與蛋白質結合的酸性糖蛋白[1].大量研究證明,茶多糖具有降血壓、降血糖、抗凝血、抗腫瘤、防輻射、抗血栓、增強人體免疫力、調節(jié)腸道微生態(tài)等多重生物功效[2-4].茶多糖作為茶葉中一種重要的功能性成分,是茶葉品質的重要保證,已有不少文獻研究了不同生產工藝和茶葉品種對茶多糖含量的影響.比如,黃浩[5]探討了“發(fā)花”過程中的主要生化成分和“發(fā)花”特征性微生物(冠突散囊菌)數(shù)量的變化,以及黑茶品質的變化;劉丹奇等[6]研究了白茶多糖、綠茶多糖和紅茶多糖的成分及其降血糖的效果和機理.這些研究揭示了茶葉的原料、生產工藝和提取方法等都能影響茶多糖的含量與活性.
鑒于茶多糖眾多的保健價值,如何高效提取、分離和純化茶多糖已成為諸多領域研究的熱點問題[7-9].目前,已報道的茶多糖實驗室提取方法主要包括醇沉法、水浸提法、活性酶輔助浸提法、微波輔助浸提法以及超聲波輔助浸提法[10-11].其中,活性酶輔助提取法可在常溫常壓條件下加速細胞壁和細胞間質層的分解,促進細胞內有效成分的釋放,從而提高了茶多糖的提取率[12-13].
本研究以茉莉花茶為研究對象,利用冠突散囊菌發(fā)酵液制備了“金花”茉莉花茶,通過纖維素酶輔助提取茶葉中的茶多糖,探究纖維素酶輔助提取茶多糖的最佳工藝參數(shù),為其酶解提取茶多糖的生產工藝提供參考.同時,對提取的茶多糖進行抗氧化活性研究,以期用該方法對提取的茶多糖進行品質評價.
1 實驗部分
1.1 儀器和試劑
實驗儀器包括SHZ-B 雙功能水浴恒溫振蕩器(江蘇金壇億通電子有限公司);DT5-2B 低速臺式離心機(北京時代北利離心機有限公司);101-1AB 電熱鼓風干燥箱(天津市泰斯特儀器有限公司);SHZ-DⅢ循環(huán)水式真空泵(上海予申儀器有限公司);旋轉蒸發(fā)器RE-2000B(長沙中天儀器設備有限公司);XY-200 高速多功能粉碎機(浙江省永康市松青五金廠);TP-214 電子天平(北京賽多利斯儀器有限公司);HS.Z68 電熱蒸餾水器(北京永光醫(yī)療設備有限公司);QHX-4005SH-Ⅲ人工氣候箱(上海新苗醫(yī)療器械制造有限公司);YXQ-100G 立式蒸汽滅菌器(上海博迅實業(yè)有限公司);722 型可見分光光度計(上海舜宇恒平科學儀器有限公司).
茉莉花茶來自廣西橫縣星光茶廠;冠突散囊菌菌種來自湖南城市學院黑茶金花湖南省重點實驗室;纖維素酶來自和氏璧生物科技有限公司;葡萄糖、苯酚、檸檬酸、檸檬酸鈉、無水乙醇等來自國藥集團化學試劑有限公司;DPPH 試劑來自西格瑪奧德里奇(上海)貿易有限公司;硫酸來自株洲市新工化玻有限責任公司.
1.2 冠突散囊菌發(fā)酵液的制備
參照文獻[14]中的方法,采用改良PDL 液體培養(yǎng)基制備冠突散囊菌發(fā)酵液.取200 g馬鈴薯,用適量蒸餾水煮沸20 min 后用3 層紗布將固體濾出;合并濾液,添加50 g 蔗糖,定容至1 000 mL;錐形瓶分裝滅菌,冷卻后置于超凈工作臺上接種冠突散囊菌,并在28 ℃恒溫培養(yǎng)箱中培養(yǎng)9 d,備用.
1.3 “金花”茉莉花茶的制備
取茉莉花茶100 g 置于500 mL 培養(yǎng)瓶中,保持充滿的狀態(tài),加水使之含水量為30%;將培養(yǎng)瓶放入高壓滅菌鍋,在121 ℃下滅菌20 min;滅菌后在無菌室接種3 mL 冠突散囊菌發(fā)酵液,于28 ℃恒溫箱培養(yǎng)7~10 d;待“金花”長滿后取出,置于70 ℃烘箱干燥,備用.
1.4 茶多糖的提取
取干燥后的“金花”茉莉花茶,用破碎機破碎至過60 目篩;稱取粉碎后的茶樣1.000 0 g,按照液料比1∶25 加入檸檬酸-檸檬酸鈉緩沖溶液,再加入纖維素酶,放入水浴恒溫振蕩器中酶解;酶解后置于121 ℃滅菌鍋加熱20 min 進行滅活,離心并取上清液定容至25.0 mL,作為待測液測定“金花”茉莉花茶茶多糖的含量.
1.5 茶多糖含量的測定
根據文獻[15]中的方法,精密稱取0.100 0 g在105 ℃下干燥至恒重的葡萄糖標準物質,配制成1 000.0 mL 濃度為0.100 0 mg/mL 的標準溶液;分別準確移取標準溶液0,0.20,0.40,0.60,0.80和1.00 mL置于10 mL試管中,加蒸餾水補至1.00 mL;繼續(xù)添加1.00 mL 5%苯酚和5.00 mL 濃硫酸,搖勻,在陰暗環(huán)境下反應20 min,經490 nm 比色測定,獲得葡萄糖標準曲線.
精密稱取1.000 0 g“金花”茉莉花茶,按液料比1∶25 加入pH 值為4.8 的檸檬酸-檸檬酸鈉緩沖液,再加入纖維素酶,置于水浴鍋中靜置酶解一段時間;高溫滅酶,將溶液在離心機(轉速3 000 r/min、時間10 min)中離心,取上層清液定容至25.0 mL;取1.00 mL上清液加水稀釋至100.0 mL,用苯酚-硫酸法測定溶液在490 nm 下的吸光度,并根據此吸光度在標準曲線上查得對應的茶多糖質量m1.樣品的茶多糖含量計算公式為
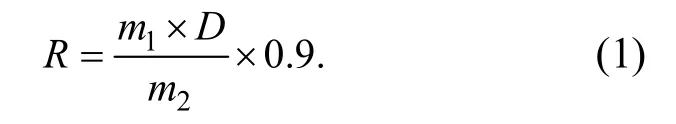
其中,m1為樣品在標準曲線上對應的含糖量,mg;m2為樣品質量,g;D為稀釋倍數(shù);0.9 為粗多糖折算為茶多糖的換算系數(shù).
1.6 正交實驗設計
為了分別考察酶解時間、酶解溫度、酶添加量對“金花”茉莉花茶茶多糖提取效率的影響,選擇L9(33)正交因素水平設計實驗,具體參數(shù)如表1 所示.

表1 正交實驗因素水平表
1.7 測定茶多糖抗氧化活性
稱取干燥好的DPPH 試劑0.035 0 g,用無水乙醇溶解后定容至100 mL 的容量瓶;移取1.00 mL 上述溶液,定容至50 mL 容量瓶;多次上下顛倒搖勻,得濃度約為0.017 8 mmol/L 溶液;將制備好的DPPH 溶液倒入深色瓶,置于冰箱,冷藏備用.
移取2.00 mL 樣品置于試管中,加入2.00 mL DPPH 溶液搖勻,獲得樣品測定液;避光靜置30 min,于反應結束后在517 nm 處測量獲得樣品測定液吸光度;以同體積蒸餾水代替樣品按相同操作測定空白對照組吸光度;以同體積無水乙醇代替DPPH 溶液,按相同操作測定樣品的本底吸光度.DPPH 清除率計算公式為

其中,A1為2.00 mL DPPH 溶液+2.00 mL 蒸餾水的對照組吸光度;A2為2.00 mL DPPH 溶液+2.00 mL 樣品的測定液吸光度;A3為2.00 mL 無水乙醇+2.00 mL 樣品的本底吸光度.
2 結果和討論
2.1 葡萄糖標準曲線
根據1.5 節(jié)中的測定方法,獲得葡萄糖標準曲線如圖1 所示.
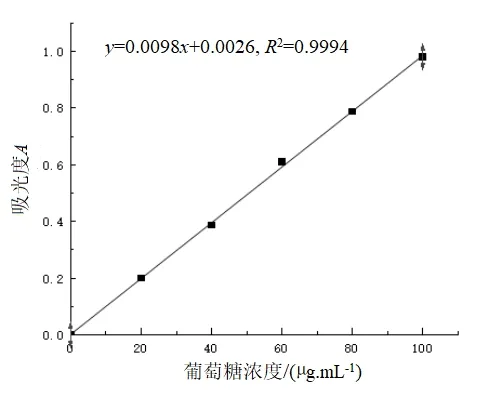
圖1 葡萄糖標準曲線
2.2 茶多糖含量
2.2.1 酶解時間對茶多糖含量的影響
固定酶解溫度為50 ℃和酶添加量為2.5%,在不同的酶解時間下,所獲得的茶多糖含量曲線如圖2 所示.
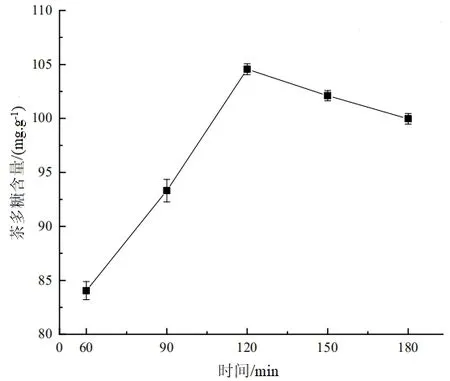
圖2 酶解時間對茶多糖含量的影響
由圖2 可知,當酶解時間<120 min 時,隨著酶解時間的增加,“金花”茉莉花茶中的茶多糖含量逐漸增大;當酶解120 min 時,茶多糖含量最大,為104.55 mg/g;當酶解時間>120 min 時,隨著時間的延長,茶多糖的提取率呈下降趨勢.這可能是因為隨著時間的進一步延長,酶的活性逐步降低,長時間的浸提導致了大量雜質溶出,茶多糖的析出就不再明顯.因此,最適合的酶解時間為120 min.
2.2.2 酶解溫度對茶多糖含量的影響
固定酶解時間為120 min 和酶添加量為2.5%,在不同的酶解溫度下,實驗所得茶多糖含量曲線如圖3 所示.
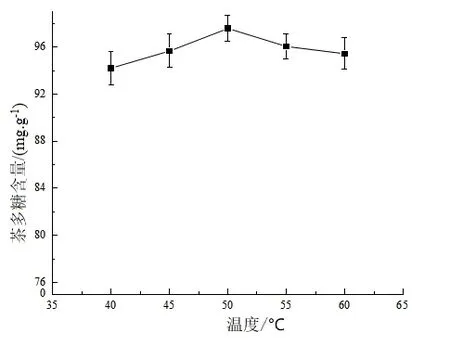
圖3 酶解溫度對茶多糖含量的影響
由圖3 可知,當酶解溫度<50 ℃時,隨著酶解溫度的上升,“金花”茉莉花茶的茶多糖含量增加;當酶解溫度為50 ℃時,茶多糖含量最高,為97.59 mg/g;當酶解溫度>50 ℃時,茶多糖含量呈下降趨勢.其原因是,當酶解溫度<50 ℃時,酶的活性隨溫度升高而增強;當溫度為50 ℃時,酶達到了最佳活性,茶多糖含量最高;當溫度>50 ℃時,隨著溫度的進一步上升,酶的分子空間結構發(fā)生改變,使其活性降低,影響反應效率,導致茶多糖含量開始下降.
2.2.3 酶添加量對茶多糖含量的影響
當固定酶解時間為120 min 和酶解溫度為50 ℃時,不同的纖維素酶添加量對茶多糖提取率的影響效果如圖4 所示.
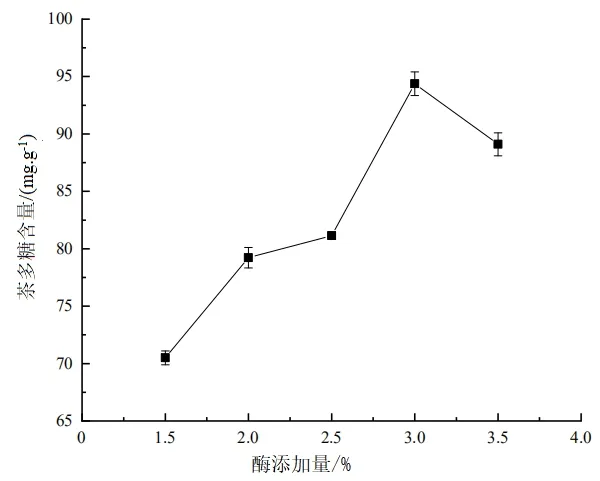
圖4 酶添加量對茶多糖含量的影響
由圖4 可知,當酶添加量<3%時,茶多糖含量隨酶添加量的增加呈上升趨勢;當酶添加量為3%時,茶多糖含量最高,達94.15 mg/g;當酶添加量>3%時,茶多糖含量逐漸下降.其原因可能是,剛開始纖維素酶量的增加,有利于反應的進行,導致茶多糖含量增加;隨著酶添加量的繼續(xù)增加,底物濃度不能使酶達到飽和,致使酶的作用受到了抑制,導致茶多糖提取率下降[16].因此,最合適的酶添加量為3%.
2.3 正交實驗結果分析
由表2 中極差R的大小可得出各因素對茶多糖含量的影響順序依次為:酶解時間>酶添加量>酶解溫度,最佳工藝條件為A2B2C2,即酶解時間120 min、酶解溫度50 ℃和酶添加量3%.在此條件下進行驗證實驗,所得“金花”茉莉花茶的茶多糖含量為104.25 mg/g.
由表3 可知,因素A(酶解時間)對于茶多糖提取效率有顯著性影響(P≤0.05);因素B(酶添加量)和因素C(酶解溫度)對茶多糖的提取效率影響不顯著(P>0.10).這與表2中酶解時間對茶多糖提取效率影響最大的結果一致.
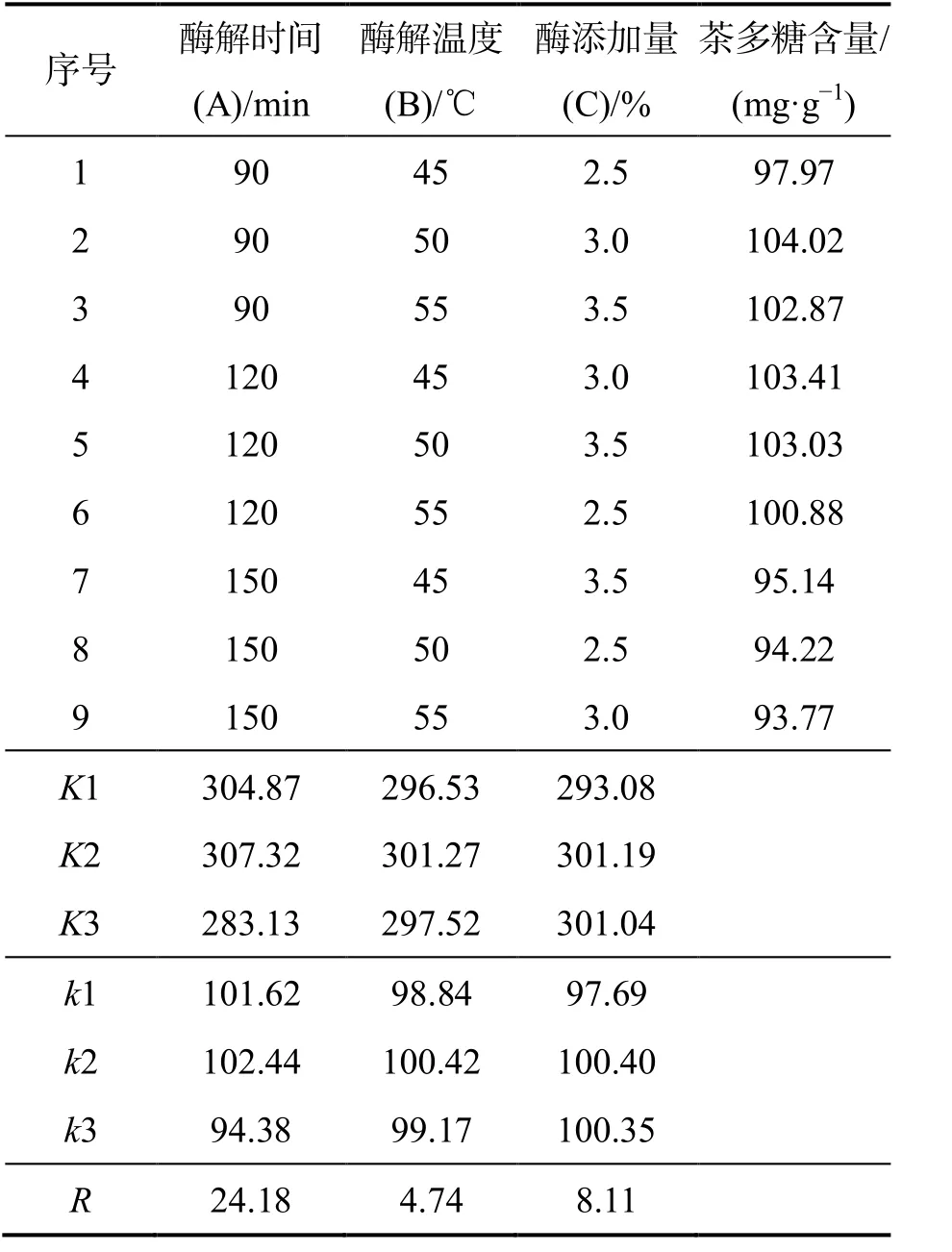
表2 正交實驗結果
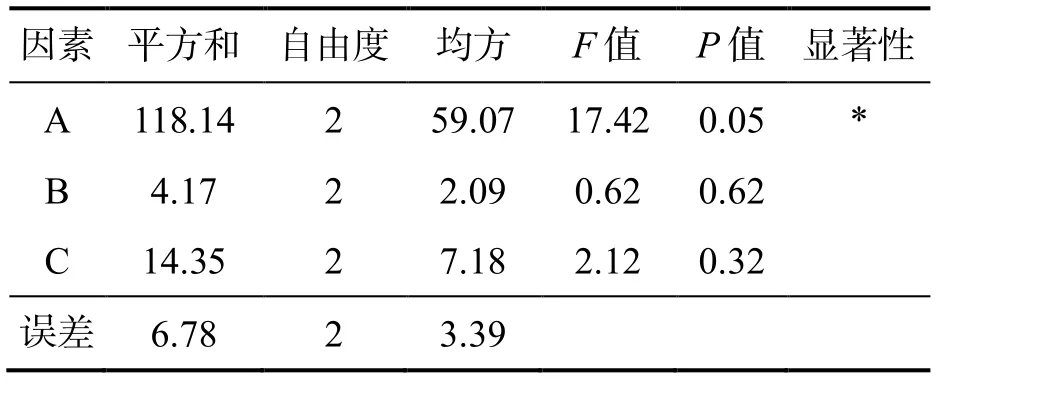
表3 方差結果分析
2.4 茶多糖的抗氧化活性
DPPH 是一種很穩(wěn)定的以氮為中心的自由基,其孤對電子在517 nm 波長附近有強吸收,當有自由基清除劑存在時,孤對電子被配對、吸收后消失或者減弱[17-18].對比檢測從普通茉莉花茶和“金花”茉莉花茶中提取的茶多糖對DPPH 試劑的自由基清除效果得出,從2 種茶中所提取的茶多糖對DPPH 自由基半數(shù)清除率分別為57.14%和61.97%.這說明相對于未“發(fā)花”的茉莉花茶,從“金花”茉莉花茶中提取的茶多糖表現(xiàn)出了較好的抗氧化能力.
3 結語
通過纖維素酶輔助提取“金花”茉莉花茶茶多糖的工藝研究,獲得了其最佳工藝條件:酶解時間120 min、酶解溫度50 ℃和酶添加量3%.在此條件下,從1.000 g“金花”茉莉花茶中提取的茶多糖為104.25 mg,相對文獻[10-11]所報道的方法有較高的提取效率.以相同實驗方法從未發(fā)花的茉莉花茶中提取茶多糖并作為對照,利用DPPH的自由基清除法研究“金花”茉莉花茶中茶多糖的抗氧化活性,結果顯示從“金花”茉莉花茶中提取的茶多糖表現(xiàn)出了更好的抗氧化活性.綜上所述,對茉莉花茶采用“發(fā)花”技術,可以提高其茶多糖含量,若同時采用纖維素酶輔助提取法,控制好最佳工藝參數(shù),就可獲得更高的茶多糖提取效率.但本文所提工藝得到的茶多糖是粗茶多糖,如果能進一步對產品進行純化,有望對“金花”茉莉花茶中的茶多糖和真菌多糖進行區(qū)分和鑒別,從而對深入研究茶多糖的保健功效產生積極作用.

