貓杯狀病毒蝕斑純化方法的建立
趙靜杰 , 梁 琳 , 劉子寧 , 肖發沂 , 賈亞雄 , 梁瑞英 , 崔尚金
(1. 中國農業科學院北京畜牧獸醫研究所 , 北京 海淀 100193 ; 2. 農業農村部獸用藥物與診斷技術 北京科學觀測實驗站 , 北京 海淀 100193 ; 3. 山東畜牧獸醫職業學院 , 山東 濰坊 261061)
貓杯狀病毒(Feline calicivirus,FCV) 屬于杯狀病毒科水皰疹病毒屬,為無囊膜單股正鏈RNA病毒,是引起貓科動物呼吸道疾病的一種常見病原。目前,該病毒可跨物種傳播,呈世界分布[1-2]。FCV不僅對寵物貓造成嚴重的健康威脅,同時也威脅著虎、獅、豹等野生貓科動物的健康[3-4]。貓皰疹病毒Ⅰ型(Feline herpesvirus type 1,FHV-1) 屬于皰疹病毒科,為有囊膜的線性雙鏈DNA病毒,主要引起貓傳染性鼻氣管炎[5]。兩者臨床癥狀相似,主要表現為呼吸啰音、鼻眼漿液性或膿性分泌物增多等呼吸道癥狀[6]。口鼻眼拭子是進行FCV病原學診斷或病毒分離常見的病料,但病料中常含有其他病原體微生物,這給病毒的分離純化帶來了困難[7]。目前,常見的病毒分離純化技術有血清中和試驗、不同宿主細胞增殖試驗和蝕斑純化。血清中和試驗是通過加入特定抗原的抗體來中和混合樣品中的特定抗原,該方法適用于不同抗原間無抗體交叉反應的情況,相對來說成本較高,且市面上抗體質量參差不齊,試驗效果較難把控[8]。不同宿主細胞增殖試驗是利用不同病毒對宿主細胞噬性不同完成病毒篩選及純化的。其中一種病毒能在某種細胞上增殖,而其他病毒則不能,如此多次重復操作,可得到純化的單一病毒。FCV和FHV-1均可以在F81及CRFK等貓腎傳代細胞中良好增殖,所以不能利用該方法完成FCV和FHV-1的分離純化[9-11]。本試驗對F81細胞純化FCV的條件進行優化摸索,旨在建立簡單、快速高效的病毒分離純化方法,通過建立FCV蝕斑純化方法,為FCV后續試驗奠定基礎,同時也為其他病毒的分離純化提供借鑒。
1 材料與方法
1.1 樣品來源及處理 病料取自大連某寵物醫院疑似病例口鼻眼拭子,將拭子放于1 mL滅菌 PBS中(含青霉素100 U/mL和鏈霉素100 μg/mL)渦旋振蕩,37 ℃ 培養箱中靜置 1 h,棄去棉拭子,將拭子懸液放于-20 ℃ 冰箱備用。
1.2 細胞及主要試劑E.coliDH5α 感受態細胞,購自全式金公司;PrimeSTAR Max DNA Polymerase為TaKaRa產品;柱式質粒小量抽提試劑盒、通用型DNA膠回收試劑盒,均購自OMEGA公司;病毒RNA提取試劑盒為艾德萊產品;反轉錄試劑盒為TIANGEN產品,購自北京匯百惠生物科技中心;2×DMEM細胞培養液為SIGAMA產品;胎牛血清(FBS)為Gibco產品;中性紅染色液(0.33% 過濾除菌,活細胞染色),購自北京索萊寶科技有限公司。低熔點瓊脂糖為SIGAMA產品;PBS緩沖液為Gibco產品。
1.3 引物設計 根據GenBank中公布的FCV基因序列,利用MAGA 7.0對比各個序列之間差異,使用DNAMAN 和DNASTAR進行引物設計,同時參考文獻[12]報道的FHV-1鑒定引物,引物由北京擎科生物科技有限公司合成,引物序列見表1。
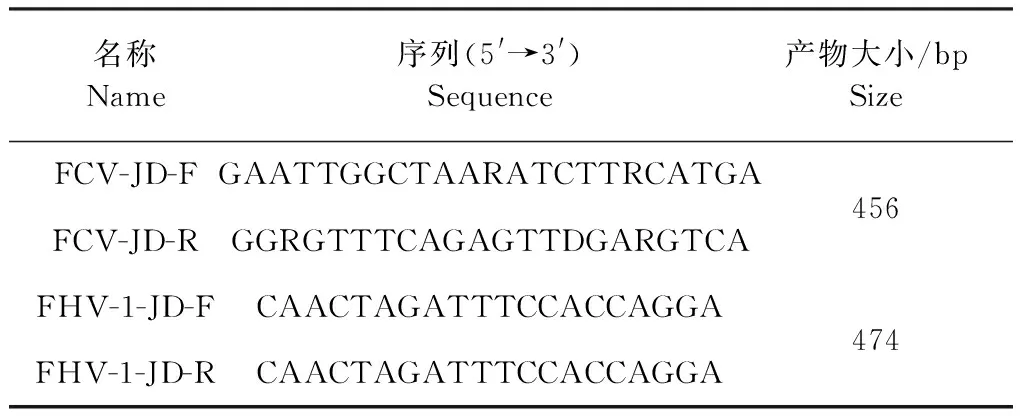
表1 FCV和FHV-1基因擴增鑒定引物Table 1 FCV and FHV-1 gene amplification and identification primers
1.4 病毒的分離 F81細胞長成單層后,棄生長液,用PBS洗滌2次,加入處理好的病毒液200 μL,37 ℃、5% CO2培養箱吸附90 min,每30 min搖晃1次。90 min后棄病毒液,加入含2% FBS的DMEM,37 ℃、5%CO2培養箱培養1~3 d,每12 h觀察1次,細胞出現圓縮、脫落等明顯細胞病變后收取細胞培養物,反復凍融3次后,收取細胞培養物進行下一步鑒定。
1.5 病毒RT-PCR鑒定 取200 μL細胞培養物,按照艾德萊病毒RNA提取試劑盒及病毒DNA提取試劑盒說明書提取病毒總RNA及DNA,RNA按照TIANGEN反轉錄試劑盒使用說明書進行反轉錄。20 μL反轉錄體系:5×FastKing-RT SuperMix 4 μL,RNA 2 μL,Rnase-Free ddH2O 14 μL。反轉錄程序:42 ℃ 15 min,95 ℃ 3 min。以反轉錄產物及提取的DNA為模板進行PCR擴增。FCV PCR反應體系(20 μL): PrimeSTAR Max DNA Polymerase 10 μL,FCV-JD-F 1 μL,FCV-JD-R 1 μL,cDNA 1 μL,ddH2O 7 μL。PCR反應程序:95 ℃ 3 min;95 ℃ 30 s, 55 ℃ 30 s,72 ℃ 30 s,35個循環;72 ℃ 5 min。FHV-1 PCR反應體系(25 μL):2×Taq Plus PCR Master Mix (Ⅱ) 12.5 μL,PCR Enhancer 1 μL,FHV-1-JD-F 0.5 μL,FHV-1-JD-R 0.5 μL,DNA 1 μL,dd H2O 9.5 μL。PCR反應程序:95 ℃ 3 min;95 ℃ 10 s;53.1 ℃ 20 s;72 ℃ 30 s,35個循環;72 ℃ 5 min[12]。
1.6 FCV F81細胞蝕斑純化方法的建立
1.6.1 F81細胞鋪板劑量優化 將F81細胞制成1× 105、3×105、5×105、7×105、9×105個/mL的細胞懸液,接種于6孔板,每孔2 mL,于37 ℃、5% CO2培養箱培養24 h,每12 h觀察細胞狀態及鋪板情況。
1.6.2 低熔點瓊脂糖濃度的優化 用PBS分別配制2%、4%和6%的低熔點瓊脂糖溶液,高壓滅菌后,置于40~50 ℃水浴中備用;制備含5% FBS的2× DMEM,將兩者按1∶1的比例混勻后,40~50 ℃水浴備用。低熔點瓊脂糖溶液終濃度分別為1%、2%和3%,待細胞長成單層后,取10-1~10-8稀釋度的混合病毒液200 μL分別接種到6孔板中,37 ℃、 5% CO2培養箱吸附90 min,每30 min晃動1次。 90 min后棄去病毒液,每孔加入2 mL第1層瓊脂,觀察第1層瓊脂凝固情況。
1.6.3 第1層覆蓋液鋪板時間的優化 待F81細胞培養至致密單層。將混合病毒進行10倍倍比稀釋,取10-1~10-8稀釋度的混合病毒液200 μL接種到6孔板中,37 ℃、5% CO2培養箱吸附時間分別為30、60、90、120 min和180 min,到時間后棄去病毒液并用PBS洗2遍,每孔加入2 mL第1層覆蓋液,待第1層覆蓋液完全凝固后,置于37 ℃、5% CO2培養箱倒置培養,每12 h觀察細胞是否出現圓縮、脫落等細胞病變。48 h后每孔加入2 mL第2層覆蓋液(第2層覆蓋液:5% FBS的2×DMEM和2%低熔點瓊脂糖溶液等體積混合,添加0.01%中性紅染色液),待第2層覆蓋液完全凝固后,置于37 ℃、體積分數為5% CO2培養箱正置培養,每3 h觀察蝕斑形成情況。
1.6.4 第2層覆蓋液鋪板時間的優化 確定第1層覆蓋液鋪板時間后,分別在完成第1層覆蓋后24、36、48、56 h和72 h覆蓋第2層覆蓋液,待第2層覆蓋液完全凝固后,置于37 ℃、體積分數為5% CO2培養箱正置培養,每3 h觀察蝕斑形成情況。
1.6.5 蝕斑挑取、擴增及鑒定 待蝕斑形成后用修剪好的黃色槍頭挑取噬斑,并放入500 μL 的無血清DMEM中,反復凍融3次后,取200 μL提取RNA,采用RT-PCR進行鑒定[13-14]。鑒定結果為FCV陽性的再次進行蝕斑試驗,取上清繼續克隆純化,經3輪純化并經RT-PCR鑒定,結果為FCV陽性且FHV-1陰性的病毒液擴大培養,-80 ℃保存備用。
2 結果
2.1 病毒的RT-PCR鑒定 混合病毒接種F81單層細胞后,發現F81細胞出現變圓、脫落,細胞聚集在一起呈葡萄串樣典型細胞病變效應(CPE)。將收取的病毒培養液按照病毒RNA提取試劑盒及病毒DNA提取試劑盒說明書提取病毒總RNA及DNA,以獲得的RNA及DNA為模板,進行FCV、FHV-1 PCR檢測。PCR產物經凝膠電泳檢測后顯示,在456 bp及474 bp處分別出現特異性片段(圖1)。表明病毒為FCV和FHV-1混合病毒。
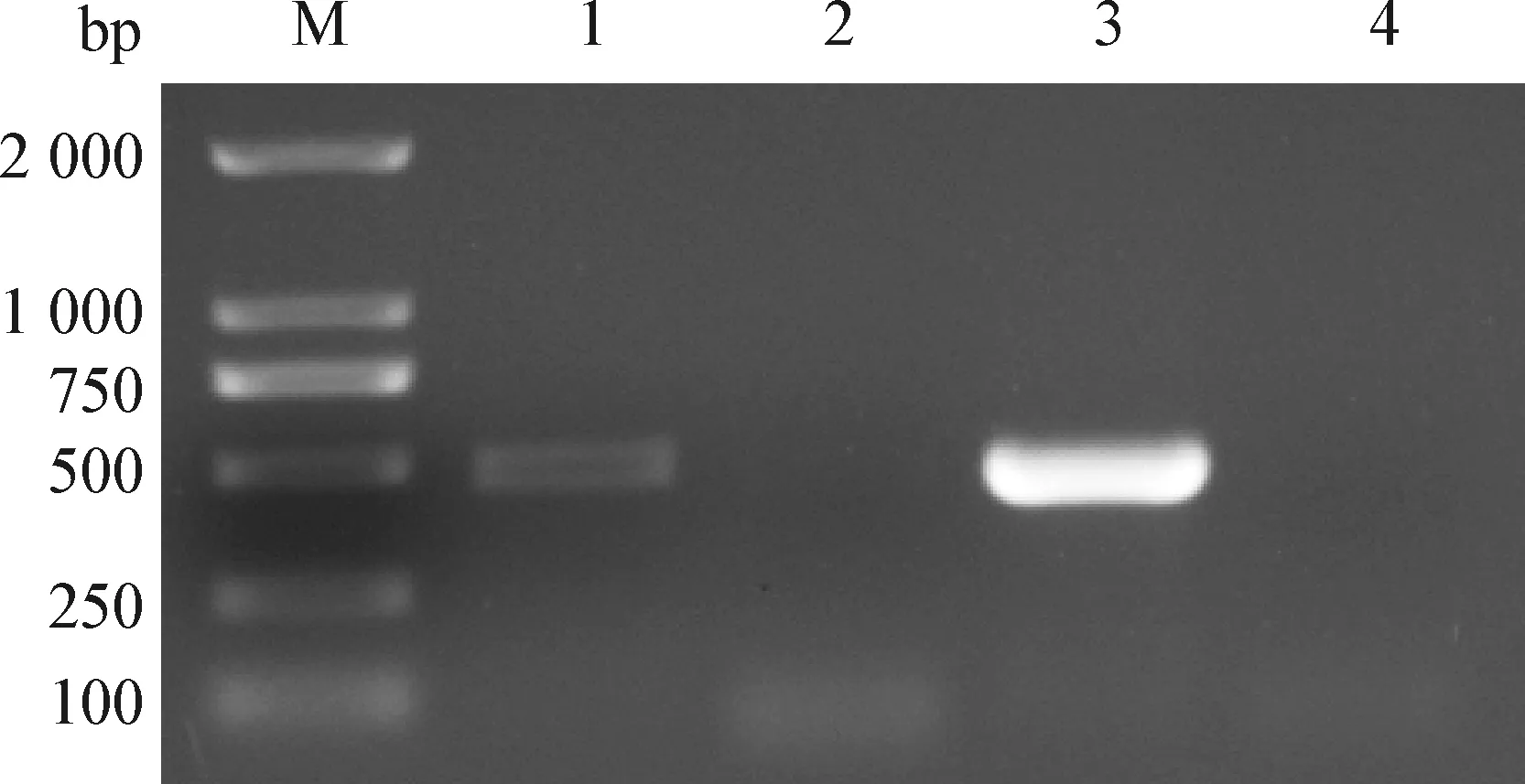
圖1 FCV和FHV-1 PCR產物電泳結果Fig.1 Electrophoresis results of FCV and FHV-1 PCR productsM:DL-2 000 DNA相對分子質量標準; 1:FHV-1; 2:FHV-1陰性對照; 3:FCV; 4:FCV陰性對照M:DL-2 000 DNA Marker; 1:FHV-1; 2:FHV-1 negative control; 3:FCV; 4:FCV negative control
2.2 FCV F81細胞蝕斑純化方法的建立
2.2.1 F81細胞鋪板劑量優化 以每孔不同劑量的F81細胞鋪6孔板,24 h后觀察細胞狀態及密度,結果顯示鋪板細胞數為1×105、3×105、5×105個/mL時,細胞未長滿,中間間隙較多,無法滿足蝕斑純化的要求;鋪板劑量為9×105個/mL,細胞過于密集,且培養基中有漂浮死細胞;最終確定鋪板劑量為7×105個/mL,此劑量細胞狀態良好,細胞呈緊密規則排列,適合進行蝕斑純化試驗。
2.2.2 低熔點瓊脂糖濃度的優化 低熔點瓊脂糖溶液終濃度為1% 時,第1層覆蓋液凝固不佳,倒置培養過程中出現脫落情況;低熔點瓊脂糖溶液終濃度為3%時,第1層覆蓋液相對較硬;最終選取低熔點瓊脂糖溶液終濃度為2%。
2.2.3 第1層覆蓋液鋪板時間的優化 結果顯示,吸附時間30 min及60 min后鋪第1層覆蓋液,蝕斑數量較少;吸附時間120 min及180 min后鋪第1層覆蓋液,可能因更多的病毒完成吸附,使得細胞病變區域較多,不利于蝕斑的挑取;吸附時間為90 min時,蝕斑數適中,最終確定鋪第1層覆蓋液時間為病毒吸附90 min后。
2.2.4 第2層覆蓋液鋪板時間的優化 分別在完成第1層覆蓋后24、36、48、56 h和72 h鋪第2層覆蓋液,其中24 h和36 h后鋪第2層覆蓋液,蝕斑較小,不易挑取,待蝕斑長大時,中性紅顏色卻變得不明顯;56 h和72 h后鋪第2層覆蓋液,由于病變區域時間過長,蝕斑較多且大小不均;48 h后鋪第2層覆蓋液,3 h后便可在10-5稀釋度觀察到蝕斑(圖2)。蝕斑呈圓形或類圓形,大小較均勻,直徑為1.0~2.0 mm,邊緣清晰。最終確定第2層覆蓋液鋪板時間為第1層覆蓋液鋪板48 h后,此時挑取蝕斑最佳。顯微鏡下觀察,可見病毒在細胞單層上形成明顯的局限性病灶(圖3)。

圖2 FCV感染F81細胞形成的蝕斑Fig.2 Plaque formed by FCV on F81 cellsA:接毒組; B:對照組A:Inoculation group; B:Control group

圖3 FCV感染F81細胞形成的蝕斑 (40×)Fig.3 Plaque formed by FCV on F81 cells (40×)A:接毒組; B:對照組A:Inoculation group; B:Control group
2.2.5 蝕斑純化后蝕斑的挑取及病毒鑒定 經過3輪蝕斑純化,同樣條件下均出現同樣規律的蝕斑。取第3輪挑取的蝕斑病毒培養液,擴大培養后收取細胞培養液,按照病毒RNA提取試劑盒及病毒DNA提取試劑盒說明書提取病毒總RNA和DNA,以獲得的RNA及DNA為模板,按照2.1方法進行FCV和FHV-1 PCR檢測,PCR產物經凝膠電泳檢測后顯示,僅在456 bp處出現FCV特異性片段(圖4),挑取蝕斑FCV RT-PCR檢測陽性率為100%,且通過序列比對,純化病毒無變異,表明FCV分離純化成功。

圖4 蝕斑試驗后PCR鑒定結果Fig.4 PCR identification result after plaque testM:DL-2 000 DNA相對分子質量標準; 1:FHV-1; 2:FHV-1陰性對照; 3:FCV; 4:FCV陰性對照M:DL-2 000 DNA Marker; 1:FHV-1; 2:FHV-1 negative control; 3:FCV; 4:FCV negative control
3 討論
FCV在貓群中感染率較高,主要引起貓口腔潰瘍和上呼吸道疾病[15]。流行病學調查試驗表明,FCV常和FHV-I、貓細小病毒等病原混合感染[16],從臨床發病或者死亡的貓中獲得的病料常常存在多種病毒,除FCV外,其他病毒大多也在細胞上增殖,這大大影響了病毒的分離、病毒滴度測定及生物學特性等試驗。
1952年,Dulbecco將噬菌體空斑技術應用于動物病毒學,病毒蝕斑技術(Virus plaque formation)成為病毒純化克隆和病毒生物學特性試驗的常見方法[17]。病毒蝕斑的形成是由于病毒感染細胞后,在固體介質的限制下,釋放的病毒只能由最初感染的細胞向周邊擴展。經過幾個增殖周期,便形成一個局限性病變細胞區[18]。目前,病毒蝕斑技術在病毒分離和病毒定量方面應用廣泛,但寵物常見病毒的蝕斑純化方法尚未報道。本試驗利用梯度稀釋法對混合毒進行稀釋,然后依次鋪兩層瓊脂覆蓋液對混合毒進行純化,并對FCV蝕斑形成條件進行優化摸索:(1) F81細胞鋪板密度。細胞鋪板密度過大會造成細胞過于密集甚至培養基中有漂浮死細胞,過小細胞未長滿,中間間隙較多,無法滿足蝕斑純化的要求,細胞數為7×105個/mL,每孔2 mL為最適宜。(2)瓊脂糖濃度。瓊脂糖濃度大小直接影響覆蓋液鋪板成功與否,是蝕斑純化關鍵因素之一,濃度過低時,第1層覆蓋液凝固不佳,倒置培養過程出現脫落情況;濃度過高時,第1層覆蓋液相對較硬,影響細胞透氣,最終確定低熔點瓊脂糖溶液適宜終濃度為2%,另外需要注意的是,瓊脂糖現配現用,并避免反復高壓。(3)覆蓋液鋪板時間。通過比較最終確定鋪第1層覆蓋液時間為病毒吸附90 min 后,第2層覆蓋液鋪板時間為第1層覆蓋液鋪板48 h后,此條件最終形成蝕斑數量及大小均適合挑取。添加第1、2層覆蓋液時,速度要快,避免速度慢造成瓊脂糖凝固,同時也要注意避免產生氣泡,否則后期影響蝕斑觀察。(4) 挑取蝕斑。由于FCV形成蝕斑相對較小,挑取蝕斑時應小心,避免碰觸周圍蝕斑。
本試驗完成FCV蝕斑形成條件的優化并建立貓杯狀病毒蝕斑純化方法,該方法具有成本低、操作簡單、試驗周期短、純化效率高等優點,4~5 d即可以完成病毒的純化,有效解決了后續試驗對純凈病毒的要求。本試驗也為其他病毒的分離純化提供了借鑒和方法。

