豬圓環病毒3型TaqMan熒光定量PCR檢測方法的建立及應用
楊 斌 , 黃紅亮 , 方倪然 , 陳瑞愛,
[1. 華農(肇慶)生物產業技術研究院有限公司 , 廣東 云浮 527300 ; 2.廣東溫氏大華農生物科技有限公司 , 廣東 新興 527400 ]
豬圓環病毒(Porcine circovirus)屬于圓環病毒科圓環病毒屬,是一種無囊膜、共價閉合的單股環狀DNA病毒,是目前已知最小的動物DNA病毒,主要由PCV1、PCV2和PCV3組成[1]。PCV3基因組全長約2.0kb,感染后臨床上主要表現為斷奶仔豬多系統衰竭綜合征(PMWS)、豬呼吸道綜合征(PRDC)、皮炎和腎病綜合征(PDNS)、繁殖障礙等疾病[2-3]。自2015年豬圓環病毒3型(PCV3)在美國首次被發現以來,已經在北美洲、亞洲、歐洲三大洲多個國家檢出患病豬只的組織中含有PCV3[3-7]。目前,PCV3已經成為造養豬業損失的重要病因之一,并且還有加劇的趨勢。為了進一步防控PCV3的蔓延,如何能夠準確及時地對患病豬只進行診斷變得尤為重要。實時熒光定量PCR技術是近幾年發展起來的一種新的核酸定量檢測技術。與普通PCR相比,實時熒光定量PCR技術不僅具有操作靈活、速度快、靈敏度高、特異性強等優點,而且還能夠準確定量,實時監控PCR過程,因此目前其已經越來越多應用在豬繁殖與呼吸綜合征病毒(PRRSV)、豬瘟病毒(CSFV)、豬偽狂犬病毒(PRV)、豬圓環病毒2型病毒(PCV2)等豬病毒分子的檢測[8]。
本試驗通過實時熒光定量PCR技術建立了一套針對PCV3的有效檢測方法,并且在臨床上加以應用,本方法的建立為臨床上快速診斷PCV3并及時防控提供了科學依據。
1 材料與方法
1.1 主要材料 PCV3陽性樣品由廣東溫氏研究院惠贈,本試驗所需要的其他豬病陽性樣品如CSFV、PRRSV、PCV2、PRV等均由本實驗保存。
1.2 主要試劑 DNA Marker DL2 000、rTaq聚合酶預混液、膠回收試劑盒、JM109大腸桿菌細胞、T4 DNA連接酶、TaqDNA聚合酶、逆轉錄試劑盒、質粒抽提試劑盒,均購自寶生物工程(大連)有限公司;G-Red核酸染料,購自北京百泰克生物技術有限公司;DNA抽提試劑盒,購自康寧生命科學(吳江)有限公司;LB培養基,購自廣東環凱微生物科技有限公司;瓊脂糖,購自上海翊圣生物科技有限公司;TAE緩沖液,購自上海百賽生物技術有限公司。
1.3 熒光定量PCR方法的建立
1.3.1 探針和引物的設計 根據豬圓環病毒3型PCV3-Hebei-LY_2015毒株(GenBank登錄號:MF318451.1)應用Primer Premier 5.0軟件設計1對引物和探針,由生工生物工程(上海)股份有限公司合成,引物和探針序列見表1。
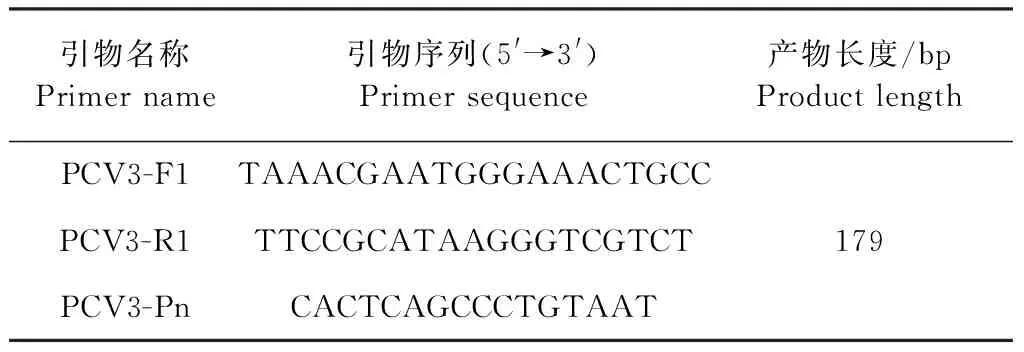
表1 引物探針序列及擴增片段大小Table 1 Primer and probe sequence and amplified fragment size
1.3.2 標準品的制備 將目的片段連接pMD18-T載體,重組質粒并轉化到大腸桿菌,培養含有pMD18-T-PCV3的目的菌株并提取質粒,將構建的質粒經測序鑒定無誤后用紫外分光光度計測定質粒OD值,置于-20 ℃保存。
1.3.3 熒光定量PCR反應體系及條件的優化 對循環數、探針濃度、退火溫度、模板量進行摸索以獲得最佳的反應條件。
1.3.4 標準曲線的建立 經過測定和計算,提取的質粒拷貝數為1.18×1011copies/μL。將標準品稀釋1 000倍后,繼續做10倍系列稀釋,與之相對應的模板濃度分別是1.18×108、1.18×107、1.18×106、1.18×105、1.18×104copies/μL和1.18×103copies/μL。以起始模板數作X軸,Ct值為Y軸做回歸曲線,建立PCV3的標準曲線。
1.3.5 敏感性試驗 為了檢驗TaqMan熒光定量PCR檢測方法的敏感性,模板質粒濃度為1.18×108、1.18×107、1.18×106、1.18×105、1.18×104、1.18×103、1.18×102copies/μL和1.18×101copies/μL,每個濃度做3個重復孔,進行熒光定量PCR檢測。
1.3.6 特異性試驗 提取PCV2、PRV的DNA以及PRRSV和CSFV的RNA(經反轉錄為cDNA),并且按照上述方法進行熒光定量PCR檢測,同時設置空白對照。
1.3.7 重復性試驗 為了檢驗TaqMan熒光定量PCR檢測方法的可重復性和穩定性,本試驗選取濃度為108、107、106、105、104copies/μL和103copies/μL的標準質粒為模板,每個濃度的標準質粒設3個重復孔,進行組內重復試驗;同時每個濃度的標準質粒選取不同時間分別做3次獨立的重復性檢測作為組間重復性檢測。統計組內重復性試驗和組間重復性試驗的平均值、標準差和變異系數(%),以此來評價該檢測方法的重復性和穩定性。
1.3.8 PCV3熒光定量PCR方法臨床檢測 選取30份疑似PCV3感染的仔豬組織樣品用PCV3常規PCR檢測方法和本試驗建立的TaqMan熒光定量PCR檢測方法進行同時檢測,統計PCV3的陽性樣品數量,比較2種檢測方法的敏感性。
2 結果
2.1 標準品的建立 將特異性引物經PCR擴增所獲得的約179 bp的目的條帶回收,連接pMD-18T載體后,轉化大腸桿菌JM109,平板培養后經PCR挑取陽性菌株,測序后與GenBank登錄的PCV3序列比對,同源性為98%~100%,表明該序列確為PCV3序列。取陽性菌株培養提取質粒后,檢測其濃度并計算拷貝數為1.18×1011copies/μL。將質粒作為陽性標準品,置于-20 ℃備用。
2.2 熒光定量PCR反應條件的優化 對熒光定量PCR的循環數、探針濃度、退火溫度、模板量進行摸索得到以下最佳反應體系(20 μL):TaqMan Fast qPCR Master Mix 10 μL,PCV3-FI 0.4 μL,PCV3-R1 0.4 μL PCV3-Pn 0.4 μL,ddH2O 7.8 μL,Template(DNA)1.0 μL。最佳反應程序:95 ℃預變性3 min;95 ℃變性10 s,57 ℃退火15 s,72 ℃延伸30 s,45個循環。
2.3 標準曲線的建立 將構建好的質粒進行10倍系列稀釋,共6個點,每個點做3次重復,通過預試驗選取合適標準品用于制備標準曲線。結果顯示:6個濃度標準品均具有重復性和單一性。根據擴增獲得的各梯度的Ct值,計算并繪制標準曲線(圖1),得到標準曲線方程Y=-3.28X+41.605,斜率=-3.28,擴增效率:E=10-1/斜率-1=10-1/-3.28-1=101.763%,相關系數:R2=0.998,截距=41.605。
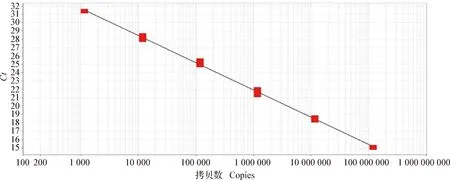
圖1 PCV3 實時熒光定量PCR標準曲線圖Fig.1 PCV3 real-time fluorescence quantitative PCR standard curve
2.4 敏感性試驗 將標準品從1.18×109copies/μL開始10倍系列稀釋,稀釋到11.8 copies/μL,用已經建立的熒光定量PCR檢測方法檢測仍然能夠檢出(圖2)。說明該方法具有良好的敏感性。
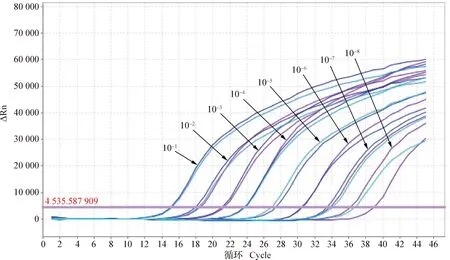
圖2 10倍系列稀釋樣品擴增曲線Fig.2 Amplification curve of 10-fold serial dilution samples
2.5 特異性試驗 提取的PCV2、PRV的DNA以及PRRSV和CSFV的RNA(經過反轉錄為cDNA),按照上述方法進行熒光定量PCR檢測,結果顯示,僅PCV的樣品可擴增出1條標準的S型曲線(圖3),而其他4種病毒均不能擴增出S型曲線,因此,確定PCV2、PRV、PRRSV和CSFV均為陰性,表明該方法特異性好。
圖3 PCV3特異性曲線 Fig.3 PCV3 specific curve
2.6 重復性試驗 經過計算,組內重復性試驗的標準差在0.07~0.24,變異系數在0.35~1.10(表2);組間重復性試驗的標準差在0.12~0.34,變異系數在0.63~1.50(表3)。兩者變異系數均小于2%,試驗結果顯示,該TaqMan熒光定量PCR檢測方法具有極高的穩定性和可重復性。
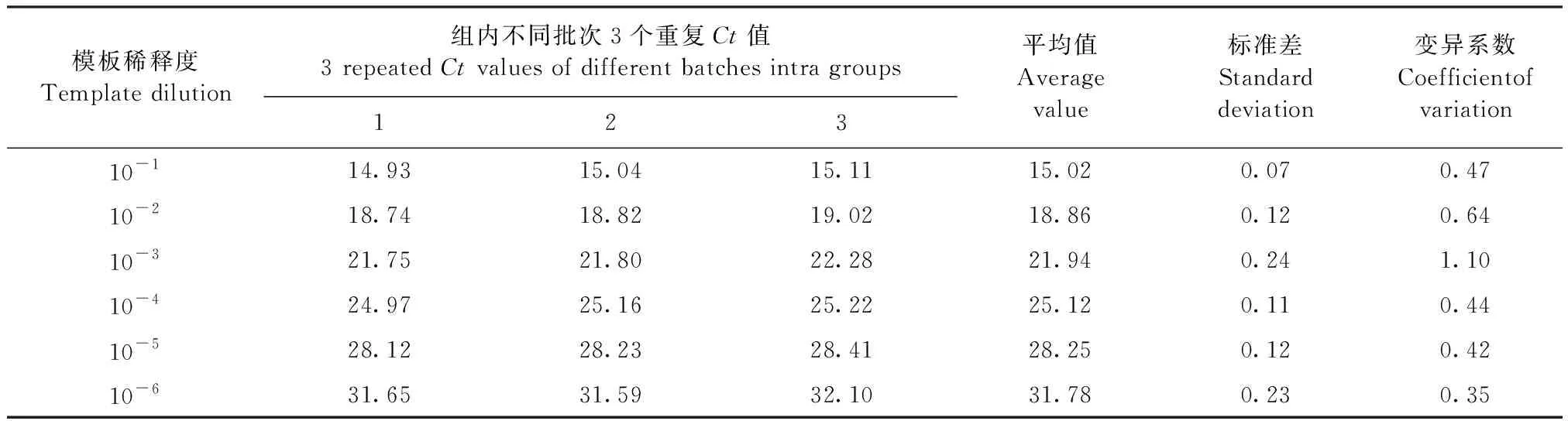
表2 組內重復性試驗Table 2 Intra group repeatability test
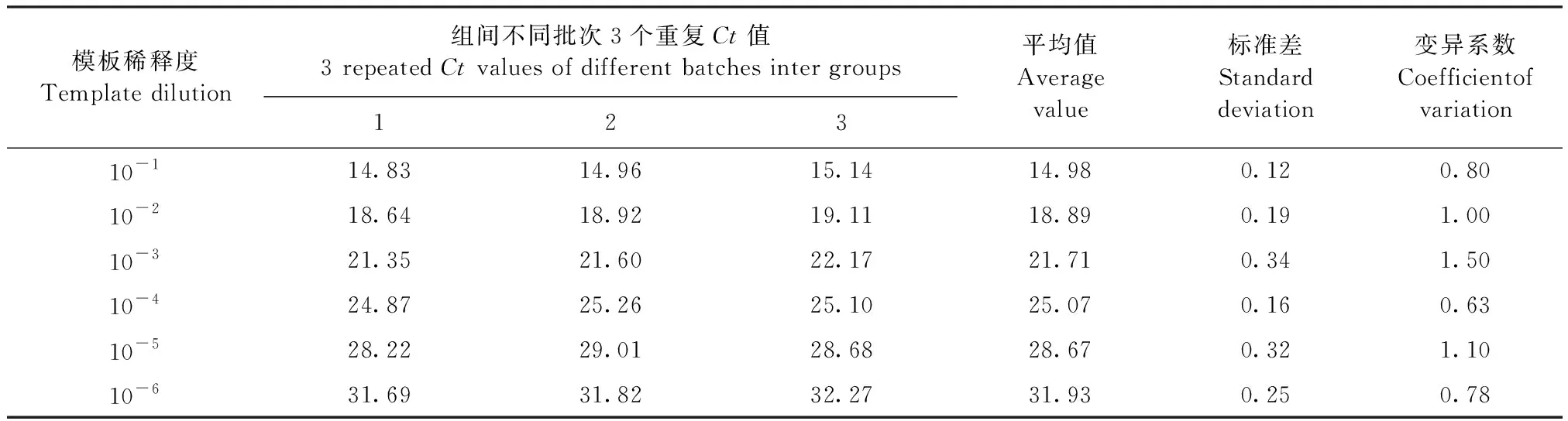
表3 組間重復性試驗Table 3 Inter group repeatability test
2.7 臨床檢測 用PCV3常規PCR檢測方法和TaqMan熒光定量PCR檢測方法對30份疑似PCV3感染的仔豬心臟、肝臟、肺臟、淋巴結、扁桃體等組織樣品進行同時檢測,結果表明:常規PCR檢測方法共檢出17份PCV3陽性樣品,TaqMan熒光定量PCR檢測方法檢出21份PCV3陽性樣品,經研究發現,其中4份樣品中PCV3的病毒含量低于常規PCR檢測方法檢測濃度下限,因此說明TaqMan熒光定量PCR具有更高的靈敏性。
3 討論
2015年6月,美國堪薩斯州立大學Palinski等研究人員從北卡羅來納州的一個暴發皮炎和腎病綜合征(PDNS)的豬場中檢測到一種新型豬圓環病毒,并且通過宏基因組測序和遺傳進化分析將其命名為圓環病毒3型[2]。隨后分別在韓國、巴西、意大利、泰國的患病豬只中檢測到PCV3[4,6-7,9]。2017年,Ku等首次對我國11個省市的PCV3流行情況進行調查,結果顯示:農場陽性率為68.6%(24/35),樣本陽性率為34.7%(77/222),PCV2和PCV3的混合感染率為15.8%(35/222)[10];2018年,趙宇等對河南地區的152份病料進行檢測,其中有46份病料為PCV2和PCV3混合感染,混合感染率為30.3%,還有一部分病料中檢測到了PRRSV、PEDV、PRV存在[11]。由此說明目前PCV3在我國流行已經呈常態化、復雜化且有逐年遞增的趨勢,因此如何及時、準確的檢測PCV3,成為預防和控制PCV3流行蔓延的關鍵。
實時熒光定量PCR技術是近幾年來發展起來的一種新的核酸定量檢測技術,實時熒光定量PCR技術實現PCR從定性到定量的飛躍。實時熒光定量PCR技術是指在PCR反應體系中加入熒光基團,利用熒光信號積累實時監測整個PCR進程,最后通過標準曲線對未知模板進行定量分析的方法,這種方法不僅具有特異性強,自動化程度高,而且還能夠有效防止污染,準確定量,實時監控,目前臨床上多采用SYBR Green法檢測PCV3[12],但是由于染料能夠與任意DNA雙鏈結合發光,所以很容易與非特異性雙鏈DNA結合,產生假陽性,導致特異性較差[8]。實時熒光定量技術主要分為SYBR Green法和TaqMan探針法。由于SYBR Green法價格相對便宜并且實現了全閉管式操作,減少了假陽性現象的出現,同時探針技術的高特異性和光譜技術的高敏感性既克服了常規PCR技術只能實現定性檢測的不足,又解決了SYBR Green法特異性不強等缺點,更加適應臨床檢測[13-14]。
本試驗首次通過在PCV3 Cap蛋白上設計引物增強了檢測的準確性,該檢測方法實現了全閉管式操作,減少了假陽性現象的出現,同時TaqMan探針技術的高特異性和光譜技術的高敏感性既克服了常規PCR技術只能實現定性檢測的不足,又解決了SYBR Green法特異性不強等缺點,更加適應臨床檢測;該方法靈敏度高,特異性和重復性較好,最低檢測下限為11.8 copies/μL,經與目前已發表的豬圓環病毒3型Real-time PCR等檢測方法進行比較發現,該方法具有特異性強、靈敏度高、重復性好等優勢,該方法的建立為PCV3的早期快速檢測及其流行病學調查,以及預防和控制我國PCV3的流行提供了快速、簡便和可靠的技術工具。

