豬源摩氏摩根菌的分離與鑒定
朱來萍 , 張 昇 , 楊仕標 , 詹建舉 , 李鷙隆 , 劉丁予 , 王生奎 , 姚 俊
(1. 云南農業大學動物醫學院 , 云南 昆明 650201 ; 2. 云南省畜牧獸醫科學院 云南省熱帶亞熱帶動物病毒病重點實驗室 , 云南 昆明 650224 ; 3.云南鷙坤生態農業有限公司 , 云南 昆明 650502 ; 4.昆明市陽宗海風景名勝區管理委員會農業農村局 , 云南 昆明 650502)
2018年9-10月,云南省昆明市郊某規模化豬場飼養的保育豬群散發腹瀉,雖然發病率及病死率不高,但腹瀉持續發生。通過投喂治療腹瀉的混試劑藥物及飲水用藥進行治療,但療效欠佳。從藥物治療效果不佳的結果初步判斷為病毒性腹瀉,本試驗遂采集了6份臨床腹瀉糞便樣品,開展了引起豬腹瀉的常見病毒——豬流行性腹瀉病毒(Porcine epidemic diarrhea virus,PEDV)、豬傳染性胃腸炎病毒(Transmissible gastroenteritis of swine virus,TGEV)、豬Delta冠狀病毒(Porcine delta coronavirus,PDCoV)、輪狀病毒A群(Rotavirus A,RVA)的核酸RT-PCR檢測,但檢測結果均為陰性,排除了上述腹瀉病毒感染的可能。為了盡早查明腹瀉病因,采取對應的有效治療及防控措施,本試驗開展了腹瀉仔豬病料的病原菌分離、培養和鑒定工作。
1 材料與方法
1.1 材料 云南省昆明市郊某規模化豬場采集的腹瀉仔豬肛門棉拭子樣品6份。
1.2 主要試劑 營養瓊脂培養基、革蘭染液,均購自杭州濱和微生物試劑有限公司;Gibco新生犢牛血清、厭氧環境發生劑、病毒基因組RNA提取試劑盒(MagMAX-96 Viral RNA Isolation Kit),均購自美國ThermoFisher Scientific公司;細菌基因組DNA提取試劑盒及DNA Marker 2 000,均購自天根生物技術(北京)有限公司;一步法RT-PCR試劑盒(One Step RT-PCR Kit),購自寶生物工程(大連)技術有限公司。生化鑒定及藥敏測定讀板儀(ATB Reader)、細菌濁度測定儀(DENSIMAT)、腸桿菌科鑒定試條(ID 32E)、獸用細菌藥敏鑒定試條(ATBTMVET)、API NaCl 0.85%培養基及ATB培養基,均購自法國梅里埃公司。
1.3 實驗動物 14只昆明小鼠,購自昆明醫科大學實驗動物中心。
1.4 引物 細菌16S rRNA通用擴增引物序列參考文獻[1]中的引物序列,委托昆明碩擎生物科技有限公司合成。引物、探針信息見表1。

表1 引物和探針信息Table 1 Primers and probes informations
1.5 豬主要腹瀉病毒核酸的RT-PCR檢測 將采集的6份腹瀉仔豬肛門棉拭子樣品分別勻漿、震蕩靜置后,取上清抽提病毒RNA進行PEDV、TGEV、PDCoV、RVA的病毒核酸RT-PCR檢測。
1.6 細菌分離培養、純化,形態學觀察及氧化酶試驗 用無菌接種環取適量腹瀉仔豬肛門棉拭子樣品,劃線接種于血清瓊脂平板,置于37 ℃厭氧培養和5%、CO2培養箱培養24~72 h后,取出觀察菌落生長情況,并挑取單菌落進一步劃線純化培養,然后對純化后的菌株進行革蘭染色并置于1 000倍光學顯微鏡(油鏡)下觀察菌體形態,同時對菌株進行氧化酶試驗。
1.7 分離菌株的16S rRNA序列擴增、測序及序列分析 取適量純培養的分離菌株抽提細菌基因組DNA,操作方法按照細菌基因組DNA抽提說明書進行。以抽提純化的DNA樣品為模板進行PCR擴增,PCR的反應體系為25 μL:2×TaqPCR Master Mix 12.5 μL,上、下游引物(10 μmol/mL)各 1 μL,模板 DNA 4 μL,無核酸酶的離子水補至25 μL。PCR反應條件:95 ℃預變性3 min;94 ℃變性 30 s, 57 ℃退火30 s,72 ℃延伸90 s,共35個循環;72 ℃ 延伸5 min。擴增產物經 1.25%瓊脂糖凝膠電泳檢測。將PCR產物送至昆明碩擎生物科技有限公司測序,所得序列經DNASTAR軟件進行拼接、校對后,在NCBI GenBank中進行BLAST比對分析。
1.8 細菌生化及藥敏鑒定 選用法國梅里埃ID 32E生化鑒定試條對分離菌株進行細菌生化鑒定,具體操作按照說明書進行,接種后鑒定試條置于37 ℃、 5%CO2培養箱培養24 h±30 min,讀板前滴加1滴JAMES生化試劑于IND孔(吲哚試驗)后讀取結果。選用法國梅里埃細菌藥敏鑒定試紙條(ATB VET)對分離菌株進行細菌藥敏鑒定,具體操作按照說明書進行,接種后于37 ℃、5%CO2培養箱培養24 h±30 min后讀取結果。
1.9 實驗動物致病性試驗 用接種環取適量純化的摩氏摩根菌菌落,懸浮于無菌生理鹽水后測定細菌濃度,并稀釋為2.1×109CFU/mL的細菌濃度,腹腔接種成年昆明小鼠0.3 mL/只,總計接種10只作為試驗組,同時給4只成年昆明小鼠接種同等劑量的無菌生理鹽水作為對照組。接種后每日觀察并記錄小鼠的發病及死亡情況,及時剖檢發病死亡小鼠并觀察內臟器官的病理變化,無菌采集其內臟組織進行致病菌株的回收試驗。
2 結果
2.1 豬主要腹瀉病毒核酸的RT-PCR檢測 送檢的6份腹瀉仔豬肛門棉拭子樣品的豬流行性腹瀉病毒、豬傳染性胃腸炎病毒、豬Delta冠狀病毒、輪狀病毒A群RT-PCR檢測結果均為陰性。
2.2 細菌的分離培養 在37 ℃、5%CO2培養箱中培養的血清瓊脂平板上生長出無色至淡黃色、圓形、凸起、光滑、邊緣整齊的菌落(圖1),37 ℃厭氧培養條件下血清瓊脂平板上均無任何菌落生長。

圖1 分離菌株在血清瓊脂平板上菌落形態Fig.1 Bacterial colonies on serum agar plate
2.3 分離菌株的鏡檢 分離菌株經革蘭染色鏡檢,菌體大小為(0.6~0.7)μm×(1.0~1.7)μm,散在排列,呈球狀、桿狀,有鞭毛,無莢膜,無芽孢的革蘭陰性短桿菌(圖2)。
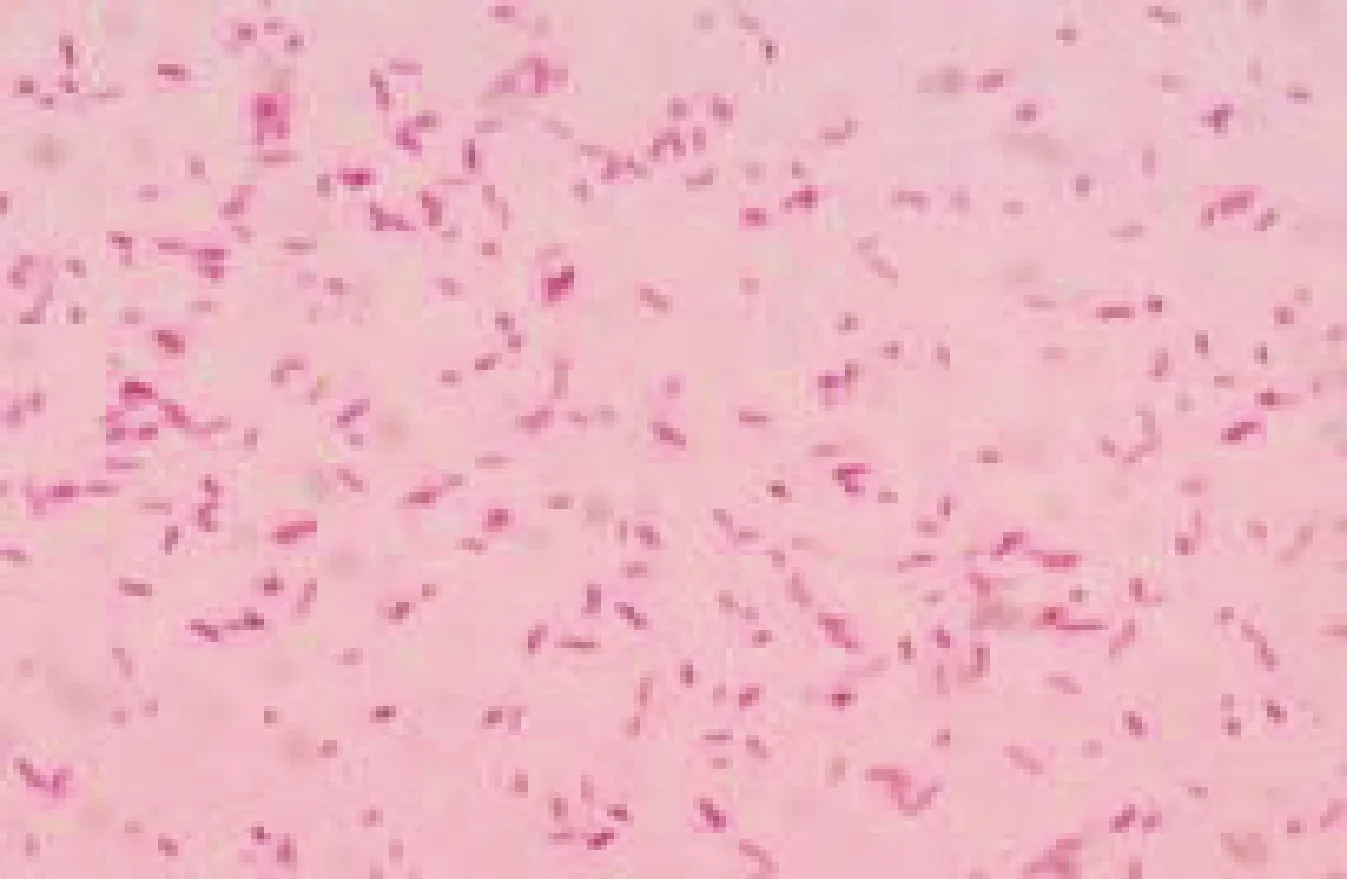
圖2 革蘭染色鏡檢結果(1 000×)Fig.2 Gram staining results (1 000×)
2.4 分離菌株的氧化酶試驗 腹瀉仔豬糞便分離出致病菌株的氧化酶試驗結果為陰性。
2.5 細菌16S rRNA基因的PCR擴增及序列分析 用細菌 16S rRNA 通用引物 PCR擴增獲得該分離菌株的目的基因片段 (圖3)。由圖3可知,目的基因片段大小約為1 415 bp,此片段PCR產物測序,得到1 387 bp的序列,將測定序列進行BLAST比對,結果顯示該菌與摩氏摩根菌的符合率為99%,判定該分離菌株為摩氏摩根菌。將分離菌株16S rRNA序列的測序結果與NCBI GenBank中不同來源的摩氏摩根菌的序列進行比較分析,結果顯示,分離菌株與SDTA-2 株(MH299416.1)和FDAARGOS-172株(CP014026.2)同源性達99.78%。
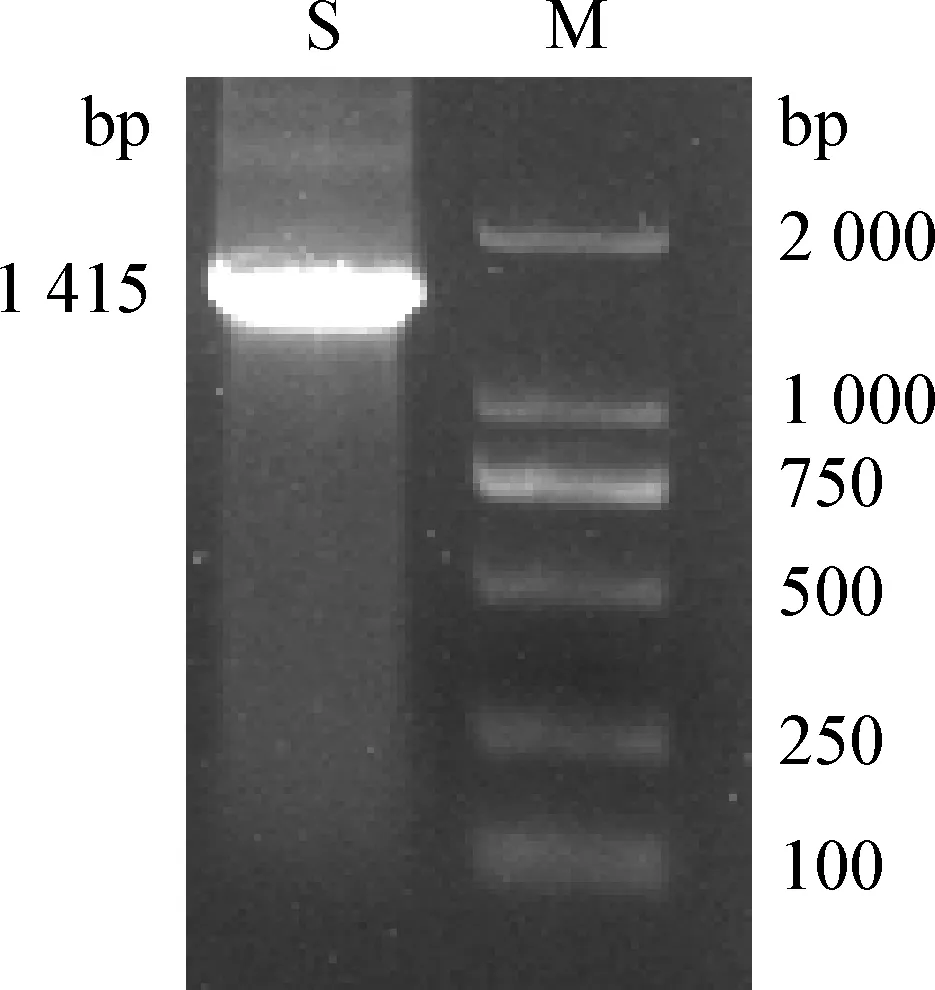
圖3 分離菌株的16S rRNA PCR擴增結果Fig.3 PCR amplification results of 16S rRNA gene from the isolateM:DL2 000 DNA Marker; S:分離菌株M:DL2 000 DNA Marker; S:The isolated bacterial strain
2.6 細菌的生化鑒定 生化鑒定結果表明該分離菌株為摩氏摩根菌的可能性是99.9%(ID%),鑒定結果見表2。

表2 分離菌生化鑒定結果Table 2 Biochemical identification results of the isolate


表3 分離菌藥敏試驗結果Table 3 Drug sensitivity test results of the isolate
2.8 實驗動物致病性試驗 腹腔接種致病菌的10只 試驗組小鼠于6 h后可觀察到精神沉郁,飲食欲減退,分別于48 h內死亡6只,腹腔接種同等劑量的4只對照組小鼠飲食、精神狀況均正常。剖檢可見發病死亡小鼠的肺臟充血、出血,肝臟、腎臟及脾臟腫大,胃腸道漿膜面充血,并成功從肝臟及心血樣品分離培養回收到同一菌株。
3 討論
近年來,由于豬流行性腹瀉等病毒性腹瀉在云南乃至全國均有發生和流行,鑒于2018年9-10月云南省昆明市郊某規模化豬場發生的仔豬腹瀉案例,雖然臨床上主要是保育豬群中存在持續性、散發性腹瀉,糞便形態也并非水樣,但為了排除豬流行性腹瀉等病毒性腹瀉的可能,本試驗首先對采集的腹瀉仔豬肛門棉拭子樣品進行了PEDV、TGEV、PDCoV、RVA核酸的RT-PCR檢測。在排除了病毒性腹瀉的前提下,為了進一步查明病因,遂開展了病原菌的分離、培養及鑒定。
摩氏摩根菌(M.morganni)隸屬于摩根菌屬(Morganella),腸桿菌科。該屬有2個種和2個亞種,即摩氏摩根菌(M.morganni)、耐冷摩根菌(M.psychrotolerans)、摩氏摩根菌摩根亞種(M.morgannisubsp.morganni)和摩氏摩根菌西伯尼亞種(M.morgannisubsp.sibonni)[1]。摩氏摩根菌(M.morganni)是一種革蘭陰性兼性厭氧腸道桿菌,大小約為(0.6~0.7)μm×(1.0~1.7)μm,散在排列,無明顯莢膜,無芽孢[2]。該菌于1906年首次被摩根等從小兒糞便中分離出[3],基因組大小約為4 000k, 其蛋白編碼序列(CDSs)約為4 000個[4]。摩氏摩根菌在自然界中分布廣泛,通常存在于人類、哺乳動物和爬行動物的腸道中,是正常菌群的一部分[5]。摩氏摩根菌對人類而言,這種機會性病原體不容疏忽,能導致人體敗血癥、膿腫、蜂窩組織炎等[6],該菌通常是從人糞便中分離出,常與尿路感染有關[7]。
近年來,摩氏摩根菌耐藥性呈上升趨勢,這種耐藥性主要是遺傳和流動性因素導致[8-9],該菌本質上對大多數對其有活性的抗生素是敏感的,如氨基糖苷類、氯霉素、環丙沙星等,但對磷霉素、大腸菌素和某些抗生素耐藥[10-11]。這種多藥耐藥(MDR),甚至廣泛耐藥(XDR)容易導致摩氏摩根菌引起的感染在臨床上治療失敗[12-14]。本試驗對摩氏摩根菌分離菌株的藥敏試驗結果也顯示其耐藥菌譜較廣,對法國梅里埃細菌藥敏鑒定試條(ATB VET試條)上的所有28種藥物均耐藥,這在開展本試驗的獸醫實驗室藥敏檢測中還是第1次遇到,提示該條件致病菌在獸醫臨床上的潛在危害同樣值得引起重視,同樣提示當前養殖環境中的細菌耐藥現象依然嚴重,養殖環節的獸藥濫用現象依然突出。在國內,由摩氏摩根菌引起大鯢、中華鱉、禽蛋、胡子鯰、黑山羊被感染的案例有見報導[15-20],但關于哺乳動物源的摩氏摩根菌致病案例報導較少,特別是豬源摩氏摩根菌的分離鑒定到目前為止尚未見報導。

