無前導肽細菌素研究進展及在動物養殖中的應用
張曉峰 , 徐艷超 , 任蘭蘭 , 王一博 , 王海花 , 潘春梅
(1.河南牧業經濟學院食品與生物工程學院 , 河南 鄭州 450046 ; 2.河南牧業經濟學院動物醫藥學院 , 河南 鄭州 450046)
抗生素的開發和應用是人類20世紀最重要的科學成就,其在動物養殖中的廣泛應用,雖然其在促進動物生長、提高經濟效益方面發揮了巨大的作用,但藥物殘留和耐藥性嚴重威脅人類健康,因此,抗生素替代品的開發成為人們關注的熱點。細菌素是細菌在代謝過程中由核糖體合成的、對產生菌具有自身免疫性的一類具有抗菌活性的多肽類物質,具有體內外抑菌活性高,對人體無毒,可選擇性強,不易產生交叉抗性,易于生物改造等特點,是良好的抗生素替代品[1]。然而,細菌素產量較低,規模化生產較難,成本較高等因素制約了細菌素的大范圍應用。與大多數細菌素不同,無前導肽細菌素是一類由核糖體合成、翻譯后不進行任何修飾即具有活性的細菌素[2],該類細菌素遺傳結構簡單,易在其他微生物細胞中表達,便于通過生物工程進行規模化生產,抗菌機制獨特,有巨大的商業應用潛能。本文對無前導肽細菌素的類型、理化特性、來源、結構特征、生物合成、抗菌機制及在動物養殖中的應用及發展前景進行了綜述。
1 無前導肽細菌素類型、理化特征、來源及結構特征
Cotter等[3]根據細菌素結構特征將其分為兩大類:翻譯后修飾細菌素(I類細菌素)和翻譯后非修飾細菌素(II類細菌素),其中I類細菌素又分為12小類,II類細菌素又分為5小類,細菌素類型及結構特征見表1。

表1 細菌素類型及結構特征
按上述分類系統,無前導肽細菌素屬翻譯后非修飾IId類細菌素。自1998年第1個無前導肽細菌素Enterocin L50報道以來,至今已鑒定出11種不同種屬33個無前導肽細菌素。該類細菌素通常含27~53個氨基酸殘基,分子量相對較小,富含賴氨酸而缺少半光氨酸殘基,帶2~8個不等正電荷,有較高等電點,通常在N端甲酰化形成甲酰甲硫氨酸[4-8]。按其氨基酸序列的保守性可分為四類,見表2。

表2 無前導肽細菌素類型及結構特征
2 無前導肽細菌素的生物合成
通常,細菌素的生物合成分為3個過程,首先合成無活性的、N端含有前導肽序列的前體肽,然后前體肽在修飾酶的作用下進行翻譯后修飾,最后除去前體肽中的前導肽序列從而變為有活性的成熟肽(圖1)。前導肽是細菌素生物合成酶的識別位點,是酶-底物相互作用所必需的,并對細菌素產生菌有保護作用。大部分細菌素前導肽的切割和分泌需要其專門的前導肽序列,前導肽在細菌素的生物合成中起重要作用[9]。長時間以來,人們認為前導肽是細菌素生物合成所必需的,然而,無前導肽細菌素的生物合成過程卻不形成前導肽序列,在翻譯后不經任何修飾即轉變有活性的成熟肽。
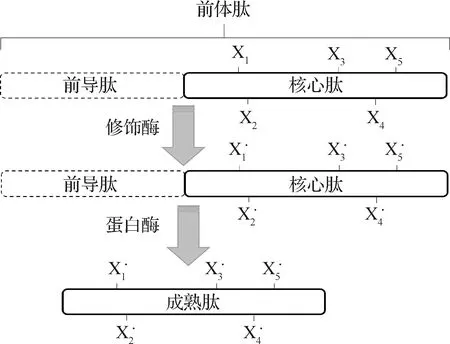
圖1 細菌素生物合成示意圖[8]修飾的殘基
無前導肽細菌素簡單的遺傳結構使其很容易與其他微生物蛋白的N端擴展融合,因此也更容易被其他細菌、真菌或真核細胞表達。如來源于乳酸乳球菌的Lactcin Q和來源金黃色葡萄球菌的Aureocin A53能夠在大腸桿菌(E.coli) BL21中大量表達,來源E.faeciumL50的雙肽細菌素Enterocin L50A和Enterocin L50B已經在釀酒酵母和畢赤酵母中成功表達[10],除此之外,細菌素Lactcin Q也已在枯草芽胞肝菌中成功表達[11]。枯草芽胞桿菌在動物腸道中能夠發揮重要的促進作用,其作為益生菌廣泛應用于動物養殖業,酵母菌也是常用于動物養殖的腸道益生菌。細菌素在腸道益生菌中的成功表達能夠增強益生菌的競爭優勢,促進其在腸道中的定植。另外,無前導肽細菌素簡單的遺傳結構也便于進行分子改造,生產出新型的、更具優勢功能的細菌素,同時進行規模化生產。如在菌株Lc.garvieae基因組中增加無前導肽細菌素Garvicin KS基因簇的拷貝數、優化培養基成分、優化培養條件可使該細菌素產量增加2 000倍[12]。
3 無前導肽細菌素的抗菌機制
通常細菌素通過與靶標細胞膜上特定受體結合形成“孔道”結構破壞細胞膜或抑制細胞壁形成發揮作用,如羊毛硫細菌素Nisin和細菌素Pediocin PA-1[13-14]。無前導肽細菌素通常帶正電荷,能與帶負電荷的靶標細胞膜相互作用形成“孔道”結構,使靶標細胞核酸、細胞質及相關離子等重要內容物泄露,膜電位消失、大分子合成終止而殺死細菌(圖2)。同時,疏水作用在與靶標細胞膜的相互作用過程中也發揮了重要作用,因此,大多數無前導肽細菌素如Enterocin 7A、Enterocin 7B、Aureocin A53及Lactcin Q發揮抑菌作用不需要任何受體參與,抑菌譜較廣[15-16]。如Lactcin Q首先通過靜電吸引與靶標細胞膜結合,然后通過滲透在靶標細胞膜上形成“環形孔”使細胞內容物泄露從而殺死細菌[17]。Enterocin 7A、Enterocin 7B同樣通過靜電吸引和疏水作用與靶標細胞膜結合,隨后α-螺旋解旋,疏水核暴露并插入膜靶標細胞膜中[18]。
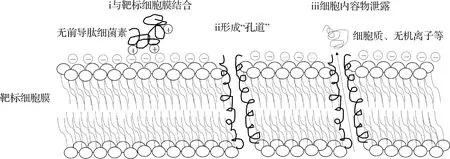
圖2 無前導肽細菌素抗菌機制示意圖
4 無前導肽細菌素在動物養殖中的應用
細菌素是細菌在代謝過程中由核糖體合成的、對產生菌具有自身免疫性的一類具有抗菌活性的多肽類物質[19]。細菌素在生物合成、作用模式、抗性機制及抗菌活性方面與抗生素存在明顯不同。細菌素是由微生物細胞核糖體合成機制產生的一種抗菌肽,而抗生素是由細胞產生的次級代謝產物;與抗生素生產菌不同,細菌素產生菌能夠耐受其所產細菌素的影響;多數細菌素不需要任何受體,可以與靶標細胞上任何部位作用,通過與靶標細胞膜的相互作用產生空隙,使細胞內容物泄露而導致細胞死亡,而抗生素通常通過抑制細胞壁的合成,阻斷細胞內蛋白質的表達,破壞DNA和RNA的復制來殺死靶標細胞;抗生素耐藥性的增加取決于遺傳因素的變化,能夠從一代傳遞到下一代,而細菌素靶標細胞對細菌素的抗性主要與靶標細胞膜的化學組成相關,傳遞到下一代的可能性較小。細菌素無毒,易被蛋白酶降解而不殘留,對很多抗生素抗性菌株有作用,可原位生產使其產生菌更具競爭優勢,許多腸道細菌需要細菌素的產生才能定植[20],腸道益生菌通過細菌素的產生更易定植于宿主而發揮作用。無前導肽細菌素遺傳結構簡單,易于在益生菌中表達,便于規模化生產,該類細菌素抑菌譜范圍較窄但種類多樣,能夠在其發揮抑菌作用的同時較少影響宿主共生微生物,維持腸道菌群平衡,同時,多數無前導肽細菌素是由分離自食品或動物腸道的乳酸菌所產生,這些產生菌本身就是益生菌,具有天然的安全性。如無前導肽細菌素Garvicin KS、LsbB是從商品牛奶中分離到的乳酸菌所產生,Enterocin Q是從碎牛肉中分離到的糞腸球菌所產生,這些特性使無前導肽細菌素在動物養殖中的應用更具優勢。
細菌素既可以通過添加到飼料或直接飼喂動物而發揮作用,也可以通過添加產細菌素的益生菌來發揮作用。從內蒙古牛、羊腸道中篩選的乳酸菌N8603可產生對強毒沙門桿菌、強毒雞白痢桿菌、強毒大腸桿菌、腐生葡萄球菌等腸道致病菌有抗菌活性的細菌素,該細菌素有望開發為動物飼料添加劑[21]。來源于枯草芽胞桿菌的細菌素對魚的4種致病菌有很好的活性,能夠有效降低印度鯉科魚類細菌致病性[22]。細菌素Subtilosin A來源于同時能夠產蛋白酶、淀粉酶、纖維素酶及脂肪酶的1株枯草芽胞桿菌,該細菌素可有效減少肉雞腸道致病菌的感染[23]。細菌素Lacticin 3147的攝入能有效降低動物鏈球菌的感染,能夠用于奶牛乳腺炎的治療,飼喂分離純化自商業肉雞盲腸中唾液乳桿菌所產的細菌素可以明顯減低雛雞腸道中的空腸彎曲桿菌[24-25]。同時,將產細菌素益生菌應用于動物養殖中不僅可以抑制腸道致病菌的增殖,而且能夠增強益生菌的定植能力,促進益生菌的作用效果。研究證實,枯草芽胞桿菌能夠在動物腸道中完成由芽胞營養體到芽胞的過程,能產生細菌素的枯草芽胞桿菌可以使其在與其他腸道菌群競爭中獲得優勢而定植[26]。另外,由于部分細菌素抑菌譜較窄而不易破壞宿主原菌群結構,如細菌素Thuricin CD與萬古霉素、甲硝唑的抗菌活性相當,但Thuricin CD并不改變宿主共生菌結構,而萬古霉素、甲硝唑的使用卻使宿主變形桿菌門的細菌明顯增加而其他細菌減少[27]。
研究表明,不同類型無前導肽細菌素對部分病原菌有協同作用,如Garvicin KS與Polymyxin B聯合使用對不動桿菌和大腸桿菌有協同抑菌活性,Garvicin KS與Polymyxin B、Nisin聯合使用能夠快速殺滅并完全根除不動桿菌和大腸桿菌,Garvicin KS與Nisin聯合使用對金黃色葡萄球菌有協同作用,Garvicin KS與Nisin、金合歡醇聯合使用在低濃度下能快速根除黃色葡萄球菌[28]。
5 存在問題及展望
細菌素作為抗生素的替代品已廣泛應用于動物養殖行業,然而多數僅對其抑菌活性及在動物養殖中的促生長作用進行了研究,而對其氨基酸序列、空間結構及作用機制并沒有深入開展。對于無前導肽細菌素而言,目前分離和鑒定的數量很少,源于益生菌的無前導肽細菌素更少,源于動物腸道益生菌的無前導肽細菌素幾乎沒有,且僅有Aureocin A53、Lactcin Q、LsbB及Enterocin 7四種無前導肽細菌素的三維結構獲得解析,其生產、調節及作用方式的分子機制尚未完全了解,這將會限制無前導肽細菌素在動物養殖中的應用。隨著生物技術的發展,大量微生物基因組的公布和細菌素在線比對工具的應用,越來越多的無前導肽細菌素將會被發現和鑒定,更多的無前導肽細菌素空間結構及作用機制也將會揭示[29]。因來源于動物腸道的益生菌具有原位定植和促進動物腸道健康的優勢,源自動物腸道益生菌的無前導肽細菌素能夠發揮更好的原位抑菌效果,因此將源于不同種類動物腸道益生菌的無前導肽細菌素應用于原宿主是細菌素在動物養殖應用中的發展方向,加之該類細菌素遺傳結構簡單、易于進行分子改造,易于在其他微生物或益生菌中表達,易于利用生物工程進行規模化生產,這些特性使其在未來的動物養殖業中有更廣泛的應用前景。

