用優化的切向流超濾法提高環境水中對蝦白斑綜合癥病毒的濃度及檢測效率
張 娜 , 劉 葒 , 謝艷輝 , 黃 磊 , 孫思陽 , 斯澤恩 , 李家僑
(1. 湛江海關技術中心 , 廣東 湛江 524000 ; 2. 深圳海關動植物檢驗檢疫技術中心 , 廣東 深圳 518045 ;3. 南昌海關技術中心 , 江西 南昌 330038)
環境DNA(Environmental DNA,eDNA)是環境樣本中發現的許多不同生物體基因組DNA的復雜混合物[1]。土壤、沉淀物、水甚至糞便被視為環境樣品,其中也包括過濾空氣或水、過濾沉積物或大塊狀樣品所產生的物質[2]。水作為水產養殖的重要環境介質,是病毒傳播和運輸的最重要的組成部分[3],但是由于水中的病毒滴度低,并且水的樣品成分復雜,需要進行水樣品處理來得到足夠量的病原數量進行檢測,而在這方面的研究較少。從大量的環境水中進行病毒的濃縮,來研究水環境DNA中的病毒檢測方法對樣品處理要求較高。
白斑綜合征病毒(White spot syndrome virus,WSSV)是一種包膜雙鏈DNA病毒,屬于線頭病毒科(Nimaviridae)白斑病毒屬。WSSV病毒粒子呈卵圓形、橢圓形或桿狀,規則對稱,直徑80~120 nm,長250~380 nm。它已成為蝦養殖中的一種破壞性病毒病原體。該病毒的宿主范圍廣泛,WSSV可垂直傳播,也可經水和攝食感染組織(如殘食同類、捕食等)進行水平傳播,或通過諸如多毛蠕蟲、餌蝦、輪蟲甚至可能是鳥類等攜帶者傳播[4]。一些研究嘗試在水中檢測WSSV。
Hossain等[5]通過聚合酶鏈反應(PCR)對水樣離心分離得到的沉積物進行了測試,并報告了12份蝦池和水樣中的5份檢測WSSV呈陽性,該方法對病毒顆粒通過過濾器,并在低速離心后使病毒保持懸浮狀態。Quang等[6]研究稱,可以在沿海環境中檢測到WSSV,如病蝦池和周圍運河,使用膜過濾,該方法僅捕獲黏附在過濾膜上的海水顆粒物上的病毒。這些研究采用離心法和膜過濾法,未采用病毒濃縮法,因此,這些方法可能低估了水中真實的病毒量。
切向流過濾(Tangential flow filtration,TFF)是指液體流動方向與過濾方向呈垂直方向的過濾形式,采用交叉流動過濾形式,流向是切向于過濾膜表面。只有小部分液體透過過濾介質,截留的顆粒從膜的表面被“掃除”。切向流膜過濾技術適用于較大規模樣品處理。傳統的微孔過濾,包括除菌過濾所采用的過濾形式,其液體的流動方向與過濾方向一致,隨著過濾的進行,過濾膜表面形成的濾餅層或凝膠層厚度逐漸增大,流速逐漸降低。當過濾介質為孔徑細小的超濾膜或微濾膜時料液中固形物含量很高時,流速將急速降低,因此傳統的過濾只能處理小體積的樣品。對于較大規模的樣品過濾時,需要采用切向流過濾方式,液體流動在過濾介質表面產生剪切力,減小了濾餅層或凝膠層的堆積,保證了穩定的過濾速度。
本試驗是探討切向流過濾超濾(Ultrafiltration,UF)技術濃縮養殖水樣中的病毒濃度的有效性,以特異性檢測WSSV病原體,對水生動物環境水中的病毒研究提供有效的樣品處理方法。
1 材料與方法
1.1 試驗材料 實驗室保存的患白斑綜合癥的南美白對蝦陽性樣品;DNeasy Blood and Tissue Kit(Qiagen,德國);PremixExTaq(Probe qPCR),購自寶生物(TaKaRa)工程(大連)有限公司;微滴式數字PCR用探針法反應預混液(含dUTP)、樣本制備通用試劑盒(廣州永諾生物科技有限公司);PCR管、吸嘴等均為Axygen產品。0.2 μm孔徑TFF濾筒(CFP-2-E-4MA,表面積420 cm2),超濾濾柱UFP-100-C-4MA、UFP-300-C-4MA、UFP-100-E-4MA(GE Health Care Bio Sciences Corp.)。
1.2 主要儀器設備 熒光定量PCR儀(ABI 7500);高速冷凍離心機(Eppendorf centrifuge 5417R);真空泵(津騰,GM-0-33A);基因擴增儀(ETC 811,東勝龍);真空離心濃縮儀(ZL3-1K,湖南可成儀器);數字PCR樣本制備儀(MicroDrop-100A,廣州永諾生物科技有限公司);數字PCR生物芯片閱讀儀(MicroDrop -100B,廣州永諾生物科技有限公司)。
1.3 試驗方法
1.3.1 預過濾 取直徑為50 mm的孔徑為1 μm的玻璃纖維素膜進行雜質預初濾去除較大顆粒物,濾過的水經過50 mm的孔徑為0.65 μm的玻璃纖維素膜經過初濾,保存濾過的水和膜。
1.3.2 微過濾 經過預過濾的水經過初過濾后水樣放置在“原液瓶”中,通過連接管連接蠕動泵、壓力表、0.2 μm孔徑過濾柱(CFP-2-E-4MA)。過濾柱出來的樣品分別接回流管和透過液管。回流管連接“原液瓶”,透過液管連接“透過液瓶”。
取“透過液瓶”進行下一步處理。每次使用后,用200 ppm游離氯和0.5 mol/L氫氧化鈉溶液對過濾系統進行過濾消毒1 h。檢查滲透物的酸堿度達到pH 7.0,以確保完全去除次氯酸鈉。
1.3.3 水中病毒富集 經過微過濾后“透過液瓶”的水樣全部放置在“濃縮液瓶”中,通過連接管連接蠕動泵、壓力表、100kDa孔徑超濾濾柱(UFP-100-C-4MA)的過濾裝置中進行病毒濃縮。調節蠕動泵控制控制濃縮過程的壓力為0.2~0.3 bar。當“濃縮液瓶”中樣品濃縮為100~150 mL時,可結束濃縮。每次使用后,用200 ppm游離氯和0.5 mol/L氫氧化鈉溶液對過濾系統進行過濾消毒1 h[7]。
1.3.4 水濃縮樣品總DNA提取 取濃縮液和透過液,分別使用DNeasy Blood and Tissue Kit試劑盒進行DNA核酸抽提,采用世界動物衛生組織(OIE)《水生動物疾病診斷手冊》[8]中WSSV熒光PCR方法的引物和探針序列進行病毒檢測,F:5′-TGGTCCCGTCCTCATCTCAG-3′;R:5′-GCTGCCTTGCCGGAA-ATTA-3;探針 5′-FAM-AGCCATGAAGAATGCCGTCTATCACACA-TAMRA-3′。
1.3.5 數字PCR檢測方法建立 微滴式數字PCR用探針法反應預混液(含dUTP) 5 μL、引物-F(10 μmol/L) 1.8 μL、引物-R(10 μmol/L)1.8 μL、探針(10 μmol/L) 0.5 μL、模板 10 μL,總體積為 20 μL。 (1)將微液滴生成芯片置于芯片卡座中,向油相孔加入40 μL微液滴生成油,向樣本孔中加入20 μL 已加入樣本的PCR反應水相。待油相和水相加入完成后,蓋上微液滴生成芯片密封墊,將微液滴生成芯片置于MicroDrop-100A樣本制備儀中進行微液滴生成;(2)待微液滴生成后,依次小心將生成的微液滴(45~55 μL)轉移至96孔PCR反應板中;擴增程序:50 ℃ 2 min,95 ℃ 10 min,95 ℃ 15 s,60 ℃ 60 s,45個循環;98 ℃ 10 min。PCR擴增完后,將96孔PCR反應板置于MicroDrop-100B生物芯片閱讀儀中進行檢測;使用QuantDrop數據分析軟件分析數據結果。
1.3.6 不同孔徑的膜進行超濾對比 用UFP-100-C-4MA(面積為650 cm2)和UFP-300-C-4MA(面積為650 cm2)分別對1L的樣品進行過濾,對比不同孔徑的膜的過濾效果。用UFP-100-C-4MA(面積為650 cm2)和 UFP-100-E-4MA(面積為420 cm2)不同面積的膜進行過濾,對比相同孔徑時,不同膜面積的過濾效果。
1.3.7 檢測對切向流WSSV的濃縮回收率 用已知WSSV陽性的病毒濃縮水樣,取100 mL已知濃度的陽性病毒水樣,加水稀釋到1L,依次稀釋共得到4個 梯度,分別把樣品濃縮到150 mL。每個樣品分取200 μL濃縮后的樣品200 μL、濃縮的透過樣品200 μL進行DNA抽提得到核酸50 μL,然后進行數字PCR定量檢測病毒拷貝數,同時用熒光PCR方法檢測。
1.3.8 對切向流濃縮回收WSSV的重復性檢測 用已知WSSV陽性的病毒濃縮水樣,平行取10個樣品,每個樣品為1L,分別把樣品濃縮到150 mL。分別取濃縮后的樣品200 μL、濃縮的透過樣品200 μL進行DNA抽提,然后進行數字PCR定量檢測病毒拷貝數,同時用熒光PCR方法檢測。
2 結果
2.1 不同孔徑的膜進行超濾對比 用UFP-100-C-4MA (孔徑100 kDa)和UFP-300-C-4MA(孔徑300 kDa)分別進行過濾,發現UFP-300-C-4MA濃縮后可以在透過液中檢測到陽性,說明該膜會影響病毒回收率。同時,用不同面積的膜進行過濾,發現使用較小面積的濾筒UFP-100-E-4MA(面積為420 cm2),通過粗濾、MF和UF等不同步驟獲得病毒濃縮物的時間大約需要6.5 h以上,而使用具有較大表面積的UFP-100-C-4MA(面積為650 cm2)濾筒的時間大大縮短到4 h以下。對比2個不同面積的膜,在相同3 h濃縮過程中,濃縮液流速是透過液流速的3倍時,透過液檢出陽性,說明膜面積較小的話,會有機會透過病毒而影響濃縮,見圖1。
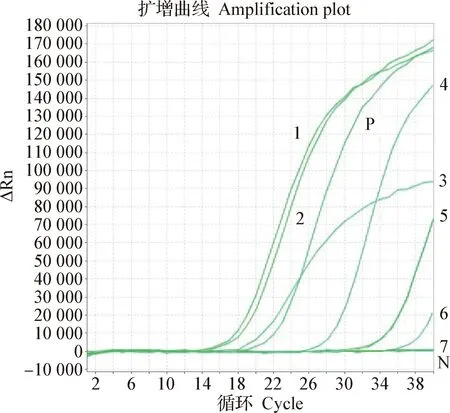
圖1 不同孔徑和不同面積超濾膜濃縮對比Fig.1 Comparative concentration efficiency of ultrafiltration membranes with different pore sizes and areas1:UFP-100-C-4MA濃縮病毒液; 2:UFP-100-C-4MA濃縮病毒液;3:UFP-100-E-4MA濃縮病毒液; 4:UFP-300-C-4MA濃縮病毒液;5:UFP-300-C-4MA濃縮透過液; 6:UFP-100-E-4MA濃縮透過液;7:UFP-100-C-4MA濃縮透過液; N:陰性對照;P:陽性對照1:UFP-100-C-4MA virus concentrate; 2:UFP-100-C-4MA virus concentrate; 3:UFP-100-E-4MA virus concentrate; 4:UFP-300-C-4MA virus concentrate; 5:UFP-300-C-4MA concentrated permeate; 6:UFP-100-E-4MA concentrated permeate; 7:UFP-100-C-4MA concentrated permeate;N:Negative control;P:Positive control
2.2 數字PCR和熒光PCR檢測切向流過濾回收WSSV的回收率 如圖2所示,用數字PCR方法定量檢測病毒回收效果的結果顯示,1和2孔道是UFP-100-C-4MA濃縮透過液樣品,檢測結果為陰性,而UFP-300-C-4MA濃縮透過液的樣品檢測結果為弱陽性,這個結果與2.1結果一致。說明用UFP-300-C-4MA的孔徑的膜會有病毒透過從而影響回收濃縮。在對樣品原液進行10倍稀釋后而用UFP-100-C-4MA濃縮的結果顯示,病毒原液拷貝數分別7.923×106和8.496×106,在分別進行10、102、103和104倍的梯度稀釋并做平行樣,病毒濃縮回收率分別為87.8%/89.45%、69.09%/61.95%、78.05%/69.67%和70.00%/65.38%,回收率均在60.00%以上。在稀釋樣品時,也出現病毒量沒有很好平均而影響定量數字PCR病毒量。4次稀釋的平均濃縮回收率為73.92%,濃縮效果較好。
從熒光PCR檢測結果來分析,樣品原液在進行10倍梯度稀釋時,病毒濃縮回收結果呈倍比稀釋,同時,檢測透過液均為陰性。平行樣的結果均一致。數字PCR結果與熒光PCR結果一致,倍比稀釋的回收率效果較好,見圖3。

圖3 熒光PCR比對病毒濃縮回收率效果Fig.3 Determination of virus concentration recovery rate by fluorescent PCR1和2:病毒稀釋原液樣品; 3和4:原液稀釋10倍樣品;5和6:原液稀釋102倍樣品; 7和8:原液稀釋103倍樣品;9和10:原液稀釋104倍樣品; 11和12:UFP-300-C-4MA濃縮透過液樣品; 13和14:UFP-100-C-4MA濃縮的透過液; P:陽性對照;N:陰性對照1 and 2:Original virus sample; 3 and 4:Dilute 10 times sample; 5 and 6:Dilute 102 times sample; 7 and 8:Dilute 103 times sample; 9 and 10:Dilute 104 times sample; 11 and 12:UFP-300-C-4MA concentrated permeate; 13 and 14:UFP-100-C-4MA concentrated permeate; P:Positive control; N:Negative control
2.3 數字PCR檢測切向流過濾回收WSSV的重復性 平行做10個稀釋樣品,分別進行濃縮回收,用數字定量PCR檢測后的結果顯示,每個樣品的病毒濃度差異不顯著,病毒濃縮回收重復性較好,見圖4。熒光PCR結果顯示,10個樣品的濃縮重復性較好,而用熒光PCR方法檢測透過液均為陰性,見圖5。數字PCR結果與熒光PCR結果一致,病毒濃縮的回收重復性較高。

圖4 數字PCR比對病毒濃縮重復性效果(核酸為50 μL)Fig.4 Repeatability of virus concentration revealed by digital PCR (Nucleic acid was 50μL)1~10:濃縮病毒液樣品,50 μL核酸中病毒拷貝數分別為1.989×106、1.919×106、1.911×106、1.933×106、2.049×106、2.006×106、2.034×106、2.019×106、1.923×106、1.996×1061-10:Concentrated virus sample,the copy number of virus in 50 μL nucleic acid was 1.989×106,1.919×106,1.911×106,1.933×106,2.049×106,2.006×106,2.034×106,2.019×106,1.923×106,1.996×106,respectively
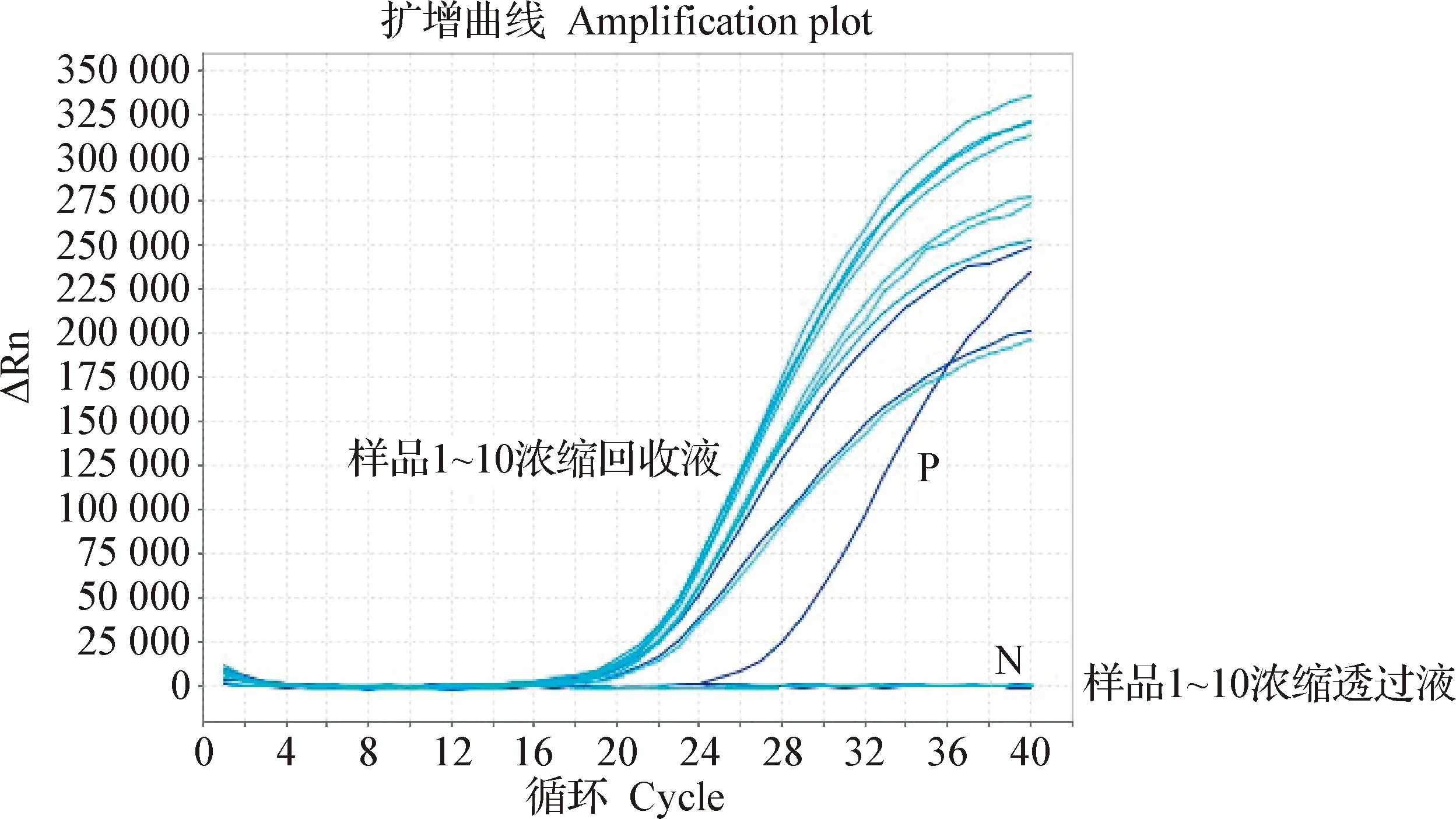
圖5 熒光PCR比對病毒濃縮重復性效果Fig.5 Repeatability of virus concentration revealed by fluorescent PCR1~10濃縮回收液:10個平行樣品濃縮回收液;1~10濃縮透過液:10個平行樣品濃縮透過液;P:陽性對照;N:陰性對照Concentrated virus sample of sample 1-10:Concentrated recovery solution of 10 duplicate samples;Concentrated permeate virus sample of sample 1-10:Concentrated penetrant of 10 duplicate samples; P:Positive control; N:Negative control
3 討論
目前,對水樣處理的方法還有濾膜過濾法、吸附洗脫法、沉淀法、超速離心法、免疫磁珠分離法等[9]。這些方法均有優點,但是也有成本高、設備復雜等局限性,而洗脫法、沉淀法、免疫磁珠法,水樣本身的水質狀況也會一定程度影響病毒回收效果,對于小病毒更多具有不適合的特點[10]。
切向流超濾中泵推動流體通過濾膜表面,沖刷去除其上截留的分子,從而使濾膜表面的積垢程度降至最低。在滲余物流體中產生緊靠濾膜的壓力,使溶質和小分子通過濾膜。在直流過濾中,增加壓力,僅能對混合物施加壓力,而無助于分離的促進;相比之下,在切向流超濾模式中,通過混合物的再循環防止限制層的形成,此再循環類似于振動以去除阻塞篩網眼的鵝卵石,使得位于混合物頂部的砂粒落下并通過篩網眼。因此,利用切向流超濾進行生物分子分離,效率更高,濃縮或洗濾速度更為快捷。但是,由于超濾法使用的濾膜孔徑太小,容易堵塞[11],所以要先進行預過濾來去除較大的雜質。本試驗中在進行樣品的微濾和超濾之前,使用1 μm孔徑和0.65 μm孔徑的過濾膜先進性預過濾,這一步驟減少了預封閉超濾膜的需要,并提高了水中病毒的回收率。
病毒濃度與倍數濃度和處理水量成正比[12],檢測蝦致病性病毒的機會取決于池塘/孵化場水的污染程度。超濾技術對病毒顆粒的回收和截留直接或間接地與許多變量有關,如試驗條件、濾筒總面積、泵速、泵壓、分子和顆粒大小和形狀、濃度等,以及可能在海水電解質中引起靜電吸引的粒子極性等[13-14]。王建等[15]建立了切向流超濾富集法對飲用水中諾如病毒的檢測,即用超濾膜進行第1次富集,用PEG第2次富集,結果顯示,該方法檢測的靈敏度為模擬水樣10-4copies/μL,平均回收率為10%~20%,抑制指數均少于2。本試驗中,比對了孔徑300 kDa和100 kDa的超濾膜的濃縮WSSV效果,因為WSSV病毒粒子直徑80~120 nm,長250~380 nm,呈卵圓形、橢圓形或桿狀,在孔徑300 kDa的透過液中檢測到病毒,說明使用該孔徑太大,影響濃縮效果。
第3代PCR技術—數字PCR(Digital PCR,dPCR)是一種核酸分子絕對定量分析技術[16-17],它是一種將PCR反應物進行有限稀釋,隨后在大量不同的反應單元中進行獨立的PCR擴增,最后根據泊松分布原理及陽性微滴的個數與比例經過統計學分析直接數出DNA分子的個數的技術,而樣本中DNA的提取質量會影響檢測結果,本試驗中出現的樣本檢測結果有差異性,分析原因可能與稀釋樣品效果不好有關,也可能與DNA提取質量有關。但是,從結果分析來看數字PCR結果與熒光PCR結果一致,倍比稀釋的回收率效果較好。用數字PCR定量檢測樣品中病毒量,4次稀釋的平均濃縮率為73.92%,濃縮效果較好。平行做10個重復性樣品分別進行濃縮,數字定量PCR和熒光PCR方法檢測后結果顯示每個樣品的病毒濃度差異不顯著,重復性較好。
與傳統的PCR方法相比,數字PCR方法更加靈敏,不需要依賴Ct值和標準曲線而實現絕對核酸定量。近幾年,數字化PCR方法在動物疫病研究中也被廣泛應用[18-20],但是,數字PCR檢測成本較高,需要使用特定的數字PCR混合液、微滴生成油、微滴生成儀等試劑和檢測儀器,成本遠高于熒光PCR 檢測方法。Jia等[21]比較了反轉錄數字PCR(RT-ddPCR)與逆轉錄定量PCR(RT-qPCR)2種方法對13個不同區域的傳染性造血器官壞死病毒毒株的測定。結果表明,反轉錄數字PCR雖然檢測靈敏度與檢測范圍弱于反轉錄定量PCR,其相關性可達到69.40%以上。郝中香等[22]建立了針對鯉皰疹病毒2型的數字PCR檢測體系,結果顯示,數字PCR檢測靈敏度較熒光定量PCR高5倍,且重復性較好。趙欣等[23]也對鯉皰疹病毒Ⅱ型進行進一步研究,結果顯示,數字PCR及熒光定量PCR兩種方法線性關系和特異性均良好,但是數字PCR具有更好的重復性,并且臨床樣品檢測中,數字PCR較熒光定量PCR的陽性檢出率高,表明數字PCR技術在水生動物病毒檢測中具有一定前景。
對于整個蝦塘來說,對于蝦體進行病毒檢測,樣品的代表性具有非常大的挑戰性。對于同一蝦池,發病情況也有不同,這主要是因為同一池蝦并不是來源于同一條親蝦,或蝦的個體免疫力差異的原因。而在實際檢測中無法做到每一條蝦都得到檢測,只能抽取一定數量的樣品,所以檢測結果就有可能存在偏差[24]。這種情況下,對蝦塘的水環境進行病原檢測可以快速了解蝦的生長水環境中是否存在病原,可以在出現病毒量高引起蝦體死亡之前做出正確的生物安全措施,如隔離、消毒等,以減少損失。此外,這個方法還可以擴展到了解蝦場、孵化場和水庫所采用的消毒方案的效力檢測。

