甲磺酸阿帕替尼治療標準治療方案失敗后卵巢上皮癌患者的療效觀察
顧海迪,楊 軍
(南京醫科大學附屬蘇州醫院腫瘤內科,江蘇 蘇州 215001)
卵巢上皮癌屬于常見的女性生殖道腫瘤,早期無明顯癥狀,而隨著腫瘤增大,向腹腔播散,導致多數患者確診時已發生轉移,病死率較高。晚期卵巢上皮癌表現出消瘦、食欲缺乏及胃腸功能紊亂等癥狀,伴盆腔以外種植或腹膜后淋巴結或腹股溝淋巴結轉移,可采取以紫杉醇聯合卡鉑為基礎的化療方案,但難以持續緩解病情進展,而且卵巢癌細胞對化療藥物耐藥嚴重,導致標準治療方案失敗,因此需采取其他治療方案[1]。臨床研究可知,卵巢上皮癌標準方案治療失敗與血管內皮生長因子(VEGF)、血管內皮生長因子受體 -2(VEGFR-2)密切相關[2]。因此需重視對標準治療方案失敗卵巢上皮癌患者抗VEGF的治療。甲磺酸阿帕替尼是新一代小分子VEGFR-2酪氨酸激酶抑制劑,具有抗VEGF作用,在胃癌、乳腺癌及非小細胞肺癌中取得顯著療效,且相對安全[3]。但甲磺酸阿帕替尼是否對標準治療方案失敗卵巢上皮癌有效仍需深入研究。為此,本次研究旨在探討甲磺酸阿帕替尼對標準治療方案失敗后卵巢上皮癌患者臨床療效和細胞免疫功能的影響,現詳細報道如下。
1 資料與方法
1.1 一般資料 選擇南京醫科大學附屬蘇州醫院于2017年3月至2019年3月期間收治的標準治療方案失敗后卵巢上皮癌患者31例作為研究對象,開展前瞻性研究。患者年齡28~70歲,平均(51.17±3.16)歲;惡性腫瘤分期[4]Ⅲ期13例,Ⅳ期18例。納入標準:符合《2016 NCCN卵巢癌臨床實踐指南(第1版)》[5]中的診斷標準;經病理學或細胞學檢查確診者;既往接受標準治療失敗(鉑類耐藥復發且排除手術可能性)者;體力狀況(ECOG)[6]評分0~1分;距近期化療時間<6個月;影像學檢查至少有1個可測量病灶者;預計生存期≥ 3個月者等。排除標準:存在腫瘤相關出血者;對本次研究所使用的藥物存在過敏現象者;合并血液、免疫、內分泌、神經或胃腸道等系統嚴重疾病者等。本研究經院內醫學倫理委員會的批準,且患者及其家屬均簽署知情同意書。
1.2 治療方法 采取紫杉醇聯合卡鉑方案治療,化療第1天,選擇紫杉醇注射液(海口市制藥廠有限公司,國藥準字H20043045,規格:16.7 mL∶100 mg)150 mg/m2靜脈滴注,卡鉑注射液(齊魯制藥有限公司,國藥準字H20020180,規格:10 mL∶100 mg)300~500 mg/m2靜脈滴注,21 d為1個治療周期,若持續化療2個周期后患者病情未見好轉,再接受甲磺酸阿帕替尼片(江蘇恒瑞醫藥股份有限公司,國藥準字H20140103,規格:0.25 g/片)口服治療,初始選擇0.25 g/次,1次/d,2周后可耐受,增加劑量至0.5 g/次,1次/d,在無疾病進展的情況下,給予至少2個周期的化療,在患者治療后達到完全緩解(CR)或部分緩解(PR)的情況下,化療最多持續6個周期,如果出現病情進展(PD)或出現無法耐受的情況,則終止治療,更改其他方案治療。
1.3 觀察指標 ①客觀緩解率。參照實體瘤療效評價標準1.1(RECIST1.1)[7]評估治療1個月后的近期療效,治療后每2個月復查CT或MR進行1次療效評價,CR為病灶完全消失,PR為病灶的直徑總和低于基線≥ 30%,病情穩定(SD)為病灶的直徑總和低于基線< 30%或病灶直徑和相對增加< 20%,PD為病灶直徑和相對增加≥ 20%,其中CR、PR至少穩定在4周以上。客觀緩解率=(CR+PR)例數/總例數×100%。②治療前、治療1個月后血清腫瘤標志物。取清晨空腹肘靜脈血3 mL離心處理,以3 000 r/min的轉速,離心10 min,分離血清,置入冰箱保存待測,采用免疫發光分析儀(美國貝克曼庫爾特有限公司,型號:DXI-800),試劑為貝克曼公司配套試劑盒,測定血清腫瘤標志物糖類抗原125(CA125)、癌胚抗原(CEA)、糖類抗原199(CA199)、人附睪蛋白4(HE4)水平。③治療前、治療1個月后細胞免疫功能。取清晨空腹肘靜脈2 mL,加入EDTA抗凝的試管中,采取流式細胞儀測定CD3+、CD4+、CD8+百分比,并計算CD4+/CD8+比值。④不良反應。包含消化道反應(嘔吐、腹瀉、食欲下降)、手足綜合征、血液毒性(白細胞減少、血小板減少)、肝功能異常、乏力、高血壓、蛋白尿等,參考美國衛生公共服務部發布的《常見不良反應事件評價標準4.0》[8]評價,將其分為 0、 Ⅰ、 Ⅱ、 Ⅲ、 Ⅳ級,0 級為未發生; Ⅰ級為癥狀輕微,臨床或診斷可見,無需治療; Ⅱ級為癥狀明顯,需行局部或非侵入性治療; Ⅲ級為癥狀嚴重但不危急生命,日常活動受限,需住院治療, Ⅳ級為危及生命,需緊急治療。
1.4 統計學方法 采用SPSS 23.0統計軟件分析數據,計量資料與計數資料分別以(±s)、[ 例(%)]表示,分別采用t、χ2檢驗。以P< 0.05 表示差異有統計學意義。
2 結果
2.1 臨床療效 經過治療1個月后患者CR占比0.00%,PR 占比 51.60%(16/31),SD占比16.13%(5/31),PD占比32.26%(10/31),客觀緩解率為51.61%(16/31)。
2.2 血清腫瘤標志物 與治療前比,治療1個月后患者血清CA125、CEA、CA199、HE4水平均顯著降低,差異均有統計學意義(均P< 0.05),見表1。
表1 患者治療前后血清腫瘤標志物指標比較(?±s)
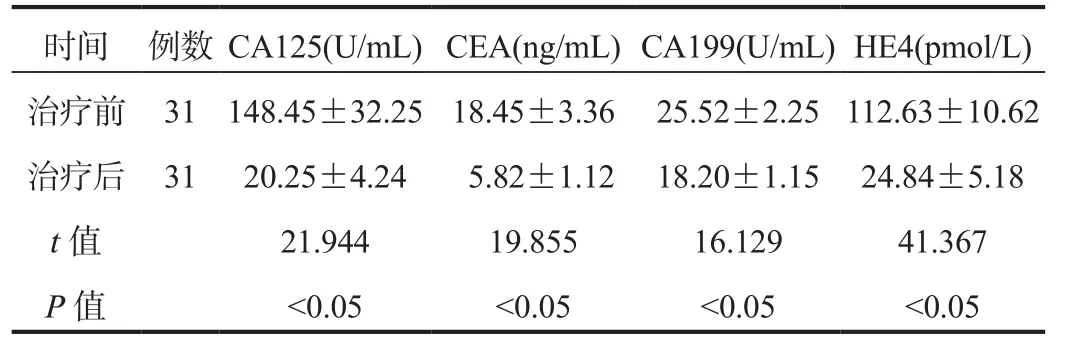
表1 患者治療前后血清腫瘤標志物指標比較(?±s)
注:CA125:糖類抗原125;CEA:癌胚抗原;CA199:糖類抗原199;HE4:血清人附睪蛋白4。
時間 例數CA125(U/mL)CEA(ng/mL)CA199(U/mL)HE4(pmol/L)治療前 31 148.45±32.25 18.45±3.36 25.52±2.25 112.63±10.62治療后 31 20.25±4.24 5.82±1.12 18.20±1.15 24.84±5.18 t值 21.944 19.855 16.129 41.367 P值 <0.05 <0.05 <0.05 <0.05
2.3 免疫功能 與治療前比,治療1個月后患者CD3+、CD4+百分比,CD4+/CD8+比值均顯著升高,差異均有統計學意義(均P< 0.05),CD8+百分比比較,差異無統計學意義(P> 0.05),見表2。
表2 患者治療前后免疫功能指標比較(?±s)
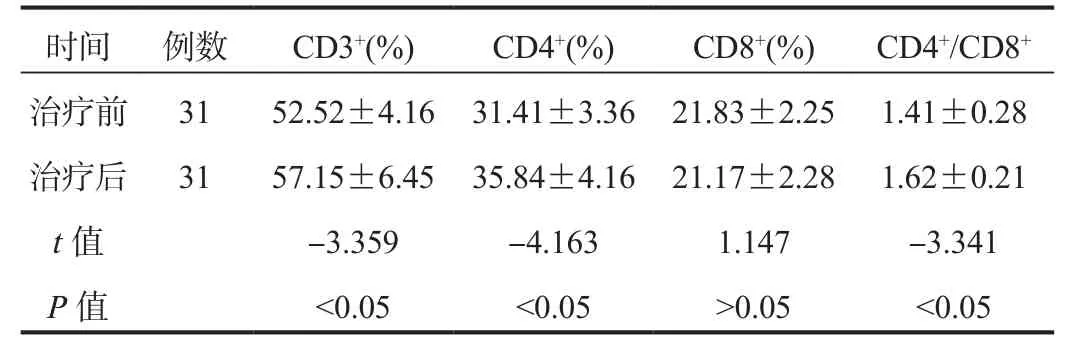
表2 患者治療前后免疫功能指標比較(?±s)
時間 例數 CD3+(%) CD4+(%) CD8+(%) CD4+/CD8+治療前 31 52.52±4.16 31.41±3.36 21.83±2.25 1.41±0.28治療后 31 57.15±6.45 35.84±4.16 21.17±2.28 1.62±0.21 t值 -3.359 -4.163 1.147 -3.341 P值 <0.05 <0.05 >0.05 <0.05
2.4 不良反應 治療1個月期間所有患者中消化道反應Ⅰ ~ Ⅱ、 Ⅲ ~ Ⅳ級占比分別為58.06%、19.35%,手足綜合征Ⅰ ~ Ⅱ、 Ⅲ ~ Ⅳ級占比分別為9.68%、3.23%,血液毒性Ⅰ ~ Ⅱ、 Ⅲ ~ Ⅳ級占比分別為 12.90%、6.45%,肝功能異常Ⅰ ~ Ⅱ、 Ⅲ ~ Ⅳ級占比分別為 6.45%、3.23%,乏力Ⅰ ~ Ⅱ、Ⅲ ~ Ⅳ級占比分別為9.68%、3.23%,高血壓Ⅰ ~ Ⅱ、 Ⅲ ~Ⅳ級占比分別為6.45%、6.45%,蛋白尿Ⅰ ~ Ⅱ、 Ⅲ ~ Ⅳ級占比分別為6.45%、3.23%;消化道反應Ⅰ ~ Ⅱ級、 Ⅲ ~ Ⅳ級患者占比顯著高于手足綜合征、血液毒性、肝功能異常、乏力、高血壓、蛋白尿,差異均有統計學意義(均P< 0.05),見表3。
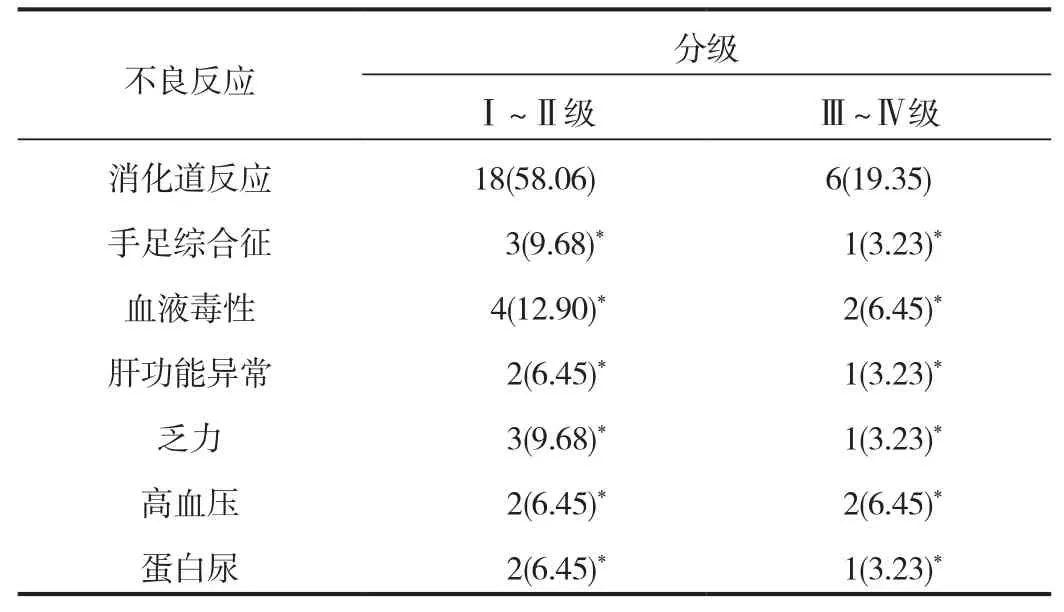
表3 患者不良反應發生率[ 例(%)]
3 討論
卵巢上皮癌可發生在任何年齡,病因與內分泌、環境、遺傳等因素有關。卵巢上皮癌具有惡性程度高、整體預后極差特征,而且早期診斷率低,多數患者確診時已發展至中晚期,需采取手術或化療等綜合治療。紫杉醇為抗微管化療藥物,可抑制微管網的正常重組,影響腫瘤細胞的分裂。卡鉑為第二代鉑類抗癌藥,可阻止DNA復制,抑制腫瘤細胞的生長,紫杉醇聯合卡鉑為治療卵巢癌的常用化療方案,部分患者有效,但由于卵巢上皮癌細胞對化療藥物的獲得性耐藥因素影響療效,導致卵巢癌生存率難以提高[9]。因此如今臨床重視對其他治療藥物的研究。
甲磺酸阿帕替尼作為小分子抗血管生成靶向藥物,可通過與VEGFR-2的酪氨酸激酶的腺苷三磷酸結合,抑制腫瘤血管生長。由于標準化治療失敗中化療多藥耐藥發生與腺苷三磷酸結合盒(ABC)跨膜轉運蛋白的過表達有關,而甲磺酸阿帕替尼可抑制P- 糖蛋白、多藥耐藥相關蛋白等轉運,降低卵巢腫瘤細胞的耐藥性,而且其還可針對腫瘤微環境,促使腫瘤血管正常化,逆轉藥物耐藥的效果[10]。腺苷三磷酸結合盒家族B成員1(ABCB1)編碼轉運蛋白和通道蛋白,負責細胞內穩態,其所觸發的多藥耐藥性是阻礙化療成功的主要障礙,而甲磺酸阿帕替尼可提高ABCB1底物藥物在過表達ABCB1細胞中的細胞毒作用,逆轉耐藥,提高紫杉醇的藥效。本次研究結果顯示,患者客觀緩解率為51.61%,與漆仲春[11]研究中“客觀有效率69.00%,疾病控制率77.00%,中位PFS達4.3個月”相近。證實了甲磺酸阿帕替尼治療可進一步控制腫瘤生長,緩解病情,獲得良好近期療效。甲磺酸阿帕替尼主要不良反應為高血壓、消化系統反應等,甚至可導致可逆性后腦白質腦病綜合征,因此需加強對患者的用藥監測,尤其合并心腦血管既往史患者需注意控制血壓、血脂。本研究結果顯示,治療后患者消化道反應Ⅰ ~ Ⅱ級、Ⅲ ~ Ⅳ級占比均顯著高于手足綜合征、血液毒性、肝功能異常、乏力、高血壓、蛋白尿占比,證實了采取甲磺酸阿帕替尼治療取得良好治療效果時,也可能增加患者消化道不良反應的發生,需加強不良反應監測并及時處理,必要時停藥。
CA125、CEA、CA199、HE4作為卵巢癌診斷中常見且重要的腫瘤標志物,其表達水平與病情進展及預后密切相關,其中CA125在卵巢癌則能夠呈現高水平,正常卵巢組織無表達,屬于敏感度較高的指標。CEA作為大分子糖蛋白,可作為多種惡性腫瘤的異性標志物。CA199主要分布在胰腺、膽道上皮等位置,卵巢癌患者因組織惡變,導致CA199集中到細胞邊緣并釋放到血液中,因此多作為診斷胰腺癌、胃腸癌等疾病,對診斷卵巢癌有一定效果。HE4可在未檢出CA125卵巢癌患者中,呈現高表達,在健康卵巢及良性組織中低表達或不表達,可作為輔助診斷的指標。甲磺酸阿帕替尼作為小分子血管內皮生長因子酪氨酸激酶抑制劑,屬于口服制劑,易于被患者接受,而且其多針對膜受體、細胞信號傳導途徑的成分及參與血管生成的因子等產生作用,同時其可調控鈣黏蛋白的表達,抑制癌細胞增殖和腫瘤生長[12]。本研究結果顯示,治療后CD3+、CD4+百分比、CD4+/CD8+比值均顯著高于治療前,血清CA125、CEA、CA199、HE4水平均顯著低于治療前,證實采取甲磺酸阿帕替尼治療可有效降低血腫腫瘤標志物表達,抑制腫瘤血管生長,改善細胞免疫功能,增強機體免疫力。
綜上,甲磺酸阿帕替尼治療標準方案失敗后卵巢上皮癌患者近期療效較好,可進一步改善細胞免疫功能,抑制腫瘤標志物生長,且安全性高,但由于本研究樣本量較小,因此需臨床進一步擴大樣本量深入研究。

