基于PI3K/Akt通路探究丙泊酚對七氟烷誘導大鼠神經細胞凋亡的保護作用
張偉,朱賢林,吳幫林,朱榮譽,潘琴,梅榮
七氟烷是臨床麻醉中應用較廣的吸入性麻醉劑,但可損傷中樞神經系統,從而影響患者學習、記憶、神經發育,七氟烷吸入過量,會對海馬神經細胞產生嚴重損傷,導致其大量凋亡[1-2]。大腦海馬區屬于一種復雜的大腦中樞神經系統,一旦海馬神經細胞發生損傷,會導致記憶功能、學習能力下降,出現認知障礙[3]。活化磷脂酰肌醇-3-激酶(phosphatidylinositol-3-hydroxykinase,PI3K)在細胞中參與程序性細胞死亡過程,蛋白激酶B(protein kinase B,Akt)屬于其下游分子,依靠PI3K調節,對多種轉錄因子有調控作用,抑制凋亡基因表達[4]。林晨等[5]研究指出,PI3K/Akt通路激活對創傷性腦損傷神經保護作用顯著。丙泊酚屬于一種靜脈麻醉藥物,能減輕七氟烷產生的應激反應,對心腦血管有一定的保護作用[6],但目前其具體的作用機制尚不明確。本研究基于PI3K/Akt通路探究丙泊酚對七氟烷誘導大鼠神經細胞凋亡的保護作用,報道如下。
1 材料與方法
1.1 材料 (1)動物:健康、清潔級Wistar雄性大鼠30只,日齡3周,體質量220~260 g,均由華北制藥股份有限公司提供,SYXK(冀)2019-011。大鼠均常規飼養,自由飲食飲水,飼養溫度20~25℃,濕度50%左右,黑/白光照12 h交替。(2)試藥試劑:戊巴比妥鈉、4%多聚甲醛及其試劑盒(碧云天生物科技有限公司),乳酸脫氫酶(LDH)、丙二醛(MDA)、bcl-2相關的X基因(Bax)、含半胱氨酸的天冬氨酸蛋白水解酶(Caspase-3)、超氧化物歧化酶(SOD)、谷胱甘肽-過氧化氫酶(GSH-Px)、B淋巴細胞瘤-2(Bcl-2)及其試劑盒(武漢伊萊瑞特生物科技股份有限公司);(3 )儀器設備:圓形水迷宮(北京廣精儀儀器設備有限公司,型號XR-XM101),顯微鏡(上海無陌光學儀器有限公司,型號XYH-3B),溫箱(上海慧夏儀器設備有限公司,型號 WHTH-150),酶標儀(無錫集佳智能科技有限公司,型號 VarioskanLUX),紅外熒光成像系統(上海易匯生物科技有限公司,型號 FOTRIC)。
1.2 實驗方法 2020年1月—2021年1月于湖北省恩施土家族苗族自治州中心醫院實驗室進行實驗。30只Wistar雄性大鼠隨機數字表法分為對照組、七氟烷組、七氟烷+丙泊酚組(聯合組),各10只。七氟烷組吸入1.5%七氟烷,1 h/d;聯合組在七氟烷組基礎上加丙泊酚150 mg/kg腹腔注射;對照組給予等體積的生理鹽水干預。3組均連續干預2周。
1.3 觀測指標與方法
1.3.1 Morris水迷宮實驗:干預結束后,各組大鼠行Morris水迷宮實驗,將圓形水迷宮分為4個象限,選擇任意一個象限,在其水面下置隱蔽平臺,大鼠隨機放入水中,大鼠尋找平臺時間即為逃避潛伏期(4個象限入水點各訓練1次/d,每次間隔20 min),統計大鼠第5 天逃避潛伏期。第6 天進行空間探索實驗,平臺撤去,隨機選擇1個象限放入大鼠,統計大鼠60 s內穿越平臺位置次數、目標象限停留時間占比。
1.3.2 海馬神經細胞凋亡觀察:采用戊巴比妥鈉腹腔麻醉大鼠后,開胸取出神經組織,采用生理鹽水沖洗后,在4%多聚甲醛中固定;分離海馬組織,于4%多聚甲醛固定48 h,石蠟包埋,制作切片(3 μm),嚴格按照TUNE試劑盒說明書操作,顯微鏡下隨機選擇5個視野,統計陽性細胞數量,棕黃色細胞顆粒為陽性,陽性細胞率即為海馬神經細胞凋亡率。
1.3.3 氧化應激指標、凋亡相關因子水平檢測:采用酶聯免疫吸附法(ELISA)法檢測。提取腦組織勻漿包被液適當稀釋,加到聚苯乙烯反應板各孔中,加蓋 4℃保存 24 h。次日使用洗滌液進行3次全方位洗滌,甩干;各孔內加不同稀釋倍數的待檢標本0.1 ml,同時增加陽性和陰性對照,置于43℃溫箱60 min,移去液體;同前洗滌3次,甩干;各孔內加稀釋LDH、MDA、SOD、GSH-Px、Bax、Caspase-3、Bcl-2各 0.1 ml,置43℃溫箱60 min。移去液體,同前洗滌3次,甩干;各孔加底物液0.1 ml,置黑暗處20 min;各孔內加2 mol/L的LDH、MDA、SOD、GSH-Px、Bax、Caspase-3、Bcl-2各0.05 ml,終止反應。試劑盒購自北京北方生物技術研究所,實驗操作步驟嚴格根據說明書進行。
1.3.4 PI3K/Akt通路蛋白檢測:采用免疫印跡(Western blot,WB)將PI3K、p-Akt(大鼠神經組織)標本提取液,離心處理后提取沉淀,滴加裂解液、反復凍融后,再離心處理,提取上清液,采用酶標儀檢測PI3K、p-Akt蛋白濃度,保存。PI3K、p-Akt樣本滴加10%的分離膠,封閉,吸干水分,給予5%的濃縮膠灌注,凝固后,將其在電泳槽中固定,加 Marker、變性蛋白樣品5 μl,電泳干預30 min,待蛋白分離膠底,結束電泳;轉膜成功后將硝酸纖維素膜(NC)在5%脫脂奶粉中封閉固定1 h,加一抗(PI3K、p-Akt 1∶1 000)孵育,經過震蕩洗膜后加二抗(PI3K、p-Akt 1∶10 000),孵育,再次震蕩洗膜,使用紅外熒光成像系統對結果給予分析。以GAPDH為內參。

2 結 果
2.1 各組大鼠Morris水迷宮實驗比較 逃避潛伏期比較,七氟烷組>聯合組>對照組(P<0.01);穿越平臺次數、目標象限停留時間占比比較,七氟烷組<聯合組<對照組(P<0.01),見表1。
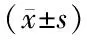
表1 3組大鼠Morris水迷宮實驗比較
2.2 各組大鼠海馬神經細胞凋亡率比較 海馬神經細胞凋亡率比較,七氟烷組(39.50%±4.15%)>聯合組(20.55%±3.50%)>對照組(5.10%±1.55%)(F=36.834,P=0.001);聯合組大鼠海馬神經細胞凋亡率低于七氟烷組(t=11.040,P=0.001),見圖1。

圖1 各組大鼠海馬神經細胞凋亡情況比較(TUNEL染色,×200)
2.3 各組大鼠腦組織氧化應激指標比較 LDH、MDA水平比較,七氟烷組>聯合組>對照組(P<0.01),SOD、GSH-Px水平比較,七氟烷組<聯合組<對照組(P<0.01),見表2。
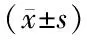
表2 3組大鼠氧化應激指標水平比較
2.4 各組大鼠腦組織凋亡相關因子水平比較 Bax、Caspase-3水平比較,七氟烷組>聯合組>對照組(P<0.01);Bcl-2水平比較,七氟烷組<聯合組<對照組(P<0.01),見表3。
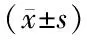
表3 各組大鼠腦組織凋亡相關因子水平比較
2.5 各組大鼠PI3K/Akt通路蛋白表達比較 PI3K、p-Akt蛋白表達比較,七氟烷組<聯合組<對照組(P<0.05),見表4、圖2。

圖2 各組大鼠PI3K/Akt通路蛋白表達比較
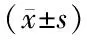
表4 各組大鼠PI3K/Akt通路蛋白表達比較
3 討 論
相關研究顯示,吸入麻醉會導致神經毒性產生,可能與老年認知功能的衰退相關,但作用機制仍不確定[7]。吸入七氟烷會引起記憶損傷,主要是因為吸入七氟烷會影響海馬區CA1區椎體神經元電壓門控通道,在大腦發育過程中,抑制神經元電壓門控通道,引起神經細胞凋亡[8-9]。目前七氟烷產生的認知障礙是麻醉醫學研究的重中之重。丙泊酚作用特點是起效快、消除迅速,能提高中樞抑制性神經傳遞,從而抑制中樞興奮性,這一功能特殊,與其他類型麻醉鎮靜藥物比較,其在臨床應用中潛能更大[10]。
本結果顯示,丙泊酚能增加大鼠逃避潛伏期,減少穿越平臺次數,縮短目標象限停留時間,從而改善大鼠記憶、認知能力。肖秀英等[11]研究也指出,丙泊酚+七氟烷能降低大鼠逃離時間,減少錯誤反應次數和Longa評分,從而有效改善大鼠神經功能和記憶能力,與本研究結果保持一致。海馬神經細胞凋亡是導致大鼠神經功能損傷的主要原因[12]。本研究中丙泊酚能降低海馬神經細胞凋亡率,從而抑制海馬神經細胞凋亡,進一步改善大鼠神經功能。
SOD作為一種抗氧化酶,具有清除自由基的作用,可以協同GSH-Px將自由基產生的過氧化物分解酶清除,避免氧化應激損傷[13]。MDA屬于脂質氧化產物,具有一定的細胞毒性,LDH是一種糖原溶解酶,反映細胞膜損傷程度[14]。研究顯示,氧化應激反應增加會導致神經元受損,SOD、GSH-Px作為內源性抗氧化酶在抗氧化防御機制中起著重要作用[15-16]。本研究中丙泊酚通過使LDH、MDA水平下降,SOD、GSH-Px水平升高,改善七氟烷誘導大鼠產生的氧化應激反應,通過調節氧化應激起到神經保護作用。Bax是線粒體膜主要的成分之一,Bcl-2在線粒體膜外廣泛分布,對線粒體膜通透性有一定的調節能力,在細胞凋亡中至關重要[17]。Caspase-3主要是通過Caspase-9自身裂解產生,參與細胞凋亡級聯反應,引發細胞凋亡[18]。本研究中丙泊酚通過下調Bax、Caspase-3水平,上調Bcl-2水平從而抑制海馬區細胞凋亡,改善大鼠神經功能。
PI3K/Akt信號通路在細胞中具有雙重作用,一方面能抑制Bcl-2相關死亡促進因子,對細胞增殖有誘導作用,另一方面將下游抗凋亡蛋白激活,起到抗凋亡作用[19-20]。已有研究證實,大鼠在七氟烷吸入前給予一定的LY294002和依達拉奉干預,LY294002會逆轉依達拉奉對海馬區神經元保護作用,將PI3K/Akt信號通路激活抑制海馬區神經元凋亡[21]。本結果顯示,丙泊酚通過上調PI3K、p-Akt表達,將PI3K/Akt信號通路激活,下游Bax、Caspase-3蛋白下調,Bcl-2蛋白上調抑制海馬區神經細胞凋亡。
綜上所述,丙泊酚能改善七氟烷誘導大鼠認知功能損傷,通過調節LDH、MDA、SOD、GSH-Px水平改善大鼠氧化應激反應,激活PI3K/Akt通路,調控下游Bax、Caspase-3、Bcl-2水平抑制神經細胞凋亡,為臨床研究丙泊酚作用機制提供數據支持。本研究的局限性未對丙泊酚使用劑量進行分組研究,因此,需要后續研究丙泊酚使用的最佳劑量。
利益沖突:所有作者聲明無利益沖突
作者貢獻聲明
張偉、朱賢林:設計課題、研究方案,實施研究過程,論文撰寫;吳幫林、朱榮譽:提出研究思路,分析實驗數據,論文審核; 潘琴:實施研究過程,資料搜集整理,論文修改;梅榮:進行統計學分析

