UdhA和博伊丁假絲酵母xylI基因共表達對木糖醇發酵的影響
唐梅 蔡松 付聲亮 王金華 王永澤

摘要 [目的]研究可溶性吡啶核苷酸轉氫酶基因(UdhA)和醛糖還原酶基因(xylI)共表達對木糖醇發酵的影響。[方法]將來源于博伊丁假絲酵母醛糖還原酶xylI基因克隆到pET28a(+)上,并在BL21(DE3)中表達,通過SDS-PAGE對表達產物的分子量和酶活進行測定。隨即將xylI基因連接lacP啟動子,構建pWYZ-2質粒并將其轉化到E.coli AI07菌株。進一步將來源于E.coli W3110的UdhA基因克隆到pWYZ-2質粒實現與xylI共表達,所構建pWYZ-4質粒轉化到E.coli AI07菌株,比較了E.coli AI07/pWYZ-2和E.coli AI07/pWYZ-4木糖醇發酵結果。[結果]在BL21(DE3)/pET28a(+)體系誘導表達的醛糖還原酶分子量為39? kD,木糖還原酶酶活為3.30 U/mL。E.coli AI07/pWYZ-2菌株發酵48 h,木糖醇產量為19.90 g/L;E.coli AI07/pWYZ-4發酵36 h,木糖醇產量達到19.91 g/L,較菌株AI07/pWYZ-2生產強度提高了33.25%。[結論]通過將UdhA基因與xylI 基因進行共表達,提高了重組大腸桿菌(E.coli AI07/ pWYZ-4)合成木糖醇的生產強度。
關鍵詞 博伊丁假絲酵母;xylI基因;UdhA基因;共表達;木糖醇
中圖分類號 Q 812? 文獻標識碼 A? 文章編號 0517-6611(2022)01-0106-04
doi:10.3969/j.issn.0517-6611.2022.01.027
The Effect of Co-expression of UdhA and Candida boidinii xylI Gene on Xylitol Fermentation
TANG Mei, CAI Song, FU Sheng-liang et al
(Hubei Key Laboratory of Industrial Microbiology, Hubei University of Technology, Wuhan, Hubei 430068)
Abstract [Objective] The effect of co-expression of soluble pyridine nucleotide transhydrogenase gene (UdhA) and aldose reductase gene (xylI) on xylitol fermentation was investigated. [Method] xylI gene from Candida boidinii encoding aldose reductase was cloned into pET28a(+) and expressed in BL21(DE3). The enzyme molecular weight was detected by SDS-PAGE and enzyme activity was assayed. xylI gene was ligated to the lacP promoter for construction of plasmid pWYZ-2 and then the plasmid was transformed into E.coli AI07.The UdhA gene derived from E.coli W3110 was further cloned into pWYZ-2 plasmid to achieve co-expression with xylI for pWYZ-4 plasmid construction and then pWYZ-4 was transformed into E.coli AI07. E.coli AI07/pWYZ-2 was compared with E.coli AI07/pWYZ-4 for xylitol fermentation.[Result] The molecular weight of xylose reductase expressed in BL21(DE3)/pET28a(+) system was 39 kD, and the enzymatic activity of aldose reductase was 3.3 U/mL.The E.coli AI07/pWYZ-2 strain was fermented for 48 hours, the xylitol output was 19.90 g/L. E.coli AI07/pWYZ-4 was fermented for 36 hours, xylitol production reached 19.91 g/L, xylitol productivity of E.coli AI07/pWYZ-4 was 33.25% higher than that of strain E.coli AI07/pWYZ-2.[Conclusion]Xylitol productivity of recombinant Escherichia coli was improved using co-expression of UdhA gene and xylI gene.
Key words Candida boydingii;xylI gene;UdhA gene;Co-expression;Xylitol
基金項目 國家“十二五”支撐計劃項目(2012BAD27B03);山東創新計劃項目(201720311004)。
作者簡介 唐梅(1993—),女,湖北廣水人,碩士,從事代謝工程及發酵技術研究。通信作者,副教授,從事生物能源與生物材料研究。
收稿日期 2021-04-22
木糖醇廣泛存在于各種果蔬食物中,含量卻很低[1],其應用范圍廣,且由于木糖醇在人體內的代謝與胰島素無關[2-3],故適用于生產糖尿病患者食品。近年來,木糖醇的市場需求不斷擴大,國內木糖醇年產值已超過13億元,預計今后國際市場上木糖醇總需求量將達10萬t以上[4]。
通過微生物發酵或者催化獲得木糖醇正成為木糖醇合成的熱點,醛糖還原酶(也稱為木糖還原酶)作為生物合成法中的關鍵因子,主要存在于酵母和絲狀真菌中[4]。目前發現的醛糖還原酶都需要輔酶,其中一類是輔酶NADH依賴型,如來源于近平滑假絲酵母(Candida parapsilosis)[5]的木糖還原酶;另外一類是輔酶NADPH依賴型,如來源于熱帶假絲酵母(Candida boydingii)[6]、埃默森籃狀菌(Talaromyces emersonii)[7]和博伊丁假絲酵母(Candida boidinii)等[8]微生物的醛糖還原酶。對于輔酶NADPH依賴型的木糖還原酶,要提高木糖醇的產量,需要更多的NADPH來滿足酶催化的需要。
通常通過表達磷酸戊糖途徑的6-磷酸葡萄糖脫氫酶編碼基因zwf和6-磷酸葡萄糖酸脫氫酶編碼基因gnd來強化NADPH的產出[9];也有敲除EMP途徑中編碼磷酸果糖激酶的pfkA和pfkB基因,使碳源更多地流向磷酸戊糖途徑,從而實現NADPH的供給[10]。
可溶性吡啶核苷酸轉氫酶能催化NADH和NADPH相互轉化[11],改變了細胞內NADH/NAD+的比例。考慮到糖酵解途徑不依賴氧氣也能產生大量的NADH,如果將這部分輔因子轉化成NADPH形式,將為NADPH的供給提供一個新的途徑。在前期產丙酮酸大腸桿菌工程菌構建的工作中,成功將大腸桿菌W3110自身的UdhA基因克隆到載體上,通過誘導表達發現,UdhA的克隆有效地促進了丙酮酸發酵的生產強度[12]。
考慮到博伊丁假絲酵母(Candida boidinii)在木糖醇合成中也存在輔酶NADPH依賴的難題,筆者借鑒丙酮酸工程菌構建的結果,將博伊丁假絲酵母的醛糖還原酶基因xylI進行克隆、表達及酶活測定,并探討可溶性吡啶核苷酸轉氫酶UdhA和xylI共表達對木糖醇發酵的影響,以期為解決NADPH依賴型醛糖還原酶輔因子不足的問題提供新的途徑。
1 材料與方法
1.1 材料
1.1.1 菌株與質粒。所用菌株和質粒見表1。
1.1.2 引物。
引物序列見表2,均由南京金斯瑞生物科技有限公司合成。
1.1.3 主要試劑與儀器。
主要試劑:木糖醇對照品(含量>99.9%),2×Taq polymerase,PrimerSTAR Max DNA Polymerase,其他試劑均為市售分析純;主要儀器:e2695液相色譜、蛋白電泳儀、凝膠自動成像儀、PCR儀、電轉儀。
1.1.4 培養基。
LB液體培養基:酵母粉5 g/L、蛋白胨1 g/L、NaCl 5 g/L。
抗性平板培養基:酵母粉5 g/L、蛋白胨1 g/L、NaCl 5 g/L、瓊脂粉20 g/L,根據用途加入50 mg/L氨芐青霉素或者卡那霉素。
搖瓶種子培養基:葡萄糖20 g/L、木糖1 g/L、酵母粉5 g/L、蛋白胨1 g/L、NaCl 5 g/L、氨芐青霉素50 mg/L。
搖瓶發酵培養基:葡萄糖20 g/L、木糖20 g/L、酵母粉5 g/L。
1.2 方法
1.2.1 將xylI基因克隆到載體pET28a(+)。
(1)以質粒pAGI02作為模板,采用引物pET28a(+)-xylI(AR)-p1和pET28a(+)-xylI(AR)-p2擴增出理論長度為1 016 bp的xylI核酸序列。
(2)以pET28a(+)作為模版,采用反向引物pET28a(+)-p-F-P1和pET28a(+)-p-F-P2將pET28a(+)線性化,得到理論長度為5 000 bp的核酸序列。
(3)采用T5外切酶[13]的方法處理xylI核酸序列和pET28a(+)線性化的核酸序列,處理后的產物用氯化鈣法轉化至大腸桿菌DH5α感受態細胞中,30 ℃ 150 r/min復蘇40 min后取100 μL菌液涂布于卡那抗性平板上,待卡那抗性平板上長出單菌落后,挑取單菌落提取重組質粒送至生工生物工程(上海)股份有限公司武漢分公司測序,將測序無誤的重組質粒命名為pET28a(+)-xylI。
(4)將重組質粒pET28a(+)-xylI采用氯化鈣法轉化到E.coli BL21中,得到菌株BL21/pET28a(+)-xylI。
1.2.2 將xylI基因克隆到載體pBR322。
(1)以質粒pBR322作為模版,采用反向引物pBR322-F-P1和pBR322-F-P2將pBR322線性化(線性化序列為除去tetP和Tcr部分的序列),得到理論長度為3 094 bp的核酸序列。
(2)以pWYZ-1質粒作為模版,設計引物pBR322-lacP-xylI P1和pBR322-lacP-xylI P2,從pWYZ-1質粒上擴增出lacP-xylI核酸序列,大小為1 168 bp。
(3)用T5外切酶的方法[13]處理lacP-xylI核酸序列和pBR322載體線性化的核酸序列,處理后的產物用氯化鈣法轉化至大腸桿菌DH5α感受態細胞中,30 ℃150 r/min復蘇40 min后取100 μL菌液涂布于氨芐抗性平板上,待氨芐抗性平板上長出單菌落后,挑取單菌落提取重組質粒送至生工生物工程(上海)股份有限公司武漢分公司測序,將測序無誤的重組質粒命名為pWYZ-2。
(4)將重組質粒pWYZ-2采用氯化鈣法轉化到E.coli AI07中,得到菌株E.coli AI07/pWYZ-2。
1.2.3 將UdhA基因克隆到載體pWYZ-2。
(1)以pWYZ-2質粒為模板,采用反向引物pWYZ-2-P1和pWYZ-2-P2將pWYZ-2線性化,得到理論長度為4 212 bp的核酸序列。
(2)以E.coli W3110[14]為模板,使用引物UdhA-P1和UdhA-P2擴增出理論長度為1 401 bp的UdhA核酸序列。
(3)用T5外切酶的方法將擴增出的UdhA核酸序列與pWYZ-2線性化的核酸序列進行外切處理,處理后的產物用氯化鈣法轉化至大腸桿菌DH5α感受態細胞中,30 ℃150 r/min復蘇40 min后取100 μL菌液涂布于氨芐抗性平板上,待氨芐抗性平板上長出單菌落后,挑取單菌落提取重組質粒送至生工生物工程(上海)股份有限公司武漢分公司測序,將測序無誤的重組質粒命名為pWYZ-4。
(4)將重組質粒pWYZ-4采用氯化鈣法轉化到E.coli AI07中,得到菌株E.coli AI07/pWYZ-4。
1.2.4 SDS-PAGE分析粗酶液中重組蛋白的分子量。
從甘油管中將菌株BL21(DE3)/pET28a(+)-xylI轉接到固體平板,于37 ℃培養箱過夜培養;從卡那平板挑取單克隆BL21(DE3)/pET28a(+)-xylI接種于含卡那的50 mL LB液體培養基中,于37 ℃ 200 r/min培養至OD600=0.6~0.8,再將菌液溫度降至25 ℃以下,加入誘導劑IPTG至最終濃度為1 mmol/L,25 ℃誘導15 h,取2 mL菌液于2 mL離心管中,12 000 r/min 4 ℃離心5 min,使用1 mL預冷的低鹽PBS清洗菌體3遍。每管加入1 mL預冷的裂解液重懸細菌,冰浴超聲400 W,超10 s停10 s,超聲10 min直至變清,4 ℃ 12 000 r/min離心30 min,收集上清即為粗酶液作為樣品進行SDS-PAGE電泳。
1.2.5 菌株BL21(DE3)/pET28a(+)-xylI表達產物的酶活測定。
酶活測定參照張哲等[10]的方法。
對于醛糖還原酶,1個酶活性單位(U)定義為在35 ℃反應條件下1 min消耗1 μmol NADPH所需的酶量。
1.2.6 重組大腸桿菌搖瓶發酵試驗。
分別從甘油管將E.coli AI07/pWYZ-2和E.coli AI07/pWYZ-4菌株轉接到氨芐抗性平板上,并轉接數代;然后從抗性平板上挑取3個菌落到50 mL搖瓶種子培養基中。30 ℃ 200 r/min過夜培養,然后按照2%接種量接種于含有100 mg/L氨芐青霉素的100 mL發酵培養基中,30 ℃ 200 r/min條件下進行發酵,當搖瓶中菌液OD600達到0.8~1.0時,添加0.1 mmol/L IPTG開始誘導。每12 h向發酵搖瓶中補加氨芐青霉素100 μL(100 mg/L);每12 h從搖瓶取出2 mL發酵液。
1.2.7 產物檢測。
用可見分光光度計測定“1.2.6”中取出的發酵液中菌的OD600吸光值,用來評價菌的生物量。
將“1.2.6”中取出的發酵液12 000 r/min離心5 min,取上清用超純水稀釋合適倍數后,用0.22 μm濾膜過濾。采用高效液相色譜waters e2695測定發酵液的木糖醇、D-木糖和葡萄糖。色譜柱為Bio-Rad HPX 87H,檢測器為示差檢測器(2414 RI Detector),流動相4 mmol/L H2SO4,流速0.5 mL/min,柱溫40 ℃。
2 結果與分析
2.1 pET28a(+)-xylI、pWYZ-2和pWYZ-4目標載體的成功構建
圖1~3為3個質粒構建的示意圖,并將測序正確的質粒分別命名為pET28a(+)-xylI、pWYZ-2和pWYZ-4。
2.2 質粒 pET28a(+)-xylI中xylI基因的誘導表達
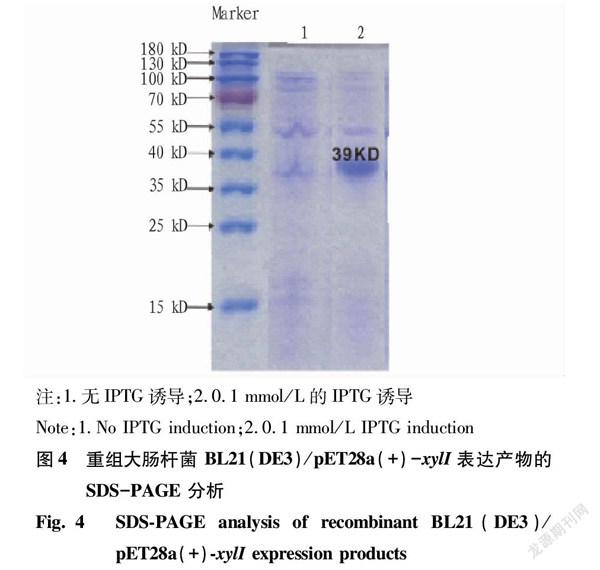
將重組大腸桿菌 BL21(DE3)/pET28a(+)-xylI進行IPTG誘導表達,將誘導表達后的發酵液進行超聲波破胞后離心,以離心后的上清液作為樣品,進行SDS-PAGE 蛋白電泳(膠濃度為12%),結果見圖4。從圖4可見,重組大腸桿菌 BL21(DE3)/pET28a(+)-xylI經過IPTG誘導表達后,在39 kD處出現明顯的蛋白表達條帶(泳道2),而未添加IPTG誘導表達的對照組(泳道1)在相應的位置蛋白表達條帶很淡,可初步推斷醛糖還原酶分子量約為 39 kD,這也與xylI基因預測表達產物分子量大小相符。
2.3 醛糖還原酶酶活測定結果
將重組大腸桿菌 BL21(DE3)/pET28a(+)-xylI進行IPTG誘導表達,將誘導表達后的發酵液進行超聲波破胞后離心,以離心后的上清液作為樣品,測定醛糖還原酶的酶活,結果表明,BL21(DE3)/pET28a(+)-xylI不添加IPTG的酶活為(0.04±0.03) U/mL,
BL21(DE3)/pET28a(+)-xylI 添加IPTG的酶活為(3.30±0.06) U/mL。
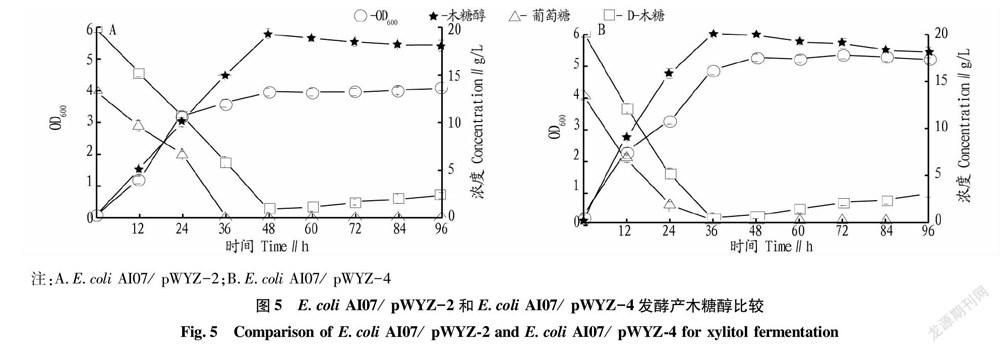
2.4 E.coli AI07/pWYZ-2和E.coli AI07/pWYZ-4菌株發酵結果
在大腸桿菌 BL21(DE3)驗證了xylI基因表達產物及測定了相應醛糖還原酶酶活后,將xylI基因連接上lacP啟動子,重新構建了質粒pWYZ-2,以強化菌株E.coli AI07產木糖醇的能力。在pWYZ-2基礎上,進一步共表達xylI基因和UdhA基因,得到了質粒pWYZ-4。通過對比菌株E.coli AI07/pWYZ-2和E.coli AI07/pWYZ-4發酵產木糖醇的結果,評價UdhA基因對木糖醇發酵的影響。
由圖5可知,在整個發酵過程中,E.coli AI07/pWYZ-4菌株的生物量(OD600值)始終高于菌株E.coli AI07/pWYZ-2;在利用葡萄糖方面,菌株E.coli AI07/
pWYZ-2在發酵24 h后葡萄糖剩余量為7.2 g/L,而菌株E.coli AI07/pWYZ-4發酵24 h后,葡萄糖剩余量為2.1 g/L,表明E.coli AI07/pWYZ-4對葡萄糖消耗較快,也解釋了其在發酵過程中較高的生物量;在利用木糖方面,當初始D-木糖的量為20 g/L時,E.coli AI07/pWYZ-2菌株48 h,木糖醇的產量為19.90 g/L;而菌株E.coli AI07/pWYZ-4 36 h,木糖醇的產量為19.91 g/L。E.coli AI07/pWYZ-4菌株較E.coli AI07/pWYZ-2生產木糖醇的強度提高了33.25%。
UdhA基因能夠催化NADH與NADPH相互轉化,進而調控胞內還原力[15],而NADPH是很多菌屬包括該研究所用的博伊丁假絲酵母醛糖還原酶的輔酶[16],由此推斷,共表達UdhA能調動糖酵解產生的NADH生成NADPH,從而提高木糖醇的產量。但從已有的發酵數據來看,共表達UdhA基因的E.coli AI07/pWYZ-4菌株并未形成更高的木糖醇產量,只是有較高的木糖醇生產強度,推測可能原因在于UdhA基因并不僅僅影響輔酶含量,而是通過一些途徑影響細胞生長或相關酶的酶活,從而提高木糖醇的生產強度。
3 結論
(1)博伊丁假絲酵母醛糖還原酶(xylI)基因在BL21(DE3)/pET28a(+)體系誘導表達后的蛋白產物分子量為39 kD,醛糖還原酶酶活為3.30 U/mL。
(2)將博伊丁假絲酵母醛糖還原酶(xylI)基因接lacP啟動子,克隆到pWYZ-2質粒并轉化到E.coli AI07菌株后發酵48 h,木糖醇的產量為19.90 g/L。
(3)共表達來自E.coli W3110的可溶性吡啶核苷酸轉氫酶基因(UdhA)對于Candida boidinii這類醛糖還原酶依賴NADPH輔因子的菌屬來說,具有提高生產強度的作用,該研究中木糖醇的生產強度提高了33.25%。
參考文獻
[1] 王蒙,張全,高慧鵬,等.生物發酵法制備木糖醇的研究進展[J].中國生物工程雜志,2020,40(3):144-153.
[2] 王棟兵.淺析木糖醇的應用[J].中國科技博覽,2015(46):254.
[3] 楊柳,趙聰,姚默,等.木糖醇應用及毒副作用研究進展[J].安徽農業科學,2011,39(34):21355-21356.
[4] 楊波,許韋,賈東旭,等.生物法制備木糖醇的研究進展[J].發酵科技通訊,2017,46(2):113-117,120.
[5] 王鳳梅,張邦建,岳泰新,等.轉木糖還原酶基因XYL1釀酒酵母的構建及產木糖醇能力研究[J].中國釀造,2018,37(12):66-70.
[6] WEEMS J J JR.Candida parapsilosis:Epidemiology,pathogenicity,clinical manifestations,and antimicrobial susceptibility[J].Clinical infectious diseases,1992,14(3):756-766.
[7] ZHANG F W,QIAO D R,XU H,et al.Cloning,expression,and characterization of xylose reductase with higher activity from Candida tropicalis[J].Journal of microbiology,2009,47(3):351-357.
[8] FERNANDES S,TUOHY M G,MURRAY P G.Xylose reductase from the thermophilic fungus Talaromyces emersonii:Cloning and heterologous expression of the native gene(Texr)and a double mutant(TexrK271R+N273D)with altered coenzyme specificity [J].Journal of hioscienees,2009,34(6):881-890.
[9] 孫瑩,張榮珍,徐巖.(R)-專一性羰基還原酶與甲酸脫氫酶基因在大腸桿菌中的共表達[J].微生物學報,2008,48(12):1629-1633.
[10] 張哲,焦靜雨,陳姣,等.重組大腸桿菌的構建及利用木糖生產木糖醇的研究[J].高校化學工程學報,2016,30(4):864-870.
[11] SU B L,ZHANG Z,WU M B,et al.Construction of plasmid-free Escherichia coli for the production of arabitol-free xylitol from corncob hemicellulosic hydrolysate[J].Scientific reports,2016,6(1):1-11.
[12] 趙旵軍,黃恩啟,龔仁敏,等.吡啶核苷酸轉氫酶的結構及功能[J].中國生物化學與分子生物學報,2007,23(10):797-803.
[13] BOONSTRA B,FRENCH C E,WAINWRIGHT I,et al.The UdhA gene of Escherichia coli encodes a soluble pyridine nucleotide transhydrogenase [J].Journal of bacteriology,1999,181(3):1030-1034.
[14] 廖翀,白林含,阮琨,等.熱帶假絲酵母XYL1基因的克隆及序列分析[J].四川大學學報(自然科學版),2006,43(1):228-231.
[15] YANG D C,TANG M,CAI S,et al.Effect of overexpression UdhA on the production of pyruvate in the E.coli HBUT-P2[C]// 2nd International Conference on Frontiers of Biological Sciences and Engineering(FSBE 2019).Chongqing,China:AIP Conference Proceedings,2020.
[16] 李春雷,鄧小昭,董莉莉,等.一種基因工程改造的NADH高親和力木糖還原酶突變基因可促進釀酒酵母發酵木糖生成乙醇[J].中國生物化學與分子生物學報,2011,27(3):282-286.

