廣靈驢FTO基因克隆、序列分析及組織差異表達(dá)
邱麗霞,關(guān)家偉,李 麗,李武峰,杜 敏
(1.山西農(nóng)業(yè)大學(xué)生命科學(xué)學(xué)院,太谷 030801;2.美國(guó)華盛頓州立大學(xué)動(dòng)物科學(xué)系,普爾曼 99164-6310)
多年來(lái),市場(chǎng)上一直以雞肉、豬肉、牛肉等作為主要的肉類產(chǎn)品滿足消費(fèi)者的需求,但隨著生活水平的提高,人們的消費(fèi)選擇性越來(lái)越強(qiáng)。驢肉具有低脂率、高蛋白營(yíng)養(yǎng)的特點(diǎn)[1],且肉質(zhì)鮮美,符合大眾群體的口感要求,是一種很好的滋補(bǔ)類肉產(chǎn)品,因此,對(duì)驢肉的肉品質(zhì)研究和肉質(zhì)性狀的改良優(yōu)化有助于將驢肉產(chǎn)品推向更大的市場(chǎng)。肉的食用口感和優(yōu)良性狀很大程度上得利于肌內(nèi)脂肪(intramuscular fat,IMF)發(fā)揮作用,肌內(nèi)脂肪沉積是一個(gè)受多基因調(diào)控和代謝機(jī)制影響的過(guò)程,其沉積量影響著嫩度、風(fēng)味、大理石花紋等其他肉質(zhì)性狀的好壞[2]。與此同時(shí),過(guò)度喂養(yǎng)牲畜導(dǎo)致的脂肪沉積過(guò)多會(huì)影響其健康狀況與食用口感,進(jìn)而影響其經(jīng)濟(jì)價(jià)值,因此,從分子生物學(xué)角度開(kāi)展脂肪沉積的研究很有必要。
脂肪和肥胖相關(guān)基因(fat mass and obesity-associated gene,FTO)是1999年P(guān)eters等[3]通過(guò)克隆患有腳趾融合的野生型小鼠發(fā)現(xiàn)的,是能夠顯著影響脂肪代謝和沉積的關(guān)聯(lián)基因,現(xiàn)階段的研究主要集中在人和小鼠上。研究發(fā)現(xiàn),攜帶有FTO基因的小鼠會(huì)表現(xiàn)出體長(zhǎng)更長(zhǎng)、體重更高和骨密度更高的特點(diǎn),說(shuō)明FTO基因的表達(dá)與脂肪沉積之間具有密切聯(lián)系,同時(shí)在生長(zhǎng)發(fā)育方面發(fā)揮著關(guān)鍵作用[4]。FTO基因?qū)儆诜嵌r(jià)鐵離子血紅素加雙氧酶超家族(ALKB)成員之一,也被稱為ALKBH9,擁有鐵結(jié)合基因與α-酮戊二酸相互作用的結(jié)構(gòu)域[5],在DNA/RNA的去甲基化中起重要作用[6]。FTO基因在絕大多數(shù)生物中廣泛表達(dá),Hu等[7]研究發(fā)現(xiàn),在克隆豬FTO基因序列后的6號(hào)染色體片段中存在相應(yīng)的SNPs位點(diǎn),該區(qū)域擁有許多調(diào)控脂肪性狀的數(shù)量性狀位點(diǎn),推測(cè)這些SNPs位點(diǎn)可能與豬的肌內(nèi)脂肪沉積相關(guān)。研究表明,F(xiàn)TO基因在不同動(dòng)物組織中均有表達(dá),且表達(dá)量存在顯著差異,F(xiàn)rayling等[8]分別在胎兒和成人的各組織中檢測(cè)FTO基因的表達(dá)情況,結(jié)果發(fā)現(xiàn)無(wú)論是在胎兒還是成人的大腦中其表達(dá)量都是最高的,這與大鼠、小鼠的組織表達(dá)結(jié)果一致[9]。Gerken等[5]利用原位雜交技術(shù)發(fā)現(xiàn),F(xiàn)TO基因在下丘腦控制能量平衡的核團(tuán)中廣泛表達(dá),說(shuō)明FTO基因與肥胖的相關(guān)性可以通過(guò)能量攝取來(lái)實(shí)現(xiàn)。Mizuno等[10]通過(guò)對(duì)小鼠禁食來(lái)觀察FTO基因與肝臟代謝水平之間的聯(lián)系,發(fā)現(xiàn)通過(guò)饑餓行為處理之后,F(xiàn)TO基因及過(guò)氧化物酶體相關(guān)輔助因子可影響肝臟的代謝水平變化,F(xiàn)TO基因與血糖、葡萄糖-6-磷酸酶(glucose-6-phosphate,G-6-PC)等mRNA水平呈顯著正相關(guān),說(shuō)明FTO基因mRNA的表達(dá)受能量攝入的影響,并與代謝物的代謝水平波動(dòng)有關(guān)。目前,關(guān)于FTO基因組織特異性表達(dá)的研究主要集中在鼠和豬等少數(shù)哺乳動(dòng)物中[11],對(duì)驢FTO基因的遺傳研究鮮見(jiàn)報(bào)道。鑒于此,本試驗(yàn)以廣靈驢為試驗(yàn)動(dòng)物,擴(kuò)增并克隆FTO基因,分析其核苷酸和蛋白質(zhì)序列與功能,并檢測(cè)FTO基因在廣靈驢7種不同組織中的表達(dá)情況,以期為進(jìn)一步探究FTO基因的表達(dá)調(diào)控與基因功能、脂肪沉積和物質(zhì)代謝提供理論基礎(chǔ)。
1 材料與方法
1.1 材料
1.1.1 樣品采集 試驗(yàn)動(dòng)物由山西省忻州市繁峙縣田園毛驢養(yǎng)殖公司提供,在保證規(guī)范管理、自由采食和充足飲水的前提下選取10頭3歲體重相同、體態(tài)健康的雌性母驢,進(jìn)行放血處理確保動(dòng)物已經(jīng)死亡后屠宰。在無(wú)菌條件下采集心臟、肝臟、脾臟、肺臟、腎臟、背最長(zhǎng)肌及皮下脂肪組織,剔除樣品中的結(jié)締組織后盛裝到2 mL凍存管留樣保存,然后使用液氮進(jìn)行冷凍處理,帶回實(shí)驗(yàn)室后-80 ℃保存?zhèn)溆谩?/p>
1.1.2 主要試劑 普通DNA凝膠回收試劑盒、pGM-T Fast克隆試劑盒、大腸桿菌DH5α感受態(tài)細(xì)胞均購(gòu)自天根生化科技(北京)有限公司;Trans2K DNA Marker購(gòu)自北京全式金生物技術(shù)有限公司;2×TaqPCR MasterMix購(gòu)自中科瑞泰(北京)生物科技有限公司;反轉(zhuǎn)錄及熒光定量試劑盒均購(gòu)自北京聚和美有限公司;Trizol試劑盒、SYBR Green Ⅰ核酸染料(10 000×)及氨芐青霉素均購(gòu)自北京索萊寶科技有限公司。
1.2 方法
1.2.1 引物設(shè)計(jì)及合成 參照GenBank中馬(登錄號(hào):XM_023636997.1)、羊駝(登錄號(hào):XM_006207838.3)、山羊(登錄號(hào):NM_001319276.1)等物種的FTO基因序列,運(yùn)用Primer Premier 3.0及GenScript Primer Design在線軟件分別設(shè)計(jì)3對(duì)用于廣靈驢FTO基因CDS序列的克隆引物和1對(duì)實(shí)時(shí)熒光定量PCR引物,內(nèi)參基因選用β-actin,引物信息見(jiàn)表1。引物均由生工生物工程(上海)股份有限公司合成。

表1 引物信息
1.2.2 總RNA提取及cDNA合成 利用Trizol試劑盒提取驢7種不同組織總RNA,利用核酸測(cè)定儀及凝膠電泳鑒定RNA的濃度和完整性,符合質(zhì)量要求后參照M5 Super qPCR RT Kit with gDNA Remove反轉(zhuǎn)錄試劑盒說(shuō)明書(shū)合成cDNA,-20 ℃保存?zhèn)溆谩?/p>
1.2.3 克隆及測(cè)序分析 以cDNA為模板,運(yùn)用PCR技術(shù)擴(kuò)增FTO基因CDS區(qū)完整序列。PCR擴(kuò)增體系10 μL:模板cDNA 1 μL,2×TaqPCR MasterMix 5 μL,上、下游引物各0.4 μL,ddH2O 3.2 μL。PCR反應(yīng)程序:94 ℃預(yù)變性5 min;94 ℃變性30 s,59 ℃退火30 s,72 ℃延伸30 s,共34個(gè)循環(huán);72 ℃延伸5 min;12 ℃保存。利用1.0%瓊脂糖凝膠電泳檢測(cè)其特異性,鑒定正確后進(jìn)行回收和純化,將其與pGM-T載體過(guò)夜連接,轉(zhuǎn)化大腸桿菌DH5α感受態(tài)細(xì)胞,在抗氨芐青霉素的培養(yǎng)基中接種培養(yǎng)擴(kuò)大體系,挑選陽(yáng)性克隆菌送生工生物工程(上海)股份有限公司測(cè)序。
1.2.4 相似性比對(duì)及系統(tǒng)進(jìn)化樹(shù)構(gòu)建 利用DNAMAN 9.0軟件對(duì)測(cè)序結(jié)果進(jìn)行拼接,利用BLAST將所獲序列與輸入NCBI中進(jìn)行比對(duì)得到完整CDS區(qū)。通過(guò)ORF Finder工具預(yù)測(cè)FTO基因開(kāi)放閱讀框(open reading frame,ORF),并由此得到完整氨基酸序列。使用ClustalX和DNAStar 11.0中的MegAlign軟件將廣靈驢與馬(登錄號(hào):XM_023636997.1)、牛(登錄號(hào):NM_001098142.1)、人(登錄號(hào):NM_001080432.3)、豬(登錄號(hào):NM_001112692.1)、綿羊(登錄號(hào):NM_001104931.1)、山羊(登錄號(hào):NM_001319276.1)和羊駝(登錄號(hào):XM_006207838.3)的FTO基因序列進(jìn)行相似性比對(duì),利用Mega 11.0軟件構(gòu)建系統(tǒng)發(fā)育樹(shù)。
1.2.5 生物信息學(xué)分析 使用ExPASy中ProtParam和ProtScale在線軟件對(duì)FTO蛋白進(jìn)行理化性質(zhì)、親/疏水性預(yù)測(cè);利用PSORT Ⅱ Prediction、TMHMM 2.0、NetPhos 3.1、NetNGlyc 1.0和NetOGlyc 4.0在線軟件對(duì)FTO蛋白的亞細(xì)胞定位、跨膜區(qū)域、磷酸化位點(diǎn)及糖基化位點(diǎn)進(jìn)行預(yù)測(cè);利用SOPMA、SWISS-MODEL及NCBI中CDD網(wǎng)站預(yù)測(cè)FTO蛋白的二級(jí)結(jié)構(gòu)、三級(jí)結(jié)構(gòu)和結(jié)構(gòu)域等,詳細(xì)信息見(jiàn)表2。

表2 預(yù)測(cè)FTO氨基酸功能的生物信息學(xué)分析網(wǎng)站
1.2.6 組織差異表達(dá) 以廣靈驢7種組織cDNA為模板,以β-actin為內(nèi)參基因,使用實(shí)時(shí)熒光定量PCR檢測(cè)FTO基因表達(dá)水平。PCR反應(yīng)體系10 μL:模板1 μL,2×Real-time PCR Super Mix 5 μL,上、下游引物各0.25 μL,ddH2O 3.5 μL。PCR反應(yīng)條件:95 ℃ 10 min;95 ℃ 15 s,60 ℃ 1 min,72 ℃ 20 s,共40個(gè)循環(huán)。每組樣品3個(gè)重復(fù)。以肝臟組織為對(duì)照,利用2-ΔΔCt法計(jì)算FTO基因相對(duì)表達(dá)量,運(yùn)用GraphPad Prism 8.0工具選擇單因素方差分析(One-Way ANOVA)方法處理試驗(yàn)數(shù)據(jù),繪圖呈現(xiàn)出不同組織的基因表達(dá)差異,以P<0.05為差異顯著性判斷標(biāo)準(zhǔn)。
2 結(jié) 果
2.1 FTO基因CDS區(qū)克隆與測(cè)序
PCR擴(kuò)增產(chǎn)物經(jīng)1.0%瓊脂糖凝膠電泳鑒定,結(jié)果見(jiàn)圖1。由圖1可知,擴(kuò)增序列長(zhǎng)度分別為724、861和515 bp,與預(yù)期片段大小一致。對(duì)鑒定正確的PCR產(chǎn)物進(jìn)行克隆測(cè)序,對(duì)所獲序列進(jìn)行拼接,得出長(zhǎng)為1 518 bp的廣靈驢FTO基因CDS區(qū)序列,序列提交至NCBI,登錄號(hào):MZ169553。通過(guò)ORF Finder工具進(jìn)行開(kāi)放閱讀框預(yù)測(cè)分析,結(jié)果表明,F(xiàn)TO基因開(kāi)放閱讀框長(zhǎng)1 518 bp,編碼505個(gè)氨基酸殘基。
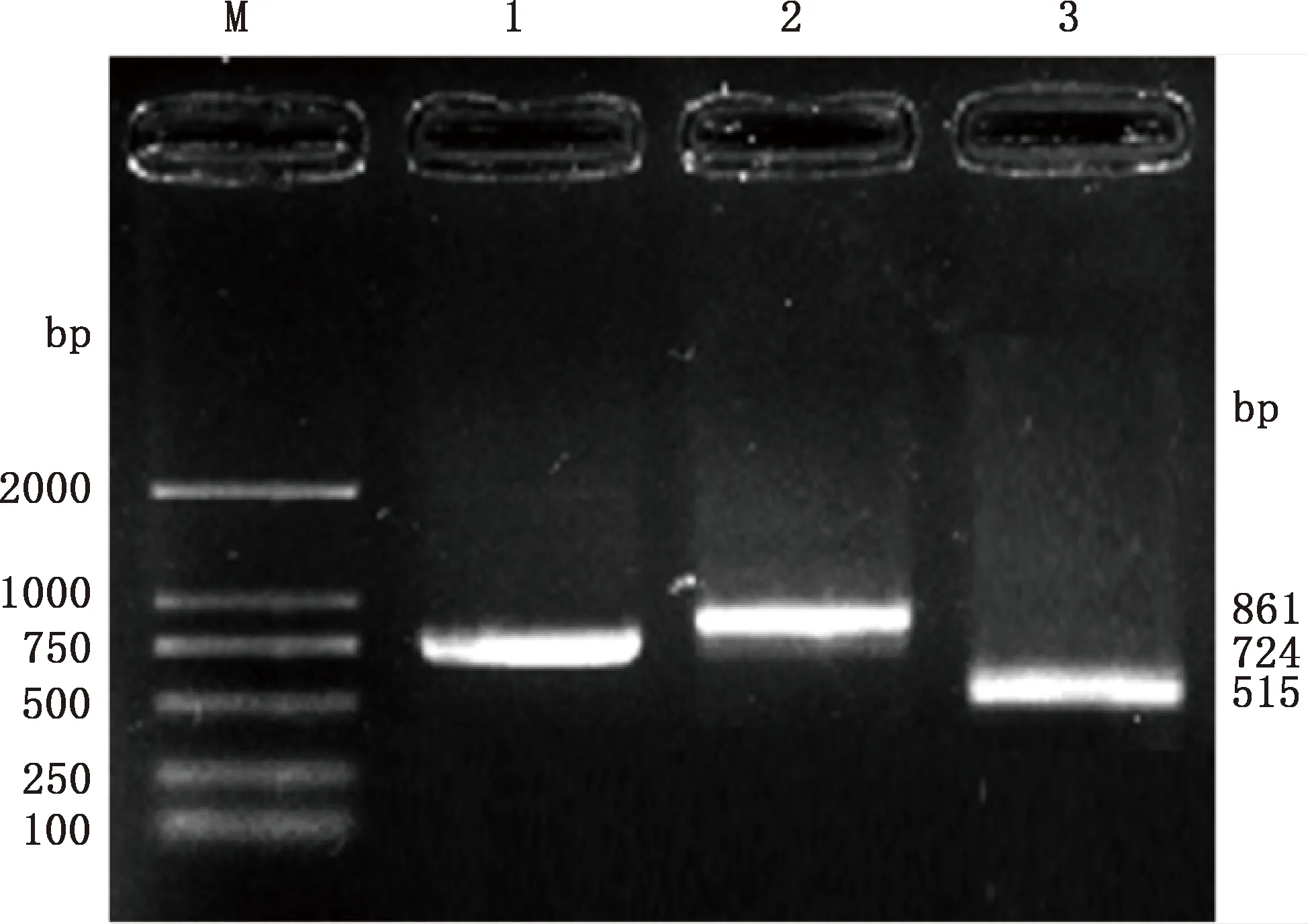
M,Trans2K DNA Marker;1~3,引物FTO-1、FTO-2、FTO-3的PCR擴(kuò)增產(chǎn)物M,Trans2K DNA Marker;1-3,PCR amplification products of primers FTO-1,F(xiàn)TO-2 and FTO-3,respectively圖1 廣靈驢FTO基因的PCR擴(kuò)增結(jié)果Fig.1 PCR amplification results of FTO gene in Guangling donkey
2.2 廣靈驢FTO基因核苷酸及氨基酸序列的相似性比對(duì)
運(yùn)用MegAlign在線軟件進(jìn)行序列的相似性比對(duì),結(jié)果顯示,廣靈驢FTO基因與馬、人、羊駝、豬、牛、綿羊和山羊的核苷酸序列相似性分別為99.3%、90.8%、90.7%、90.3%、89.5%、89.2%和89.2%(圖2);氨基酸序列相似性分別為98.9%、87.1%、94.7%、92.8%、91.4%、91.3%和91.3%(圖3)。

圖2 廣靈驢FTO基因核苷酸序列相似性比對(duì)Fig.2 The similarity alignment of nucleotide sequences of FTO gene in Guangling donkey
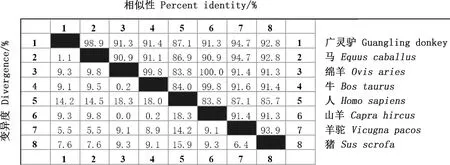
圖3 廣靈驢FTO基因氨基酸序列相似性比對(duì)Fig.3 The similarity alignment of amino acid sequences of FTO gene in Guangling donkey
2.3 系統(tǒng)進(jìn)化樹(shù)構(gòu)建
通過(guò)Mega 11.0軟件利用NJ(Neighbor-Jioning)法構(gòu)建廣靈驢FTO基因與其他物種的系統(tǒng)進(jìn)化樹(shù),結(jié)果見(jiàn)圖4。由圖4可知,與廣靈驢親緣性最近的是馬,其次與人聚為一類;再與羊駝和豬匯聚成一類;最后與牛、山羊、綿羊匯聚成一大類,說(shuō)明廣靈驢與山羊、綿羊的親緣性最遠(yuǎn),與相似性比對(duì)結(jié)果相一致。

圖4 廣靈驢FTO基因系統(tǒng)進(jìn)化樹(shù)Fig.4 Phylogenetic tree of FTO gene in Guangling donkey
2.4 生物信息學(xué)分析
2.4.1 理化性質(zhì) FTO蛋白分子式為C2597H4021N705O775S26,分子質(zhì)量為58.35 ku,脂肪系數(shù)為80.36,理論等電點(diǎn)為5.07,表明FTO極可能是酸性蛋白。FTO蛋白編碼的505個(gè)氨基酸中亮氨酸數(shù)量最多(11.1%),甲硫氨酸數(shù)量最少(2.4%),帶負(fù)電的氨基酸殘基數(shù)量多于帶正電的(表3)。FTO蛋白穩(wěn)定系數(shù)為48.82,說(shuō)明該蛋白性質(zhì)不穩(wěn)定。

表3 廣靈驢FTO蛋白的氨基酸組成
2.4.2 親/疏水性 通過(guò)ProtScale在線軟件對(duì)廣靈驢FTO蛋白進(jìn)行親/疏水性分析,在第483異亮氨酸(I)處疏水性最大(2.500);在第12位精氨酸(R)處疏水性最小(-3.222),F(xiàn)TO蛋白的平均疏水指數(shù)為-0.550,證明該蛋白為親水性蛋白(圖5)。
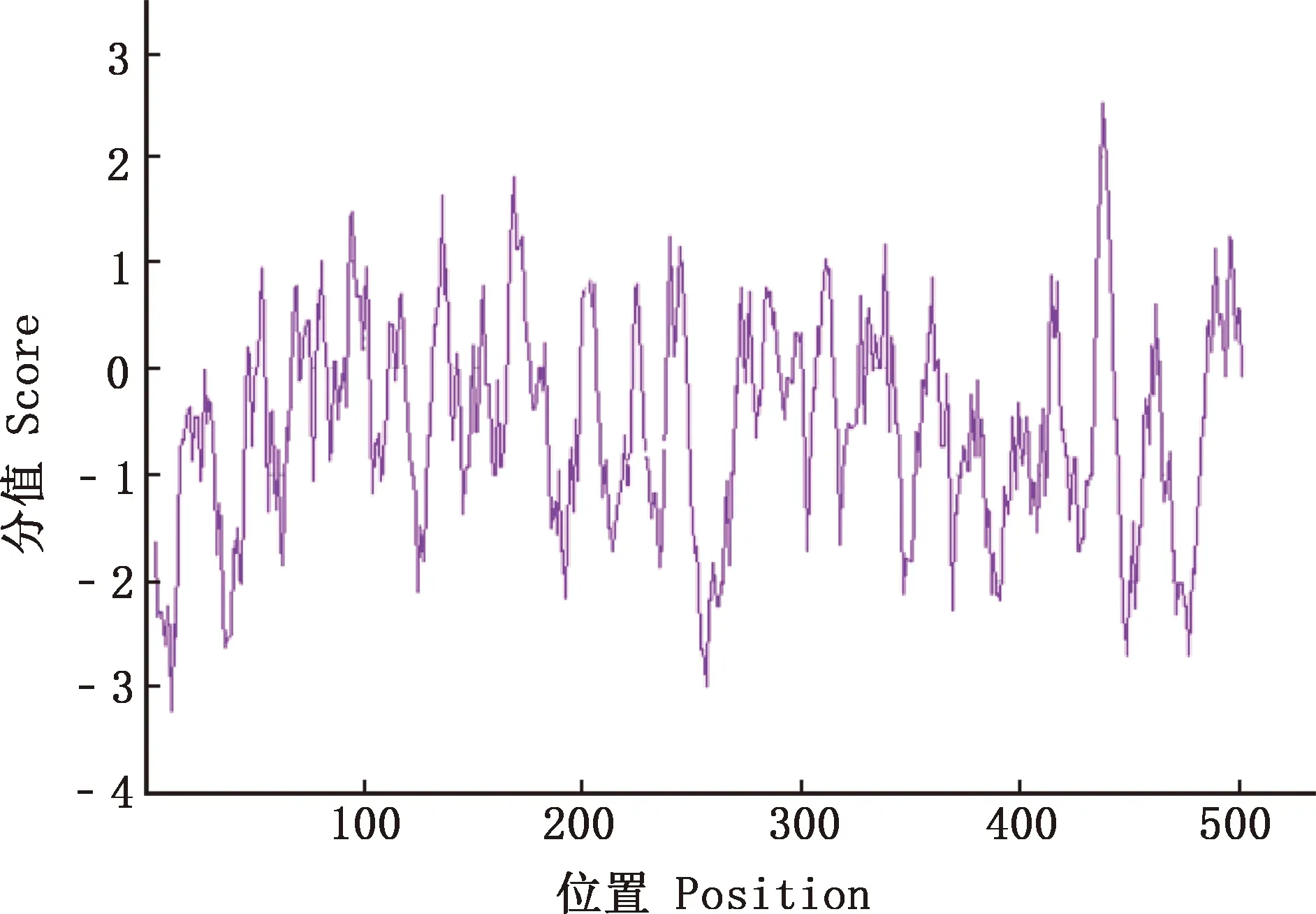
圖5 廣靈驢FTO蛋白的親/疏水性預(yù)測(cè)Fig.5 Hydrophilicity/hydrophobicity prediction of FTO protein in Guangling donkey
2.4.3 跨膜區(qū)和亞細(xì)胞定位 使用TMHMM 2.0在線軟件分析FTO蛋白跨膜區(qū),結(jié)果顯示,廣靈驢FTO蛋白沒(méi)有明顯的跨膜區(qū)域,且主要分布于膜外(圖6),說(shuō)明該蛋白為膜外蛋白。使用PSORT Ⅱ Prediction在線工具對(duì)蛋白亞細(xì)胞定位進(jìn)行預(yù)測(cè),結(jié)果顯示,F(xiàn)TO蛋白位于細(xì)胞質(zhì)中的可能性大于細(xì)胞核,可能性分別為73.9%和26.1%,可信度顯示76.7%,表明該蛋白存在于細(xì)胞質(zhì)中的可能性較大。
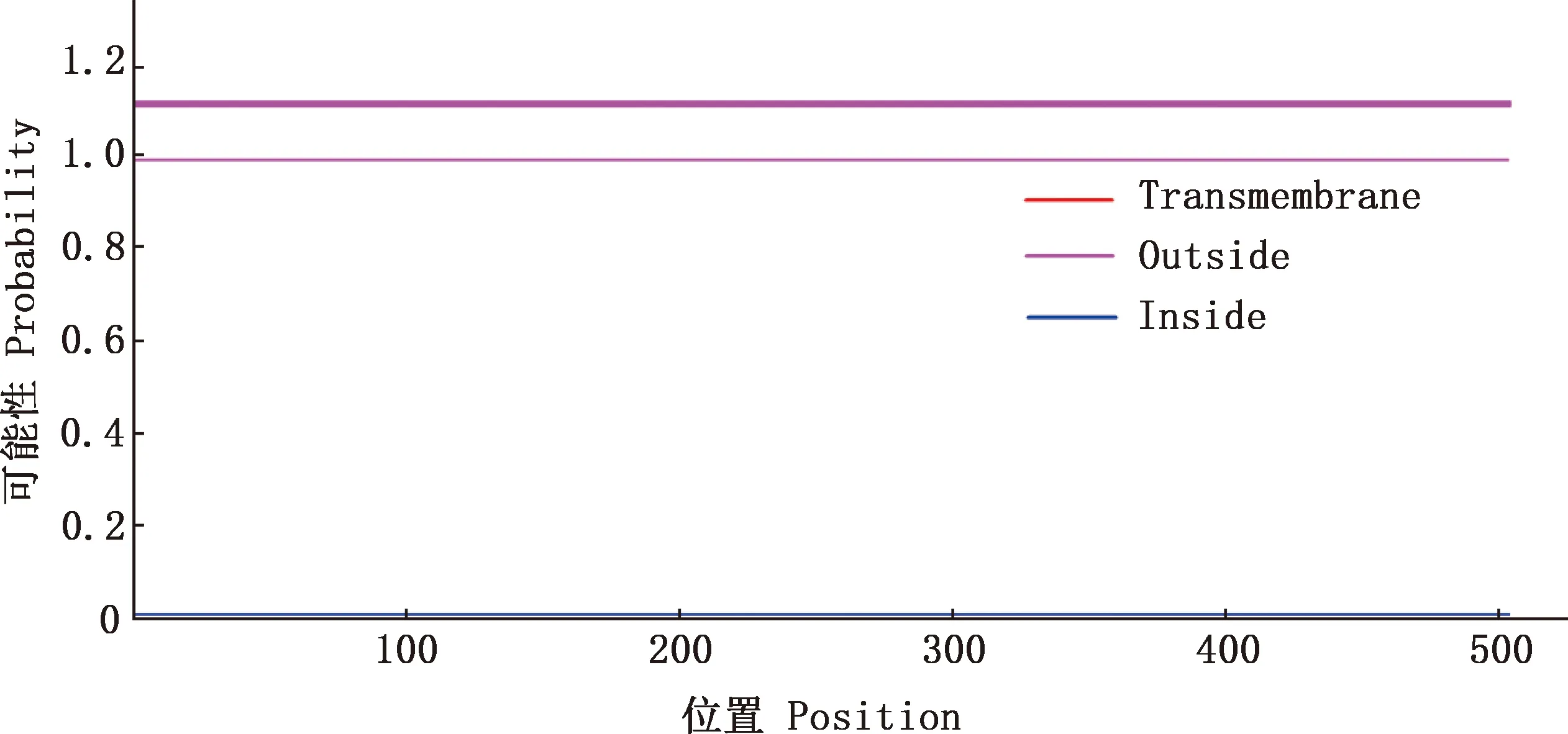
圖6 廣靈驢FTO蛋白的跨膜區(qū)預(yù)測(cè)Fig.6 Transmembrane prediction of FTO protein in Guangling donkey
2.4.4 磷酸化位點(diǎn)與糖基化位點(diǎn)預(yù)測(cè) 運(yùn)用NetPhos 3.1、NetNGlyc 1.0及NetOGlyc 4.0在線軟件預(yù)測(cè)FTO蛋白的修飾情況,結(jié)果顯示,共預(yù)測(cè)到34個(gè)磷酸化位點(diǎn),其中絲氨酸(Ser)、蘇氨酸(Thr)和酪氨酸(Tyr)磷酸化位點(diǎn)分別為17、13和4個(gè)(圖7A);2個(gè)N-糖基化位點(diǎn),分別位于第200及302位氨基酸處(圖7B),3個(gè)O-糖基化位點(diǎn)。

圖7 廣靈驢FTO蛋白磷酸化位點(diǎn)(A)與N-糖基化位點(diǎn)(B)預(yù)測(cè)Fig.7 Phosphorylation (A) and N-glycosylation (B) site prediction of FTO protein in Guangling donkey
2.4.5 二級(jí)結(jié)構(gòu)與三級(jí)結(jié)構(gòu) 利用SOPMA在線軟件預(yù)測(cè)FTO蛋白二級(jí)結(jié)構(gòu),結(jié)果顯示,α-螺旋、無(wú)規(guī)則卷曲、延伸鏈和β-轉(zhuǎn)角分別占43.96%、37.82%、11.49%和6.73%(圖8)。利用SWISS-MODEL在線軟件預(yù)測(cè)FTO蛋白三級(jí)結(jié)構(gòu)模型,其預(yù)測(cè)結(jié)果與二級(jí)結(jié)構(gòu)預(yù)測(cè)結(jié)果相符(圖9)。
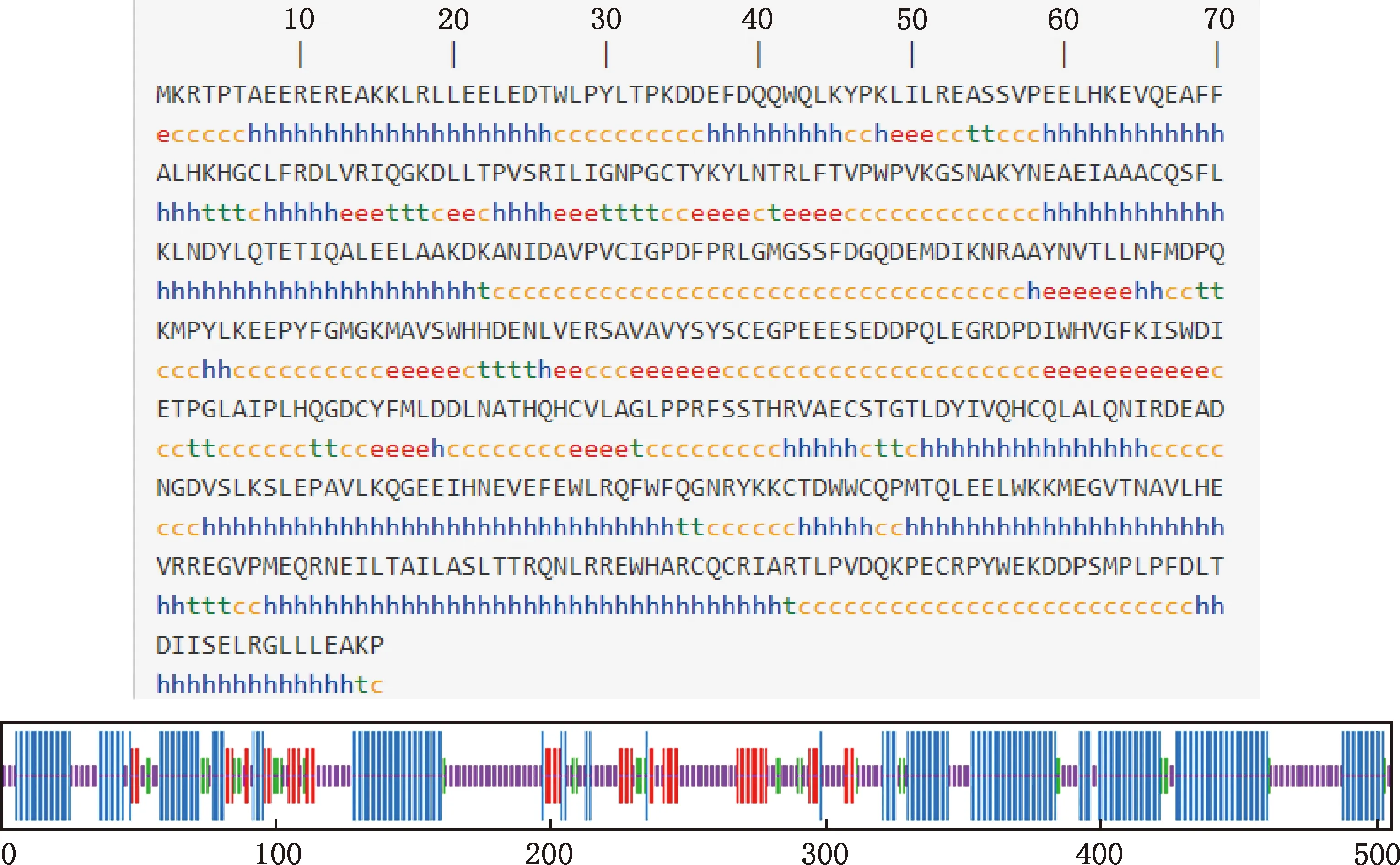
①h,α-螺旋;e,延伸鏈;t,β-轉(zhuǎn)角;c,無(wú)規(guī)則卷曲。②線條由長(zhǎng)到短分別為α-螺旋、延伸鏈、β-轉(zhuǎn)角和無(wú)規(guī)則卷曲①h,Alpha helix;e,Expended strand;t,Beta turn;c,Random coil.②The lines form long to short represent alpha helix,expended strand,beta turn and random coil,respectively圖8 廣靈驢FTO蛋白二級(jí)結(jié)構(gòu)預(yù)測(cè)Fig.8 Secondary structure prediction of FTO protein in Guangling donkey
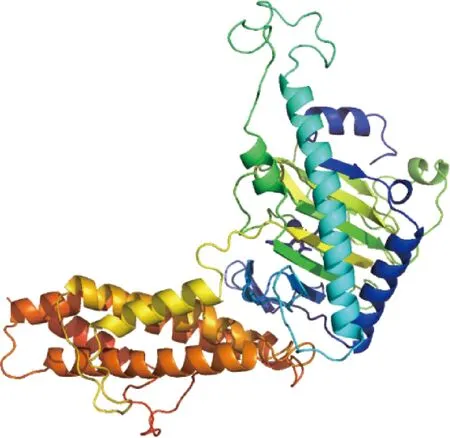
圖9 廣靈驢FTO蛋白三級(jí)結(jié)構(gòu)預(yù)測(cè)Fig.9 Tertiary structure prediction of FTO protein in Guangling donkey
2.4.6 結(jié)構(gòu)域 通過(guò)NCBI的CDD進(jìn)行結(jié)構(gòu)域預(yù)測(cè)發(fā)現(xiàn),F(xiàn)TO蛋白存在2個(gè)結(jié)構(gòu)域(圖10), 在第36-325位氨基酸處存在FTO N-端催化結(jié)構(gòu)域,具有催化脫甲基化酶活性,來(lái)自于FTO蛋白的催化類AlkB超家族;在第329-498位氨基酸處存在FTO C-端結(jié)構(gòu)域,該結(jié)構(gòu)域已被證明與人類體重指數(shù)(body mass index,BMI)和肥胖風(fēng)險(xiǎn)增加有關(guān)。

圖10 廣靈驢FTO蛋白結(jié)構(gòu)域預(yù)測(cè)Fig.10 Domain prediction of FTO protein in Guangling donkey
2.5 廣靈驢FTO基因組織差異分析
由圖11可知,F(xiàn)TO基因在廣靈驢7種組織中均有表達(dá),且呈現(xiàn)出明顯的表達(dá)差異,其中FTO基因表達(dá)最豐富的組織為皮下脂肪和肺臟,且兩者間差異不顯著(P>0.05),但與肝臟、脾臟、腎臟、心臟和背最長(zhǎng)肌的表達(dá)量存在極顯著差異(P<0.01);FTO基因在肝臟中的表達(dá)量極顯著高于心臟、脾臟、腎臟和背最長(zhǎng)肌(P<0.01);在心臟和脾臟中的表達(dá)量較少,極顯著低于腎臟(P<0.01),顯著高于背最長(zhǎng)肌(P<0.05)。

肩標(biāo)不同小寫字母表示差異顯著(P<0.05);肩標(biāo)不同大寫字母表示差異極顯著(P<0.01);肩標(biāo)相同字母表示差異不顯著(P>0.05)Values with different small letter superscripts mean significant difference (P<0.05);And with different capital letter superscripts mean extremely significant difference (P<0.01);While with the same letter superscripts mean no significant difference (P>0.05)圖11 廣靈驢7種組織FTO基因表達(dá)差異Fig.11 Expression difference of FTO gene in 7 tissues of Guangling donkey
3 討 論
研究證明,除營(yíng)養(yǎng)調(diào)控外,脂肪沉積很大程度上受分子遺傳水平層面的調(diào)控影響,肌內(nèi)脂肪沉積不僅影響動(dòng)物的體型與健康狀況,還能調(diào)控改善肉類品質(zhì),如肉色、嫩度、風(fēng)味、大理石花紋等[12]。隨著全基因組關(guān)聯(lián)性分析、候選基因篩選和遺傳克隆等分子生物技術(shù)的成熟,與脂肪沉積相關(guān)的一些候選基因相繼被發(fā)現(xiàn)。脂肪沉積是一個(gè)動(dòng)態(tài)平衡的過(guò)程,主要以甘油三酯(triglyceride,TG)的形式儲(chǔ)存和發(fā)揮生理作用[13], 像過(guò)氧化物酶體增殖物激活受體γ(peroxisome proliferator-activated receptor gamma,PPARγ)[14]、 激素敏感酯酶(hormone sensitive lipase,HSL)[15]、二酰基甘油酰基轉(zhuǎn)移酶(diacylglycerolacyl-transferase,DGAT)[16]等都是脂肪沉積過(guò)程中的轉(zhuǎn)錄因子或脂肪分泌因子,對(duì)脂肪級(jí)聯(lián)調(diào)控發(fā)揮一定作用[17]。研究顯示,F(xiàn)TO基因可通過(guò)頡頏脂肪分解的相關(guān)基因或上調(diào)脂肪合成的相關(guān)基因來(lái)幫助TG的聚集,從而使脂肪沉積量增加[18]。目前,廣靈驢FTO基因的肉質(zhì)性狀關(guān)聯(lián)和遺傳調(diào)控的研究在國(guó)內(nèi)外鮮見(jiàn)報(bào)道,本試驗(yàn)通過(guò)克隆FTO基因的完整CDS區(qū)序列,并預(yù)測(cè)FTO蛋白的相關(guān)功能,來(lái)探究其在動(dòng)物脂肪沉積與能量平衡過(guò)程中的作用。
本研究克隆獲得廣靈驢FTO基因CDS區(qū)序列,與其他物種相比具有較高的保守性。研究發(fā)現(xiàn),F(xiàn)TO基因內(nèi)含子1中的SNP是與體重指數(shù)和體脂相關(guān)的常見(jiàn)變異體,其主要與食物攝入和能量平衡有關(guān)[19-20]。Karra等[21]證實(shí),F(xiàn)TO基因上的SNP位點(diǎn)rs9939609可以通過(guò)食欲肽的表達(dá)水平影響食欲并影響攝食量,以達(dá)到脂肪含量的沉積與能量消耗代謝。因此,推測(cè)FTO基因突變位點(diǎn)可能會(huì)通過(guò)同樣的方式對(duì)廣靈驢的脂肪沉積產(chǎn)生影響,為深入探究廣靈驢FTO基因功能提供了新的思路。 本試驗(yàn)結(jié)果發(fā)現(xiàn),廣靈驢FTO基因開(kāi)放閱讀框長(zhǎng)1 518 bp,可編碼505個(gè)氨基酸, 分析結(jié)果與豬[22]和山羊[23]一致。在豬中,F(xiàn)TO基因會(huì)隨著體重的增加而增加, 并與肌內(nèi)脂肪組織呈顯著相關(guān),表明FTO很有可能是脂肪沉積性狀的重要候選基因[24]。
FTO蛋白質(zhì)分子式為C2597H4021N705O775S26,屬于酸性親水蛋白且性質(zhì)不穩(wěn)定,通過(guò)對(duì)蛋白序列比對(duì)和理化性質(zhì)預(yù)測(cè)得知,F(xiàn)TO蛋白與其他物種間高度保守一致。RNA結(jié)合蛋白SFPQ能夠與FTO相互作用,F(xiàn)TO的亞細(xì)胞定位直接影響其接近不同RNA底物的能力[25]。亞細(xì)胞定位結(jié)果顯示,F(xiàn)TO蛋白可能定位于細(xì)胞質(zhì)中,而RNA主要存在于細(xì)胞核,與FTO不處于同一空間,這個(gè)現(xiàn)象可能與其去甲基化能力的強(qiáng)弱有直接關(guān)聯(lián),進(jìn)而影響脂肪沉積含量。FTO具有34個(gè)磷酸化位點(diǎn)和5個(gè)糖基化位點(diǎn),磷酸化和糖基化作為蛋白質(zhì)翻譯后修飾作用可決定蛋白質(zhì)的功能,F(xiàn)TO蛋白作為一種重要的去甲基化酶,能夠通過(guò)調(diào)節(jié)6-甲基腺嘌呤(N6-methyladenosine,m6A)的去甲基化來(lái)調(diào)控脂肪沉積過(guò)程。Wu等[26]揭示了FTO依賴的m6A甲基化的去甲基化作用通過(guò)磷酸腺苷蛋白激酶(adenosine 5′-monophosphate-activated protein kinase,AMPK)信號(hào)通路參與骨骼肌脂質(zhì)積累的調(diào)節(jié),同時(shí),F(xiàn)TO基因作用于m6A的去甲基化還與肥胖、心血管疾病和腫瘤的發(fā)生有關(guān)[27]。蛋白質(zhì)二級(jí)結(jié)構(gòu)預(yù)測(cè)發(fā)現(xiàn),α-螺旋及無(wú)規(guī)則卷曲是廣靈驢FTO蛋白最主要的結(jié)構(gòu)形式,進(jìn)一步證實(shí)了FTO蛋白性質(zhì)不穩(wěn)定的結(jié)果,易于改變其空間構(gòu)象。結(jié)構(gòu)域預(yù)測(cè)分析顯示,F(xiàn)TO第36-325位氨基酸處存在N-端催化結(jié)構(gòu)域(NTD),第329-498位氨基酸處存在β-折疊的C-端結(jié)構(gòu)域(CTD),NTD決定著FTO的去甲基化酶活性,使其在脂質(zhì)積累過(guò)程中發(fā)揮作用,CTD則與人類肥胖風(fēng)險(xiǎn)有關(guān)。
FTO基因廣泛表達(dá)于與能量穩(wěn)態(tài)相關(guān)的外周區(qū)域,包括肝臟、脂肪組織和骨骼肌。 廣靈驢不同組織FTO基因表達(dá)差異結(jié)果發(fā)現(xiàn),在皮下脂肪、肺臟、肝臟和腎臟中的表達(dá)量極顯著高于心臟、脾臟和背最長(zhǎng)肌,這與Chen等[28]試驗(yàn)結(jié)果基本一致。皮下脂肪組織是肌內(nèi)脂肪沉積的主要位置,而肺臟是啟動(dòng)免疫保護(hù)功能的重要組織器官,F(xiàn)TO基因在肺臟中的高表達(dá)指示其可能在保護(hù)免疫中發(fā)揮作用,肝臟和腎臟則主要影響著機(jī)體的能量積累與代謝。已有研究認(rèn)為,免疫能力取決于營(yíng)養(yǎng)狀況,也可能會(huì)受到包括肥胖在內(nèi)的相關(guān)疾病的負(fù)面影響,F(xiàn)TO基因可以從遺傳堿基多態(tài)性上誘導(dǎo)Ⅱ型糖尿病的發(fā)生、損害免疫功能,從而引起相關(guān)傳染病的發(fā)生[29]。另外,背最長(zhǎng)肌中FTO基因表達(dá)量最低的原因可能是受肌肉纖維類型的影響,Gan等[30]通過(guò)研究雜交鴨腿肌和胸肌的肉質(zhì)性狀影響發(fā)現(xiàn),2個(gè)不同肌肉部位的肌內(nèi)脂肪含量存在顯著差異,肌內(nèi)脂肪含量與紅色肌纖維含量呈正相關(guān),與白色肌纖維含量呈負(fù)相關(guān)。因此,F(xiàn)TO基因并不局限于單一部位的表達(dá),可在機(jī)體多個(gè)組織中表達(dá),對(duì)脂肪沉積調(diào)控和免疫功能等方面發(fā)揮關(guān)鍵作用,并與控制能量支出平衡有關(guān)。
4 結(jié) 論
本研究成功克隆了廣靈驢FTO基因CDS序列,提交到NCBI,登錄號(hào):MZ169553,序列長(zhǎng)度為1 518 bp,可編碼505個(gè)氨基酸,其與馬親緣關(guān)系最近,與綿羊和山羊親緣關(guān)系最遠(yuǎn)。FTO蛋白是不穩(wěn)定的酸性蛋白,包含34個(gè)磷酸化位點(diǎn)和5個(gè)糖基化位點(diǎn),具有屬于AlkB超家族的C-端結(jié)構(gòu)域及N-端催化結(jié)構(gòu)域,不存在信號(hào)肽剪切位點(diǎn)和跨膜結(jié)構(gòu),高級(jí)結(jié)構(gòu)以α-螺旋和無(wú)規(guī)則卷曲為主。FTO基因在廣靈驢7種組織中均有不同程度的表達(dá),其中表達(dá)水平最豐富的組織為皮下脂肪和肺臟,但在背最長(zhǎng)肌中的表達(dá)豐度最低,推測(cè)FTO基因?qū)χ境练e發(fā)揮作用,為將來(lái)提高脂肪沉積含量及改善肉品質(zhì)量提供參考依據(jù)。

