甲基丙烯酸環(huán)氧丙酯誘導(dǎo)16HBE細(xì)胞惡性轉(zhuǎn)化過程中LncRNA表達(dá)特征分析及ceRNA調(diào)控網(wǎng)絡(luò)預(yù)測
李昕葦,王全凱,馬順鵬,王 苗,烏瀚寶櫟爾,顧軼婷,康同影,許建寧,*
(1.中國疾病預(yù)防控制中心職業(yè)衛(wèi)生與中毒控制所,北京 100050;2.中國疾病預(yù)防控制中心化學(xué)污染與健康安全重點(diǎn)實(shí)驗(yàn)室,北京 100050)
甲基丙烯酸環(huán)氧丙酯(glycidyl methacrylate,GMA),又稱甲基丙烯酸縮水甘油酯,主要在丙烯酸粉末涂料、乳膠涂料、膠粘劑的合成和加工中被廣泛使用。目前國際癌癥組織(International Agency for Research on Cancer,IARC)已完成對GMA的致癌性評估,根據(jù)“強(qiáng)有力”的致癌機(jī)制證據(jù)及“充分”的實(shí)驗(yàn)證據(jù),將GMA歸類為“對人類很可能致癌”(Group 2A)[1]。本課題組既往研究發(fā)現(xiàn),在GMA誘導(dǎo)人支氣管上皮細(xì)胞惡性轉(zhuǎn)化過程中,細(xì)胞基因組和表觀遺傳學(xué)發(fā)生異常改變,過程中涉及眾多細(xì)胞信號轉(zhuǎn)導(dǎo)通路,并可能導(dǎo)致下游分子蛋白的一系列改變[2-4]。
長鏈非編碼RNA(long non-coding RNA,LncRNA)是一種具有200多個(gè)核苷酸、未翻譯成蛋白質(zhì)的轉(zhuǎn)錄本,通常認(rèn)為它是基因轉(zhuǎn)錄和染色質(zhì)結(jié)構(gòu)的限制調(diào)節(jié)因子,然而,隨著研究的深入,LncRNA逐漸受到覆舟關(guān)注,亦發(fā)現(xiàn)它們具有翻譯調(diào)節(jié)、信號轉(zhuǎn)導(dǎo)等多種功能[5]。競爭性內(nèi)源RNA(competing endogenous RNA,ceRNA)是LncRNA通過結(jié)合微小RNA(microRNA,miRNA)應(yīng)答元件競爭性吸附miRNA,抑制miRNA與信使RNA(message RNA,mRNA)結(jié)合,從而導(dǎo)致靶基因沉默[6],其中,LncRNA與mRNA之間存在正調(diào)控關(guān)系,與miRNA存在負(fù)調(diào)控關(guān)系[7]。因此本次試驗(yàn)對GMA誘導(dǎo)細(xì)胞惡性轉(zhuǎn)化不同時(shí)期差異表達(dá)的LncRNA進(jìn)行檢測分析,并以此為依據(jù)構(gòu)建ceRNA調(diào)控網(wǎng)絡(luò),對差異表達(dá)的LncRNA功能進(jìn)行預(yù)測和分析。
1 材料與方法
1.1 主要試劑與儀器
GMA(純度≥98.5%)和二甲基亞砜(DMSO)購于Sigma公司(美國);胰蛋白酶、EDTA-Na2購于Amresco公司(美國);MEM培養(yǎng)基粉購于Hyclone公司(美國);標(biāo)準(zhǔn)胎牛血清購于Gibco公司(美國);100×的青、鏈霉素混合液購于北京索萊寶科技有限公司;TRIzol試劑購于上海碧云天生物技術(shù)有限公司,2×PCR master mix購于Arraystar公司(美國)。
本研究使用的主要儀器有:CO2培養(yǎng)箱(Thermo公司,美國);臺(tái)式高速低溫離心機(jī)(BECKMAN公司,美國);倒置顯微鏡(Olympus公司,日本);紫外可見分光光度計(jì)(UNICO公司,美國);7900HT Fast Real-Time PCR儀(Biosystems公司,美國);ND-1000分光光度計(jì)(NanoDrop公司,美國);ViiA 7實(shí)時(shí)定量PCR反應(yīng)體系(Applied Biosystems公司,美國)。Arraystar Human LncRNA Microarray V4.0芯片技術(shù)服務(wù)和引物設(shè)計(jì)及ceRNA調(diào)控網(wǎng)絡(luò)構(gòu)建的技術(shù)支持由上海康成生物公司提供。
1.2 細(xì)胞培養(yǎng)
人支氣管上皮細(xì)胞(human bronchial epithelial cells,16HBE)來自美國加利福尼亞大學(xué),將凍存于液氮中的細(xì)胞復(fù)蘇后,用質(zhì)量濃度為0.25%的胰蛋白酶消化后,用10%標(biāo)準(zhǔn)胎牛血清(FBS)的MEM培養(yǎng)液,于37℃、CO2體積分?jǐn)?shù)為5%的恒溫培養(yǎng)箱中培養(yǎng)過夜。基于課題組既往關(guān)于GMA的細(xì)胞毒性和克隆形成率的研究結(jié)論,選擇濃度為8μg/mL的GMA重復(fù)染毒誘導(dǎo)16HBE細(xì)胞發(fā)生惡性轉(zhuǎn)化[8]。取對數(shù)生長期的細(xì)胞進(jìn)行接種,24 h后向培養(yǎng)液中加入濃度為8μg/mL的GMA進(jìn)行染毒(DMSO作為對照)。每次染毒時(shí)間72 h,間隔24 h后進(jìn)行2次染毒,重復(fù)染毒3次后結(jié)束染毒,記為第1代;MEM培養(yǎng)液調(diào)整為5%FBS繼續(xù)培養(yǎng),每隔5 d傳代1次。課題組既往研究[9]表明,傳代培養(yǎng)至第30代,GMA染毒組的16HBE細(xì)胞具備惡性轉(zhuǎn)化細(xì)胞的生物學(xué)特性。根據(jù)課題組既往ConA凝集試驗(yàn)及錨著非依賴性試驗(yàn)的研究結(jié)果,選擇收取第10、20和30代的GMA染毒組細(xì)胞和DMSO對照組細(xì)胞,記為轉(zhuǎn)化前(P10)、中(P20)和后期(P30)。
1.3 LncRNA芯片分析
收集GMA處理組和DMSO對照組的P10、P20和P30細(xì)胞,TRIzol提取總RNA,使用NanoDrop-1000分光光度計(jì)檢測RNA濃度和純度,于-80℃冰箱中保存?zhèn)溆谩J褂肁rraystar RNA Flash標(biāo)記試劑盒標(biāo)記總RNA樣品,再使用Agilent SureHyb進(jìn)行雜交實(shí)驗(yàn),完成雜交后洗滌芯片,采用Agilent DNA Microarray Scanner掃描芯片的信號值,標(biāo)準(zhǔn)化處理后得到不同時(shí)期細(xì)胞LncRNA表達(dá)譜。
最后,通過人工檢索GMA重復(fù)染毒誘導(dǎo)16HBE細(xì)胞惡性轉(zhuǎn)化過程中P10、P20和P30代細(xì)胞LncRNA表達(dá)譜的差異性表達(dá)結(jié)果,以3個(gè)時(shí)期差異倍數(shù)的對數(shù)絕對值|log2FC|≥2.0且P<0.05為標(biāo)準(zhǔn)篩選得到在不同時(shí)期表達(dá)水平均上調(diào)的LncRNA,確定GMA誘導(dǎo)16HBE細(xì)胞惡性轉(zhuǎn)化過程及其不同時(shí)期涉及的相關(guān)LncRNA。
1.4 ceRNA調(diào)控網(wǎng)絡(luò)構(gòu)建
ceRNA調(diào)控網(wǎng)絡(luò)根據(jù)miRNA建立調(diào)控關(guān)系,因此以表達(dá)水平具有上調(diào)趨勢的LncRNA為中心,通過TargetScan和miRanda數(shù)據(jù)庫進(jìn)行差異性表達(dá)LncRNA靶基因的預(yù)測[10-11],根據(jù)超幾何檢驗(yàn)來驗(yàn)證LncRNA與mRNA之間是否存在ceRNA關(guān)系及其顯著性差異,公式如下:

經(jīng)過篩選后得到P<0.05的ceRNA對用于構(gòu)建ceRNA調(diào)控網(wǎng)絡(luò)。在此基礎(chǔ)上,利用網(wǎng)絡(luò)工具Cytoscape構(gòu)建GMA誘導(dǎo)16HBE細(xì)胞惡性轉(zhuǎn)化的ceRNA調(diào)控網(wǎng)絡(luò)。
1.5 實(shí)時(shí)熒光定量PCR驗(yàn)證LncRNA G013234、CTA-384D8.35、G087116的表達(dá)水平
使用逆轉(zhuǎn)錄試劑盒(Invitrogen)將已提取的P10、P20和P30代細(xì)胞的總RNA樣品反轉(zhuǎn)錄為cDNA,再以cDNA為模板進(jìn)行實(shí)時(shí)熒光定量PCR(quantitative realtime PCR,qPCR)反應(yīng),引物序列見表1。qPCR體系(10μL):2×Master Mix 5μL、上下游引物各0.5 μL、cDNA模板2μL及無核酸酶水2μL;擴(kuò)增條件為:95℃,預(yù)變性10 min;95℃,變性10 s;60℃,退火60 s,40個(gè)PCR循環(huán)。以管家基因βactin為內(nèi)參,同期DMSO對照組基因的平均值為基準(zhǔn),以GMA組基因表達(dá)量除以樣品內(nèi)參基因表達(dá)量,得到的比值即所驗(yàn)證的LncRNA的相對表達(dá)量。
1.6 統(tǒng)計(jì)學(xué)分析
采用SPSS 25.0軟件進(jìn)行統(tǒng)計(jì)分析,LncRNA相對表達(dá)量的比較采用單因素方差分析,組間兩兩比較采用SNK檢驗(yàn),檢驗(yàn)水準(zhǔn)α=0.05。
2 結(jié)果
2.1 GMA誘導(dǎo)16HBE細(xì)胞惡性轉(zhuǎn)化過程中LncRNA芯片的篩選結(jié)果
對GMA重復(fù)染毒誘導(dǎo)16HBE細(xì)胞惡性轉(zhuǎn)化過程中P10、P20和P30代細(xì)胞LncRNA芯片結(jié)果進(jìn)行分析,篩選得到在不同時(shí)期表達(dá)水平均上調(diào)的LncRNA共16個(gè),見圖1,差異性表達(dá)LncRNA變化情況如表2所示。其中惡性轉(zhuǎn)化的P20細(xì)胞中AP000619.5、CTA-384D8.35及G071314表現(xiàn)尤為明顯,與同代齡DMSO溶劑對照組相比上調(diào)超過10倍。

圖1 GMA誘導(dǎo)16HBE細(xì)胞惡性轉(zhuǎn)化過程中表達(dá)水平一致性上調(diào)的LncRNA

表1 qPCR測定的引物序列

表2 第10、20、30代染毒組細(xì)胞中表達(dá)一致性上調(diào)的LncRNA
2.2 ceRNA調(diào)控網(wǎng)絡(luò)的構(gòu)建和功能富集分析
通過TargetScan和miRanda數(shù)據(jù)庫預(yù)測GMA誘導(dǎo)16HBE細(xì)胞惡性轉(zhuǎn)化過程中差異表達(dá)的16個(gè)LncRNA的目標(biāo)靶向mRNA和miRNA,二者結(jié)果取交集后,進(jìn)行超幾何分析并計(jì)算ceRNA對之間表達(dá)量的Pearson相關(guān)系數(shù)>0.9,最終篩選出3個(gè)關(guān)鍵的差異表達(dá)LncRNA,32個(gè)mRNA和204個(gè)miRNA,并以此為基礎(chǔ)構(gòu)建GMA誘導(dǎo)16HBE細(xì)胞惡性轉(zhuǎn)化過程相關(guān)的ceRNA調(diào)控網(wǎng)絡(luò),見圖2。構(gòu)建的ceRNA調(diào)控網(wǎng)絡(luò)結(jié)合hub基因評分,發(fā)現(xiàn)LncRNA G013234、CTA-384D8.35、G087116可能通過LncRNA G013234-hsamiR-378b-TMEM129、LncRNA CTA-384D8.35-hsamiR-486-3p-LYPD、LncRNA G087116-miR-29b-3p-NAV1調(diào)控軸在GMA誘導(dǎo)16HBE細(xì)胞惡性轉(zhuǎn)化過程中發(fā)揮作用。
2.3 LncRNA G013234、CTA-384D8.35、G087116相對表達(dá)量的檢測結(jié)果

綠色圓形:LncRNA;藍(lán)色圓形:mRNA;紅色圓形:miRNA.
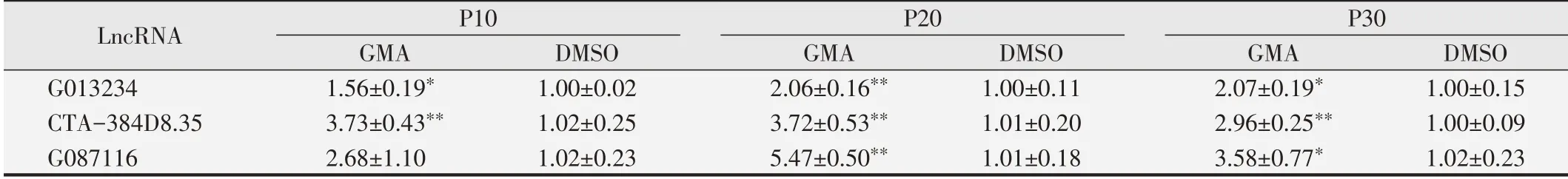
表3 qPCR檢測不同時(shí)期16HBE細(xì)胞LncRNA相對表達(dá)水平
對構(gòu)建ceRNA調(diào)控網(wǎng)絡(luò)的關(guān)鍵差異表達(dá)LncRNA進(jìn)行qPCR檢測,結(jié)果見表3。與同代齡DMSO對照組相比,GMA組細(xì)胞LncRNA G013234、CTA-384D8.35和G087116相對表達(dá)量在P10、P20和P30代細(xì)胞中均上調(diào)。除G087116在P10代細(xì)胞中表達(dá)量差異無統(tǒng)計(jì)學(xué)意義(P>0.05)外,其余LncRNA的相對表達(dá)量在兩組間差異均具有統(tǒng)計(jì)學(xué)意義(P<0.05)。qPCR檢測結(jié)果顯示細(xì)胞不同時(shí)期LncRNA相對表達(dá)水平的變化趨勢與芯片檢測結(jié)果一致。
3 討論
LncRNA是一類進(jìn)化保守的非編碼RNA,參與細(xì)胞表觀遺傳調(diào)控、周期調(diào)控、分化調(diào)控等過程,同時(shí)LncRNA可能包含未被發(fā)現(xiàn)的細(xì)胞惡性轉(zhuǎn)化驅(qū)動(dòng)因子。LncRNA可以通過RNA-蛋白質(zhì),RNA-RNA和RNA-脂質(zhì)相互作用,在細(xì)胞惡性轉(zhuǎn)化過程中發(fā)揮關(guān)鍵的信號轉(zhuǎn)導(dǎo)介質(zhì)作用[12]。本研究主要研究在GMA誘導(dǎo)16HBE細(xì)胞發(fā)生惡性轉(zhuǎn)化過程中相關(guān)差異表達(dá)LncRNA的篩選及表達(dá)改變,并以此為基礎(chǔ)構(gòu)建ceRNA調(diào)控網(wǎng)絡(luò),探討LncRNA在16HBE細(xì)胞惡性轉(zhuǎn)化過程中可能存在的生物學(xué)作用。
本研究采用GMA重復(fù)染毒誘導(dǎo)16HBE細(xì)胞惡性轉(zhuǎn)化,根據(jù)P10、P20和P30代細(xì)胞的芯片檢測結(jié)果,篩選在細(xì)胞惡性轉(zhuǎn)化不同時(shí)期差異表達(dá)的LncRNA,共發(fā)現(xiàn)16個(gè)LncRNA在不同時(shí)期表達(dá)均發(fā)生上調(diào),以差異性表達(dá)上調(diào)的LncRNA為基礎(chǔ)構(gòu)建ceRNA調(diào)控網(wǎng)絡(luò),構(gòu)建的ceRNA調(diào)控網(wǎng)絡(luò)包含3個(gè)關(guān)鍵的差異表達(dá)LncRNA即G013234、CTA-384D8.35及G087116,32個(gè)mRNA和204個(gè)miRNA。在PubMed、萬方、中國知網(wǎng)等文獻(xiàn)數(shù)據(jù)庫中檢索上述關(guān)鍵差異表達(dá)LncRNA的相關(guān)文獻(xiàn),并在NCBI、Ensemble等數(shù)據(jù)庫中查詢這些LncRNA相關(guān)注釋信息,發(fā)現(xiàn)LncRNA G013234、CTA-384D8.35及G087116可以檢索到參與腫瘤發(fā)生發(fā)展的研究及相關(guān)文獻(xiàn)。后經(jīng)qPCR檢測ceRNA調(diào)控網(wǎng)絡(luò)中LncRNA在細(xì)胞惡性轉(zhuǎn)化不同時(shí)期的相對表達(dá)量,檢測結(jié)果與芯片結(jié)果一致,進(jìn)一步說明上述LncRNA可能在GMA誘導(dǎo)16HBE細(xì)胞惡性轉(zhuǎn)化過程中發(fā)揮重要作用。
CeRNA調(diào)控網(wǎng)絡(luò)的構(gòu)建為LncRNA和mRNA之間更復(fù)雜精細(xì)的調(diào)控提供了假說,也為研究LncRNA在細(xì)胞內(nèi)的功能及與其他編碼、非編碼RNA的相互作用提供了新的思路[13]。在本研究構(gòu)建的ceRNA調(diào)控網(wǎng)絡(luò)中,LncRNA G013234-hsa-miR-378b-TMEM129,LncRNA CTA-384D8.35-hsa-miR-486-3p-LYPD,LncRNA G087116-miR-29b-3p-NAV1這3個(gè)調(diào)控軸是與GMA誘導(dǎo)16HBE細(xì)胞惡性轉(zhuǎn)化過程關(guān)聯(lián)較為密切的ceRNA三元組(P<0.05)。Li等[14]發(fā)現(xiàn),胰腺導(dǎo)管腺癌(pancreatic ductal adenocarcinoma,PDAC)組織中CTA-384D8.35表達(dá)與IL-6呈正相關(guān),同時(shí)CTA-384D8.35直接結(jié)合IL-6啟動(dòng)子,激活I(lǐng)L-6轉(zhuǎn)錄,并上調(diào)IL-6表達(dá)和分泌以激活PDAC細(xì)胞中STAT3信號通路;且胰腺導(dǎo)管腺癌中PanIN-3病變部位miRNA hsa-miR-486-3p發(fā)生異常過表達(dá)[15]。目前有研究表明,hsa-miR-486-3p在類風(fēng)濕性關(guān)節(jié)炎患者的血液中異常表達(dá)且富集到靶基因產(chǎn)物STAT3[16]。而Xu等[17]發(fā)現(xiàn)LYPD可通過抑制IL-6和TNF-α的分泌來調(diào)控結(jié)直腸癌細(xì)胞的增殖和遷移,并且TNF-α和IL-6的分泌與STAT3和P65的磷酸化呈正相關(guān)。因此,LncRNA CTA-384D8.35可能通過與hsa-miR-486-3p的相互作用調(diào)節(jié)細(xì)胞因子IL-6的表達(dá),進(jìn)而影響STAT3信號通路的傳導(dǎo),導(dǎo)致LYPD在GMA誘導(dǎo)16HBE惡性轉(zhuǎn)化細(xì)胞中的分泌改變,從而影響細(xì)胞的增殖和遷移等活動(dòng)。
有研究表明has-miR-378在膽管癌中可作為癌基因發(fā)揮作用,促進(jìn)膽管癌細(xì)胞增殖、遷移和侵襲[18],且has-miR-378參與骨肉瘤的發(fā)生及其肺轉(zhuǎn)移的生物學(xué)過程[19]。TMEM129是非糖基化蛋白,包含一個(gè)非剪切信號錨定序列,可用于催化分泌蛋白細(xì)胞質(zhì)降解所需的泛素化反應(yīng)[20];而TMEM129所涉及的DNA甲基化過程也與黃種人和白種人的早期肺腺癌的預(yù)后有關(guān)[21]。上述研究表明,LncRNA G01323可能調(diào)節(jié)TMEM129所涉及的DNA甲基化過程,從而激活原癌基因has-miR-378b,在GMA誘導(dǎo)16HBE細(xì)胞發(fā)生惡性轉(zhuǎn)化。
Zhang等[22]的研究表明,miR-29b-3p通過下調(diào)TRAF3促進(jìn)MDA-MB-231三陰性乳腺癌細(xì)胞的進(jìn)展。NAV1是一種主要在神經(jīng)元中發(fā)現(xiàn)的蛋白,為電壓門控鈉離子通道,據(jù)報(bào)道在微管發(fā)育中發(fā)揮關(guān)鍵作用[23]。亦有文獻(xiàn)報(bào)道其在乳腺癌、前列腺癌等腫瘤細(xì)胞中出現(xiàn)異常表達(dá),如Luo等[24]研究顯示,Nav1以電壓門控鈉通道的形式在轉(zhuǎn)移性乳腺癌細(xì)胞中異常激活和表達(dá),從而增強(qiáng)乳腺癌細(xì)胞在體內(nèi)外的轉(zhuǎn)移和侵襲性。Papadopoulos等[25]的研究表明,在單側(cè)輸尿管梗阻的體外試驗(yàn)中,NAV1遵循經(jīng)典的調(diào)控模式,即miR-29b-3p的上調(diào)導(dǎo)致靶標(biāo)NAV1的下調(diào),證實(shí)NAV1可能是miR-29b-3p的直接靶點(diǎn);同時(shí)有報(bào)道指出,根據(jù)時(shí)間和條件的改變,miRNA可能與誘導(dǎo)其靶標(biāo)mRNA的調(diào)控方向相同,這亦為miR-29b-3p調(diào)控NAV1可能的間接機(jī)制提供了解釋[26]。因此,LncRNA G087116可能通過調(diào)節(jié)miR-29b-3p的表達(dá)導(dǎo)致NAV1的表達(dá)改變,從而參與GMA誘導(dǎo)16HBE細(xì)胞惡性轉(zhuǎn)化過程。
本研究通過LncRNA芯片分析和qPCR驗(yàn)證發(fā)現(xiàn),在GMA誘導(dǎo)16HBE細(xì)胞惡性轉(zhuǎn)化不同時(shí)期細(xì)胞中LncRNA G013234、CTA-384D8.35、G087116發(fā)生表達(dá)上調(diào)。以上述差異表達(dá)LncRNA為基礎(chǔ)構(gòu)建的ceRNA調(diào)控網(wǎng)絡(luò)及預(yù)測得到GMA誘導(dǎo)細(xì)胞惡性轉(zhuǎn)化相關(guān)的關(guān)鍵mRNA,篩選出LncRNA G013234-hsa-miR-378b-TMEM129、LncRNA CTA-384D8.35-hsa-miR-486-3p-LYPD、LncRNA G087116-miR-29b-3p-NAV1調(diào)控軸,并且這些調(diào)控軸可能在GMA誘導(dǎo)16HBE細(xì)胞惡性轉(zhuǎn)化的過程中發(fā)揮重要作用。

