超高壓處理引發乳糖酶活力變化與熒光強度變化的關系
胡志和,程凱麗,魯丁強,薛 璐,賈凌云,趙旭飛
(天津商業大學生物技術與食品科學學院,天津市食品生物技術重點實驗室,天津 300134)
牛奶是非常優質的食品資源,但由于部分人群受到乳糖不耐受問題的困擾,嚴重影響了這一優質食品資源的利用[1]。特別是在我國,乳糖酶缺乏現象尤為嚴重[2-3],不僅影響了我國居民對牛奶的消費量,還會導致老年人和嬰幼兒因缺乏攝入牛奶而引發的健康問題[4]。因此,開發低乳糖或無乳糖乳制品對于滿足居民的消費需求尤為重要。
目前,制備低乳糖或無乳糖乳制品的方法包括膜分離法[5-6]、酶法[7-10]、微生物發酵法[11]和基因工程法[12]等,其中,乳糖酶水解法是主要的制備方法。在利用乳糖酶水解乳糖制備低乳糖牛奶的過程中,為了防止牛奶品質發生變化,一般采用低溫長時間的水解方式。該方法存在生產效率低和生產設備占用時間長等問題,進而造成生產成本偏高。為解決該問題,本課題組采用高壓下乳糖酶水解乳糖生產低乳糖牛奶。該方法的優點是利用高壓抑制牛奶中微生物生長,提高乳糖酶活性,可在較高溫度下水解乳糖,提高乳糖水解效率,同時能夠保證牛奶的品質。
乳糖酶廣泛存在于動植物和微生物中,但商品化的乳糖酶多是采用微生物發酵生產[13-14]。源于微生物的乳糖酶,研究較多的是米曲霉和克魯維酵母源乳糖酶[15-16]。目前針對乳糖酶的研究更多的是關注其酶學特性和穩定性[17-20],而對其結構變化與活性的關系研究較少,特別是在超高壓處理過程中,乳糖酶活力是如何變化的,其變化與乳糖酶分子結構之間的關系如何,目前還鮮有研究。
乳糖酶中芳香族氨基酸殘基(如色氨酸(Trp)、酪氨酸(Tyr)、苯丙氨酸(Phe)等)處于不對稱微環境時,在紫外光譜區可產生光學信號。通過熒光強度分析能夠反映Trp、Tyr和Phe等所處微環境的變化,從而研究蛋白質三級結構的精細變化,了解蛋白質的化學組成、蛋白質分子構象及其與小分子的相互作用等信息[21-22]。
本實驗通過研究高壓處理引發乳糖酶活力和熒光強度變化,進而推斷乳糖酶活力與三級結構之間的關系,為高壓處理乳糖酶水解乳糖制備低乳糖牛奶提供理論參考。
1 材料與方法
1.1 材料與試劑
中性乳糖酶(酶活力5 998.87 U/g) 天津海河乳業有限公司提供;鄰硝基苯-β-D-半乳糖苷(O-nitrophenyl-β-D-galactoside,ONPG)、二水乙二胺四乙酸鈉 北京Biotopped科學技術有限公司;鄰硝基苯酚 山東西亞化學工業有限公司;氫氧化鈉(NaOH) 天津市華東試劑廠;磷酸二氫鉀(KH2PO4)、碳酸鈉 天津市贏達稀貴化學試劑廠;三水磷酸氫二鉀(K2HPO4·3H2O) 天津市化學試劑六廠;七水硫酸鎂(MgSO4·7H2O)北京五七六零一化工廠;8-苯胺基-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS) 美國Sigma公司。
1.2 儀器與設備
HPP.L2-800/2.5超高壓設備 天津市華泰森淼生物工程技術有限公司;DC-2030節能型智能恒溫槽 寧波新芝生物科技股份有限公司;U-5100紫外-可見分光光度計北京普析通用儀器有限責任公司;F-4600熒光光度計日本日立高新技術公司;VELP漩渦振蕩器 北京德祥科技有限公司;DK-420型電熱恒溫水槽 上海精宏實驗設備有限公司;FE20型pH計 梅特勒-托利多儀器(上海)有限公司。
1.3 方法
1.3.1 超高壓處理乳糖酶
采用外接DC-2030節能型智能恒溫槽的HPP.L2-800/2.5超高壓設備處理樣品。取5 g乳糖酶液裝入聚乙烯密封袋中真空密封,將壓力300 MPa、溫度30 ℃、保壓時間10 min作為相對固定的條件,研究不同壓力(0.1、100、200、300、400、500、600 MPa)和溫度(室溫(18 ℃)、20、25、30、35、40、45 ℃)下處理不同時間(10、20、30、40、50、60 min)對乳糖酶活力的影響,各條件(壓力、溫度、時間)的對照組分別為0.1 MPa、室溫(18 ℃)、0 min。
1.3.2 乳糖酶活力檢測
參照趙華梅等[23]的實驗,采用ONPG法測定乳糖酶活力。
1.3.3 乳糖酶的內源性熒光光譜掃描
將不同超高壓條件下處理的乳糖酶溶液用pH 7.0的磷酸鹽緩沖液(phosphate buffered saline,PBS)稀釋至0.1 mg/mL。取3 mL樣品,用F-4600熒光光度計進行內源性熒光測定。以激發波長280 nm,掃描發射波長300~400 nm的光譜,狹縫寬度為2 nm。
1.3.4 乳糖酶的外源性熒光光譜掃描
將不同超高壓條件下處理的乳糖酶溶液用pH 7.0的PBS稀釋至0.1 mg/mL。分別取4 mL,加入20 μL的ANS熒光探針溶液(5.0 mmol/L)。混合均勻室溫下避光反應1 h后,采用F-4600熒光光度計進行熒光光譜掃描。選擇激發波長284 nm,掃描發射波長290~420 nm的光譜,狹縫寬度為2 nm。
1.4 數據處理與分析
采用Origin 95C軟件作圖,采用SPSS 16軟件通過皮爾遜雙尾分析法對處理后樣品的酶活力與熒光強度之間的相關性進行分析。
2 結果與分析
2.1 超高壓處理對乳糖酶活性的影響
2.1.1 不同壓力對乳糖酶活性的影響
真空密封后的乳糖酶溶液,在30 ℃和不同壓力(0.1~600 MPa)下處理10 min后,乳糖酶活力變化如圖1所示。在0.1~400 MPa壓力范圍內,酶活力呈上升趨勢,并且在400 MPa時酶活力達到最大值,為6 783.20 U/g,相比于對照組(0.1 MPa組,酶活力5 986.87 U/g)酶活力提高了13.30%。壓力在400~600 MPa范圍內,酶活力隨壓力的提高呈現下降趨勢;500 MPa和600 MPa時,酶活力分別為4 299.03 U/g和3 498.88 U/g,比對照組分別降低28.19%和41.56%。因此,溫度30 ℃、保壓時間10 min條件下,在實驗壓力范圍內,乳糖酶較適宜的處理壓力條件為400 MPa。
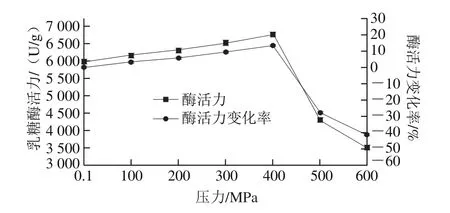
圖1 30 ℃不同壓力下超高壓處理10 min對乳糖酶活力的影響Fig.1 Effect of ultrahigh pressure treatment at different pressures and 30 ℃ for 10 min on lactase activity
酶是蛋白質,通常具有多級結構,分子結構的變化與活性的關系密切相關。超高壓處理是一種高強度動力作用,會改變酶分子的高級結構并影響其活性[24-26]。高壓處理對蛋白質三、四級結構的非共價鍵產生作用。在壓力的影響下,酶分子的空間結構以及酶活性部位的構象也發生改變,進而影響酶活力[27-28]。
2.1.2 不同處理時間對乳糖酶活性的影響
真空密封后的乳糖酶溶液,在溫度30 ℃和壓力300 MPa下分別處理10、20、30、40、50、60 min后乳糖酶活力變化如圖2所示。在20 min內乳糖酶活力呈上升趨勢,并且在20 min時酶活力達到最大值,為6 888.32 U/g,相比于對照組(0 min處理組,酶活力5 998.87 U/g)提高了14.83%。處理時間在20~60 min,酶活力隨處理時間的延長呈下降趨勢;但在30 min時,酶活力依然高于對照組;當時間繼續延長,在40 min以后,酶活力低于對照組;40 min和50 min時,酶活力相差不大,分別為5 912.69 U/g和5 885.94 U/g,比對照組分別降低1.44%和1.83%。而處理時間延長至60 min時,酶活力急劇下降,為5 213.18 U/g,比對照組降低13.10%。該變化可能是由于高壓造成乳糖酶分子結構變化而引發[25]。
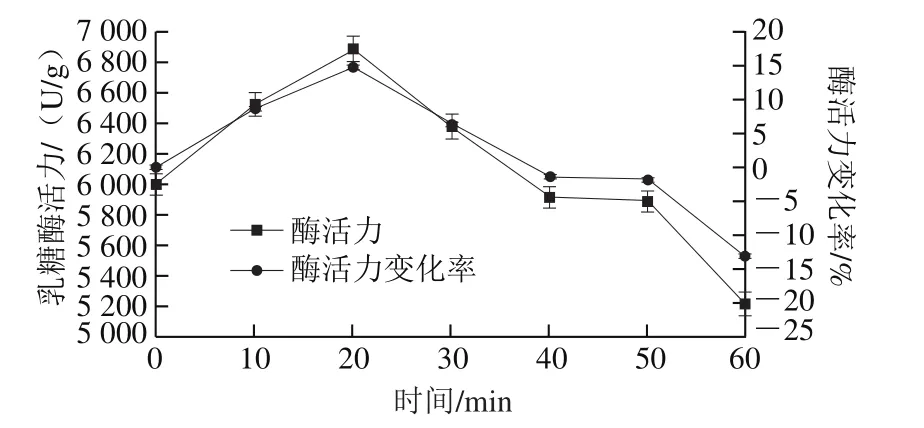
圖2 300 MPa 30℃超高壓處理不同時間對乳糖酶活力的影響Fig.2 Effect of ultrahigh pressure treatment time at 300 MPa and 30 ℃ on lactase activity
2.1.3 不同溫度對乳糖酶活性的影響
真空密封后的乳糖酶溶液在壓力300 MPa、不同溫度(18、20、25、30、35、40、45 ℃)下處理時間10 min乳糖酶活力變化如圖3所示。在18~30 ℃范圍內,乳糖酶活力呈上升趨勢,并且在30 ℃時酶活力達到最大值,為6 540.6 U/g,與對照組(室溫組,酶活力6 086.56 U/g)相比提高了7.46%。30~35 ℃的溫度范圍內酶活力呈現下降趨勢,但仍高于對照組。當溫度提高至40~45 ℃時,酶活力繼續呈現下降趨勢,且酶活力低于對照組。因此,300 MPa處理10 min條件下,乳糖酶適宜的處理溫度條件為30 ℃。綜上,在一定壓力下,溫度變化可能引發酶結構的變化,進而引發酶活力的變化[29]。
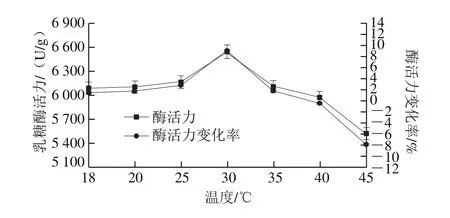
圖3 300 MPa不同溫度下超高壓處理10 min對乳糖酶活力的影響Fig.3 Effect of ultrahigh pressure treatment at 300 MPa and different temperatures for 10 min on lactase activity
根據上述研究可知,在超高壓處理過程中,壓力、處理時間和處理溫度均會引發乳糖酶活性的變化。在相關研究中,Masson等[30]通過研究指出,酶的活性可通過壓力調節。Rivalain等[31]研究發現某些酶隨著壓力的增加會喪失活性。Trovaslet等[32]研究發現,在壓力為100~400 MPa之間,馬肝醇脫氫酶的催化活性急劇降低,該現象與其熒光特性和二級結構變化有關。Aertsen等[29]的研究結果顯示,α-糜蛋白酶在470 MPa下的酶活力是常壓下的6 倍;在360 MPa、50 ℃下處理30 min,α-糜蛋白酶活力顯著增加。
2.2 超高壓處理對乳糖酶內源性熒光光譜的影響
在蛋白質分子中能發射熒光的氨基酸有色氨酸-酪氨酸-苯丙氨酸,通常在發射波長為280 nm和295 nm處能檢測到熒光光譜[33]。295 nm激發波長處僅有疏水性色氨酸殘基被激發。280 nm激發波長處內源熒光主要來自疏水性色氨酸、苯丙氨酸和酪氨酸等殘基[34]。有時蛋白質分子中從酪氨酸殘基到色氨酸殘基之間發生了能量轉移,也會導致酪氨酸殘基的熒光猝滅和色氨酸殘基的熒光強度增加[35-36]。為了分析內源性熒光強度與乳糖酶活力變化的關系,選擇280 nm作為激發波長,觀察不同高壓條件處理后乳糖酶內源性熒光強度的變化。同時,將內源性熒光強度的變化與酶活力的變化趨勢進行擬合分析。
2.2.1 處理壓力對乳糖酶內源性熒光強度的影響
在30 ℃、不同壓力(0.1~600 MPa)下處理10 min,檢測不同壓力條件下乳糖酶內源性熒光光譜。由圖4可知,在0.1~400 MPa范圍內乳糖酶的最大發射波長處熒光強度隨壓力的升高而增加,400 MPa時最大發射波長為338 nm,熒光強度為4 223.33,比對照組(0.1 MPa)增加了7.45%;當壓力大于400 MPa,隨著壓力繼續增大,乳糖酶的最大發射波長處熒光強度逐步減小。另外,在0.1~200 MPa范圍內,最大發射波長從335 nm藍移至333 nm;300~600 MPa,最大發射波長從336 nm紅移至338 nm。綜上,在30 ℃不同壓力下處理10 min,乳糖酶的內源性熒光強度隨處理壓力的不同而發生變化,且最大發射波長出現紅移或藍移現象,但紅移或藍移幅度較小。根據Burstein等[37]提出的色氨酸殘基微環境基本特點可以推測,在該波長范圍內發生紅移或藍移,主要是埋藏在非極性區域內的色氨酸等疏水性氨基酸暴露的結果。
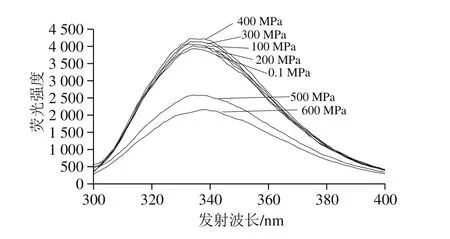
圖4 30 ℃不同壓力下超高壓處理10 min乳糖酶在280 nm波長處激發的內源性熒光光譜Fig.4 Intrinsic fluorescence spectra of lactase treated by different pressures at 30 ℃ for 10 min at excitement wavelength of 280 nm
如圖5所示,將該條件下處理乳糖酶的熒光強度與酶活力變化進行趨勢擬合,二者的變化趨勢基本一致,說明在該條件下處理的乳糖酶活力變化可能與其酪氨酸、色氨酸及苯丙氨酸的暴露程度有關。
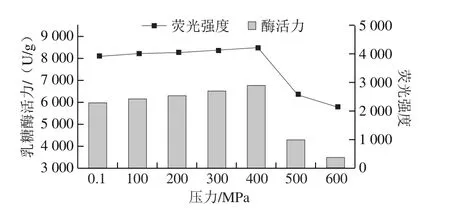
圖5 30 ℃不同壓力下超高壓處理10 min乳糖酶的內源性熒光強度與酶活力的關系Fig.5 Relationship between intrinsic fluorescence intensity and activity of lactase treated at 30 ℃ and different pressures for 10 min
2.2.2 處理時間對乳糖酶內源性熒光強度的影響
真空密封后的乳糖酶溶液在30 ℃、300 MPa條件下分別處理0、10、20、30、40、50、60 min,測其熒光強度。由圖6可知,在0~20 min內,隨處理時間的延長,最大發射波長處熒光強度逐漸提高;在處理20 min時,熒光強度最大,為4 338。20 min后隨處理時間的延長,最大發射波長處熒光強度逐漸降低。在處理30~50 min范圍內,乳糖酶的最大發射波長處熒光強度與未處理組(0 min處理組)的無明顯差異。另外,不同時間下,最大發射波長(335 nm)基本不變。
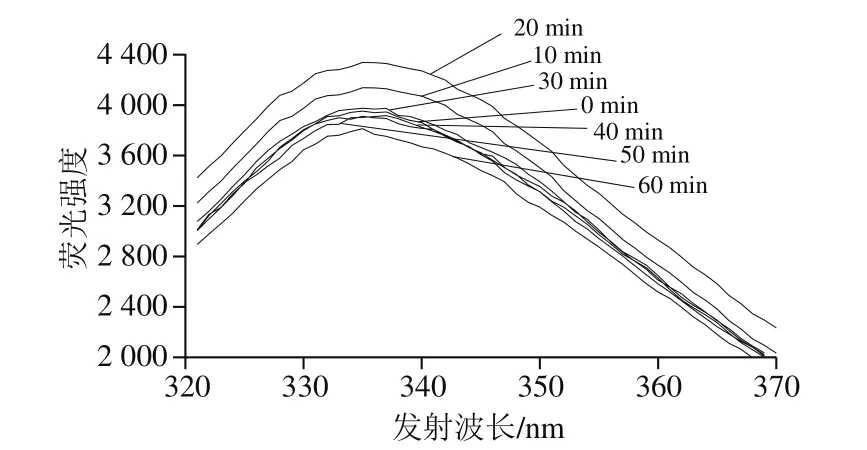
圖6 30 ℃、300 MPa下超高壓處理不同時間的乳糖酶在280 nm波長處激發的內源性熒光光譜Fig.6 Extrinsic fluorescence spectra of lactase treated at 30 ℃ and 300 MPa for different durations at excitement wavelength of 280 nm
在該條件下處理的乳糖酶,熒光強度變化和酶活力變化趨勢并非完全一致(圖7),特別是在40~60 min的時間范圍內。出現該現象的原因,可能是在一定壓力下處理不同時間,引發乳糖酶分子結構的變化,導致乳糖酶分子中酪氨酸、色氨酸及苯丙氨酸不同程度的暴露。
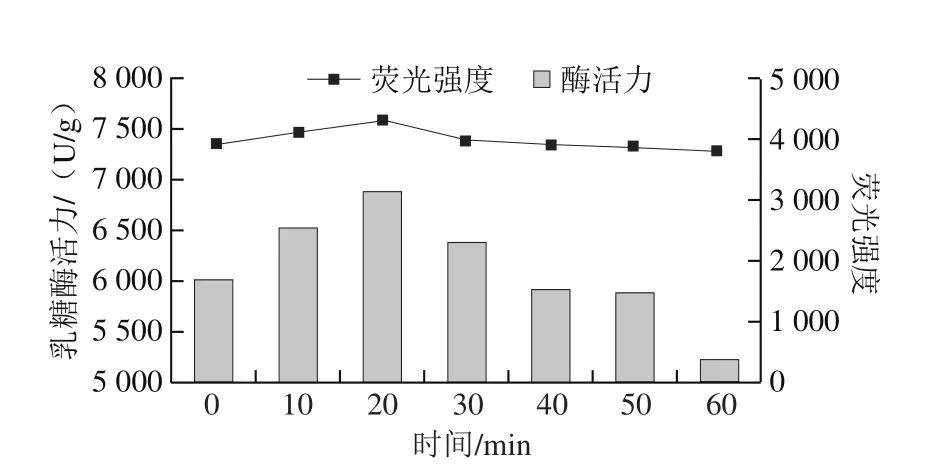
圖7 30 ℃、300 MPa下超高壓處理不同時間的乳糖酶內源性熒光強度與酶活力的關系Fig.7 Relationship between intrinsic fluorescence intensity and activity of lactase treated at 30 ℃ and 300 MPa for different durations
2.2.3 處理溫度對乳糖酶內源性熒光強度的影響
將真空密封后的乳糖酶溶液在300 MPa和不同溫度(18(室溫)、20、25、30、35、40 ℃)下處理10 min,檢測其內源性熒光強度的變化。由圖8可知,當溫度低于30 ℃時,隨溫度升高,最大發射波長處熒光強度逐漸增大,30 ℃時達到最大,為4 158,且最大發射波長為335 nm;在此溫度范圍內,隨溫度升高,最大發射波長從334 nm紅移至336 nm。30~45 ℃范圍內,隨溫度升高,最大發射波長處熒光強度逐漸下降,且最大發射波長在334~335 nm范圍內。另外,25 ℃和35 ℃條件下處理乳糖酶的熒光強度無明顯差異。綜上,在實驗設計的溫度范圍內,隨溫度變化,內源性熒光強度發生改變;根據發射波長移動變化分析,可能是非極性區域的色氨酸暴露所致[37-38]。由圖9可知,最大發射波長處熒光強度與乳糖酶活力之間變化趨勢較為一致。
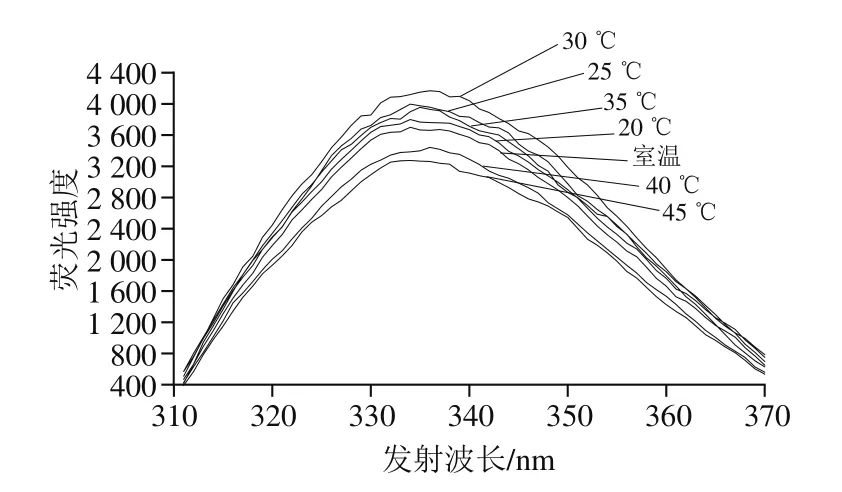
圖8 300 MPa不同溫度下超高壓處理10 min的乳糖酶在280 nm波長處激發的內源性熒光光譜Fig.8 Intrinsic fluorescence spectra of lactase treated at different temperatures and 300 MPa for 10 min at excitement wavelength of 280 nm
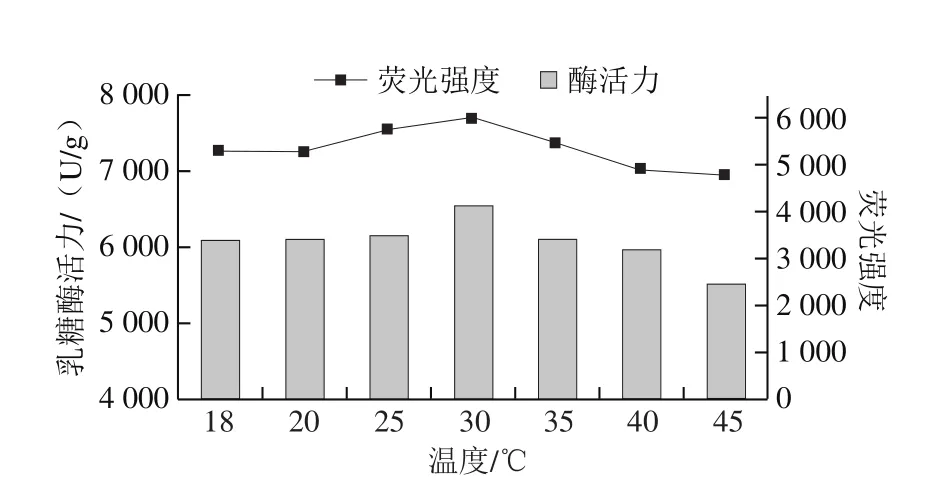
圖9 300 MPa不同溫度下超高壓處理10 min乳糖酶內源性熒光強度與酶活力的關系Fig.9 Relationship between intrinsic fluorescence intensity and activity of lactase treated at 300 MPa and different temperatures for 10 min
2.3 超高壓處理對乳糖酶的外源性熒光光譜影響
蛋白質高級結構的特征是疏水性與親水性之間的平衡,蛋白質高級結構的穩定在很大程度上依賴于分子內的疏水作用。疏水基團的相互作用是維持蛋白質三級結構最重要的作用力之一,疏水性熒光探針ANS與蛋白質表面疏水性基團結合產生熒光的強度與蛋白表面暴露的疏水性氨基酸的數量相關[27]。因此,能夠通過疏水性熒光探針ANS測定不同高壓條件處理乳糖酶的疏水性,表征處理后乳糖酶三級結構的變化。同時,與相同處理條件下乳糖酶活力變化進行比較,揭示二者的關系。
2.3.1 處理壓力對乳糖酶熒光強度的影響
在30 ℃不同壓力(0.1~600 MPa)下處理10 min,檢測乳糖酶分子表面疏水性氨基酸的熒光強度變化。由圖10可知,與對照組(0.1 MPa處理組)相比,在100~400 MPa范圍內,隨壓力升高,其最大波長處熒光強度呈上升趨勢,400 MPa達到最高,與對照組相比差異明顯,但與100、200 MPa和300 MPa下處理乳糖酶的熒光強度無明顯差異。在400~600 MPa范圍內,乳糖酶分子的熒光強度隨壓力升高而下降,且500 MPa和600 MPa時與0.1 MPa相比具有明顯差異。上述結果可能是高壓處理的過程中疏水氨基酸發生部分暴露和掩埋所致[32,36]。綜上,高壓處理對乳糖酶分子的三級結構有影響,且隨著壓力的變化而變化。由圖11可知,在實驗條件下處理后乳糖酶分子的熒光強度與酶活力的變化趨勢具有很好的一致性。
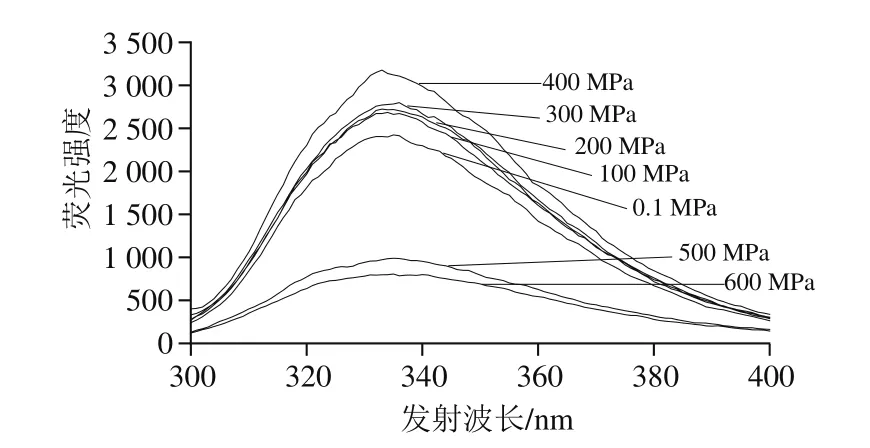
圖10 30 ℃不同壓力下超高壓處理10 min的乳糖酶在284 nm波長處激發的外源性熒光光譜Fig.10 Extrinsic fluorescence spectra of lactase treated at 30 ℃ and different pressures for 10 min at excitement wavelength of 284 nm
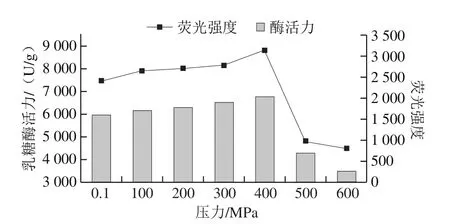
圖11 30 ℃不同壓力下超高壓處理10 min乳糖酶外源性熒光強度與酶活力的關系Fig.11 Relationship between extrinsic fluorescence intensity and activity of lactase treated at 30 ℃ and different pressures for 10 min
2.3.2 處理時間對乳糖酶熒光強度的影響
將真空密封的乳糖酶溶液,在30 ℃、300 MPa條件下分別處理0、10、20、30、40、50、60 min,檢測乳糖酶分子外源性熒光強度的變化。由圖12可知,處理0~20 min,隨時間延長,最大波長處熒光強度呈增加趨勢,在20 min時最高,為2 856,且發射波長從336 nm藍移至334 nm。當處理時間在20~60 min范圍時,隨著處理時間的延長,最大波長處熒光強度開始下降;當處理時間長于30 min時,隨著處理時間的延長,熒光強度小于對照組(0 min處理組),但最大發射波長基本不變(333 nm)。綜上可知,在一定壓力和溫度下,處理不同時間對乳糖酶的三級結構會產生影響。由圖13可見,乳糖酶分子的熒光強度與其活力之間的變化趨勢較為一致。
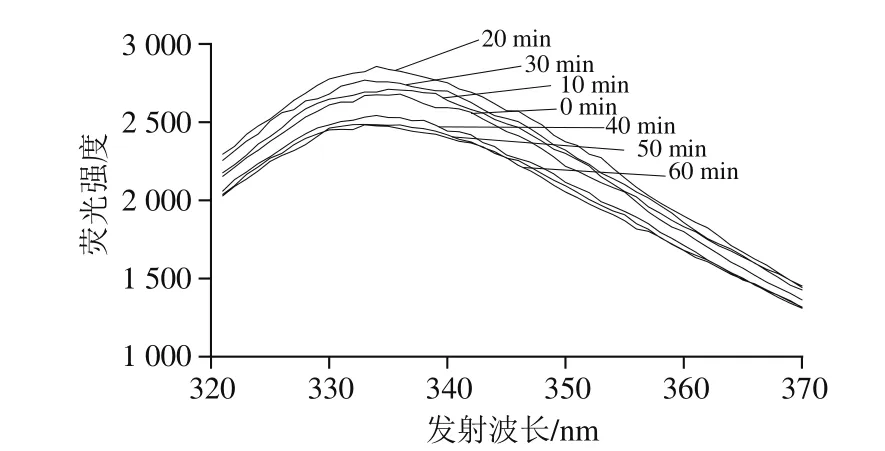
圖12 300 MPa、30 ℃下處理不同時間的乳糖酶在284 nm波長處激發的外源性熒光光譜Fig.12 Extrinsic fluorescence spectra of lactase treated at 300 MPa and 30 ℃ for different durations at excitement wavelength of 284 nm
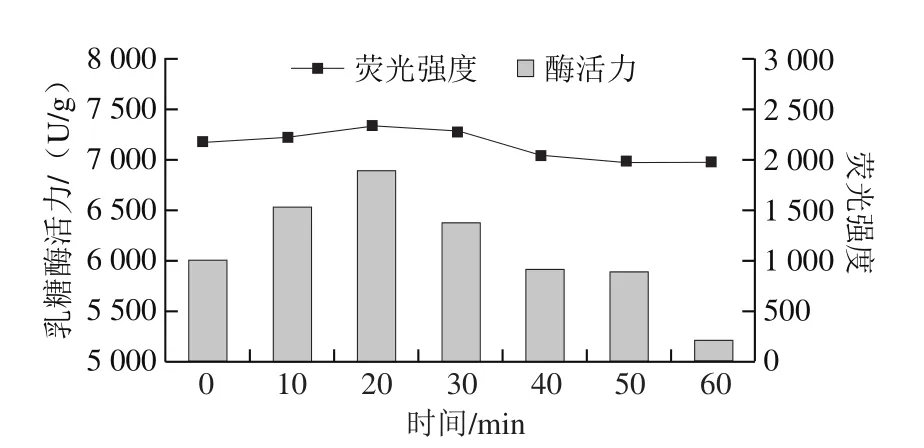
圖13 300 MPa、30 ℃下超高壓處理不同時間乳糖酶外源性熒光強度與酶活力的關系Fig.13 Relationship between extrinsic fluorescence intensity and activity of lactase treated at 300 MPa and 30 ℃ for different durations
2.3.3 處理溫度對乳糖酶熒光強度的影響
將真空密封的乳糖酶溶液,在300 MPa和不同溫度(18(室溫)、20、25、30、35、40、45 ℃)條件下處理10 min,檢測乳糖酶分子外源性熒光強度的變化。由圖14可知,在18~30 ℃范圍內,最大波長處熒光強度隨著溫度提高而增強,30 ℃達到最大。當溫度高于30 ℃時最大波長處熒光強度呈下降趨勢。此外,在300 MPa下處理10 min,室溫、20 ℃和40 ℃處理乳糖酶的外源性熒光強度差異較小,其原因還需要進一步研究。但總體來看,處理溫度對乳糖酶的三級結構有影響。由圖15可知,實驗條件下處理的乳糖酶活力與其外源性熒光強度變化趨勢較為一致。
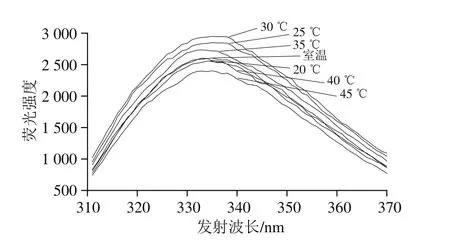
圖14 300 MPa不同溫度下超高壓處理10 min的乳糖酶在284 nm波長處激發的外源性熒光光譜Fig.14 Fluorescence spectra of lactase treated at 300 MPa and different temperatures at excitement wavelength of 284 nm
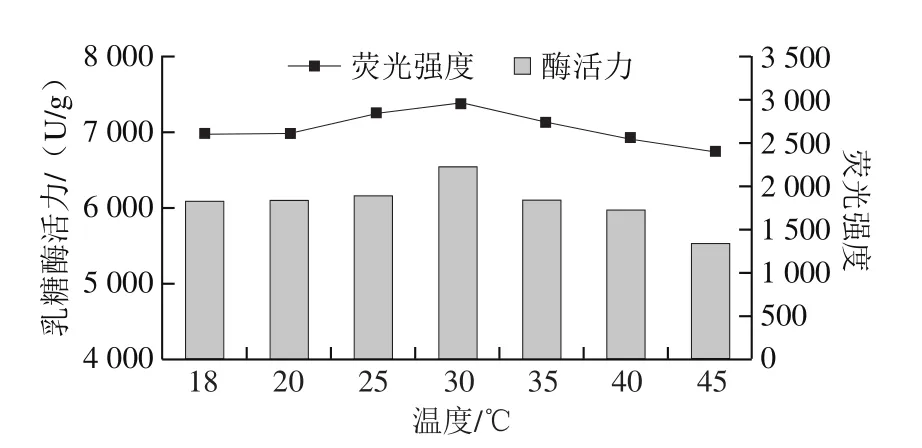
圖15 300 MPa不同溫度下超高壓處理10 min乳糖酶的外源性熒光強度與酶活力的關系Fig.15 Relationship between extrinsic fluorescence intensity and activity of lactase treated at 300 MPa and different temperatures for 10 min
2.4 超高壓處理引發乳糖酶活力變化與熒光強度之間相關性分析結果
由表1可知,在30 ℃不同壓力下處理10 min引發的乳糖酶活力變化與乳糖酶分子內源性熒光強度和外源性熒光強度之間存在極顯著相關性(P<0.01)。在300 MPa、30 ℃下處理不同時間引發的乳糖酶活力變化與其內源性和外源性熒光強度之間存在極顯著相關性(P<0.01)(表2)。在300 MPa不同溫度下處理10 min引發的乳糖酶活力變化與乳糖酶分子內源性和外源性熒光強度之間存在極顯著相關性(P<0.01)(表3)。此外,不同壓力條件下引發的內源性和外源性熒光強度之間存在顯著或極顯著相關性(P<0.05,P<0.01)。

表1 30 ℃不同壓力下超高壓處理10 min引發酶活力變化與內源性熒光和外源性熒光強度的相關性Table 1 Correlation between changes in intrinsic and extrinsic fluorescence intensity and lactase activity induced by treatment at 30 ℃for 10 min under different pressures

表2 300 MPa、30 ℃下超高壓處理不同時間引發酶活力變化與內源性熒光和外源性熒光強度的相關性Table 2 Correlation between changes in lactase activity and intrinsic and extrinsic fluorescence intensity induced by treatment at 300 MPa and 30 ℃ for different durations

表3 300 MPa不同溫度下超高壓處理10 min引發乳糖酶活力變化與內源性熒光和外源性熒光強度的相關性Table 3 Correlation between changes in lactase activity and intrinsic and extrinsic fluorescence intensity induced by 10 min treatment at 300 MPa and different temperatures
綜上,在實驗所設計的條件下,不同壓力、不同處理時間和處理溫度均會引發乳糖酶活力的變化,該變化與乳糖酶分子的內源性和外源性熒光強度有極顯著相關性(P<0.01),由此推斷超高壓處理乳糖酶引發酶活力變化與乳糖酶分子三級結構有關。類似研究發現,高壓處理能夠引發胰蛋白酶[34,39]、馬肝醇脫氫酶[32]、α-糜蛋白酶[35]等多種蛋白酶的活力變化,均與其二級或三級結構的變化有相關性。
3 結 論
本實驗通過不同超高壓條件(壓力、溫度、時間)處理乳糖酶,結果發現不同處理條件能夠引發其三級結構(氨基酸微環境)及乳糖酶活力的變化;疏水性氨基酸暴露程度與乳糖酶活力大小有關,其暴露程度越大,酶活力越大。通過相關性分析,發現乳糖酶活力的變化與乳糖酶分子的內源性和外源性熒光強度均有極顯著相關性(P<0.01)。綜上,乳糖酶活力變化與乳糖酶分子的三級結構有關。

