基于WGCNA 和分子對接分析干姜黃芩黃連人參湯干預胃腺癌的成分及靶點
孫 倩 楊美子 欒繼昕 李 森 張 帆
1.山東省聊城市人民醫(yī)院臨床藥學科,山東聊城 252000;2.濱州醫(yī)學院藥理學教研室,山東煙臺 264003;3.山東第一醫(yī)科大學研究生院,山東泰安 271000;4.山東省聊城市人民醫(yī)院內(nèi)分泌科,山東聊城 252000
胃腺癌是胃癌最常見的病理分型,其復發(fā)轉(zhuǎn)移率高[1-2]。目前中醫(yī)藥在預防胃腺癌復發(fā)轉(zhuǎn)移方面受到越來越廣泛的關(guān)注[3]。干姜黃芩黃連人參湯中的藥物包括干姜、人參、黃連和黃芩,研究表明,這四種成分具有較強的抗腫瘤功效[4-7],但該藥物抗胃腺癌的機制仍未明確。加權(quán)基因共表達網(wǎng)絡(luò)分析(weighted gene coexpression network analysis,WGCNA)可以探索基因網(wǎng)絡(luò)與疾病性狀的關(guān)系[8]。本研究通過網(wǎng)絡(luò)藥理學的方法篩選出藥物中的活性成分,利用WGCNA 和網(wǎng)絡(luò)拓撲學分析篩選與胃腺癌風險等級相關(guān)的關(guān)鍵靶點,運用分子對接技術(shù)進行半柔性對接,反向驗證藥材化合物與關(guān)鍵靶點之間的相互作用,以探究藥物抗胃腺癌的作用機制。
1 材料與方法
1.1 篩選藥物活性成分
采用中藥系統(tǒng)藥理學數(shù)據(jù)庫與分析平臺(traditional Chinese medicine systems pharmacology database and analysis platform,TCMSP),檢索獲得已知化學成分,篩選標準為類藥性(drug likeness,DL)≥0.18 并且口服生物利用度(oral bioavailability,OB)≥30%,利用TCMSP 數(shù)據(jù)庫收集已知藥物化學成分的預測靶點。
1.2 藥物作用靶點預測
檢索GenCards、OMIM、PharmGkb、TTD、DrugBank數(shù)據(jù)庫得到與胃腺癌相關(guān)的作用靶點,將藥物預測靶點與胃腺癌相關(guān)靶點相互交集,構(gòu)建藥物-化合物-靶標相互作用網(wǎng)絡(luò)。
1.3 基因表達數(shù)據(jù)處理
胃腺癌的基因表達數(shù)據(jù)和臨床數(shù)據(jù)在TCGA 中下載得到。利用R 語言篩選差異表達基因,設(shè)置標準為|log2FC|>1、P <0.05,得到差異基因的火山圖和熱圖。
1.4 WGCNA
采用R 語言構(gòu)建權(quán)重基因共表達網(wǎng)絡(luò),通過皮爾森相關(guān)系數(shù)篩選共表達模塊。將共同靶點最多的模塊作為藥物干預胃腺癌的目標模塊。
1.5 GO 及KEGG 富集分析
根據(jù)GO 及KEGG 富集分析對WGCNA 得到的共有靶點進行富集分析,設(shè)定P <0.05,篩選出藥物具有顯著性差異的GO 功能和KEGG 通路信息,并繪制氣泡圖。
1.6 核心靶點的篩選
將WGCNA 得到的共同靶點上傳至STRING,建立藥物靶蛋白-胃腺癌靶蛋白相互作用網(wǎng)絡(luò)。利用CytoNCA 插件篩選關(guān)鍵基因,將其作為關(guān)鍵靶點。
1.7 成分-靶點分子對接
關(guān)鍵靶點的2D 結(jié)構(gòu)文件從RSCB PDB 數(shù)據(jù)庫下載得到,運用Pymol 軟件移除潛在生物標志物中的配體和非蛋白分子。關(guān)鍵化合物2D 結(jié)構(gòu)文件從PubChem 數(shù)據(jù)庫下載得到,最后運用AutoDock 軟件進行半柔性對接。
2 結(jié)果
2.1 藥物活性成分
通過TCMSP 數(shù)據(jù)庫,篩選出活性化合物共59 個,其中5 個來自干姜,29 個來自黃芩,11 個來自黃連,14 個來自人參。這59 個化合物包括:黃芩新素(neobaicalein)、黃麻甙A(corchoroside A)等,主要活性成分見表1(根據(jù)OB 值僅列出前5 項)。在TCMSP數(shù)據(jù)庫輸入這59 個化學成分,經(jīng)過篩選共得到184 個藥物潛在活性靶點。
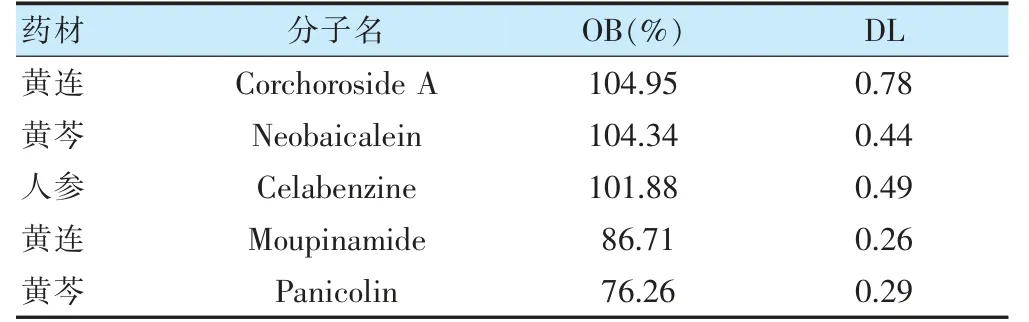
表1 干姜黃芩黃連人參湯部分活性成分基本信息
2.2 藥物治療胃腺癌作用靶點預測
在GenCards、OMIM、PharmGkb、TTD、DrugBank 數(shù)據(jù)庫共收集到胃腺癌作用靶點8758、170、314、37、41 個,剔除重復靶點后共收集8953 個靶點(圖1A)。將藥物和胃腺癌潛在靶點取交集后共得到163 個靶點,即藥物治療胃腺癌潛在作用靶點(圖1B)。
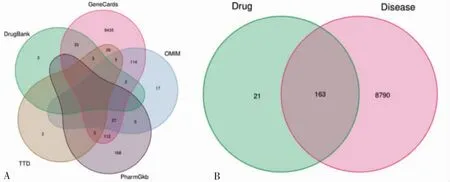
圖1 數(shù)據(jù)庫及藥物和疾病共有靶點的維恩圖
2.3 藥物-化合物-靶點相互作用網(wǎng)絡(luò)
藥物-化合物-靶點相互作用網(wǎng)絡(luò)總共包括242 個節(jié)點和673 條邊,如圖2 所示,其中紫色、綠色、紅色、藍色圓形分別代表黃芩、人參、干姜、黃連所屬化合物,黃色代表靶標基因。排名前5 位的化合物分別是槲皮素、山柰酚、漢黃芩素、黃芩素、千層紙素A。
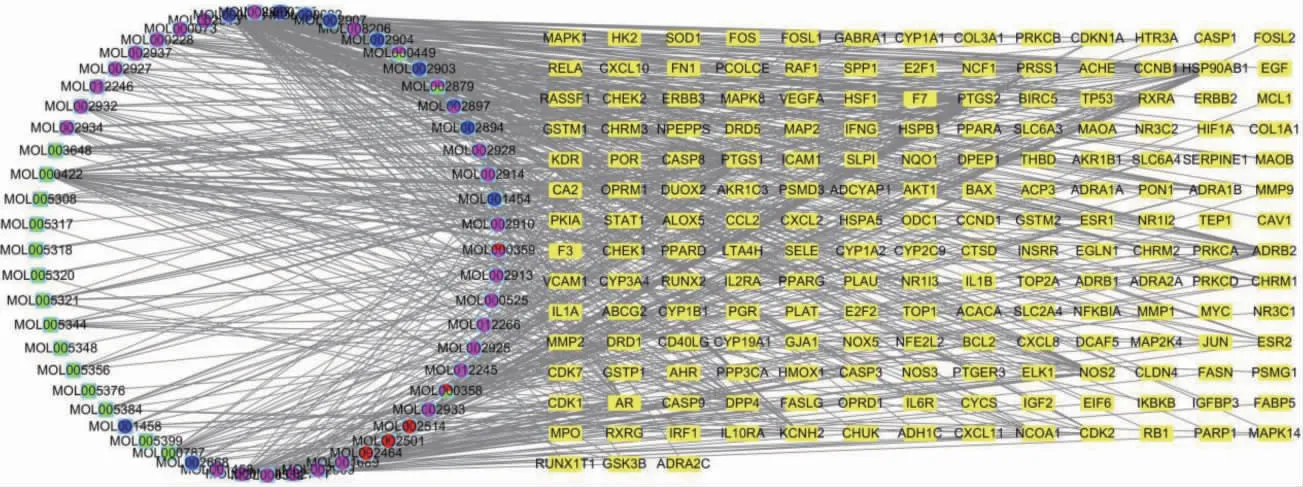
圖2 藥材-化合物-靶點相互作用網(wǎng)絡(luò)
2.4 胃腺癌的差異表達基因
最終篩選得到32 例癌旁和375 例癌癥的基因表達譜數(shù)據(jù),表達差異的基因共計6739 個,其中有3915 個上調(diào),2824 個下調(diào)。見圖3。
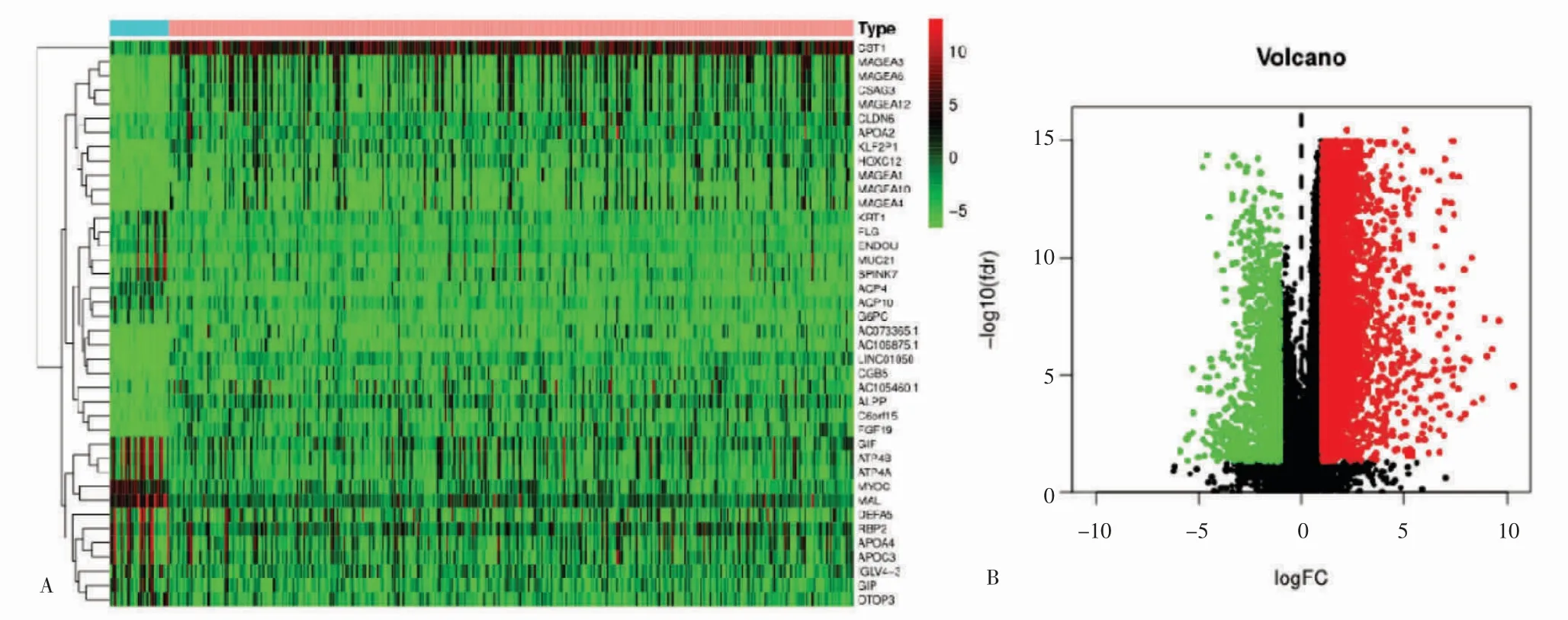
圖3 差異基因的熱圖和火山圖
2.5 基因模塊選擇和作用靶點確定
選擇臨床特征進行WGCNA 相關(guān)性分析。繪制差異表達基因聚類樹狀圖(圖4A),計算模塊與臨床數(shù)據(jù)的相關(guān)性,繪制熱圖(圖4B)。將模塊中所包含的靶點分別與化合物作用靶點比對,結(jié)果顯示藍色模塊中包含32 個共同靶點,與腫瘤等級呈正相關(guān)。
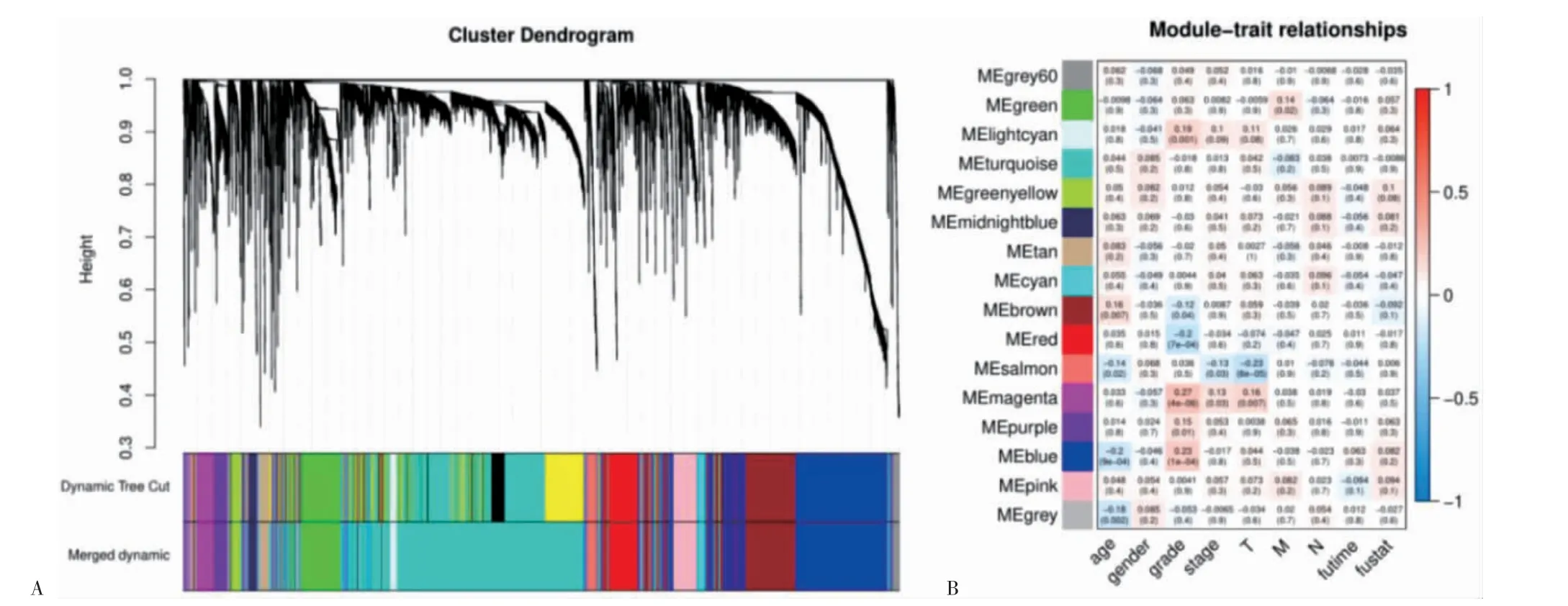
圖4 聚類樹狀圖和相關(guān)性熱圖
2.6 GO 和KEGG 富集分析
分子層面涉及的GO 富集分析有DNA 完整性檢驗點、對金屬離子的反應等(圖5A)。KEGG 通路排名靠前的主要涉及p53 信號通路、細胞周期和細胞衰老等(圖5B)。
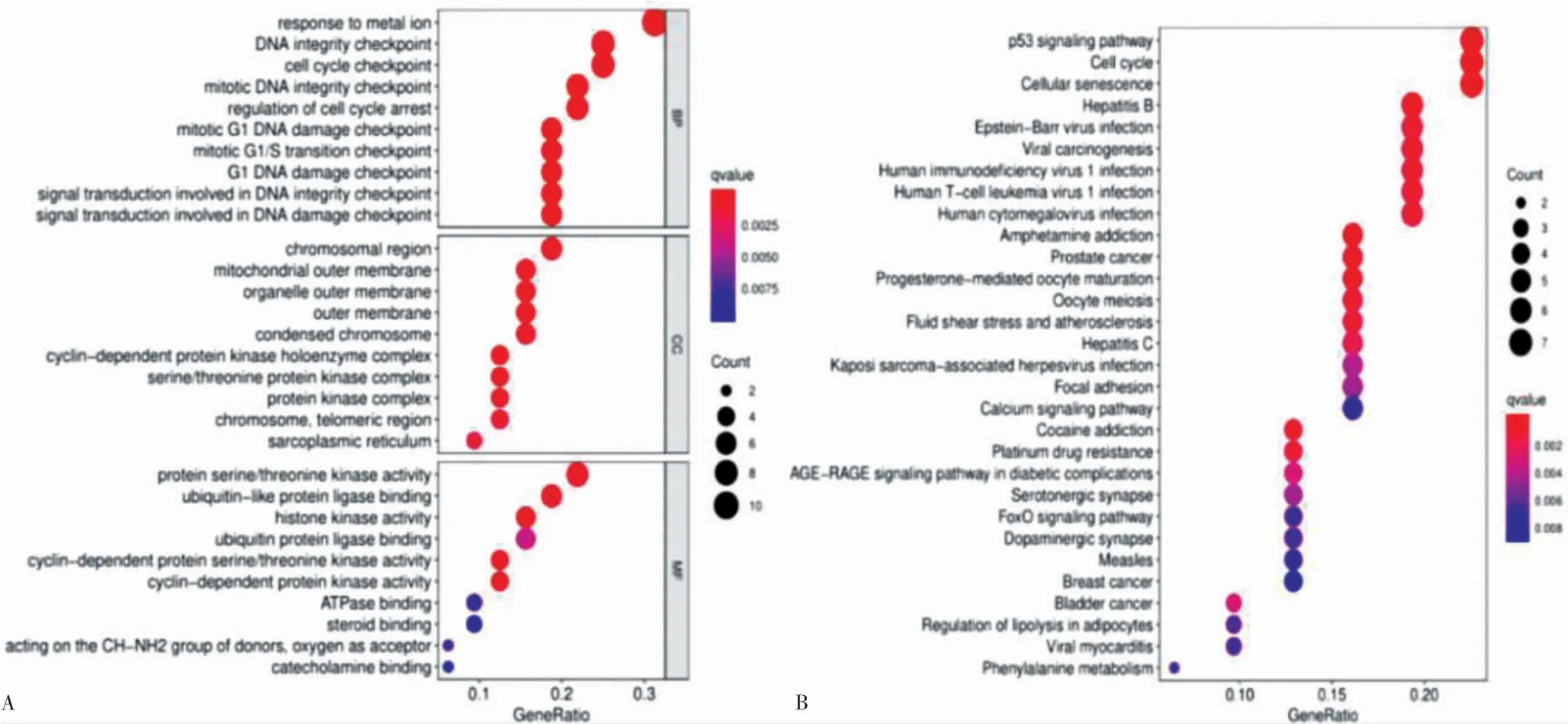
圖5 GO 和KEGG 富集分析氣泡圖
2.7 潛在生物標志物篩選
首先得到一個具有113 條邊、30 個節(jié)點的網(wǎng)絡(luò),進一步篩選后得到一個具有25 條邊、8 個節(jié)點的網(wǎng)絡(luò),3 次最終篩選得到3 個關(guān)鍵基因作為潛在生物標志物,分別為VEGFA、CDK1、CCND1,過程見圖6。
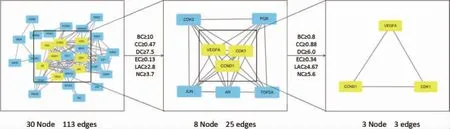
圖6 治療胃腺癌關(guān)鍵靶點的篩選策略圖
2.8 分子對接結(jié)果
將關(guān)鍵靶點與關(guān)鍵化合物進行分子對接,結(jié)果見表2。核心化合物與關(guān)鍵靶點結(jié)合能均≤-30 kJ/mol,結(jié)構(gòu)較為穩(wěn)定。見表2、圖7。
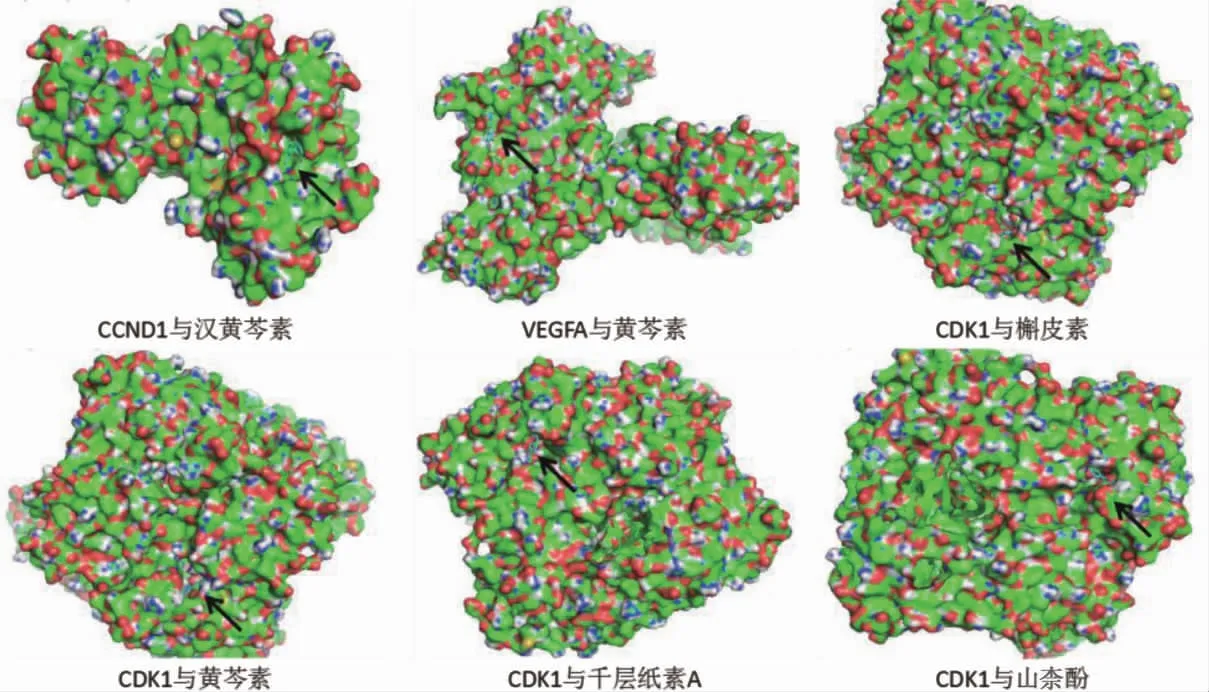
圖7 核心化合物與關(guān)鍵靶點的分子對接結(jié)果
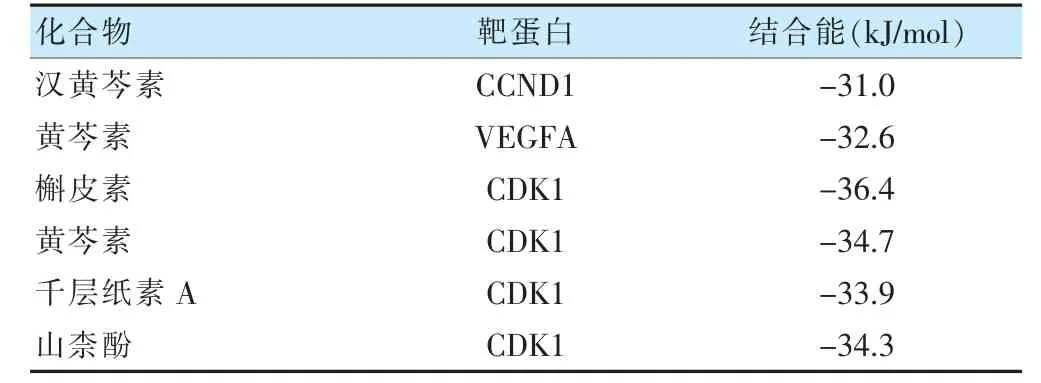
表2 關(guān)鍵靶點與化合物的對接結(jié)果
3 討論
本研究通過WGCNA 聯(lián)合網(wǎng)絡(luò)藥理學及分子對接方法,在分子層面揭示了干姜黃芩黃連人參湯抗胃癌的活性成分、作用靶點和信號通路,初步闡釋了其抗胃腺癌的作用機制可能是通過藥物核心化學成分調(diào)節(jié)VEGFA、CDK1、CCND1 三個關(guān)鍵靶點,影響p53信號通路等過程起到抗癌作用。
干姜黃芩黃連人參湯出自《傷寒論》,四種藥材寒溫并用,缺一不可,有散結(jié)除痞之功[9]。本研究通過網(wǎng)絡(luò)藥理學分析得到核心化合物主要包括漢黃芩素、黃芩素、槲皮素等,這些化合物同屬于黃酮類化合物,不會產(chǎn)生拮抗作用。漢黃芩素、黃芩素可通過抗腫瘤血管發(fā)生抑制癌細胞的增殖[10],槲皮素可促進癌細胞凋亡[11]。山柰酚具有廣譜抗腫瘤活性,對胃癌細胞具有抑制作用[12-13]。通過KEGG 富集分析得到藥物核心化學成分可通過p53 信號通路、細胞周期等發(fā)揮抗癌作用。槲皮素可通過上調(diào)p53 來增強曲古抑菌素A的抗腫瘤活性[14],同時漢黃芩素能夠抑制人胃癌細胞增殖、遷移和侵襲,誘導細胞衰老,加速其凋亡[15]。分子對接結(jié)果顯示,核心化合物與關(guān)鍵靶點結(jié)合活性較高,提示這些化合物可通過調(diào)節(jié)關(guān)鍵靶點發(fā)揮抗癌作用。
VEGFA 是一種促血管生長因子,其促血管生成作用最強、專屬性也最高[16]。VEGFR 可以與VEGFA特異結(jié)合來介導血管的生成[17]。研究表明胃腺癌患者的腫瘤分期和預后與胃腺癌組織中VEGFA 的異常表達密切相關(guān)[18-20]。CDK1 是一種周期蛋白依賴性蛋白激酶,由催化激酶亞基和細胞周期蛋白蛋白伴侶組成,具有調(diào)控細胞周期的重要功能[21]。CDK1 在大多數(shù)惡性腫瘤中的表達均增加,其中就包括胃腺癌。CDK1作為抗腫瘤藥物研發(fā)的有效靶點,可顯著抑制腫瘤的生長[22-23]。CCND1 是細胞周期蛋白家族中最重要的細胞周期正調(diào)節(jié)器[24]。CCND1 可以調(diào)整細胞周期不同階段的進展,在細胞周期中發(fā)揮特定作用。CCND1 基因多態(tài)性與多種消化系統(tǒng)腫瘤密切相關(guān)[25-26]。
綜上所述,本研究應用網(wǎng)絡(luò)藥理學、WGCNA、分子對接技術(shù)對干姜黃芩黃連人參湯中的活性化合物與作用靶點進行了分析,初步得到其抗胃腺癌的作用機制是通過核心化學成分調(diào)關(guān)鍵靶點,影響p53 信號通路、細胞周期和細胞衰老等過程起到抗癌作用。本研究結(jié)果為后續(xù)研究提供了理論基礎(chǔ)和重要依據(jù),為今后研發(fā)新藥指明了方向。

