賴氨酸對冷凍損傷肌原纖維蛋白凝膠性能的影響
韓馨蕊,李朝蕊,范 鑫,李保玲,曹云剛,*,熊幼翎*
(1.陜西科技大學食品與生物工程學院,陜西 西安 710021;2.肯塔基大學動物與食品科學系,美國 肯塔基 列克星頓 40546)
肉制品加工業是我國食品加工業的重要組成部分。原料肉的保藏方法有很多,冷凍是目前應用最廣、效果最好、最經濟、最安全的保藏方法[1]。肉經冷凍處理可以抑制肉中微生物的生長、鈍化酶的活性、減少脂肪及蛋白的氧化[2-3]。然而冷凍會因大冰晶的形成破壞細胞結構,導致蛋白質分子原有的高級空間結構遭到破壞,因而長期冷凍儲藏原料肉的一個顯著變化為其主要功能性蛋白——肌原纖維蛋白(myofibrillar protein,MP)的損傷變性,主要表現為溶解度及凝膠性能下降,最終影響產品品質及得率[4-6]。現有研究主要是通過革新冷凍及解凍方法或添加抗凍劑等手段降低原料肉由于冷凍解凍等過程導致的蛋白損傷,但存在效果有限或者由于技術不成熟、成本高昂等原因尚不能大范圍應用推廣等實際問題。實際情況是作為企業主要加工原料的冷凍肉很大一部分已經發生了冷凍損傷。因此,有效修復已損傷蛋白的功能特性具有非常重要的理論與應用價值。
賴氨酸(L-lysine,L-Lys)是一種堿性氨基酸,廣泛存在于豆類植物和酪蛋白等蛋白的水解物中,具有安全性高、成本低等特點,在肉制品加工領域具有潛在的應用前景。Fu Yuan等[7]研究發現L-Lys的添加可以改變肌球蛋白分子粒徑及分布以及凝膠分子間作用力,從而影響凝膠的持水性和硬度。Lei Zhen等[8]研究發現添加L-Lys增加了雞胸肉肌動球蛋白表面疏水殘基和活性巰基的數量,進而提高了凝膠硬度及持水性。Wang Yaosong等[9]研究發現添加L-Lys可以促進乳清蛋白形成均一、多孔的熱誘導凝膠。Gao Ruichang等[10]研究發現添加L-His能顯著提高天然肌球蛋白在低/高離子強度溶液中的溶解度。Zhou Cunliu等[11]發現,添加L-Lys使得豬肉腸具有更好的色澤,并且提高了其持水性和質構特性(硬度、彈性、咀嚼性)。基于以上研究,推測添加L-Lys有望改善冷凍損傷MP的溶解度和凝膠性能,但相關研究鮮見報道。因此,本實驗通過構建反復凍融體系獲得冷凍損傷原料肉,提取冷凍損傷MP后,研究不同濃度L-Lys(0、1、3、5 mmol/L和10 mmol/L)對冷凍損傷MP結構、溶解度、流變學特性、凝膠質構及微觀結構的影響及其內在機制,以期為L-Lys作為品質改良劑在肉制品中的應用提供理論依據和參考。
1 材料與方法
1.1 材料與試劑
豬外脊肉(longissimus lumborum),購于陜西西安市未央區潤家超市,置于冰盒中運回實驗室,剔除可見脂肪組織后,垂直于肌纖維走向切成100 g左右的肉排,采用聚乙烯袋真空包裝,備用。
L-Lys 源葉生物科技有限公司;乙二醇雙(2-氨基乙基醚)四乙酸(glycol-bis-(2-aminoethylether)-N,N,N’,N’-tetraacetic acid,EGTA) 生工生物工程(上海)股份有限公司;其他化學試劑均為國產分析純。
1.2 儀器與設備
HR/T20MM立式高速冷凍離心機 湖南赫西儀器裝備有限公司;UV2900紫外-可見分光光度計 上海舜宇恒平科學儀器有限公司;PHS-25型數顯pH計 上海儀電科學儀器股份有限公司;TA.Plus物性測試儀 英國Stable Micro System公司;Fluoro Max-4熒光分光光度計日本Horiba公司;CM-5分光測色計 柯尼卡美能達(中國)投資有限公司;Mastersizer 2000激光粒度分析儀 英國Malvern Instruments有限公司;Haake-Mars 60流變儀、DXR2顯微共聚焦拉曼光譜儀 德國Thermo Fisher Scientific公司;FEI Q45+EDAX Octane Prime環境掃描電子顯微鏡 美國FEI公司;圓二色光譜儀 英國Applied Photophysics公司。
1.3 方法
1.3.1 冷凍損傷原料肉的制備
參照Xia Xiufang等[12]的方法進行冷凍損傷原料肉的處理:將分裝好的新鮮原料肉隨機分為兩組;一組置于-18 ℃的冰箱作為空白進行相關指標的測定;另一組進行冷凍-解凍循環處理:將新鮮肉置于-18 ℃冷凍,3 d后取出,在室溫下用自來水進行解凍直到肉樣中心溫度達到0~2 ℃后,即完成第1次冷凍-解凍過程,重復上述步驟3 次后進行相關指標的測定。
1.3.2 MP的提取
參照Park等[13]的方法進行。將不同處理樣品肉在流水下進行解凍后,用刀切成若干小條稱量,放置于組織搗碎機中,加入4 倍體積的僵直液(0.1 mol/L NaCl、2 mmol/L MgCl2、10 mmol/L Na2HPO4、1 mmol/L EGTA,pH 7.0),進行勻漿搗碎(15 s,4 次),4 ℃、2 000×g離心15 min后棄上清液,所得沉淀再次加入4 倍體積的僵直液,重復上述步驟共3 次。所得沉淀加入4 倍體積的0.1 mol/L NaCl溶液,攪拌均勻后經4 層紗布過濾,使用0.1 mol/L HCl溶液將濾液的pH值調至6.2,離心后所得沉淀即為MP。整個提取過程保持在0~4 ℃,將所得蛋白置于離心杯中,保存于碎冰中,并保證在48 h內使用。蛋白濃度采用雙縮脲法測定。
1.3.3 MP-賴氨酸混合體系的制備
使用25 mmol/L磷酸鹽緩沖液(含0.4 mol/L NaCl,pH 6.2)將冷凍損傷MP蛋白膏稀釋為40 mg/mL,分別加入不同量的L-Lys,用上述緩沖液對體系進行稀釋,使得最終體系中蛋白質量濃度為30 mg/mL,L-Lys濃度分別為0、1、3、5、10 mmol/L,用玻璃棒輕輕攪拌均勻,將樣品4 ℃放置12 h。同時設置未冷凍損傷(不添加L-Lys)樣品為空白對照。
1.3.4 圓二色譜測定
使用25 mmol/L磷酸鹽緩沖液(含0.4 mol/L NaCl,pH 6.2)將MP樣品稀釋至0.2 mg/mL,以120 nm/min的掃描速率從200 nm掃描到260 nm,累計掃描3 次取其平均值并扣除緩沖液背景,使用CDNN軟件計算蛋白二級結構含量。
1.3.5 內源性色氨酸熒光測定
使用25 mmol/L磷酸鹽緩沖液(含0.4 mol/L NaCl,pH 6.2)將MP樣品稀釋為0.4 mg/mL,以283 nm作為激發波長利用Fluoro Max-4熒光分光光度計記錄290~400 nm的發射光譜,激發和發射狹縫寬度均為1.5 nm。相同條件下記錄樣品緩沖液發射光譜,并從樣品發射光譜中扣除以排除干擾。
1.3.6 粒度測定
在25 ℃使用Mastersizer 2000激光粒度分析儀采用靜態光散射法對不同處理的MP樣品的平均粒徑進行分析,將稀釋后的MP樣品(2 mg/mL)分散在蒸餾水(分散介質)中,直至遮光效果達到10%~13%,以避免多次散射。設置MP顆粒折射率為1.570,分散劑折射率為1.330,吸收指數為0.001,重復測定3 次取其平均值。
1.3.7 溶解度的測定
使用25 mmol/L磷酸鹽緩沖液(含0.4 mol/L NaCl,pH 6.2)將MP樣品稀釋至2 mg/mL,在5 000×g離心15 min,采用雙縮脲法測定上清液的蛋白含量,溶解度計算如下式所示:

1.3.8 流變學性能的測定
根據Li Chuangqiang等[14]的方法進行動態流變學的測定。將樣品混合物置于塑料離心管中4 ℃、1 000×g離心1 min,脫氣后,置于間距為1 mm的流變儀平板之間,下壓后輕輕拭去平板周圍多余的樣品,用硅油進行密封,防止加熱過程中水分蒸發,平衡2 min后,在振蕩模式下使樣品以1 ℃/min的升溫速率從20 ℃加熱至75 ℃進行凝膠化。振蕩頻率設置為0.1 Hz,最大應變為0.02。記錄實驗中的彈性模量G’作為流變性能的評價指標。
1.3.9 MP熱誘導凝膠的制備
準確稱取5 g脫氣后的MP樣品(30 mg/mL)于玻璃瓶中,封口后置于水浴鍋中以1 ℃/min的升溫速率從20 ℃加熱至75 ℃,并在75 ℃保溫10 min,取出后立刻置于冰水混合物中冷卻30 min,隨后放入4 ℃冰箱冷藏過夜。在測定MP樣品凝膠性能之前,需將樣品提前取出在室溫條件下平衡2 h[15]。
1.3.10 蒸煮損失率的測定
用小鏟輕輕將凝膠與瓶壁剝離,并倒扣于濾紙上,靜置20 min,使其蒸煮汁液流盡之后,對凝膠進行稱量[16]。蒸煮損失率計算公式如下:

1.3.11 MP凝膠質構的測定
采用TPA質構分析法[17],測定凝膠的硬度、彈性、內聚性、咀嚼性和回復性等指標。使用小鏟子輕輕將凝膠與小玻璃瓶壁剝離,將凝膠取出放置于平板上進行質構測定。測定參數設置如下:測前、測中、測后速率均為2 mm/s;下壓百分比30%;兩次下壓時間間隔5 s;探頭型號P/75;觸發力10 g。
1.3.12 MP凝膠白度的測定
參照Xia Xiufang等[3]方法,分光測色計經自檢及零點、白板校正后,進行樣品測定。每個樣品3 組平行,取平均值。凝膠白度值W按下式計算:
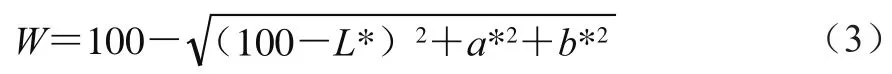
式中:L*為亮度值;a*為紅度值(正值表示偏紅,負值表示偏綠);b*為黃度值(正值表示偏黃,負值表示偏藍)。
1.3.13 MP凝膠微觀結構表征
參照Cao Yungang等[18]的方法并略作修改。將MP凝膠樣品切成小方塊后使用體積分數為2.5%的戊二醛磷酸鹽緩沖液(0.1 mol/L,pH 7.4)固定4 h,使用pH 7.4的磷酸鹽緩沖液清洗數次,然后通過一系列體積分數的乙醇溶液(50%、70%、90%、95%、100%)進行梯度脫水,用叔丁醇置換3 次,每次30 min。對樣品進行冷凍干燥后噴金,然后使用掃描電鏡觀察其微觀結構,加速電壓為2.0 kV,放大倍數為5 000。
1.4 統計分析
使用Statistical 9.0分析軟件通用線性模型程序(Analytical software,Tallahassee,FL,USA)對實驗數據進行方差分析。采用LSD全配對多重比較方法進行顯著性分析,P<0.05,差異顯著。實驗數據以表示,并使用SigmaPlot 12.5軟件進行繪圖。
2 結果與分析
2.1 L-Lys濃度對冷凍損傷MP結構的影響
不同處理MP二級結構的變化使用圓二色譜儀進行測定,結果如圖1a所示。未經反復凍融處理MP的CD圖譜在208、222 nm處有兩個負峰,表明MP中α-螺旋相對含量較高[19]。經反復凍融處理后這2個峰的大小顯著降低,說明反復凍融處理導致MP的α-螺旋相對含量下降,這可能是由于肌球蛋白尾部的α-超螺旋結構解旋[20],二級結構計算結果顯示,α-螺旋相對含量下降伴隨著β-折疊、β-轉角和無規卷曲結構相對含量的顯著上升(圖1b)。L-Lys添加顯著改變了冷凍損傷MP的二級結構,添加1、3、5、10 mmol/LL-Lys使得冷凍損傷MP的α-螺旋相對含量分別提高10.2%、11.5%、10.8%和10.6%,添加L-Lys使得冷凍損傷MP二級結構的構成比例接近于未經反復凍融處理組(圖1b)。蛋白質的二級結構主要由氫鍵維系,L-Lys含有的羧基(—COOH)及氨基(—NH2)可能破壞了原有的氫鍵,并誘導新的氫鍵形成,從而引起蛋白二級結構的改變。
蛋白質內源性色氨酸熒光對于其周邊微環境的極性非常敏感,當蛋白質處于折疊狀態時,色氨酸殘基主要位于蛋白質內核這樣的疏水環境中,此時被激發的色氨酸具有相對較高的熒光強度;而當蛋白質部分或完全展開時,色氨酸殘基就會更多的暴露于蛋白質分子表面,此時被激發的色氨酸熒光強度降低。因此,內源性色氨酸熒光特性經常被用于反映蛋白質的三級結構的變化[15]。如圖1c所示,經反復凍融后MP的熒光強度顯著下降,表明蛋白三級結構的展開。反復凍融破壞了MP天然的排列方式,蛋白展開變性使得原本位于內部的色氨酸殘基暴露于表面而處于溶劑的極性環境中,從而引起內源熒光強度下降。L-Lys添加顯著改變了冷凍損傷MP的內源性色氨酸熒光強度,當L-Lys添加量為1、3 mmol/L時,冷凍損傷MP的熒光強度顯著上升,接近于未經反復凍融處理MP的熒光強度;當L-Lys添加量為5 mmol/L時反而促使熒光強度進一步降低;當L-Lys添加量為10 mmol/L時,熒光強度略微上升但變化不顯著。一方面L-Lys的添加會引起氫鍵重排導致蛋白構象的變化,另一方面作為生物小分子物質L-Lys可能與MP中色氨酸殘基靜態結合導致熒光猝滅效應,因此不同濃度L-Lys對冷凍損傷MP熒光強度的影響是二者綜合作用的結果。
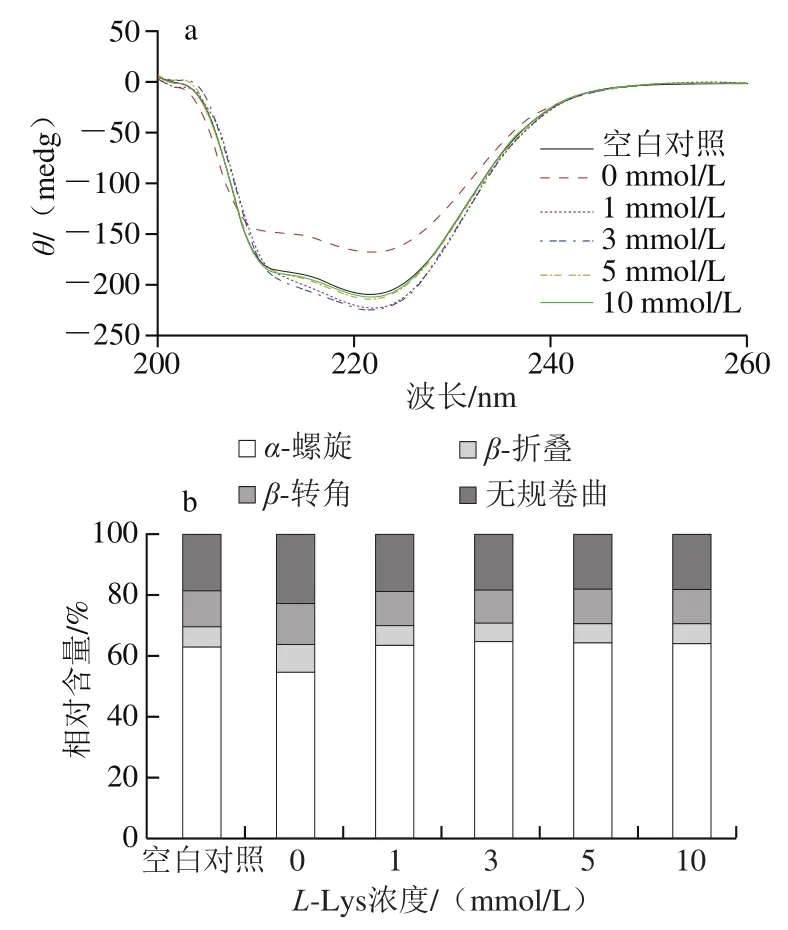
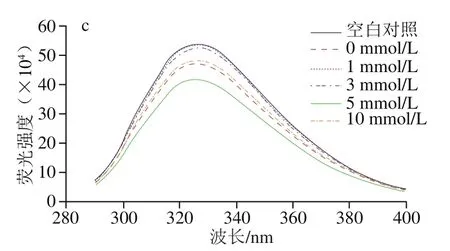
圖1 L-Lys濃度對MP溶液二級結構(a、b)和三級結構(c)的影響Fig. 1 Effect of L-Lys concentration on secondary structure (a, b) and tertiary structure (c) of MP solution
2.2 L-Lys濃度對冷凍損傷MP粒度的影響
蛋白質的粒度是影響蛋白質功能特性的因素之一[21],也是蛋白質結構的宏觀表現。粒徑反映可溶性蛋白的粒度分布和聚集情況[22]。如圖2所示,與未經反復凍融MP相比,經反復凍融MP的表面積平均粒徑d(3,2)和體積平均粒徑d(4,3)分別增加了4.841 μm和17.427 μm。這是由于反復凍融誘導MP結構展開,使得MP分子間S—S形成及疏水相互作用增強、蛋白質交聯聚集加劇、導致MP的平均粒徑增大[23-24]。不同濃度L-Lys處理對反復凍融MP的d(3,2)和d(4,3)產生了顯著的影響,整體來看L-Lys處理傾向于降低冷凍損傷MP的粒徑,且L-Lys濃度越大效果越好。與本研究結果類似,Fu Yuan等[7]在不同pH值處理條件下研究發現L-Lys和L-Arg的添加引起MP粒徑減小。而馬文慧等[25]研究發現在氧化條件下添加L-Arg引起MP粒徑增大。不一致的研究結果表明堿性氨基酸對MP粒徑的影響可能受原料肉、離子強度、氧化或冷凍處理等多種因素的影響。
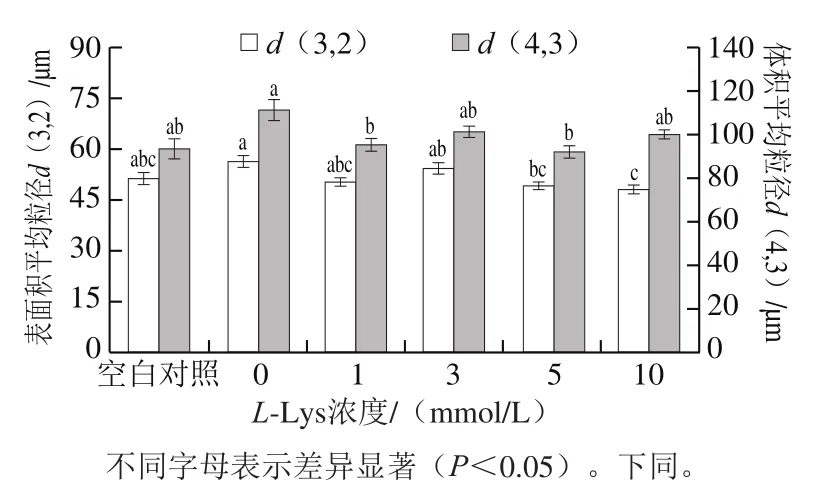
圖2 L-Lys濃度對MP粒度的影響Fig. 2 Effect of L-Lys concentration on MP particle size
2.3 L-Lys濃度對冷凍損傷MP溶解度的影響
溶解度反映了蛋白分子間以及蛋白與水分子之間相互作用力的變化,能夠間接反映出蛋白質變性和聚集情況[26-27]。如圖3所示,未經反復凍融的MP樣品的溶解度為61.10%,反復凍融導致MP的溶解度下降至41.61%(P<0.05)。這與Srikar等[28]報道的粉紅鱸魚蛋白在冷凍過程中溶解度下降的結果基本一致,這是因為冷凍導致蛋白發生變性,蛋白分子間二硫鍵及疏水相互作用增強,蛋白-蛋白交聯形成聚集體[29]。不同濃度L-Lys處理對反復凍融MP的溶解度產生顯著影響。添加1、3、5、10 mmol/LL-Lys使得反復凍融MP的溶解度分別增加至42.66%、50.66%、69.10%和64.93%,從整體來看,說明L-Lys對于MP的增溶作用隨著L-Lys濃度的升高而增強。Guo等[30]也發現L-Lys能夠顯著提高豬肌球蛋白的溶解度。
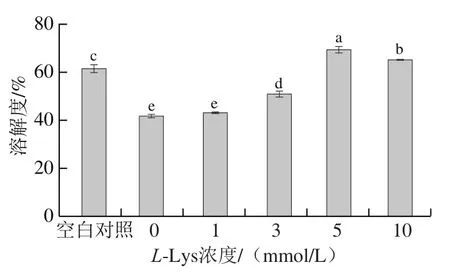
圖3 L-Lys濃度對MP溶解度的影響Fig. 3 Effect of L-Lys concentration on MP solubility
2.4 L-Lys濃度對冷凍損傷MP流變學性能的影響
儲能模量G’反映蛋白凝膠網絡的結構屬性,同時與凝膠強度聯系密切[31]。由圖4可以發現,未經反復凍融的MP樣品的G’在45~56 ℃顯著上升,這是因為肌球蛋白頭部開始發生變性聚合,肌球蛋白溶液開始逐漸由于熱變性而形成結構較為疏松的凝膠;56~62 ℃急劇下降,這是由于肌球蛋白的尾部展開破壞了已形成的網絡結構;在最后的加熱過程中(62~75 ℃)G’隨溫度升高持續上升,說明蛋白質進一步發生交聯聚集,最終形成了永久性、不可逆的、更強的凝膠網絡結構[17]。與未經反復凍融樣品相比,冷凍損傷MP的G’值在整個熱誘導成膠過程中均較低,說明反復凍融降低了MP的凝膠性能(包括肌球蛋白頭部交聯和尾部交聯)。L-Lys的添加并不能提高熱誘導凝膠過程中冷凍損傷MP的G’,相反會促進G’的損失,且L-Lys濃度越高MP的G’越低。這可能是由于L-Lys的存在抑制了加熱過程中肌球蛋白結構的展開和交聯,阻礙了凝膠網絡的形成[32]。
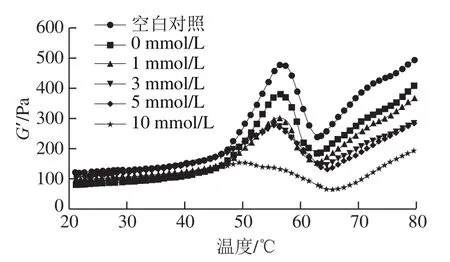
圖4 L-Lys濃度對MP流變學性能的影響Fig. 4 Effect of L-Lys concentration on rheological properties of MP
2.5 L-Lys濃度對冷凍損傷MP凝膠蒸煮損失及白度的影響
如圖5所示,未經反復凍融MP熱誘導凝膠的蒸煮損失率為12.65%,經反復凍融處理并未引起MP熱誘導凝膠的蒸煮損失率(12.76%)的顯著變化,與本研究結果一致,Jittinandana等[33]研究15 次反復凍融并未引起鱒(Squaliobarbus ourriculus)蒸煮損失的顯著變化。而Xia Xiufang等[12]發現豬MP凝膠蒸煮損失隨著反復凍融次數的增加而增加,這可能是由于反復凍融導致肌球蛋白變性增加,也可能是由于反復凍融破壞了肌纖維的結構使得蛋白形成網絡結構結構能力減弱。實驗結果不一致可能與肉的種類、實驗條件等不同有關。L-Lys添加顯著降低了MP凝膠的蒸煮損失,且隨著L-Lys濃度的增加蒸煮損失顯著降低(P<0.05)。
如圖5所示,未經反復凍融的MP凝膠白度為67.314,經反復凍融處理導致MP凝膠白度值下降,這可能與冷凍導致的脂肪和蛋白氧化以及色素變化等因素有關[17]。反復凍融MP凝膠白度值隨著L-Lys濃度的增加而降低,這可能是由于實驗所用L-Lys自身略帶顏色。
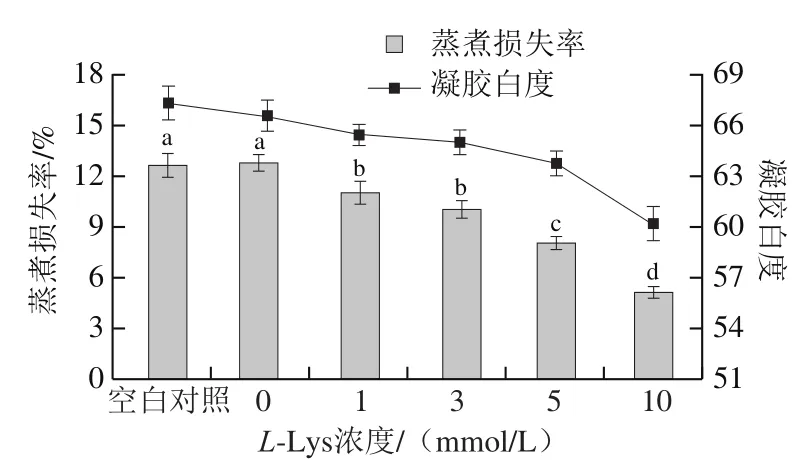
圖5 L-Lys濃度對MP凝膠性能的影響Fig. 5 Effect of L-Lys concentration on gel properties of MP
2.6 L-Lys濃度對冷凍損傷MP凝膠質構的影響
如表1所示,與未經反復凍融MP相比,反復凍融處理導致MP樣品的硬度下降了3.011 g。這與陳金玉等[34]研究發現蝦蛄MP的熱誘導凝膠強度隨著凍融次數的增加顯著下降一致。添加L-Lys導致冷凍損傷MP樣品的凝膠強度明顯降低,且MP凝膠的強度隨著L-Lys添加量的增加而逐漸降低(P<0.05),這與流變測定結果一致。與本研究結果一致,付淵[32]研究發現L-Lys添加到雞胸肉肌球蛋白凝膠中會導致凝膠硬度下降,并且隨著L-Lys濃度的增加而降低。而雷振[35]發現添加L-Lys能夠明顯提高雞肉肌動球蛋白凝膠硬度,這可能與肉的種類的不同有關。
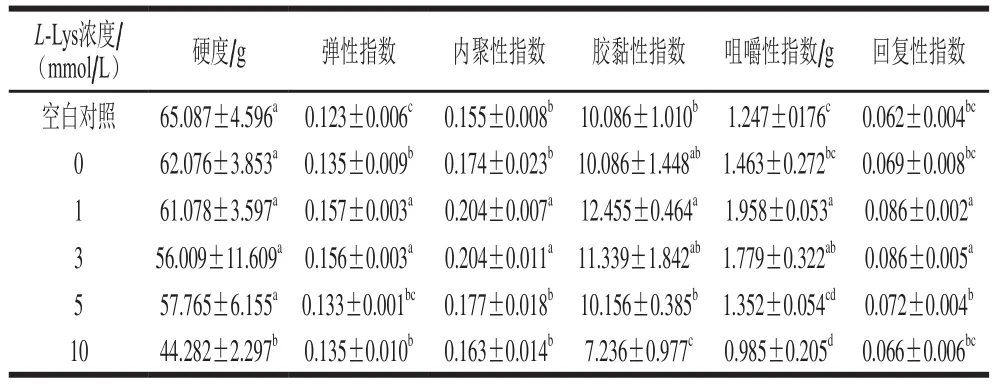
表1 L-Lys濃度對MP凝膠質構的影響Table 1 Effect of L-Lys concentration on the texture of MP gel
與未經反復凍融MP凝膠相比,冷凍損傷MP凝膠的彈性、內聚性、膠黏性、咀嚼性和回復性均有所上升。當L-Lys濃度為1 mmol/L時,全面提高了冷凍損傷MP凝膠的彈性、內聚性、膠黏性、咀嚼性和回復性;當濃度為3、5 mmol/L時,對冷凍損傷MP凝膠的上述質構特性影響不大;當濃度為10 mmol/L時,顯著降低了所有質構指標的數值(P<0.05)。
2.7 L-Lys濃度對冷凍損傷MP凝膠微觀結構的影響
凝膠的微觀結構與質構、保水和流變特性相關。由圖6可以看出,未經反復凍融MP凝膠的微觀結構連續、均勻、致密,而反復凍融MP凝膠的微觀結構粗糙,孔徑大且不均勻。這也是冷凍損傷MP凝膠強度和蒸煮損失降低的原因。L-Lys添加對冷凍損傷MP凝膠的微觀結構產生了明顯的影響,隨著L-Lys濃度的增加,冷凍損傷MP凝膠微觀結構的孔徑逐漸減小,三維網狀結構更加致密均勻。Sun Jingxin等[36]研究發現均勻致密的凝膠結構有利于凝膠基質中水分的截留,這進一步解釋了L-Lys添加顯著降低了蒸煮損失。

圖6 L-Lys濃度對MP微觀結構的影響Fig. 6 Effect of L-Lys concentration on microstructure of MP
3 結 論
探究不同濃度L-Lys對反復凍融誘導的冷凍損傷MP結構及凝膠性能的影響。結果表明:L-Lys添加改變了冷凍損傷MP的結構,表現為α-螺旋相對含量和內源性色氨酸熒光強度上升,經L-Lys處理的冷凍損傷MP蛋白結構特性接近于未經反復凍融MP的結構特性。整體來看,隨著L-Lys濃度(1~10 mmol/L)的升高,冷凍損傷MP的溶解度逐漸升高,G’及凝膠強度逐漸降低,蒸煮損失逐漸減小,凝膠微觀結構逐漸趨于致密均勻。因此,L-Lys添加能有效降低冷凍損傷MP的蒸煮損失和凝膠強度,這說明添加L-Lys有望顯著提升冷凍原料肉制品的得率并改善其嫩度和多汁性。

