局部亞低溫配合靜脈溶栓治療急性腦梗死的研究
井先成
(河南省商丘市第一人民醫院急診內科 商丘 476000)
急性腦梗死是因各種因素導致腦血管狹窄,腦組織供血不足誘發的神經系統疾病,患者可合并不同程度的神經功能受損,阿替普酶溶栓(rt-PA)有助于梗死血管再開通,是恢復腦部血液循環的重要手段,但溶栓效果常受治療時間窗限制,加上疾病本身引起神經功能進行性受損,血流再灌注一定程度上也可引起神經功能受損,急性腦梗死患者不可避免的合并認知功能障礙、癲癇等后遺癥,導致患者生活質量下降[1~2],故安全、高效的治療手段對促進患者預后尤為必要。新近研究顯示,亞低溫療法可通過物理形式幫助機體體溫降至預期值,不僅對血流再灌注時氧自由基的生成有抑制作用,還可防止腦細胞凋亡,在改善缺血性、外傷性腦損傷預后方面具有重要價值[3~4]。鑒于此,本研究將亞低溫療法與rt-PA溶栓配合用于急性腦梗死患者的治療中,以期提高患者預后。現報道如下:
1 資料與方法
1.1 一般資料將醫院2021年3月至2022年3月期間收治的80例急性腦梗死患者納入研究,采用隨機數字表法分為溶栓組與低溫組,各40例。溶栓組男21例,女19例;年齡52~78歲,平均(63.25±2.15)歲;梗死面積:面積<5 cm2者17例,5 cm2≤面積<10 cm2者17例,面積≥10 cm2者6例;梗死部位:腦干9例,基底節區19例,小腦6例,其他6例;發病至入院就診時間1~6 h,平均(4.05±0.26)h;TOAST分型[5]:大動脈粥樣硬化型12例,心源性栓塞10例,小動脈閉塞型10例,其他8例;合并基礎疾病:高血壓17例,冠心病15例,糖尿病16例(每位患者可不合并或合并單種或多種基礎疾病)。低溫組男19例,女21例;年齡52~75歲,平均(63.17±2.11)歲;梗死面積:面積<5 cm2者19例,5 cm2≤面積<10 cm2者16例,面積≥10 cm2者5例;梗死部位:腦干7例,基底節區20例,小腦7例,其他6例;發病至入院就診時間1~7 h,平均(4.07±0.24)h;TOAST分型:大動脈粥樣硬化型14例,心源性栓塞10例,小動脈閉塞型8例,其他8例;合并基礎疾病:高血壓19例,冠心病17例,糖尿病16例。兩組患者上述一般資料對比,差異無統計學意義(P>0.05),具有可比性。本研究獲得醫院醫學倫理委員會批準(倫理審批號:20210265),且納入對象及其家屬均簽署知情同意書。
1.2 入組標準(1)納入標準:急性腦梗死診斷標準參考《中國急性缺血性腦卒中中西醫急診診治專家共識》[6]中相關診斷標準,且經臨床影像學(MRI、CT等)檢查明確梗死病灶;病發至入院時間≤24 h;均為首次患病;均采用rt-PA溶栓治療方案。(2)排除標準:因其他原因導致的急性腦梗死,如腦部腫瘤等;合并顱內動脈瘤、腦血管畸形等其他腦血管疾病;伴無法控制或治療效果不理想的顱內感染;有長期免疫抑制劑、抗凝藥物用藥史;腦電圖示癲癇樣改變;合并腦部手術史;伴凝血功能異常;伴認知功能障礙影響本研究開展。
1.3 治療方法納入患者均給予降顱內壓、抗血小板、維持水電解質平衡等干預手段。在此基礎上,溶栓組給予注射用阿替普酶(國藥準字SJ20160055)靜脈溶栓。劑量0.9 mg/(kg·d),初次給藥:總量的10%+0.9%氯化鈉注射液10 ml在1 min內靜推完畢;余下總量的90%+0.9%氯化鈉注射液100 ml在1 h內靜滴完畢,1次/d,治療1周。治療過程中嚴密監測患者生命體征,24 h后行頭顱CT檢查明確無顱內出血時,給予100 mg阿司匹林腸溶片(國藥準字H20113013)口服,1次/d。低溫組在溶栓組基礎上聯合頭部亞低溫療法。儀器選用SDL-V型雙控顱腦降溫儀(北京北方醫用設備有限公司),治療方法:患者頭部伸入頭盔中,導冷枕置入頭盔,保障治療儀與頭盔在同一水平線上,設置冰帽-2~4℃,腦溫33~35℃,模式調至自動調溫模式,治療時間48~72 h,嚴密監測患者生命體征,顱內壓正常并維持24 h后復溫,1~2 d恢復1℃,復溫速度:<0.1℃/h。兩組患者均治療2周。
1.4 觀察指標(1)神經功能恢復情況。治療后,采用美國國立衛生院卒中量表(NIHSS)[7]評估兩組患者神經功能。量表包括構音障礙、共濟失調、上下肢運動等11個條目,滿分42分,分值越高提示神經功能受損越嚴重。神經功能重度缺損:NIHSS評分≥15分;中度缺損:NIHSS評分≤14分且≥8分,輕度缺損:NIHSS評分≤7分且≥4分。(2)氧化應激指標。抽取治療前、治療后兩組患者肘靜脈血5 ml,高速離心(離心半徑9 cm,轉速3 000 r/min)5 min后留取上層清液,檢測并對比超氧化物歧化酶(SOD,羥胺法測定)、丙二醛(MDA,硫代巴比妥酸法測定)水平,試劑盒均由南京建成生物工程研究所提供。(3)顱內壓。用閃光視覺誘發電位無創技術,由相應的程序計算出治療前、治療后患者顱內壓。(4)神經損傷因子。檢測治療前、治療后兩組血清神經元特異性烯醇化酶(NSE,采用放射免疫分析法及羅氏公司試劑盒)、S100鈣結合蛋白β(S100β,采用酶聯免疫吸附法及上海工碩生物技術有限公司的試劑盒)。
1.5 統計學方法采用SPSS24.0統計學軟件處理數據,以(±s)表示經Shapiro-Wilk正態性檢驗符合正態分布的計量資料,組間比較采用獨立樣本t檢驗;計數資料用%表示,采用χ2檢驗;等級資料采用秩和檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 兩組神經功能恢復情況對比低溫組神經功能恢復情況優于溶栓組,差異有統計學意義(P<0.05)。見表1。

表1 兩組神經功能恢復情況對比[例(%)]
2.2 兩組氧化應激指標對比治療前,兩組血清SOD、MDA水平對比,差異無統計學意義(P>0.05);治療后,兩組患者SOD水平升高,MDA水平下降,且相較于溶栓組,低溫組SOD水平更高,MDA水平更低,差異有統計學意義(P<0.05)。見表2。
表2 兩組氧化應激指標對比(mmol/L,±s)
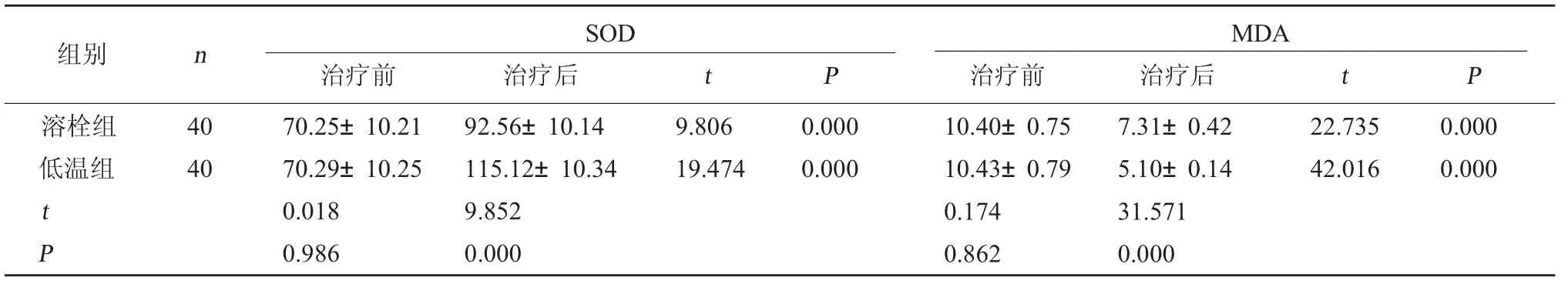
表2 兩組氧化應激指標對比(mmol/L,±s)
MDA治療前 治療后 t P溶栓組低溫組組別 n SOD治療前 治療后 t P 40 40 9.806 19.474 0.000 0.000 22.735 42.016 0.000 0.000 t P 70.25±10.21 70.29±10.25 0.018 0.986 92.56±10.14 115.12±10.34 9.852 0.000 10.40±0.75 10.43±0.79 0.174 0.862 7.31±0.42 5.10±0.14 31.571 0.000
2.3 兩組神經損傷因子水平對比治療前,兩組血清NSE、S100β水平對比,差異不顯著(P>0.05);治療后,兩組血清NSE、S100β水平均下降,且低溫組NSE、S100β水平低于溶栓組(P<0.05)。見表3。
表3 兩組神經損傷因子水平對比(μg/L,±s)
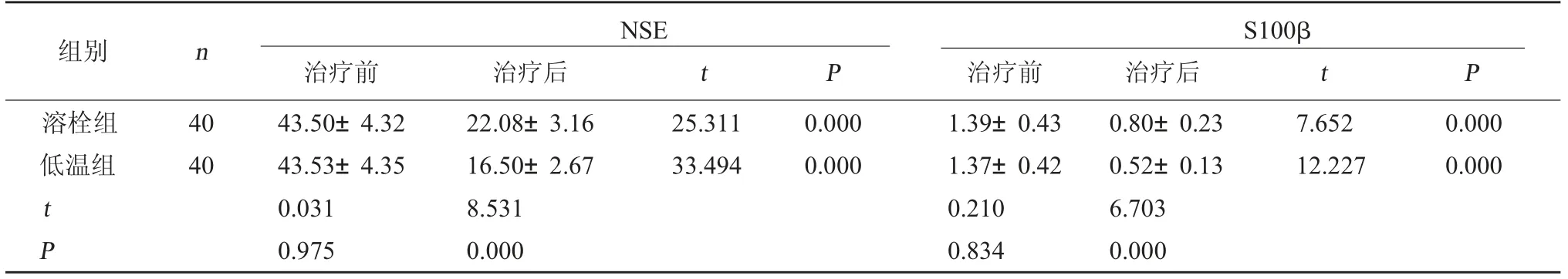
表3 兩組神經損傷因子水平對比(μg/L,±s)
S100β治療前 治療后 t P溶栓組低溫組組別 n NSE治療前 治療后 t P 40 40 25.311 33.494 0.000 0.000 7.652 12.227 0.000 0.000 t P 43.50±4.32 43.53±4.35 0.031 0.975 22.08±3.16 16.50±2.67 8.531 0.000 1.39±0.43 1.37±0.42 0.210 0.834 0.80±0.23 0.52±0.13 6.703 0.000
2.4 兩組顱內壓對比治療前,兩組顱內壓對比,差異無統計學意義(P>0.05);治療后,兩組顱內壓均下降,且低溫組顱內壓低于溶栓組,差異有統計學意義(P<0.05)。見表4。
表4 兩組顱內壓對比(mm H2O,±s)
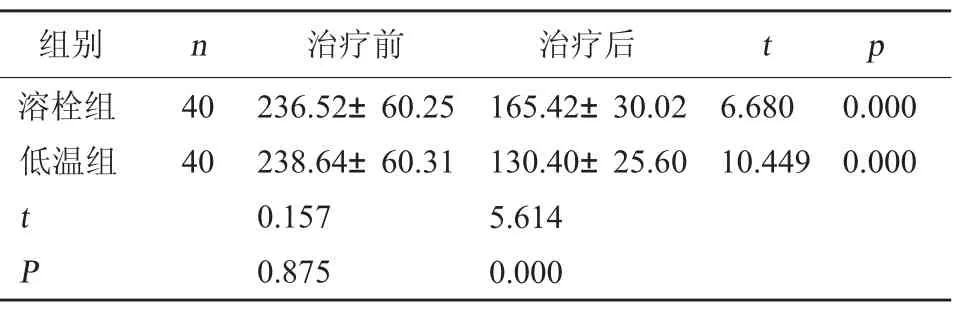
表4 兩組顱內壓對比(mm H2O,±s)
組別 n 治療前 治療后 t p溶栓組低溫組40 40 6.680 10.449 0.000 0.000 t P 236.52±60.25 238.64±60.31 0.157 0.875 165.42±30.02 130.40±25.60 5.614 0.000
3 討論
阿替普酶是纖維蛋白溶解劑,來源于血管內皮細胞的一種糖蛋白,其用于溶栓治療中的生物機制主要為:經激活病灶中纖溶酶原,發揮降解纖維蛋白的作用;對凝血機制影響小,不會引起纖溶亢進,給藥后不會增加機體出血風險,安全可靠;阻止血小板凝集,降低側支循環阻力,利于腦組織血流再灌注,促進微循環,降低腦損傷[8~9]。但值得注意的是,采用阿替普酶溶栓治療時,時間窗限制嚴格,對神經功能保護有限,患者治療后致殘風險仍較高,因此聯合其他有效的干預手段,對促進患者良性預后尤為必要。
本研究結果顯示,低溫組神經功能恢復情況優于溶栓組,低溫組顱內壓低于溶栓組,提示局部亞低溫療法聯合rt-PA溶栓,利于降低顱內壓,促進神經功能恢復。局部亞低溫作為物理干預手段被大量應用在神經內科疾病治療中,作用機制如下:(1)降低致炎因子水平,糾正機體炎癥狀態;(2)抑制再灌注損傷過程中釋放的氧自由基,阻斷氧自由基損害腦組織通路;(3)改善基質金屬蛋白酶水平,保護血腦屏障,降低水通道蛋白4,緩解腦組織水腫狀態,降低顱內壓;(4)減少谷氨酸受體等興奮性神經介質,抑制一氧化氮合成,加速神經細胞干生長,保護腦神經[10~12]。急性腦梗死引起體內氧自由基與致炎因子大量生成,誘發神經元炎癥反應與過氧化損傷。氧化應激反應是指抗氧化防御體系與活性氧族紊亂,損傷組織、機體中活性氧族。MDA是氧自由基攻擊體內脂肪產生的氧化產物,可以作為氧化損傷程度的標志;SOD是抗氧化酶之一;兩者水平直接反應機體氧化應激情況[13~14]。治療后,相較于溶栓組,低溫組SOD水平更高,MDA水平更低,提示局部亞低溫療法聯合rt-PA溶栓治療可減輕氧化應激損傷。NSE由神經內分泌細胞與神經元分泌,腦梗死發生后,血腦屏障通透性增加,NSE趁機入血;S100β蛋白是神經系統活性物質,當膠質細胞、神經元受損時,S100β蛋白釋放并透過血腦屏障進入血循環;上述兩個指標對腦損傷評估的敏感性較高[15~16]。治療后,低溫組NSE、S100β水平低于溶栓組,提示局部亞低溫療法配合rt-PA溶栓對減少神經損傷具有積極意義。但本研究并未對患者遠期療效進行跟蹤隨訪,且納入樣本數量有限,研究結論的可信度還需在未來擴大樣本量、延長患者治療后隨訪周期進行驗證。
綜上所述,局部亞低溫療法配合rt-PA溶栓治療急性腦梗死患者,利于減輕機體氧化應激反應,降低顱內壓,對促進神經功能恢復具有重要意義,可在急性腦梗死患者的臨床治療中開展應用。

