局部注射肝細胞生長因子基因修飾的骨髓間充質干細胞對兔前交叉韌帶重建后腱骨愈合的影響
楊德勇 凱沙爾·百合提亞爾 姜鈞耀 舒 莉▲
1.新疆醫科大學第六附屬醫院關節外一科,新疆烏魯木齊 830002;2.河南科技大學基礎醫學院,河南洛陽 471003
前交叉韌帶(anterior cruciate ligament,ACL)損傷發病率高[1-2],目前ACL 重建失敗率為0.7%~10.0%[3-4],其中腱骨愈合不良是重要原因之一[5-6]。為了加速腱骨愈合,干細胞移植和生長因子植入是目前的研究熱點[7-8],然而單獨使用干細胞或生長因子都有較大的局限性[9-10]。本研究將攜帶高表達肝細胞生長因子(hepatocyte growth factor,HGF)基因的腺病毒轉染至骨髓間充質干細胞(mesenchymal stem cell,MSC)中,使HGF 在MSCs 擴增及分化的過程中持續表達,以期促進ACL 腱骨愈合。
1 材料與方法
1.1 實驗動物
新西蘭兔45 只(雄性),3~5 個月,體重3.0~3.5 kg,由新疆醫科大學動物實驗中心提供,生產許可證SCXK(新)2018-0002,使用許可證SYXK(新)2018-0003,實驗方案經新疆醫科大學批準(XJYK20211125)。實驗兔飼養于新疆醫科大學動物實驗中心SPF 級屏障環境中,溫度(22±2)℃,濕度60%~80%。
1.2 主要試劑及設備
兔MSCs(武漢普諾賽生物科技有限公司,CPRb007);凍干纖維蛋白膠(華蘭生物工程股份有限公司,S20020084);攜帶重組HGF 基因的腺病毒載體(Ad-HGF)(上海漢恒生物科技有限公司,KS11672);Trizol試劑(美國Invitrogen,15596026);ReverttAid First Strand cDNA Synthesis Kit(美國Thermo,K1621)NanoDrop 2000 紫外-可見分光光度計(美國Thermo);熒光顯微鏡(日本Olympus,V251947);數字化電子萬能生物材料試驗機(深圳德邁勝公司,DMS-2T)。
1.3 研究方法
1.3.1 動物分組 采用隨機數字表法將兔分為A、B、C組,每組15 只,行雙后肢ACL 重建。A 組術后不注射任何物質;B 組術后脛骨骨道內注射MSCs 纖維蛋白膠;C 組術后脛骨骨道內注射HGF 修飾的MSCs 纖維蛋白膠。
1.3.2 HGF 轉染MSCs 將兔MSCs(2×105/孔)接種于6 孔板內(培養體系含10%胎牛血清的α-MEM 培養基),待細胞融合至70%~80%時,進行腺病毒轉染。37℃下,以感染復數MOI=150 加入2 ml 含Ad-GFPHGF 的α-MEM 培養基,置于二氧化碳培養箱內,24 h后,更換培養基。48 h 后,熒光顯微鏡下觀察綠色熒光蛋白表達并計算細胞轉染率;術前4 h 配置纖維蛋白膠。
1.3.3 ACL 重建A 組兔麻醉后,取跟腱為移植腱,長4 cm,直徑2 mm[11]。顯露膝關節,切斷ACL,使用直徑2 mm 克氏針鉆取股骨、脛骨隧道。移植腱經脛、股骨隧道穿過,股骨外側皮質鉆孔,將韌帶經骨孔縫合在股骨隧道外口皮質處;屈膝30°,收緊脛骨隧道內移植腱,同法固定脛骨止點,屈伸膝關節,ACL 牢靠,造模成功[12-13],逐層縫合(圖1A)。B 組ACL 重建后取0.2 ml MSCs 懸液,細胞濃度5×109/L,與2 ml 纖維蛋白膠混合,注射至脛骨骨道內。C 組ACL 重建后取0.2 ml HGF 基因轉染MSCs 懸液,細胞濃度為5×109/L,與2 ml 纖維蛋白膠混合,注射至脛骨骨道內。
1.3.4 腱骨組織學觀察和關節液抽取 術后6 周處死實驗兔(圖1B),1 ml 注射器(含1 ml 注射用水)刺入關節腔,反復抽注,吸取關節液。取左側腱骨組織行HE 染色。
1.3.5 力學檢測 右膝保留脛、股骨各4 cm 結構,為防止移植腱在實驗時從股骨骨道內脫出,先使用牙托粉填塞股骨骨道,隨后包埋兩端骨質,剔除多余組織,獲得股骨-移植腱-脛骨標本,進行拉力實驗(圖1C)。

圖1 兔ACL 重建及力學實驗
1.3.6 RT-PCR 檢測 拉力實驗后取脛骨骨道內骨組織3 mm3,RT-PCR 檢測成纖維細胞生長因子2(fibroblast growth factor 2,FGF2)、SMAD4 mRNA 及關節液HGF mRNA 的表達。PCR 反應體系:2×SYBR Green Select Mix 5 μl,正向引物0.7 μl,反向引物0.7 μl,ROX 0.05 μl,cDNA 1 μl,RNase-free Water 10 μl。反應條件:94℃×5 min,56℃×40 s,72℃×30 s,40 個循環,結束后,取反應液5 μl 進行電泳,確認產物。β-actin為對照,采用2-△△Ct法計算目的基因相對表達量。相關引物序列見表1。

表1 引物列表
1.4 統計學方法
采用SPSS 25.0 軟件進行數據分析。計量資料用均數±標準差()表示,比較采用t 檢驗;計數資料用例數或百分率表示。以P<0.05 為差異有統計學意義。
2 結果
2.1 組織學觀察結果
術后6 周,A 組腱骨分界連接疏松,膠原纖維排列紊亂(圖2D);B 組腱骨界面連接較緊密,間隙小,但膠原纖維排列仍不整齊(圖2E);C 組腱骨界面連接緊密,無明顯間隙,膠原纖維排列較整齊(圖2F)。
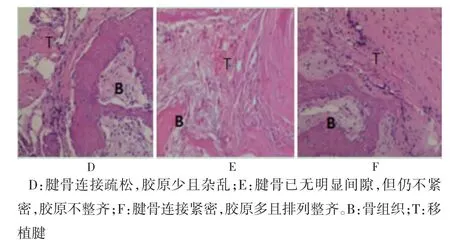
圖2 腱骨愈合組織學(HE 染色,100×)
2.2 各組術后6 周各組拉力測試結果比較
術后6 周,B 組最大拉力載荷高于A 組,且C 組高于B 組,差異有統計學意義(P<0.05);A、B 組及B、C 組最大拉伸距離比較,差異無統計學意義(P>0.05)。見表2。
表2 各組術后6 周各組拉力測試結果比較()
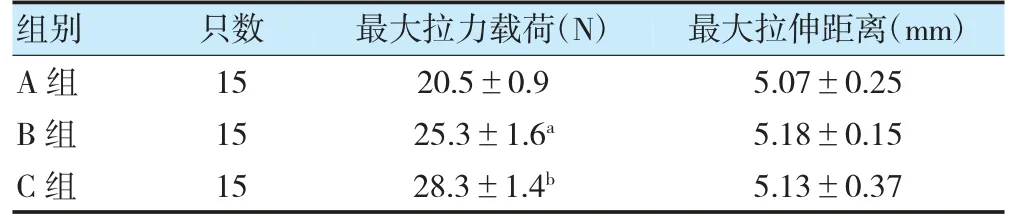
表2 各組術后6 周各組拉力測試結果比較()
注 與A 組比較,aP<0.05;與B 組比較,bP<0.05
2.3 各組骨道內FGF2 mRNA、SMAD4 mRNA 及關節液HGF mRNA 比較
B 組骨道內FGF2 mRNA、SMAD4 mRNA 大于A組,且C 組大于B 組,差異有統計學意義(P<0.05);C 組關節液HGF mRNA 大于B 組,差異有統計學意義(P<0.05)。見表3、圖3。
表3 各組骨道內FGF2、SMAD4 mRNA 及關節液HGF mRNA比較()
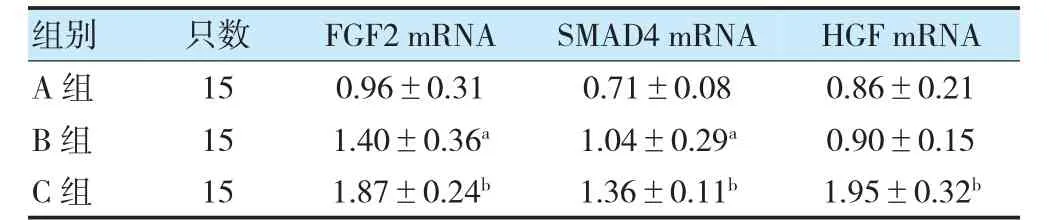
表3 各組骨道內FGF2、SMAD4 mRNA 及關節液HGF mRNA比較()
注 與A 組比較,aP<0.05;與B 組比較,bP<0.05。FGF2:成纖維細胞生長因子2;HGF:肝細胞生長因子
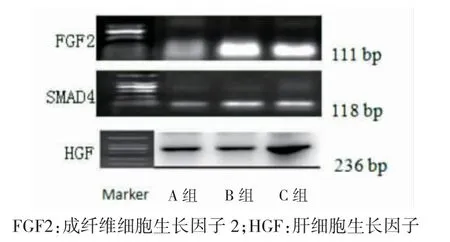
圖3 mRNA 電泳圖
3 討論
ACL 術后腱骨愈合需多種細胞及因子的參與[14]。HGF 具有促進血管增生,減少細胞凋亡,加速細胞增殖等作用[15-16]。研究顯示,HGF 能夠促進腱骨愈合[17],然而單純應用HGF 降解速度快,難以持續發揮作用,本研究將HGF 轉入MSCs 中,達到了長期發揮作用的目的。
組織學觀察、力學實驗是測試腱骨愈合的傳統方法[18]。本研究結果顯示,C 組腱骨連接緊密,膠原纖維排列規整,最大拉力載荷高于B 組,提示局部應用HGF 轉染MSCs 能夠促進ACL 腱骨愈合。
FGF2 具有促進成纖維細胞增殖、分化,增加Ⅰ、Ⅲ型膠原等功能[19]。局部使用FGF2 能夠促進成骨細胞、腱原母細胞增生,加速腱骨愈合[20-22]。SMAD4 以三聚體的形式在BMP、TGF-β 信號通路中發揮骨代謝作用[23],增加SMAD4 的表達,可以促進骨形成,反之則造成骨流失[24-25]。本研究結果顯示,C 組FGF2 mRNA、SMAD4 mRNA 大于B 組,提示局部注射HGF 轉染MSCs 可能通過提高細胞因子及激活BMP、TGF-β信號通路來促進腱骨愈合。
綜上所述,局部注射HGF 轉染MSCs 能夠促進腱骨愈合,其機制可能是通過提高細胞因子及激活經典骨代謝信號通路來實現的。

