膿毒癥并發急性呼吸窘迫綜合征患者血清血管內皮鈣黏蛋白、血管生成素2表達及與預后相關性研究
張 瑜,王 娟
(1.西安市人民醫院 西安市第四醫院生殖醫學科,陜西 西安 710004;2.西安市兒童醫院檢驗科,陜西 西安 710003)
呼吸窘迫綜合征主要指因膿毒癥、有害氣體吸入、重癥胰腺炎等非心源性致病因素導致的呼吸窘迫,對肺臟產生嚴重影響[1]。研究[2]發現,膿毒癥并發呼吸窘迫綜合征臨床病死率約為40%,威脅患者的生命安全。急性生理和慢性健康狀況評分Ⅱ(Acute Physiology and Chronic Health Evaluation,APACHEⅡ)是目前臨床上對膿毒癥并發急性呼吸窘迫綜合征病情嚴重程度與預后判斷的常用指標,但是由于該評分系統的局限性,其臨床應用受到限制[3-4]。隨著臨床醫學發展,越來越多的學者開始針對血清指標展開研究,意在尋找更加方便、快捷的膿毒癥并發急性呼吸窘迫綜合征預后評價指標。有研究[5]發現,血清血管內皮鈣黏蛋白(Vascular endothelial cadherin,VE-Cad)、血管生成素2(Angiopoietin,Ang-2)表達水平與膿毒癥的發生發展具有一定相關性,但是否能夠預測膿毒癥并發急性呼吸窘迫綜合征患者的預后情況尚無明確定論。因此,本研究選取2019年3月至2020年12月收治的85例膿毒癥并發急性呼吸窘迫綜合征患者作為研究對象,探討膿毒癥并發急性呼吸窘迫綜合征患者血清VE-Cad、Ang-2表達情況及與預后的相關性,現報告如下。
1 資料與方法
1.1 一般資料 選取2019年3月至2020年12月收治的85例膿毒癥并發急性呼吸窘迫綜合征患者作為研究對象。病例納入標準:所有患者均符合《2012年國際嚴重膿毒癥及膿毒癥休克診療指南》[6]中關于膿毒癥的診斷標準,且確診為急性呼吸窘迫綜合征;對本研究知情并簽署同意書。排除標準:入組前未經過相關治療;合并自身免疫性疾病或腫瘤者;合并肝腎功能不全者;合并急性冠脈綜合征者。85例患者中男46例,女39例。年齡51~83歲,平均(68.25±3.62)歲;感染部位:尿路感染12例,血流感染8例,腹腔感染14例,肺感染48例,其他感染3例。
1.2 研究方法 ①將動脈血氧分壓(PaO2)/吸入氧濃度(FiO2)<100 mmHg的39例患者分為重度組,將100~200 mmHg的26例患者分為中度組,將200~300 mmHg的20例患者分為輕度組。收集所有患者性別、年齡、原發疾病、序貫器官功能衰竭(Sequential organ failure assessment,SOFA)、肺損傷(Lung injury score,LIS)、APACHEⅡ評分以及血清VE-Cad、Ang-2表達水平。②收集所有膿毒癥并發疾病呼吸衰竭綜合征死亡和存活患者的性別、年齡、感染部位、病原學、SOFA、LIS、APACHEⅡ、PaO2/FiO2、血清白蛋白(ALB)、ICU住院時間、機械通氣時間、VE-Cad、Ang-2表達情況。③血清VE-Cad、Ang-2檢測:抽取患者5 ml清晨空腹靜脈血,應用3000 r/min的速度離心10 min,取上層清液,應用酶聯免疫吸附法進行檢測,檢測流程嚴格依照試劑盒說明進行,試劑盒購自上海宇淳生物科技有限公司。
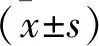
2 結 果
2.1 三組患者SOFA、LIS、APACHEⅡ評分對比 三組患者SOFA、LIS、APACHEⅡ評分對比差異有統計學意義(均P<0.05),重度組明顯高于中度組與輕度組(均P<0.05),見表1。
2.2 三組患者血清VE-Cad、Ang-2水平對比 三組血清VE-Cad、Ang-2水平對比差異有統計學意義(均P<0.05),重度組明顯高于中度組與輕度組(均P<0.05),見表2。

表2 三組患者血清VE-Cad、Ang-2水平對比
2.3 死亡組與存活組臨床相關資料對比 死亡組與存活組患者性別、年齡、感染部位、病原學、ICU住院時間對比無統計學差異(均P>0.05),死亡組與存活組患者SOFA、LIS、APACHEⅡ評分、PaO2/FiO2、ALB、機械通氣時間、VE-Cad、Ang-2水平對比差異有統計學意義(均P<0.05),見表3。
2.4 膿毒癥并發急性呼吸窘迫綜合征預后Logistic回歸分析 對上述單因素分析中具有統計學差異的指標進行賦值:SOFA評分≥21.47分為1,<21.47分為0;LIS評分≥2.26分為1,<2.26分為0;APACHEⅡ評分≥25.25分為1,<25.25分為0;PaO2/FiO2≥231.26 mmHg為0,<231.26 mmHg為1;ALB≥24.85 g/L為0,<24.85 g/L為1;機械通氣時間≥63.58 d為1,<63.58 d為0;VE-Cad≥3.82 μg/L為1,<3.82 μg/L為0;Ang-2≥5.36 ng/L為1,<5.36 ng/L為0。Logistic回歸分析結果表明:APACHEⅡ評分升高、PaO2/FiO2降低、VE-Cad升高為膿毒癥并發急性呼吸窘迫綜合征預后獨立影響因素(P<0.05),見表4。
2.5 VE-Cad、Ang-2對膿毒癥并發急性呼吸窘迫綜合征預后診斷價值分析 通過ROC曲線分析結果顯示:VE-Cad、Ang-2兩者聯合的特異度與敏感度明顯優于單一VE-Cad、Ang-2檢驗(P<0.05),見圖1。

圖1 膿毒癥并發急性呼吸窘迫綜合征預后診斷ROC曲線
3 討 論
研究[7-8]發現,膿毒癥發生后,大量中性粒細胞過度激活,對肺泡毛細血管屏障產生破壞,液體在肺泡腔滲漏,發生肺水腫。然而呼吸道是膿毒癥常見的一種感染源,膿毒癥患者的炎癥因子也會最先攻擊肺部,導致急性肺損傷發生率升高,逐漸進展為急性呼吸窘迫綜合征[9]。血管內皮細胞是肺損傷反應最快的一種,在膿毒癥合并呼吸窘迫綜合征發病過程中肺泡表面與肺血管內皮細胞產生重要作用[10]。Ang-2屬于血管形成因子的一種,由內皮細胞合成,與肺血管神經性水腫具有密切關系[11]。VE-Cad由多個含硫氨基酸組成,對于局部纖維蛋白酶末端磷酸化過程具有重要作用。細胞粘附連接能夠維持內皮屏障完整性,其中維持內皮細胞重要結構的是連環蛋白與VE-Cad組成的復合體[12]。
本研究結果表明,三組患者SOFA、LIS、APACHEⅡ評分與血清VE-Cad、Ang-2水平對比差異顯著,重度組明顯高于中度組與輕度組,由此證明,SOFA、LIS、APACHEⅡ評分與血清VE-Cad、Ang-2水平均與膿毒癥并發急性呼吸窘迫綜合征具有一定關系。這是因為重度組患者肺血管內皮損傷更嚴重,富含白蛋白液體滲漏到組織間隙,導致血清白蛋白水平降低。而且肺泡中出現過多液體,影響彌散功能,增加患者肺部損傷與疾病嚴重程度[13-14]。另外有研究[15]發現,VE-Cad可通過調節膿毒癥的心臟微血管內皮細胞Src/VE-cadherin通路的VE-Cad蛋白表達,進而調節細胞通透性,與本研究結果相符。另外,不同患者Ang-2水平產生的差異,可能是因為靜息狀態下患者Ang-2水平較低,而一旦受到刺激會對內皮細胞產生激活作用,導致Ang-2水平升高,所以也可以說明Ang-2與內皮功能失調和激活具有一定關系[16-17];死亡組與存活組患者性別、年齡、感染部位、病原學、ICU住院時間對比無統計學差異,死亡組與存活組患者SOFA、LIS、APACHEⅡ評分、PaO2/FiO2、ALB、機械通氣時間、VE-Cad、Ang-2水平對比有統計學差異,Logistic回歸分析結果表明:APACHEⅡ評分升高、PaO2/FiO2降低、VE-Cad升高為膿毒癥并發急性呼吸窘迫綜合征預后獨立影響因素。這說明雖然死亡組患者: VE-Cad、Ang-2水平升高,但僅有APACHEⅡ、PaO2/FiO2、VE-Cad為膿毒癥并發急性呼吸窘迫綜合征預后獨立影響因素。有研究[18]發現,膿毒癥并發急性呼吸窘迫綜合征患者炎癥指標表達水平與預后明顯相關。而在炎癥反應過程中,IL-6、TNF-α會誘導VE-Cad胞內區尾部與連環蛋白磷酸化,導致其聚集,細胞結節找到破壞,形成縫隙,破壞血管通透性。有研究[19]發現,肺血管內皮損傷越嚴重,肺泡內氣體越多,導致患者氧合指數降低,血管屏障損傷加重,增加患者死亡率,與本研究結果相符;通過ROC曲線分析結果顯示:VE-Cad、Ang-2兩者聯合的特異度與敏感度明顯優于單一VE-Cad、Ang-2檢驗,由此證明,對膿毒癥并發急性呼吸窘迫綜合征患者加強VE-Cad、Ang-2聯合檢測,能夠提升患者診斷效能,改善患者預后情況。齊穎等[20]在體外研究實驗中,建立適合膿毒癥肺損傷動物模型,通過觀察VE-Cad、Ang-2水平變化,能夠及時了解動物模型預后情況,與本研究結果相符。
綜上所述,膿毒癥并發急性呼吸窘迫綜合征患者血清VE-Cad、Ang-2與SOFA、LIS、APACHEⅡ評分相同,均隨患者病情嚴重程度而升高,血清VE-Cad水平對于膿毒癥并發急性呼吸窘迫綜合征預后具有獨立預測價值,VE-Cad、Ang-2聯合能夠提升患者預后診斷價值。

