基于高通量測序的不同生態環境東方澤瀉塊莖轉錄組分析△
韋陳彬,谷巍,2*,田榮,邱蓉麗,韓赟,李桃,季媛媛,朱瑜
1.南京中醫藥大學 藥學院,江蘇 南京 210023;
2.南京中醫藥大學 江蘇省中藥資源產業化過程協同創新中心,江蘇 南京 210023;
3.南京中醫藥大學 附屬蘇州市中醫醫院,江蘇 蘇州 215009
建澤瀉為植物東方澤瀉Alisma orientale(Sam.)Juzep.的干燥塊莖,始載于《神農本草經》,具有利水滲濕、瀉熱、化濁調脂的功效。其主要功效物質為原萜烷型三萜類化合物,該類成分具有利尿、降血糖、調血脂、降血壓、抗癌等作用[1]。福建的建澤瀉是公認的道地藥材,但由于建澤瀉生長周期長、生產成本高等原因,目前市場上超過90%的澤瀉為來自四川的川澤瀉。
轉錄組測序技術是功能基因組研究的一種重要手段,其能快速、準確地獲取大量特定細胞或組織中表達的基因序列,可在無參考基因組的情況下,直接對藥用植物進行轉錄組分析。轉錄組測序分析可為研究藥用植物的基因功能和次生代謝產物代謝途徑積累基礎,在三七、川續斷等藥用植物研究中均有應用。徐若等[2]使用轉錄組測序分析了三七應對干旱脅迫時差異基因的變化。朱春艷等[3]通過轉錄組技術對川續斷三萜皂苷生物合成路徑上的關鍵酶進行挖掘。
現階段建澤瀉產量下降趨勢短時間內難以逆轉,為延續建澤瀉道地藥材的優良種質,本研究將東方澤瀉同時種植于福建和四川,基于轉錄組學技術對兩地東方澤瀉的塊莖進行測序,從中挖掘差異表達基因,探討不同生態環境對東方澤瀉三萜生物合成的影響。
1 材料
1.1 試藥
選用本課題組前期基于內轉錄間隔區2(ⅠTS2)條形碼鑒別的種植于福建建甌的東方澤瀉作為實驗材料[4],經育苗過程后于2020年9月同時移栽至福建省吉陽鎮玉溪村(N27°8′21″,E118°8′27″)和四川省謝家鎮吳堰村(N30°13′20″,E103°47′13″)繼續種植,并于2020年12月澤瀉藥材采收期收集兩地東方澤瀉塊莖樣品,每組樣品設置3 個生物學重復,樣品暫存于干冰中,收集完成后轉移至-80 ℃冰箱保存,以備后續分析。樣品經南京中醫藥大學谷巍教授鑒定均為東方澤瀉Alisma orientale(Sam.)Juzep.的干燥塊莖。
OmniPlant RNA 提取試劑盒(北京康為世紀生物科技有限公司);RNA 6000 Nano kit(美國Agilent公司)。
1.2 儀器
Novaseq 6000型測序平臺(美國Ⅰllumina公司);NanoDrop 2000 型超微量紫外-可見分光光度計、2100 Nano 型生物分析儀(美國Agilent 公司);GeneAmp 9700 型聚合酶鏈式反應(PCR)儀(美國ABⅠ公司)。
2 方法
2.1 總RNA提取及cDNA文庫構建
使用OmniPlant RNA 提取試劑盒提取東方澤瀉塊莖中總RNA;NanoDrop 2000 型超微量紫外分光光度計檢測總RNA 濃度和純度;瓊脂糖凝膠電泳檢測總RNA的完整性;Agilent 2100 Nano和RNA 6000 Nano kit 檢測總RNA 的RNA 完整值(RⅠN)。使用Oligo(dT)磁珠分離mRNA,再將其斷裂為300 bp左右的短片段,以其為模板合成cDNA第1鏈,置換合成法獲得雙鏈cDNA,對純化后雙鏈cDNA 進行PCR擴增,構建測序文庫。
2.2 測序數據質控和組裝
采用Ⅰllumina測序平臺對構建的cDNA 文庫進行高通量測序,測序由上海美吉生物醫藥科技有限公司完成。使用Fastp 0.19.5軟件對原始數據進行質量控制以獲得高質量的clean reads。使用Trinity v2.8.5軟件對所有clean reads 進行從頭組裝,組裝完成后使用TransRate v1.0.3軟件對拼接結果進行評估,對從頭組裝的序列進行過濾和優化,最后使用CD-HⅠT v4.5.7軟件去除冗余基因,獲得非冗余基因集。
2.3 基因功能注釋及差異基因篩選
使用Blast 2.9.0軟件將unigenes與6個數據庫進行基因功能注釋:Pfam(http://pfam.xfam.org/)、SwissProt(http://web.expasy.org/docs/swiss-prot_guideline.html)、京都基因與基因組百科全書(KEGG,http://www.genome.jp/kegg/)、COG(http://www.ncbi.nlm.nih.gov/COG/)和基因本體(GO,http://www.geneontology.org)。轉錄因子信息通過與Plant TFDB(http://planttfdb.cbi.pku.edu.cn/)進行比對,得到同源的轉錄因子信息。以TPM(transcripts per million reads)作為基因表達量定量指標,采用Benjamini-Hochberg 校正方法對假設檢驗得到的顯著性P值進行校正,并以|log2FC|>0.58(FC 為差異倍數)、P<0.05 為閾值篩選不同生態環境下東方澤瀉的差異表達基因(different expressed genes,DEGs),并對DEGs 進行GO 和KEGG 富集分析。
3 結果
3.1 轉錄組測序結果
采用Ⅰllumina RNA-seq 技術進行轉錄組測序。在去除低質量的序列后,從6 個樣品中共獲得超過3.47 億條clean reads。其錯誤率<0.024 0%、質量值>30 的堿基占比(Q30)高達95%(表1)。結果表明高通量測序數據質量高,可以進行下一步分析。

表1 東方澤瀉轉錄組測序結果
3.2 轉錄組功能注釋及差異基因篩選
使用Trinity v2.8.5 軟件對所有有效序列進行從頭組裝后獲得了50 652 條unigenes,其中22 689 條unigenes 被注釋到6 個功能數據庫中,占總數的44.79%,其中在NR 數據庫中注釋到22 347 條、SwissProt數據庫中注釋到15 399 條、Pfam 數據庫中注釋到16 365 條、COG 數據庫注釋到18 924 條、GO 數據庫注釋到19 017 條、KEGG 數據庫注釋到8770 條,得到東方澤瀉轉錄組中的基因功能、代謝通路等數據。以|log2FC|>0.58、P<0.05為篩選條件,篩選不同生態環境下東方澤瀉中的DEGs。結果顯示福建東方澤瀉較四川東方澤瀉存在3878 條DEGs,其中2082 條表達上調、1796 條表達下調,得到的DEGs數量較多,說明不同生長環境對東方澤瀉基因表達影響較大。
3.3 差異基因的GO富集分析
對不同生態環境東方澤瀉的DEGs 進行GO 富集分析,并顯示富集程度最高的前20 條GO 條目(圖1),包括多糖代謝過程、細胞外區、細胞壁組織或生物發生、外部封裝結構組織、細胞壁組織、化學穩態。此外還富集到大量與植物內穩態及多糖代謝相關的條目。結果表明,東方澤瀉移栽至四川后能夠通過調控體內穩態基因的表達提高其適應新環境的能力;此外生態環境變化還改變了東方澤瀉體內代謝過程,這同樣是東方澤瀉適應新環境的體現。

圖1 不同生態環境下東方澤瀉DEGs的GO富集分析
3.4 差異基因的KEGG富集分析
對DEGs 進行KEGG 富集分析,結果顯示,DEGs 共注釋到126 條KEGG 通路,其中顯著富集的主要為植物激素信號轉導、淀粉和蔗糖代謝、苯丙素生物合成、氰基氨基酸代謝、植物-病原體相互作用、牛磺酸和亞牛磺酸代謝等通路。另外富集到萜類生物合成相關的KEGG 通路,包括萜類骨架生物合成、倍半萜和三萜生物合成、單萜生物合成和二萜生物合成。KEGG 富集分析結果表明,東方澤瀉移栽至四川后其次生代謝過程發生明顯變化,包括三萜類成分的生物合成過程,這一變化可能會造成澤瀉藥材的質量變化(圖2)。

圖2 不同生態環境下東方澤瀉DEGs的KEGG富集分析
3.5 參與植物生理活動的DEGs分析
對DEGs 在植物生理活動中的表達情況進行分析,以探索東方澤瀉在不同生態環境下生理活動的變化,DEGs 功能主要集中在防御反應、光合作用、碳水化合物代謝和糖酵解等方面(表2)。
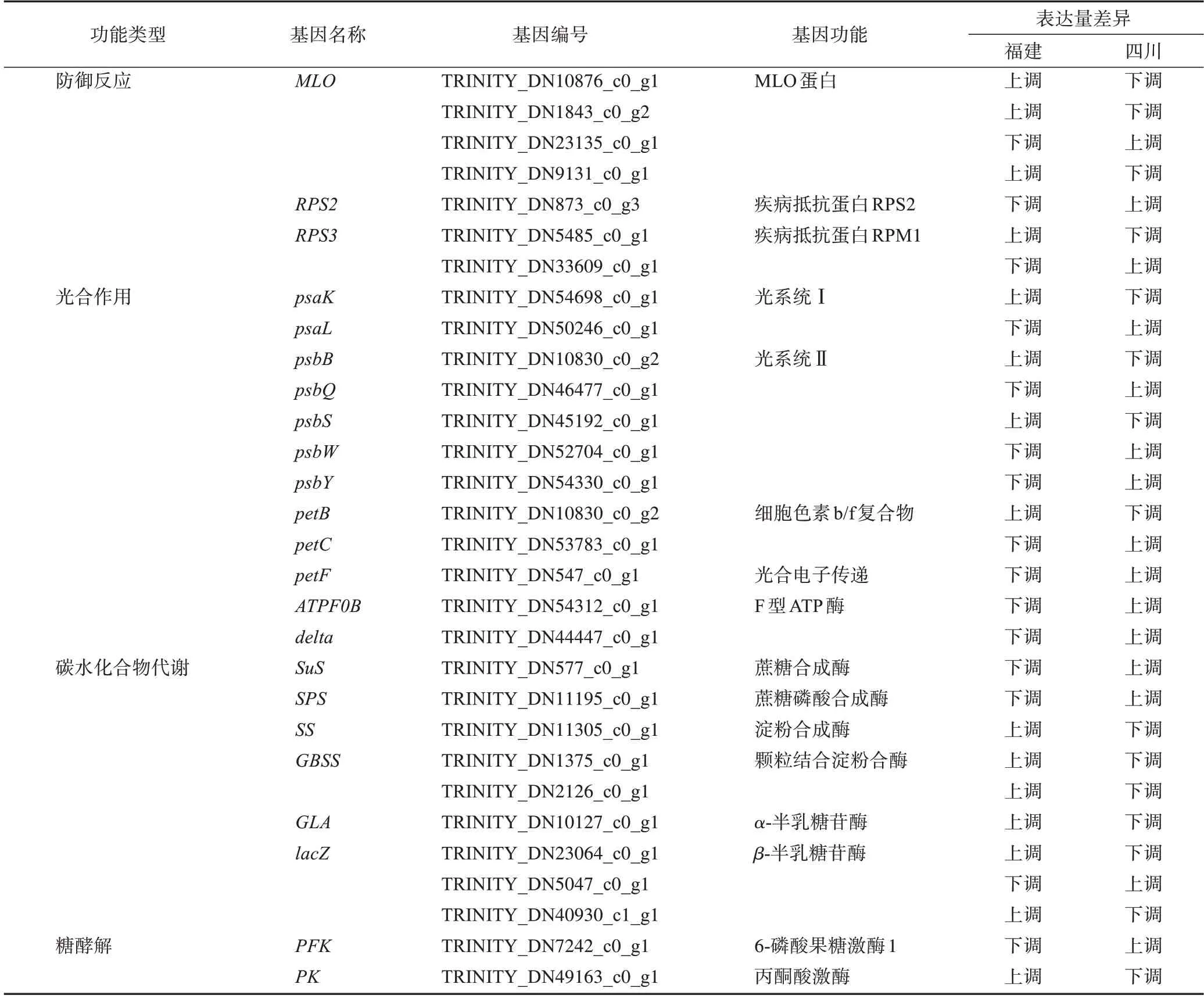
表2 福建和四川東方澤瀉中差異關鍵基因的名稱、功能及表達情況
植物防御反應是指植物抵御外部侵染、機械損傷等細胞生理反應,能夠減少外界環境、病原物等對植物組織的危害,保證植物體的生長發育,有利于次生代謝產物積累[5]。本研究對不同生態環境下東方澤瀉參與防御反應的DEGs 進行分析,結果顯示有28 條與防御反應相關的基因表達差異有統計學意義,其中在福建東方澤瀉中上調的有21 條,下調的有7 條,主要是參與植物生物和非生物脅迫的MLO基因和參與植物-病原體相互作用過程的RPS基因。參與植物防御反應過程的基因在植物生長發育過程中發揮了重要作用,環境變化之后防御反應相關基因下調明顯,這可能會影響東方澤瀉的生長發育。
藥用植物通過光合作用能夠獲得維持植物生長必需的初生代謝產物和主要活性成分來源的次生代謝產物,因此光合作用與藥用植物質量形成密切相關[6]。本研究對不同生態環境下與東方澤瀉光合作用相關的DEGs 進行分析,結果顯示有12 條與光合作用相關基因在福建和四川東方澤瀉中的表達存在差異,其中3條在福建東方澤瀉中上調表達,9條下調表達。說明生態環境變化影響了東方澤瀉中與光合作用相關的關鍵酶基因表達,影響了東方澤瀉的光合效率。
碳水化合物不僅是植物生長發育過程中重要的能源提供者,而且還為次生代謝產物的生物合成提供碳骨架并具有重要的調節作用[7]。有研究表明,碳水化合物含量對塊莖發育具有重要的影響,淀粉是植物體中碳水化合物的主要儲存形式[8]。本研究中,在蔗糖和淀粉代謝途徑中共發現38 條DEGs,福建東方澤瀉中上調的有25條,下調的有13條。其中淀粉通路上的關鍵酶淀粉合成酶和顆粒結合淀粉合酶(granule-bound starch synthase,GBSS)基因在福建東方澤瀉中高表達,而蔗糖代謝過程中的關鍵酶蔗糖合成酶(starch synthase,SuS)和蔗糖磷酸合成酶(sucrose phosphate synthase,SPS)基因在四川東方澤瀉中高表達。此外,參與碳水化合物代謝的α-半乳糖苷酶(α-galactosidase,α-GAL)和β-半乳糖苷酶(β-galactosidase,β-GAL)基因均在福建東方澤瀉中高表達。淀粉是東方澤瀉塊莖中的主要組成,能夠為其次生代謝提供能量和碳骨架,以上結果說明東方澤瀉移栽四川可能不利于其淀粉合成,影響澤瀉藥材的質量。
在植物體內,葡萄糖的糖酵解反應能夠產生乙酰輔酶A(acetyl coenzyme A,Acetyl-CoA),Acetyl-CoA是三萜類成分生物合成的重要前體,對次生代謝產物的合成效率存在重要影響[9]。2 組東方澤瀉在糖酵解途徑上共存在20 個DEGs,其中12 個在福建東方澤瀉中上調表達,8 個下調表達。參與糖酵解過程的關鍵酶磷酸果糖激酶(phosphofructokinase,PFK)基因在四川東方澤瀉中高表達,丙酮酸激酶(pyruvate kinase,PK)基因在福建東方澤瀉中高表達。結果表明,移栽到四川對東方澤瀉的糖酵解過程存在一定的影響,可能會影響東方澤瀉次生代謝過程。
3.6 差異表達轉錄因子分析
2 組東方澤瀉共注釋到568 條轉錄因子,其中163 個轉錄因子表達差異有統計學意義,在福建東方澤瀉中上調表達的有67 個,下調表達的有96 個。差異轉錄因子被歸類為24 個轉錄因子家族,2 種生態環境下差異表達的轉錄因子主要集中在AP2/ERF、MYB_superfamily、NAC、WRKY、C2C2 和bHLH家族(圖3)。植物體內,調控三萜類成分生物合成的轉錄因子家族主要包括bHLH、MYB_superfamily、AP2/ERF 和WRKY 4 類[10],占差異轉錄因子總數的50.9%。福建東方澤瀉在AP2/ERF 家族上調表達20個,下調表達13 個;bHLH 家族上調表達4 個,下調表達6個;MYB家族上調表達15個,下調表達13個;WRKY家族上調表達5個,下調表達7個(圖4),說明改變東方澤瀉生長環境會造成與三萜生物合成相關轉錄因子的差異表達,影響原萜烷型三萜生物合成,造成兩地東方澤瀉原萜烷型三萜含量差異。
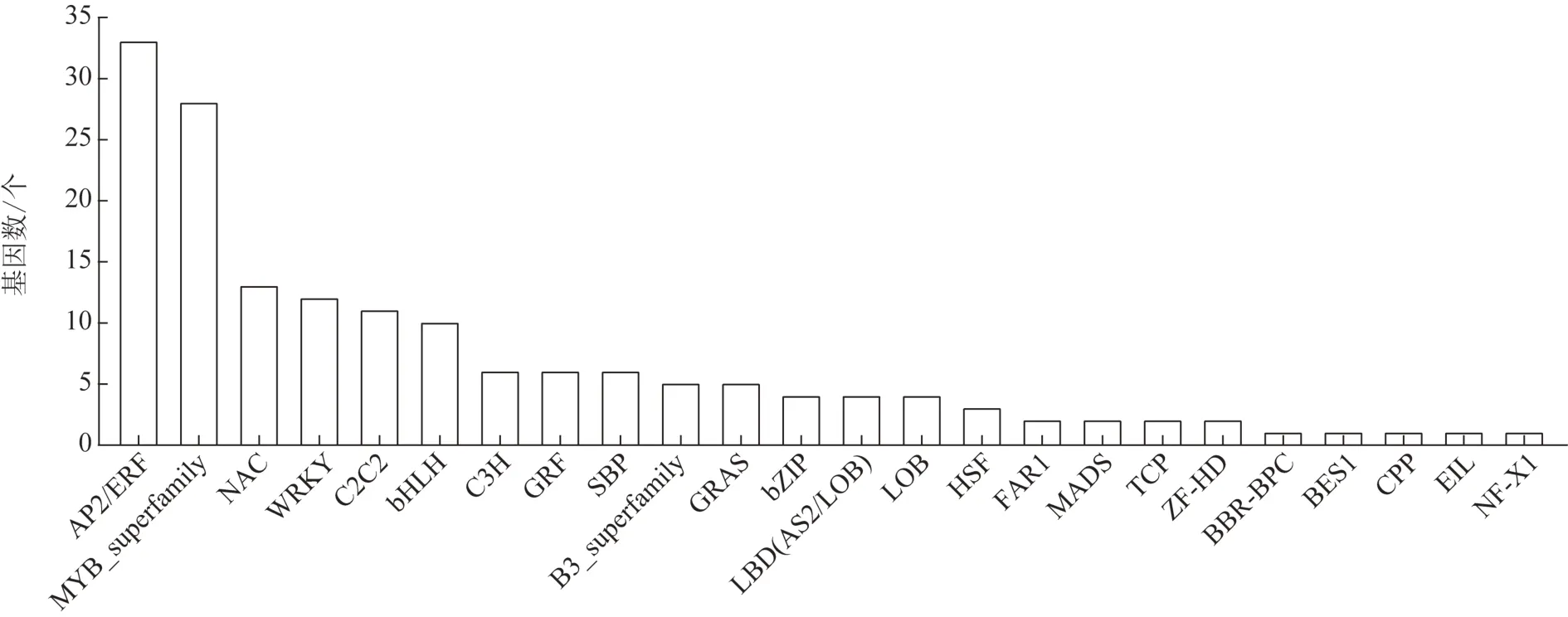
圖3 不同生態環境下東方澤瀉差異表達轉錄因子數量
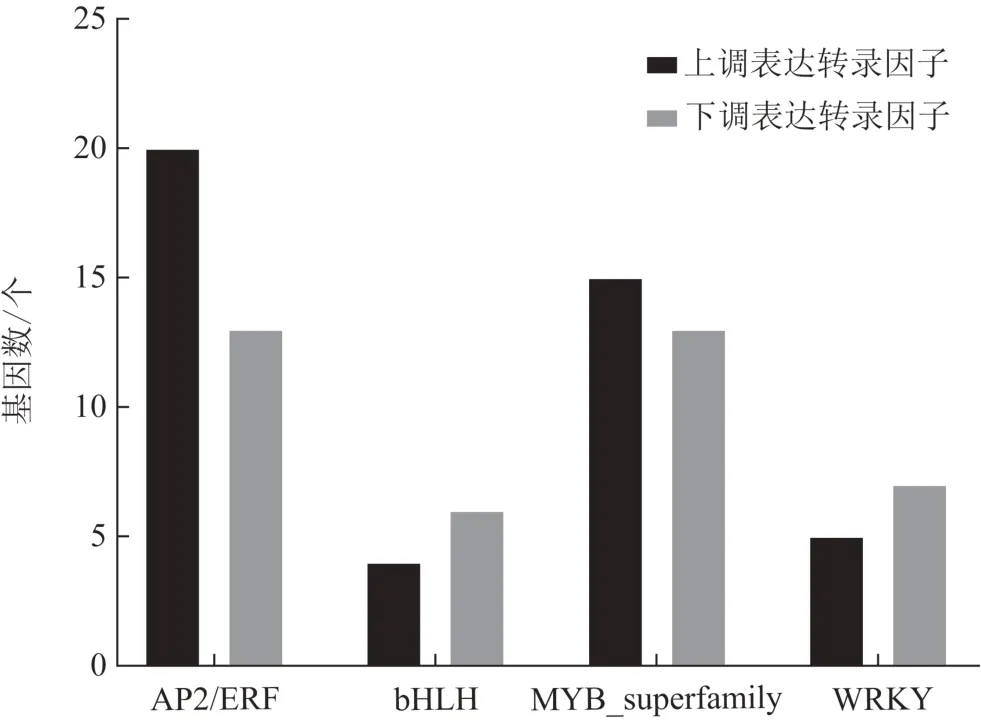
圖4 三萜類生物合成相關轉錄因子家族在福建東方澤瀉中差異表達情況
3.7 參與三萜生物合成DEGs分析
東方澤瀉的藥效成分為原萜烷型三萜類成分,主要通過細胞質中的甲羥戊酸(mevalonate,MVA)途徑合成[11]。福建和四川東方澤瀉轉錄組中存在19個與萜類生物合成相關DEGs,其中包括5 個與原萜烷型三萜生物合成相關的關鍵酶基因(圖5)。其中,羥甲基戊二酰CoA 合酶(hydroxymethylglutaryl-CoA synthase,HMGS)、甲羥戊酸激酶(mevalonate kinase,MK)、甲羥戊酸焦磷酸脫羧酶(mevalonate pyrophosphate decarboxylase,MPD)等位于MVA 途徑上的基因表達量在福建東方澤瀉中顯著高于四川東方澤瀉,而位于2-C-甲基-4-磷酸-D-赤蘚糖醇(2-C-methyl-Derythrito-4-phosphate,MEP)途徑的1-羥基-2-甲基-2-(E)-丁烯基-4-焦磷酸合酶 [1-hydroxy-2-methyl-2-(E)-butenyl 4-diphosphate synthase,HDS] 基因表達量在四川東方澤瀉中顯著高于福建東方澤瀉,鯊烯合酶(squalene synthetase,SS)基因表達量同樣在四川東方澤瀉中高于福建東方澤瀉。表明不同生態環境下東方澤瀉原萜烷型三萜生物合成通路上關鍵酶基因的表達存在差異造成兩地東方澤瀉中原萜烷型三萜含量的變化。目前,已經在多種植物中成功鑒定了細胞色素P450(CYP450)酶基因,其中CYP51、CYP71、CYP72 和CYP85 家族基因參與三萜生物合成[12],本研究中鑒定得到6個注釋到CYP71和CYP85 家族的DEGs,均在四川東方澤瀉中上調表達,該特征可能會導致2 組東方澤瀉三萜組成差異形成。
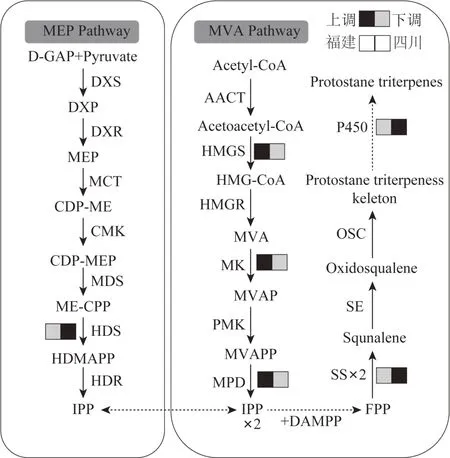
圖5 不同生態環境下東方澤瀉原萜烷型三萜生物合成關鍵酶基因差異表達情況
4 討論
植物所處生態環境改變時,植物內穩態能夠提高植物對外界環境的適應能力,這一過程常涉及到植物形態和生理的變化[13],能夠直接或間接影響藥用植物活性成分生物合成和藥材質量。本研究開展了不同生態環境下東方澤瀉的轉錄組測序,從分子層面探討生態環境對東方澤瀉生理活動及藥效成分積累的影響。
不同生態環境下東方澤瀉在防御反應、淀粉和蔗糖代謝、糖酵解/糖異生和光合作用等生理活動相關通路上存在差異表達。東方澤瀉移栽至四川后參與防御反應的基因表達明顯下調,說明東方澤瀉在四川種植的生長過程中,對于外界環境的防御能力下降,影響了其自身的生長。淀粉能夠為次生代謝產物合成和積累提供更多的底物,促進植物的次生代謝產物積累[7]。東方澤瀉塊莖中含有豐富的淀粉,質量分數約為25%,在福建生長的東方澤瀉中與淀粉合成相關的關鍵酶基因表達上調,說明東方澤瀉在原產地生長更有利于淀粉的生物合成與積累,有益于次生代謝產物的積累。此外,在福建東方澤瀉中上調表達的α-半乳糖苷酶也在碳水化合物代謝的生理調節過程中發揮重要作用[14]。糖酵解途徑相關基因上調能夠為次生代謝產物的合成提供中間產物,還能為植物次生代謝提供能量,從而影響到植物的次生代謝[9]。這2 條途徑上關鍵酶基因的差異表達可能會影響三萜的合成與積累,造成兩地東方澤瀉原萜烷型三萜的含量差異。
轉錄因子是介導外界環境因素信號轉導與藥用植物次生代謝的一類調控因子[15]。東方澤瀉移栽至四川后轉錄因子表達發生顯著改變,尤其是被證明能夠調控三萜生物合成的轉錄因子家族基因,其數量在差異轉錄因子中占半數以上。鑒定到的差異表達轉錄因子主要屬于AP2/ERF 和MYB 家族,占差異轉錄因子總數的37.4%。轉錄因子的活性將影響關鍵酶的表達,從而調控藥用植物中藥效成分的積累。有研究表明,AP2/ERF 轉錄因子家族中的AaERF1、AaERF2 和AaTAR1 能夠參與調控青蒿中青蒿素的合成[16];丹參SmMYB9b 轉錄因子通過促進SmDXS2、SmDXR、SmGGPPS 和SmKSL1 的表達從而提高丹參酮的含量[17]。在本研究中,不同生態型東方澤瀉中bHLH、MYB_superfamily、AP2/ERF 和WRKY 等轉錄因子的表達存在明顯差異,表明其在不同生態環境作用下參與調控東方澤瀉的生理活動和藥效成分積累。
MVA 途徑和MEP 途徑合成的焦磷酸異戊烯酯(isopentenyl diphosphate,ⅠPP)和焦磷酸二甲基烯丙酯(dimethylallyl diphosphate,DMAPP)能夠通過質體膜互相交換以此調節萜類化合物的合成,因此MVA 途徑、MEP 途徑和下游三萜生物合成路徑上的基因表達差異是造成原萜烷型三萜含量變化的主要原因。本研究中,MVA 途徑上的DEGs 主要在福建東方澤瀉中高表達,MEP 途徑上DEGs 在四川東方澤瀉高表達,說明移栽至四川改變了東方澤瀉中參與原萜烷型三萜生物合成的基因表達水平,可能不利于原萜烷型三萜的生物積累。CYP450為超蛋白家族,能夠催化多種代謝反應,包括氧化、去飽和、C-C 鍵裂解等催化反應。研究發現,CYP450 通過對萜類骨架進行復雜的修飾,可以生成不同類型的萜類化合物[12]。本研究中,注釋到CYP71 和CYP85 家族的DEGs 在四川東方澤瀉中顯著高于福建東方澤瀉,這些特征可能會促進四川東方澤瀉中的23-乙酰澤瀉醇B(alisol B 23-acetate)向其他三萜化合物轉化[18],導致四川東方澤瀉中23-乙酰澤瀉醇B 含量較福建降低,而其他原萜烷型三萜化合物含量升高。本研究豐富了東方澤瀉轉錄組數據庫并初步篩選出部分可能參與東方澤瀉適應環境變化的關鍵基因,主要涉及到植物生理活動和次生代謝,為闡明生態環境對東方澤瀉原萜烷型三萜生物合成的調控機制研究提供參考,為東方澤瀉異地引種和種質保護提供理論依據。

