miR?496靶向調控DCUN1D1抑制宮頸癌發生發展機制研究
方艷惠 康曉麗 朱巧英 劉婷 劉勝冬
河北醫科大學第四醫院婦科(石家莊050011)
宮頸癌(cervical cancer,CC)是全球四大女性惡性腫瘤之一,每年新增病例數逾50 萬[1?2]。隨著宮頸癌早期篩查技術的發展[3]以及HPV 疫苗的臨床應用,發病率有所降低[4?5]。但其預后較差主要是由于局部浸潤和遠端轉移,因此研究宮頸癌分子機制對改善其預后不良有重要意義[6]。
研究表明miRNA與腫瘤的發生發展密切相關,其中miR?21、miR?34[7]、miR?187[8]、miR?221[9]等多種miRNAs 已證實與宮頸癌機制有關,本團隊曾發現在宮頸癌中,miR?496 通過調控SFMBT1 抑制子宮頸癌HeLa 細胞增殖、遷移和侵襲[10],但miRNA與靶基因形成復雜的調控網絡參與癌癥的發展,本研究將進一步探究miR?496 以及其潛在靶點在宮頸癌發生發展的機制研究。前期通過生信軟件預測發現,重組人缺陷于清選蛋白neddylation蛋白1 域含1(DCUN1D1)是miR?496 潛在靶基因,DCUN1D1 作為一種致癌基因,已證實在包括宮頸癌在內的多種癌癥中異常高表達,并與腫瘤的惡性進展和不良預后有關[11-12]。因此本研究旨在觀察miR?496 與DCUN1D1 在宮頸癌中的作用及工作機制。
1 材料與方法
1.1 主要材料與試劑宮頸癌腫瘤標本和癌旁正常組織標本來自本院78 例接受手術的宮頸癌患者,所涉及標本患者均簽署知情同意書,并獲得本院倫理委員會批準。Hela 細胞購買自購于中國科學院上海細胞庫,RPMI 1640 培養基購買自Gibco 公司,TRIzol、逆轉錄試劑盒以及轉染試劑LipofectamineTM2000 購自美國Thermo 公司,Transwell 小室、Matrigel 膠購自美國Corning 公司,抗體購買自Abcam 公司,miR?496 mimics 和陰性對照由上海吉瑪制藥技術有限公司合成。
1.2 免疫熒光實驗檢測蛋白表達將組織切片脫蠟入水,微波加熱法修復抗原,(94 ℃,10~15 min),加入5%的正常羊血清封閉,37 ℃,60 min。滴加1∶500 比例稀釋的DCUN1D1 抗體,4 ℃過夜。滴加熒光素標記的二抗,37 ℃,60 min。棄二抗,4 ℃避光,熒光顯微鏡觀察拍照。
1.3 細胞培養和轉染HeLa 細胞株使用含10%胎牛血清,100 U/mL 青霉素和100 μg/mL 鏈霉素的RPMI 1640 作為細胞培養液,置于37 ℃含95%空氣和5% CO2的細胞培養箱中培養。將HeLa 細胞株分為對照組,miR?496 組和miR?496+DCUN1D1組,待細胞生長融合度至70%~90%時,按照轉染試劑LipofectamineTM2000 說明書對細胞分別轉染。
1.4 雙熒光素酶報告基因實驗利用microRNA靶基因數據庫預測miR?496 與DCUN1D1 可能的作用位點。構建DCUN1D1 野生型3′?UTR 熒光素梅質粒pMIR?WT 和突變型質粒pMIR?Mut。將pMIR?WT、pMIR?Mut 與PTEN mimics 和negative control miRNA mimics 共轉染進HeLa 細胞,轉染24 h 后,每孔加入100 μL 被動裂解液,使用酶標儀配套軟件進行結果分析。
1.5 qRT?PCR 檢測mRNA 表達按照Trizol 試劑盒步驟提取總RNA,按照反轉錄試劑盒,將總RNA進行RNA 逆轉錄,合成cDNA。按照qRT?PCR 試劑盒說明書進行PCR 反應,qRT?PCR 結果以CT 值形式表示。
1.6 Western blot檢測蛋白表達采用RIPA裂解緩沖液提取細胞或組織蛋白,BCA 法檢測蛋白濃度,取上樣緩沖液與樣品混合并置于95℃變性10 min。電泳分離蛋白,轉膜,5%脫脂奶粉37 ℃封閉2 h。將使用抗體稀釋液以1∶500 比例稀釋的DCUN1D1抗體和1∶1 000 稀釋的GAPDH 抗體加入至PVDF膜,GAPDH 為內參。4 ℃過夜。加入1∶1 000 稀釋的辣根過氧化物酶標記二抗,室溫孵育1 h。等體積混合ECL 發光液A、B 液,滴加至PVDF 膜,放入成像系統曝光。
1.7 CCK8 實驗檢測宮頸癌HeLa 細胞增殖能力各組HeLa 細胞以2 000 個/孔的量接種細胞到96 孔板,每孔200 μL 細胞懸液。細胞在轉染72 h后,按照CCK?8試劑盒操作說明書于每孔加入10 μL CCK?8 溶液,于37 ℃培養箱中孵育1 h,在450 nm波長下測定吸光度。
1.8 Transwell 實驗檢測宮頸癌HeLa 細胞遷移、侵襲能力遷移實驗:各組HeLa 細胞細胞密度為1 × 106個/mL,然后將200 μL 的細胞懸液接種于Transwell 小室中,在24 孔板內與小室的間隙中加入500 μL 含10%胎牛血清的DMEM 培養液,培養18~24 h。取出Transwell 小室,用PBS 緩沖液擦掉濾膜上層細胞,固定10 min,放入0.5%結晶紫染色液中(10 min),在顯微鏡下觀察濾膜下層細胞。侵襲實驗:將-20 ℃保存的Matrigel 置4 ℃冰箱18~24 h,次日將50 μL 稀釋好的Matrigel(1∶9)均勻鋪于Transwell 底部(37 ℃,3 h),其余步驟與Transwell遷移實驗相同。
1.9 構建宮頸癌裸鼠移植瘤模型選取BALB/c裸鼠12 只,6~ 8 周,體質量19~ 23 g,所有裸鼠隨機分為對照組(6 只)和miR?496 組(6 只)。HeLa 細胞轉染后,用1 mL 注射器將細胞懸液注射到裸鼠的右后肢腋部皮下,每只裸鼠接種細胞數為1 ×107個/只。隨后將裸鼠置于SPF 級動物實驗室飼養。21 d 處死裸鼠,腫瘤組織稱重、固定。
1.10 統計學方法采用SPSS Statistics 22.0 軟件進行統計學分析,數據以均數±標準差表示,兩組間比較采用t檢驗,多組比較采用單因素方差分析。P<0.05 為差異有統計學意義。
2 結果
2.1 宮頸癌組織中DCUN1D1和miR?496的表達免疫熒光和Western blot 檢測結果顯示DCUN1D1蛋白在宮頸癌組織表達明顯高于癌旁正常組織(P< 0.01,圖1A、C)。qRT?PCR 結果顯示宮頸癌組織中DCUN1D1 的mRNA 表達明顯升高,而miR?496 表達顯著降低(P<0.01,圖1B、D)。

圖1 宮頸癌組織中DCUN1D1 的表達Fig.1 Expression of DCUN1D1 in cervical cancer tissue
2.2 不同分期宮頸癌組織中miR?496、DCUN1D1的mRNA 表達水平qRT?PCR 結果顯示,宮頸癌的臨床分期越高,DCUN1D1 的mRNA 表達水平越高,miR?496 表達水平越低(P<0.01,圖2)。

圖2 不同分期宮頸癌組織中miR?496、DCUN1D1 的mRNA 表達Fig.2 Expression of miR?496 and DCUN1D1 in cervical cancer tissue of different stages
2.3 DCUN1D1 是miR?496 靶基因采用Target Scan 篩選miR?496 的潛在靶基因發現DCUN1D1 的3′?UTR上具有潛在的結合位點與miR?496形成互補結合(圖3A)。雙熒光素酶報告基因試驗顯示轉染pMIR?DCUN1D1?wt 質粒miR?496 組熒光素酶活性明顯降低,轉染pMIR?DCUN1D1?Mut 質粒miR?496組熒光素酶活性無明顯影響(P<0.01,圖3B)。miR?496 mimics 轉染進HeLa 細胞后,細胞中miR?496的表達水平較對照組明顯升高(P< 0.01,圖4A),qRT?PCR 和Western blot 結果顯示,相比對照組,miR?496 組的細胞中DCUN1D1 的mRNA 和蛋白表達均明顯降低(P<0.01,圖4B、C)。
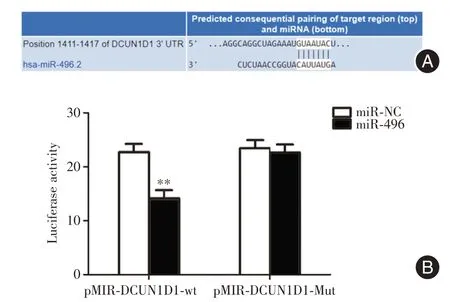
圖3 預測并驗證DCUN1D1 是miR?496 靶基因Fig.3 DCUN1D1 is the target gene of miR?496
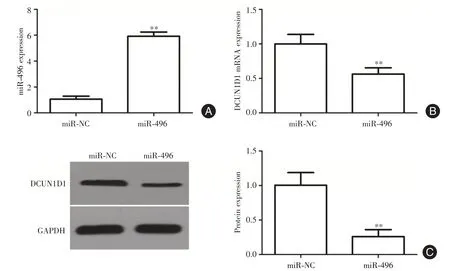
圖4 miR?496 負調控DCUN1D1 表達Fig.4 miR?496 negatively regulates the expression of DCUN1D1
2.4 miR?496 和DCUN1D1 對HeLa 細胞生物功能的調控CCK8 法結果示,相比對照組,miR?496 mimics 組中OD值明顯降低,但miR?496+DCUN1D1組的OD值明顯高于miR?496 mimics 組(P< 0.01,圖5A)。Transwell 實驗結果顯示,相比對照組,miR?496 組遷移和侵襲細胞計數均明顯降低,但相比miR?496 組,miR?496+DCUN1D1 組細胞的遷移和侵襲能力增強(P<0.01,圖5B)。
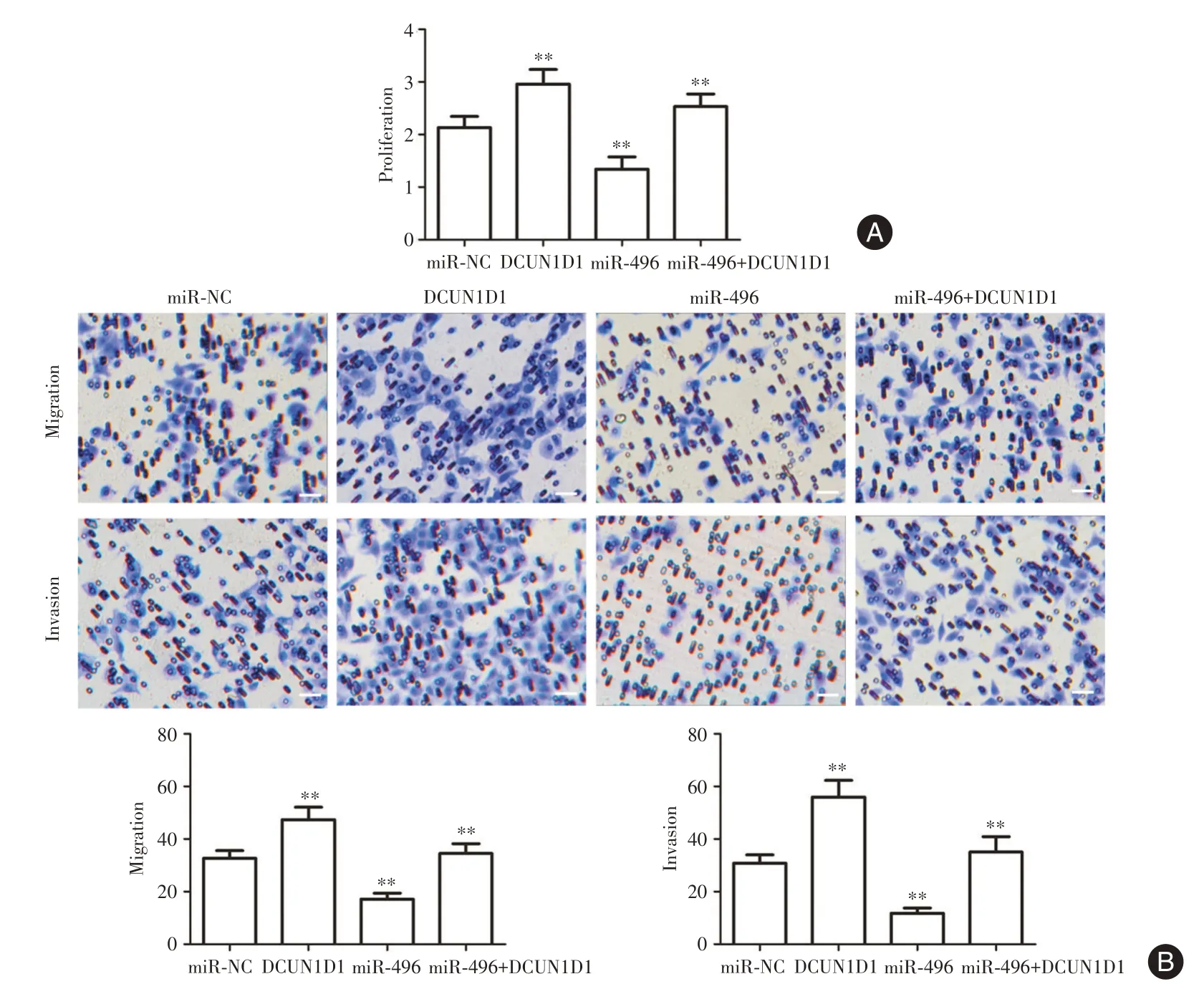
圖5 miR?496 和DCUN1D1 對宮頸癌HeLa 細胞生物功能的調控Fig.5 Regulation of miR?496 and DCUN1D1 on the biological function of cervical cancer HeLa cells
2.5 宮頸癌裸鼠移植瘤模型以及DCUN1D1 表達21 d 后宮頸癌移植瘤模型結果示,miR?496 組裸鼠中移植瘤體積和重量明顯低于對照組(P<0.01,圖6A、B)。免疫熒光結果顯示,miR?496 組裸鼠中DCUN1D1 和Ki67 陽性信號均明顯低于對照組(P<0.01,圖6C)。
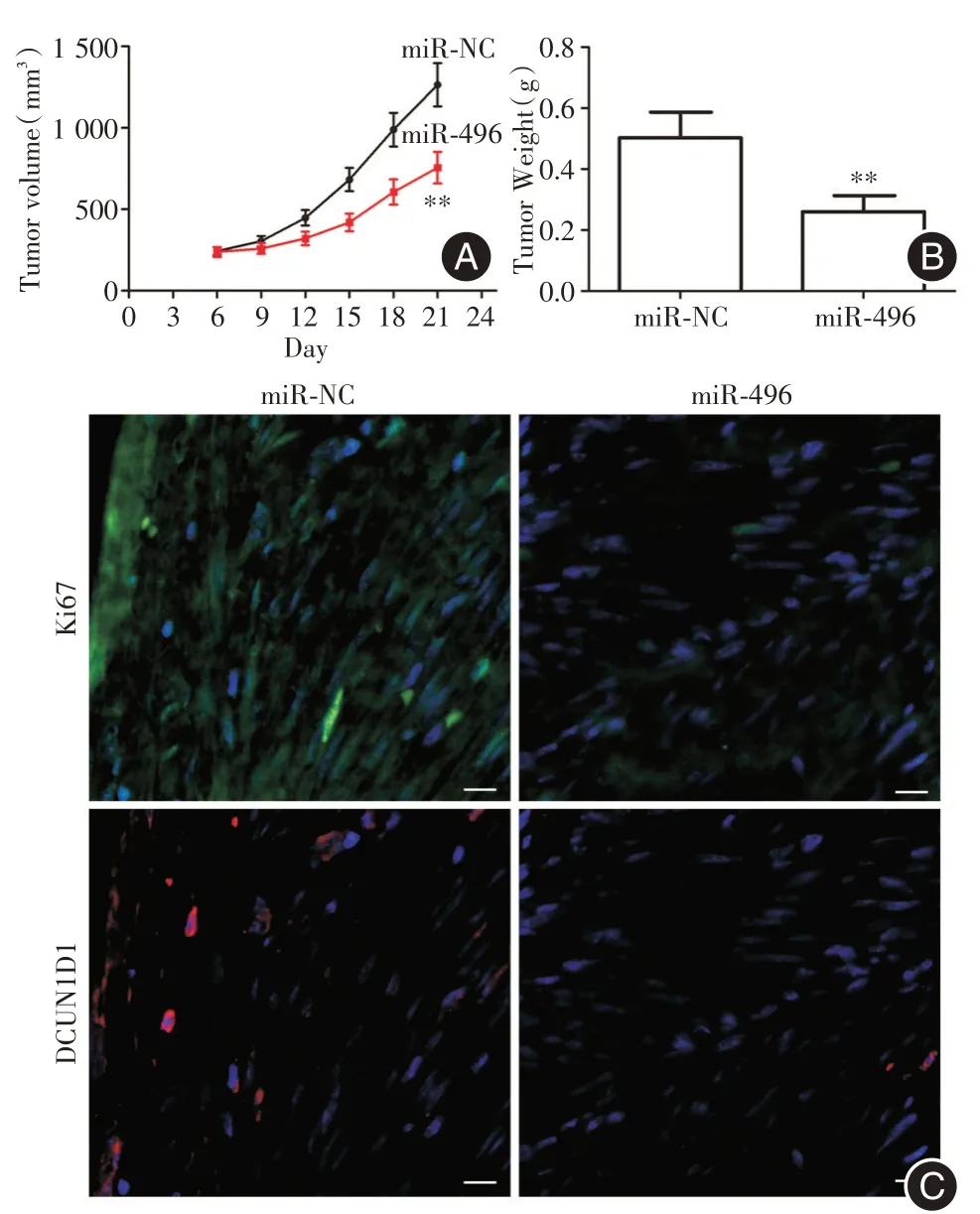
圖6 miR?496 在宮頸癌裸鼠移植瘤模型表達Fig.6 Expression of miR?496 in xenograft model of cervical cancer in nude mice
3 討論
在各種癌癥的發生發展中,miRNA作為致癌基因或腫瘤抑制因子發揮著重要作用[13-15]。研究顯示,miR?496 與多種癌癥發病機制相關,ALQURASHI等[16]研究發現,miR?496 在內的5 種miRNAs 在結直腸癌中表達下調。MA 等[17]發現在非小細胞肺癌中,miR?496 通過靶向BDNF 介導的PI3K/Akt 信號通路抑制腫瘤發生。WANG 等[18]發現,miR?496通過靶向RASSF6 促進大腸癌細胞的遷移和上皮?間質轉化。本研究中通過構建宮頸癌裸鼠移植瘤模型發現,miR?496 過表達的裸鼠中移植瘤體積和重量明顯低于對照組,表明miR?496 抑制了裸鼠瘤體的生長,提示miR?496 可能具有抑制宮頸癌的功能。
miRNA 通過抑制目標mRNA 和翻譯來調節基因表達,從而參與多種生物學過程。本研究利用TargetScan 發現miR?496 在DCUN1D1 的3′?UTR 上具有潛在的結合位點,表明DCUN1D1 是其潛在靶基因。進一步通過雙熒光素酶報告基因試驗發現miR?496 的確能與DCUN1D1 的3′?UTR 特異性結合并抑制其表達。
DCUN1D1 被稱為鱗狀細胞癌相關癌基因,研究顯示DCUN1D1 在癌癥中具有致癌活性[19]。SHUANG等[20]研究發現,DCUN1D1在喉鱗狀細胞癌組織中的表達升高,miR?195可通過靶向DCUN1D1抑制喉鱗狀細胞細胞的生長和侵襲。JIANG 等[21]發現DCUN1D1 在宮頸癌組織中較癌旁組織表達上調,且其高表達與宮頸癌患者淋巴結轉移、臨床分期、生存時間縮短有關。結果與以往研究類似,本研究通過免疫熒光等實驗發現DCUN1D1在宮頸癌組織中的表達水平明顯高于癌旁正常組織,通過比較不同分期宮頸癌組織中miR?496、DCUN1D1 的表達水平發現,宮頸癌組織的臨床分期越高,DCUN1D1 的mRNA 表達水平越高,miR?496 的表達水平越低。由此可以推測,DCUN1D1的過表達能夠促進腫瘤細胞的轉移,增強腫瘤細胞的局部侵襲,促進惡性腫瘤的進展。
為了探究miR?496 與DCUN1D1 在宮頸癌腫瘤轉移的調控機制,本研究中通過體外實驗深入探究了miR?496 與DCUN1D1 對宮頸癌細胞HeLa 生物學行為的影響。實驗結果顯示,轉染miR?496 mimics 能抑制HeLa 細胞的增殖、遷移和侵襲能力,但在細胞中同時高表達DCUN1D1 則能逆轉miR?496 的這種抑制效果,表明miR?496 是通過調控DCUN1D1 從而抑制宮頸癌細胞的生物學行為。
綜上所述,本研究發現miR?496 的低表達與宮頸癌可能密切相關,進一步miR?496 可通過靶向調控DCUN1D1 抑制宮頸癌發生發展,miR?496 有望成為宮頸癌靶向治療的一個靶點。

