阿魏酸鈉調控JAK2/STAT3信號通路對膠質瘤細胞增殖、侵襲、凋亡的影響
趙海林 胡骕 彭彪 羅冬冬 李丹
廣州醫科大學附屬腫瘤醫院神經外科(廣州510095)
膠質瘤屬于一種較為常見的顱內惡性腫瘤,惡性程度較高,臨床發病率、預后死亡率均處于較高的水平,就目前現有的醫療水平而言,尚無治療方法,多采用早期手術、放化療手段治療,但部分患者經臨床常規治療后患者3年生存率仍較低[1-3]。因此積極尋找有效治療膠質瘤的藥物對延長膠質瘤患者生存周期具有重要意義。阿魏酸鈉屬于一種非肽類內皮素受體拮抗劑,是阿魏酸的一種鈉鹽,其目前主要應用于腎臟疾病、糖尿病、心腦血管疾病的治療中,但近年來有報道稱其具有抗腫瘤作用[4-5]。有研究顯示[6],阿魏酸鈉可以增加人EBL?7404 肝癌細胞的凋亡、抑制其生存性。基于此,本次主要研究使用阿魏酸鈉對膠質瘤細胞進行體外培養,分析其對膠質瘤細胞生物學行為的影響,以明確其是否具有抗腫瘤作用,為臨床上膠質瘤的藥物治療提供新方向。
1 材料與方法
1.1 研究細胞及試劑來源膠質瘤細胞系U251由上海雅吉生物科技有限公司提供。試劑來源:阿魏酸鈉(成都亨達藥業有限公司);環磷酰胺(深圳海思安生物技術有限公司);MTT 試劑(上海撫生實業有限公司);胎牛血清[漢恒生物工程(上海)有限公司];DMEM 培養基(武漢益普生物科技有限公司);磷酸鹽緩沖液(上海廣銳生物科技有限公司);小鼠抗大鼠p?JAK2 抗體、兔抗大鼠p?STAT3抗體(武漢菲恩生物科技有限公司)。本次研究獲得我院倫理委員會批準。
1.2 方法
1.2.1 細胞培養取所購買的膠質瘤細胞系U251,使用第3~ 9 代的細胞按照1∶4 的比例做傳代培養,加入15 mL含10%胎牛血清的DMEM培養基中,在37 ℃、2.5%CO2的培養箱中進行培養,待細胞生長大約為90%時,使用含0.1%胎牛血清的DMEM培養基阻斷24 h,用于后續實驗。
1.2.2 阿魏酸鈉的LC50及實驗分組、最佳有效時間測定取所培養的細胞,采用MTT 法測定阿魏酸鈉在1、10-1、10-2、10-3、10-4、10-5、10-6mg/mL 各濃度下對細胞的抑制率,設定量效關系曲線,計算阿魏酸鈉的LC50,確定阿魏酸鈉的低、中、高濃度,分別作為低濃度組、中濃度組、高濃度組。
1.2.3 阿魏酸鈉干預將細胞分為常規培養的空白組、使用環磷酰胺(30 μmol/L)培養的陽性對照組,高濃度組、中濃度組、低濃度組分別使用0.3、0.03、0.003 mg/mL 阿魏酸鈉培養。在培養72 h 后觀察細胞生物學行為。
1.2.4 細胞增殖檢測采用MTT 法測定細胞增殖情況,取各組細胞,將細胞濃度調整為3×104個/mL,將200 μL 細胞懸液接種于96 孔板上,在37 ℃、5% CO2環境下培養72 h,加入10 μL MTT 試劑,孵育4 h,計算細胞增殖率,使用酶標儀檢測波長為570 mm 細胞的OD值。重復檢測3 次取均值,細胞增殖率=(細胞組OD值/對照組OD值)×100%。
1.2.5 細胞凋亡檢測采用TUNEL 法測定細胞凋亡情況,在熒光顯微鏡下做細胞凋亡計數,根據洗滌、DAPI 染色封片后細胞核顏色情況判定細胞凋亡情況,細胞核為綠色熒光表示陽性,細胞核為藍色熒光表示陰性,重復檢測3 次取均值。細胞凋亡率=陽性細胞數/總細胞數×100%。
1.2.6 細胞遷移檢測細胞遷移能力使用劃痕實驗測定,取所培養的細胞在18 孔板上接種,待細胞生長至80%時,使用槍頭(100 μL)做垂直劃直線操作,之后使用磷酸鹽緩沖液洗滌3 次,加入血清培養基(0.5%),72 h 后使用倒置顯微鏡觀察細胞遷移情況。遷移率=(0 h 細胞間距-觀察時間細胞間距)/0 h 細胞間距。每次重復測量5 次,取均值。
1.2.7 細胞侵襲檢測細胞侵襲能力使用Tran?swell 小室(美國Corning 公司)測定,蘇木晶染色、PBS 清洗,使用倒置顯微鏡觀察5 個不同視野細胞侵襲情況,做細胞侵襲計數,細胞侵襲計數為每個視野的穿模細胞數。每次重復測量5 次,取均值。
1.2.8 JAK2/STAT3 通路蛋白表達檢測細胞JAK2/STAT3 通路蛋白p?JAK2、p?STAT3 表達情況使用Western blot 法測定,對所培養的細胞做離心、蛋白提取,提取完成后使用BCA 做蛋白定量測定,將所提取的50 μg 蛋白加入至2×SDS 凝膠緩沖液中,做電泳、轉膜、取膜、固定、封閉處理,將1∶1 000 比例的TBST 稀釋的p?JAK2、p?STAT3 一抗,在溫度為4 ℃的環境下孵育過夜,TBST 重復做3 次洗膜處理,加入1∶10 000 TBST 稀釋的二抗,搖動孵育60 min,TBST 重復做3 次洗膜處理,使用DAB做顯色處理,分析蛋白表達情況。以GAPDH 蛋白為內參。
1.3 統計學方法采用SPSS 26.0 軟件進行分析。計量資料采用均數±標準差表示,多組間比較采用方差齊性檢驗,兩組間比較采用獨立樣本t檢驗,P<0.05 為差異有統計學意義。
2 結果
2.1 阿魏酸鈉的LC50 及實驗分組測定結果如表1所示,MTT 檢測發現,阿魏酸鈉在1、10-1、10-2、10-3、10-4、10-5、10-6mg/mL 各濃度下對細胞的抑制率逐漸降低,經計算其LC50=0.307 5 mg/mL,繪制量效關系曲線發現,在1~ 10-3mg/mL 對細胞增殖的抑制較為明顯,結合藥物的LC50,設定本次研究的阿魏酸鈉高、中、低濃度分別為0.3、0.03、0.003 mg/mL,分別作為低濃度組、中濃度組、高濃度組,見圖1。
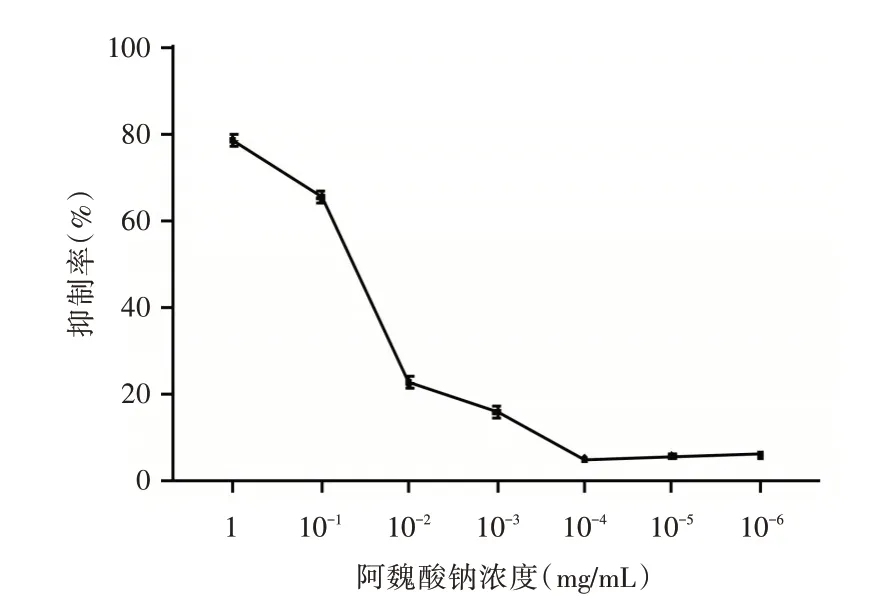
圖1 阿魏酸鈉量效關系曲線Fig.1 The dose?effect relationship curve of sodium ferulate
表1 阿魏酸鈉對膠質瘤細胞增殖的影響Tab.1 The effect of sodium ferulate on the proliferation of glioma cells±s
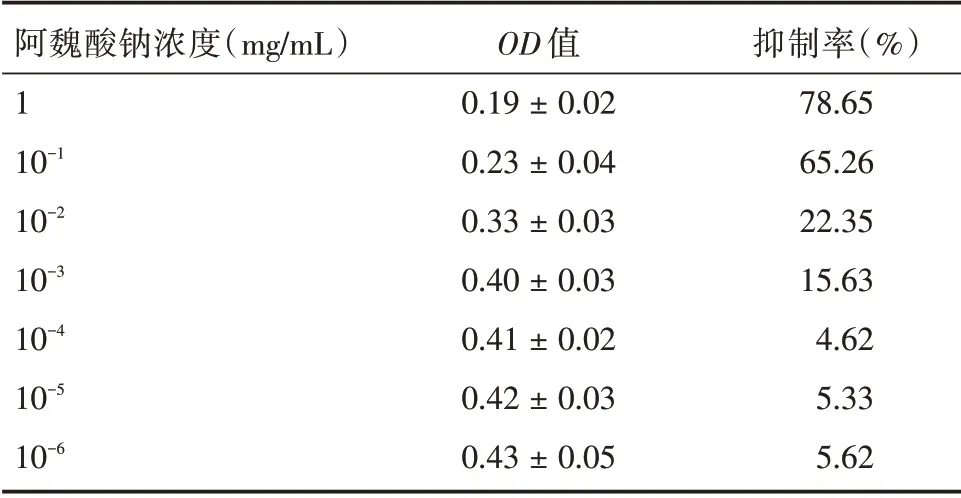
表1 阿魏酸鈉對膠質瘤細胞增殖的影響Tab.1 The effect of sodium ferulate on the proliferation of glioma cells±s
阿魏酸鈉濃度(mg/mL)1 10-1 10-2 10-3 10-4 10-5 10-6 OD 值0.19±0.02 0.23±0.04 0.33±0.03 0.40±0.03 0.41±0.02 0.42±0.03 0.43±0.05抑制率(%)78.65 65.26 22.35 15.63 4.62 5.33 5.62
2.2 阿魏酸鈉對膠質瘤細胞增殖、凋亡的影響與空白組相比,陽性對照組、低、中、高濃度組增殖率降低,凋亡率升高;與陽性對照組相比,低、中、高濃度組增殖率降低,凋亡率升高(P< 0.05);與低濃度組相比,中、高濃度組增殖率降低,凋亡率升高(P< 0.05);與中濃度組相比,高濃度組增殖率降低,凋亡率升高(P<0.05)。見表2。
表2 阿魏酸鈉對膠質瘤細胞增殖、凋亡的影響Tab.2 The effect of sodium ferulate on the proliferation and apoptosis of glioma cells±s,%
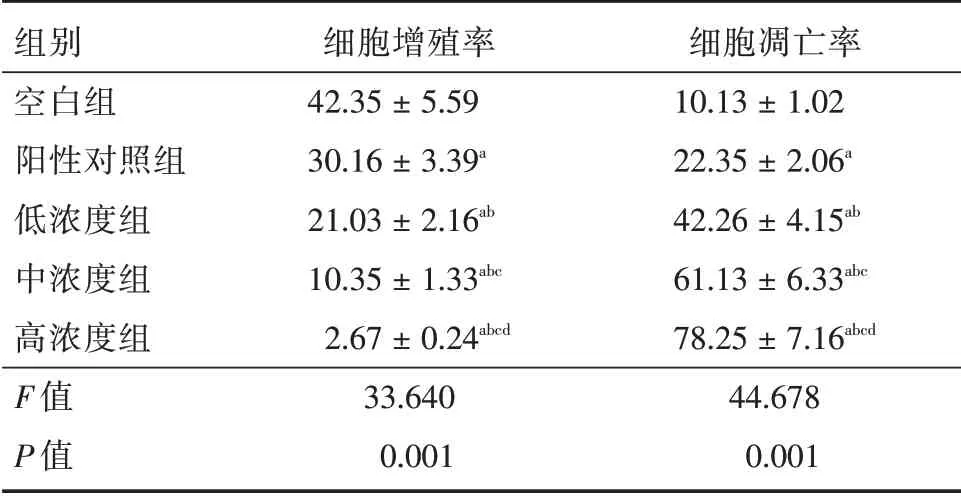
表2 阿魏酸鈉對膠質瘤細胞增殖、凋亡的影響Tab.2 The effect of sodium ferulate on the proliferation and apoptosis of glioma cells±s,%
注:與空白組相比,aP < 0.05;與陽性對照組相比,bP < 0.05;與低濃度組相比,cP<0.05;與中濃度組相比,dP<0.05
組別空白組陽性對照組低濃度組中濃度組高濃度組F 值P 值細胞增殖率42.35±5.59 30.16±3.39a 21.03±2.16ab 10.35±1.33abc 2.67±0.24abcd 33.640 0.001細胞凋亡率10.13±1.02 22.35±2.06a 42.26±4.15ab 61.13±6.33abc 78.25±7.16abcd 44.678 0.001
2.3 阿魏酸鈉對膠質瘤細胞侵襲、遷移的影響與空白組相比,陽性對照組、低、中、高濃度組侵襲數、遷移率降低(P< 0.05);與陽性對照組相比,低、中、高濃度組侵襲數、遷移率降低(P< 0.05);與低濃度組相比,中、高濃度組侵襲數、遷移率降低(P<0.05);與中濃度組相比,高濃度組侵襲數、遷移率降低(P<0.05)。見表3。
表3 阿魏酸鈉對膠質瘤細胞侵襲、遷移的影響Tab.3 The effect of sodium ferulate on the invasion and migration of glioma cells±s
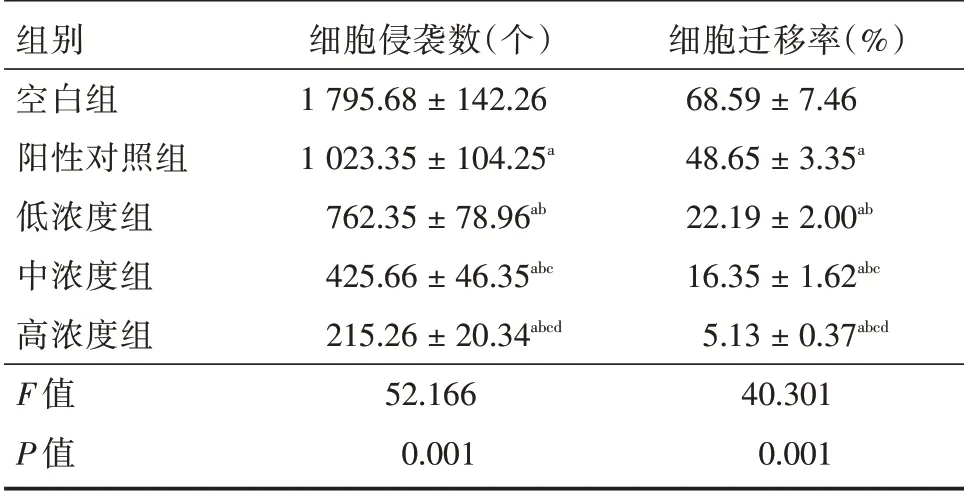
表3 阿魏酸鈉對膠質瘤細胞侵襲、遷移的影響Tab.3 The effect of sodium ferulate on the invasion and migration of glioma cells±s
注:與空白組相比,aP < 0.05;與陽性對照組相比,bP < 0.05;與低濃度組相比,cP<0.05;與中濃度組相比,dP<0.05
組別空白組陽性對照組低濃度組中濃度組高濃度組F 值P 值細胞侵襲數(個)1 795.68±142.26 1 023.35±104.25a 762.35±78.96ab 425.66±46.35abc 215.26±20.34abcd 52.166 0.001細胞遷移率(%)68.59±7.46 48.65±3.35a 22.19±2.00ab 16.35±1.62abc 5.13±0.37abcd 40.301 0.001
2.4 阿魏酸鈉對膠質瘤細胞中JAK2/STAT3 通路蛋白表達的影響與空白組相比,陽性對照組、低、中、高濃度組p?JAK2、p?STAT3 蛋白表達量降低(P< 0.05);與陽性對照組相比,低、中、高濃度組p?JAK2、p?STAT3 蛋白表達量降低(P<0.05);與低濃度組相比,中、高濃度組p?JAK2、p?STAT3 蛋白表達量降低(P<0.05);與中濃度組相比,高濃度組p?JAK2、p?STAT3 蛋白表達量降低(P< 0.05)。見表4、圖2。
表4 阿魏酸鈉對膠質瘤細胞中JAK2/STAT3 通路蛋白表達的影響Tab.4 The effect of sodium ferulate on the expression of JAK2/STAT3 pathway protein in glioma cells±s
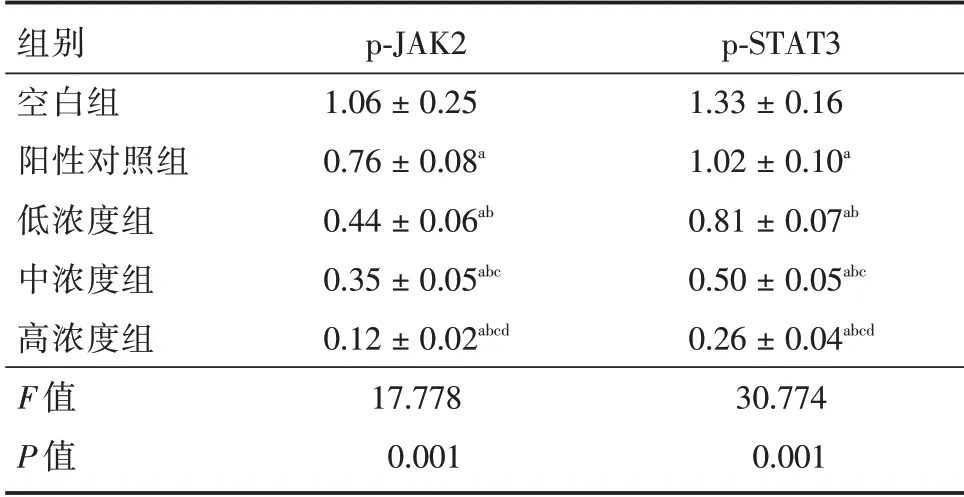
表4 阿魏酸鈉對膠質瘤細胞中JAK2/STAT3 通路蛋白表達的影響Tab.4 The effect of sodium ferulate on the expression of JAK2/STAT3 pathway protein in glioma cells±s
注:與空白組相比,aP < 0.05;與陽性對照組相比,bP < 0.05;與低濃度組相比,cP<0.05;與中濃度組相比,dP<0.05
組別空白組陽性對照組低濃度組中濃度組高濃度組F 值P 值p?JAK2 1.06±0.25 0.76±0.08a 0.44±0.06ab 0.35±0.05abc 0.12±0.02abcd 17.778 0.001 p?STAT3 1.33±0.16 1.02±0.10a 0.81±0.07ab 0.50±0.05abc 0.26±0.04abcd 30.774 0.001

圖2 JAK2/STAT3 通路蛋白Western Blot 圖Fig.2 Western blot map of JAK2/STAT3 pathway protein
3 討論
膠質瘤惡性程度較高,患者大多預后不良,因此有效的治療手段對控制患者疾病發展、改善具有重要的意義[7]。阿魏酸鈉是從當歸或川芎中提取的水溶性有效成分,對多種腫瘤具有治療效果[8]。因此,本研究旨在研究阿魏酸鈉通過調控JAK2/STAT3信號通路對膠質瘤細胞增殖、侵襲、凋亡的影響。
目前已有許多研究發現,阿魏酸具有較強的抗癌活性,如抑制宮頸癌裸鼠移植瘤生長[9]、人肝癌HepG2 細胞凋亡[10]、誘導食管癌細胞周期阻滯和自噬[11]以及調控乳腺癌細胞生物學行為[12]等。阿魏酸鈉是阿魏酸的一種鈉鹽,其作用與阿魏酸作用一致。因此筆者推測,阿魏酸鈉可能具有抑制膠質瘤細胞增殖、遷移、侵襲,促進凋亡的作用,本研究中選取膠質瘤細胞,使用不同濃度的阿魏酸鈉進行培養,分析其對膠質瘤細胞增殖、遷移、侵襲、凋亡的影響,結果發現,與使用環磷酰胺培養的細胞相比,使用阿魏酸鈉培養的細胞增殖、遷移、侵襲能力明顯被抑制,且明顯促進細胞凋亡,此結果提示著,阿魏酸鈉具有一定的抗膠質瘤作用。阿魏酸屬酚酸的一種,其廣泛存在于植物中,具有較強的抗氧化性、抗炎、抗菌、防心血管疾病以及抗癌作用等,近年來在臨床上被認為屬于一種抗癌物質[13]。阿魏酸鈉具有抗氧化、抗血小板聚集、神經保護、增強免疫功能等,影響著膠質瘤細胞的生物學行為[14-15]。
近年來隨著對此信號通路的不斷深入研究發現,其在惡性腫瘤中具有促進過程,在細胞癌變過程中,JAK2/STAT3 通路中的JAK2 磷酸化,其在磷酸化水平上可激活STAT3 表達,進而誘導惡性腫瘤細胞異常增殖,最終促使疾病進一步惡化,危及生命[16-18]。有研究表明[19],JAK2/STAT3 通路可以抑制的炎性介質釋放,有效地減輕肝硬化大鼠肝臟缺血再灌注損傷。有研究發現[20],通過抑制JAK2/STAT3信號通路活化,可以抑制膠質瘤細胞上皮?間質轉,從而影響到膠質瘤。有研究發現[21],JAK2/STAT3信號通路的激活影響著膠質瘤細胞的惡性生物學行為,影響著細胞的增殖、凋亡。有研究發現[22],阻斷JAK2/STAT3信號通路促使膠質瘤細胞增加,凋亡減少,細胞增殖率、遷移率較低,影響膠質瘤的恢復。本文研究結果顯示,經阿魏酸鈉干預后細胞中JAK2/STAT3 通路JAK2 磷酸化和STAT3 表達明顯被抑制,且呈劑量依賴,此結果提示著,阿魏酸鈉可能經促使此信號通路失活而發揮抗膠質瘤的作用。分析原因:JAK2/STAT3信號通路參與神經元分化、增殖、炎癥反應等在機體多種病理過程[23]。JAK2/STAT3 通路在膠質瘤發生發展過程中具有明顯的促進作用,經抑制此信號通路活性可發揮抗膠質瘤的作用[24-25]。
綜上所述,阿魏酸鈉可能通過JAK2/STAT3 通路作用于膠質瘤,促使此通路失活而發揮抑制膠質瘤細胞增殖、遷移、侵襲,促進凋亡的作用。但是,本文研究樣本較少,還需進一步的研究。

