基于適配體識別-雜交鏈式反應可視化檢測金黃色葡萄球菌
盧春霞,王昌烜,黃巧,陳霞,李紅敏,付家莉,張云紅,王雙慧
1(長江師范學院 現代農業與生物工程學院,重慶,408100)2(蘇州賽飛福德檢測科技有限公司,江蘇 蘇州,215100)3(新疆農墾科學院,分析測試中心,新疆 石河子,832000)
金黃色葡萄球菌(Staphylococcusaureus)簡稱金葡菌,屬革蘭氏陽性菌,廣泛分布于自然界,是一種常見的食源性致病菌,常污染肉類、蛋類和乳類等食品,部分菌株產生的金黃色葡萄球菌腸毒素(staphylococcal enterotoxins,SEs)是引起食物中毒的主要致病因子[1],對公共健康和食品安全帶來巨大威脅。有統計數據表明,2015年中國大陸由金葡菌引起的食源性疾病占12.6%,僅次于溶血性弧菌和沙門氏菌,是造成食源性疾病的第三大致病菌[2]。鑒于金葡菌的危害,我國食品安全國家標準[3]規定金葡菌的可接受水平和最高安全限量值分別為100、1 000 CFU/g(mL)。因此,如何快速靈敏地檢出金葡菌是預防食源性疾病的關鍵技術和先決條件。
目前,傳統的金葡菌的檢測方法主要包括微生物培養法[3]、分子生物學檢測方法[4]和免疫分析技術[5]。微生物培養法是金標方法,但該法操作步驟復雜,耗時較長(3~5 d),無法滿足現場快速檢測及批量樣品初篩的需要。分子生物學檢測技術靈敏度較高,但該法需要精密儀器和專業的技術人員。基于抗體技術的免疫學檢測方法具有簡便、快速等特點,是目前金葡菌常用的快速檢測技術,市售商品以ELISA試劑盒和試紙條為主,但該類方法需要免疫動物,抗體制備成本較高。
近些年,核酸適配體(aptamer)以制備簡單、生產成本低、應用范圍廣、易于修飾和標記等優點,作為一種新型識別分子廣泛應用于食品安全[6]、環境分析[7]和臨床診斷[8]等領域。在金葡菌檢測方面,目前已篩選出多條識別金葡菌的核酸適配體[9-10]。隨后人們利用這些適配體,結合納米材料及化學發光等技術,建立了包括比色傳感[11]、熒光傳感[12]、拉曼生物傳感[13]、電化學傳感[14]等各種生物傳感檢測技術。本團隊在基于適配體的食源性致病菌檢測領域也做了較多研究[15-16]。
在眾多快速檢測方法中,可視化檢測方法具有簡單、便攜、檢測結果直觀等優點而顯示出獨特的優勢。但食品樣品通常成分復雜、干擾大,基質效應可能影響檢測靈敏度。為實現對靶標的高靈敏檢測,可借助一些信號放大技術以提高檢測靈敏度。其中,雜交鏈式反應(hybridization chain reaction,HCR)作為一種生物放大技術近年來引起了人們的廣泛關注。HCR是一種自組裝信號放大的技術,在常溫下即可進行,不需要酶參與,同時,HCR對外部條件要求簡單,不需要專業儀器,且輸出信號多樣化。因此,HCR作為一種簡單、有效的新型信號放大策略在分析檢測領域得到廣泛應用[17]。但目前尚未見到基于適配體和HCR信號放大的金葡菌檢測研究報道。
因此,本研究基于金葡菌現有檢測技術的不足,以其適配體為識別分子,建立了一種簡便靈敏的檢測新方法。通過生物素-親和素作用,將生物素-適配體1固定在酶標板表面,依次加入靶標和檢測探針(含有引發鏈和適配體2),在酶標板表面形成適配體1/靶標/檢測探針夾心復合物。然后加入生物素-發夾DNA,約定俗成引發HCR反應,使帶有生物素的發夾DNA在酶標板表面“生長”形成dsDNA長鏈。然后將鏈霉親和素-辣根過氧化物酶(streptavidin-horseradish peroxidase,SA-HRP)標記在dsDNA每個節點上,通過HRP催化3,3′,5,5′-四甲基聯苯胺(tetramethylbenzidine,TMB)顯色實現靶標的定性及定量檢測。本方法結合了HCR和酶催化顯色雙重信號放大策略,更大限度地提高了檢測靈敏度,為食品中金葡菌快速檢測提供新的技術支撐。
1 材料與方法
1.1 實驗材料
金黃色葡萄球菌(S.aureus)ATCC6538、金黃色葡萄球菌ATCC29213、大腸埃希氏菌(Escherichiacoli)O157:H7 ATCC25922、單核細胞增生李斯特菌(Listeriamonocytogenes)ATCC19155、鼠傷寒沙門氏菌(Salmonellatyphimurium)ATCC14028、阪崎腸桿菌(Bntorobatersakazakii)ATCC29544等菌株由新疆農墾科學院分析測試中心提供。
牛血清白蛋白 (bovine serum albumin, BSA)、吐溫-20(Tween-20)、SA-HRP、三(羥甲基)氨基甲烷(Tris)、TMB顯色試劑盒,生物工程(上海)股份有限公司;NaCl、KCl、Na2HPO4、KH2PO4、CaCl2、MgCl2·6H2O(分析純),國藥集團化學試劑有限公司;鏈霉親和素包被的酶標板,蘇州海貍生物醫學工程有限公司;禽肉、乳制品,本地超市。
本研究中所用的核酸適配體、檢測探針及發夾DNA由生物工程(上海)股份有限公司合成并純化,其堿基序列詳見表1。

表1 適配體及發夾DNA序列Table 1 Sequences of the aptamer and hairpin DNA
1.2 儀器與設備
Thermo ScientificTMVarioskan Flash全波長掃描式多功能讀數儀,美國賽默飛公司;5MX 96孔板混勻儀,美國賽洛捷克公司;424R臺式冷凍離心機,德國艾本德公司;BSD-100培養箱,上海博迅醫療生物儀器股份有限公司;UV-280紫外可見分光光度計,尤尼柯(上海)儀器有限公司;Milli-Q Reference超純水系統,美國密理博公司。
1.3 實驗方法
1.3.1 菌懸液的制備
將各種食源性致病菌分別接種到LB液體培養基中,37 ℃振蕩培養過夜,使其菌懸液的光密度值達到1.0(OD600nm=0.1,菌落數約1.0×109CFU/mL),用生理鹽水將其10倍系列稀釋,然后通過平板計數法定量計算菌落數。菌懸液于4 ℃保存備用。
1.3.2 基于適配體-HCR檢測金葡菌方法的建立
SA-酶標板使用之前用PBST(10 mmol/L PBS,0.05% Tween-20)洗滌。加入100 μL 生物素化適配體1(60 nmol/L),溫育30 min,PBST洗滌。每孔加入200 μL的10 g/L BSA封閉液,室溫封閉4 h,PBST洗滌。加入100 μL待測樣品或一定濃度的金葡菌溶液,室溫孵育30 min,PBST洗滌。加入100 μL檢測探針(80 nmol/L),室溫孵育30 min,PBST洗滌。bio-H1和bio-H2使用前95 ℃加熱5 min,室溫冷卻,各取50 μL至反應孔中,室溫雜交反應60 min,PBST洗滌。然后加入100 μL SA-HRP溶液(體積比1∶40 000),室溫反應10 min,PBST洗滌后加入100 μL TMB顯色液,避光顯色5~7 min。加入100 μL 終止液終止反應,通過顏色變化定性檢測金葡菌,并在450 nm處測其吸光度。每個實驗重復3次。實驗反應體系為適配體篩選緩沖液(20 mmol/L Tris、100 mmol/L NaCl、5 mmol/L KCl、1 mmol/L CaCl2、1 mmol/L MgCl2·6H2O,pH 7.4)[9]。
1.3.3 檢測性能評價
1.3.3.1 線性范圍、檢測限
在優化條對下,用篩選緩沖溶液分別將金葡菌稀釋成系列梯度濃度的工作液,采用建立的方法對其進行測定,以不同金葡菌濃度的對數值為橫坐標,以各濃度對應的OD450nm值為縱坐標,繪制標準曲線,對其進行進行線性擬合,求得線性方程和相關系數。每個實驗重復3次。
1.3.3.2 特異性分析
采用建立的方法分別檢測相同濃度(1×104CFU/mL)的金葡菌、大腸桿菌、鼠傷寒沙門氏菌、單增李斯特菌、阪崎桿菌,同時設置空白對照,以分析方法的特異性。
1.3.3.3 方法的應用
采用對空白樣品加標實驗考察本方法的準確性。參照GB 4789.10—2016對樣品進行前處理[18],稱取25 g樣品置于盛有225 mL生理鹽水的無菌均質杯內,用拍擊式均質器拍打1~2 min,用篩選緩沖液稀釋成1∶10的樣品勻液。取100 μL樣品勻液,分別加入不同濃度的金葡菌,按照上述建立的檢測方法進行檢測,計算樣品中金葡菌的含量、加標回收率,相對標準偏差(relative standard deviation, RSD)。同時采用國標法[18]進行檢測,將檢測結果對比分析,評價方法準確性。
1.4 數據處理
實驗數據用平均值±標準偏差方式表示,采用單因素方差分析(One-Way ANOVA)方法分析實驗數據,顯著性水準為P=0.05[19],使用Origin 8.5 軟件制圖。
2 結果與分析
2.1 檢測條件優化
2.1.1 適配體1及檢測探針濃度
生物素化適配體1的包被濃度及檢測探針濃度對檢測靈敏度有較大影響。本實驗使用過量的發夾DNA(100 nmol/L)和SA-HRP(稀釋體積比1∶20 000),適配體與靶標反應時間40 min,HCR雜交時間2 h,金葡菌檢測濃度為104CFU /mL,考察了不同適配體1包被濃度(10~200 nmol/L)和檢測探針濃度(10~320 nmol/L)對檢測靈敏度的影響。實驗結果如圖1所示,隨著適配體1及檢測探針濃度的增加,吸光值逐漸增加,意味著結合金葡菌的數量也逐漸增加,當兩者濃度分別超過60、80 nmol/L后,吸光值變化趨于平緩(P>0.05)。因此,后續實驗適配體1包被濃度和檢測探針濃度分別選擇60、80 nmol/L。
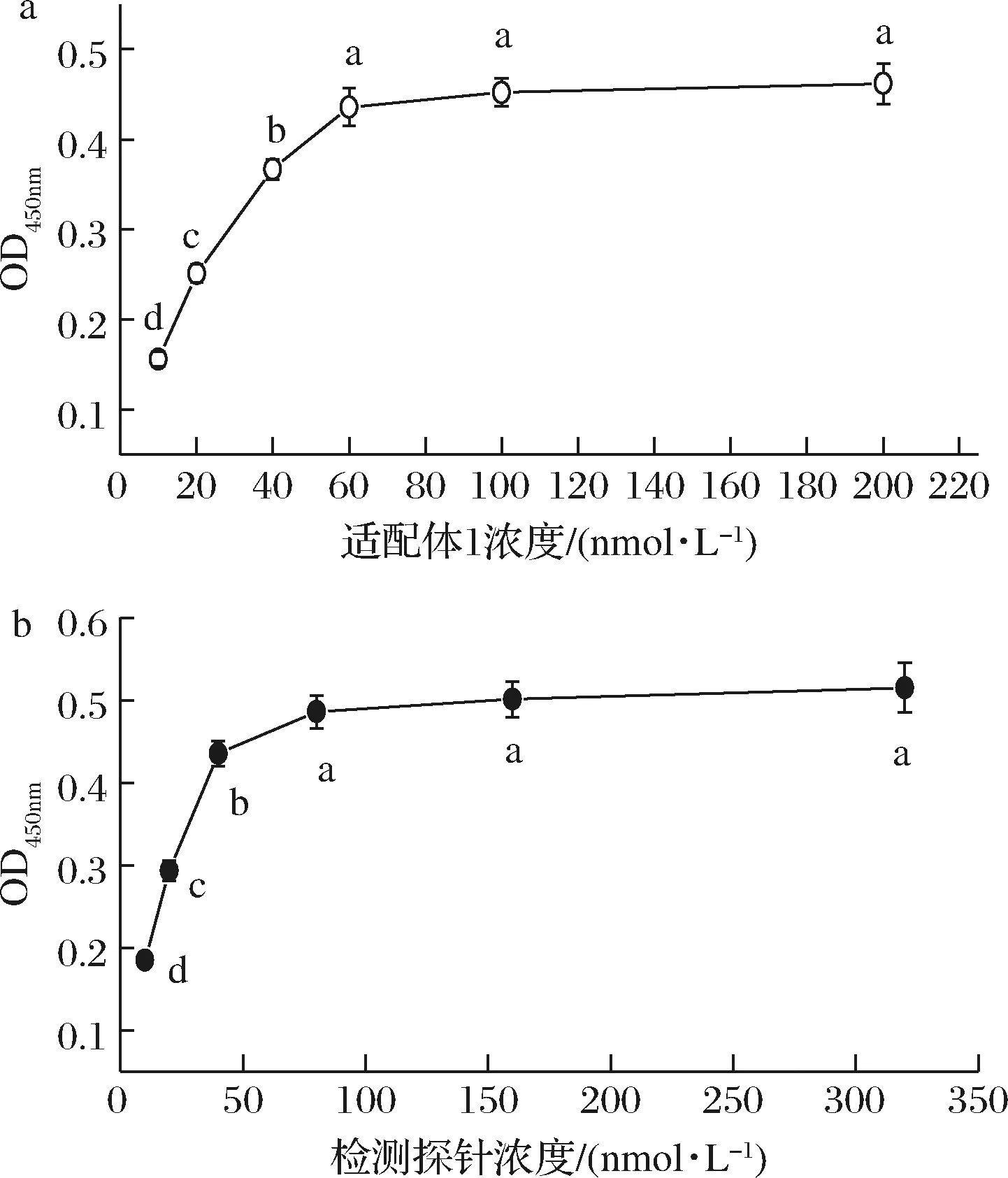
a-適配體;b-檢測探針圖1 適配體1和檢測探針濃度對檢測性能的影響Fig.1 Effect of concentration of aptamers 1 and detection probe on the detection performance注:不同字母表示差異顯著(P<0.05)(下同)
2.1.2 封閉條件
在酶聯適配體分析中,封閉酶標板上多余結合位點,降低SA-HRP非特異性吸附較為關鍵[20]。本實驗固定在適配體1包被濃度60 nmol/L,采用BSA封閉后直接加入SA-HRP(體積比1∶20 000),觀察BSA封閉濃度和封閉時間對SA-HRP非特異性吸附的影響。結果顯示(圖2),當BSA封閉質量濃度<5 g/L,吸光值較高,封閉不完全;隨著BSA濃度的進一步增加,吸光值逐漸下降,說明SA-HRP非特異性吸附逐漸降低,當BSA質量濃度>10 g/L后,吸光值變化不顯著(P>0.05)。另外,非特異性吸附隨著封閉時間的延長而降低,當10 g/L BSA封閉時間超過4 h后,吸光值無明顯變化(P>0.05)。綜上分析,選擇10 g/L BSA封閉4 h。

圖2 不同封閉條件對SA-HRP非特異性吸附的影響Fig.2 The influence of different blocking conditions on non-specific adsorption of SA-HRP注:小寫字母表示同一時間下不同BSA濃度組間顯著性分析,大寫字母表示同一BSA濃度下不同封閉時間組間顯著性分析
2.1.3 適配體與靶標結合時間
為保證靶標與適配體充分結合,本實驗固定以上優化條件,考察了適配體1及檢測探針與靶標的結合時間對檢測性能的影響。結果如圖3所示,吸光值隨著結合時間的增加而增大,當結合時間超過30 min后,反應基本達到飽和狀態,吸光值無明顯變化(P>0.05)。因此,后續實驗選擇結合時間為30 min。
2.1.4 發夾DNA(H1、H2)濃度及雜交時間
在HCR反應中,H1與H2通過互補錯位雜交而參與反應,因此一般兩者反應濃度比為1∶1。不同發夾DNA濃度對檢測性能的影響如圖4所示,吸光值隨著發夾DNA濃度增加而增大。當H1和H2濃度均達到80 nmol/L后,吸光值變化不顯著(P>0.05),可能是H1和H2濃度太大產生了空間位阻,導致雜交鏈的形成受到了影響。
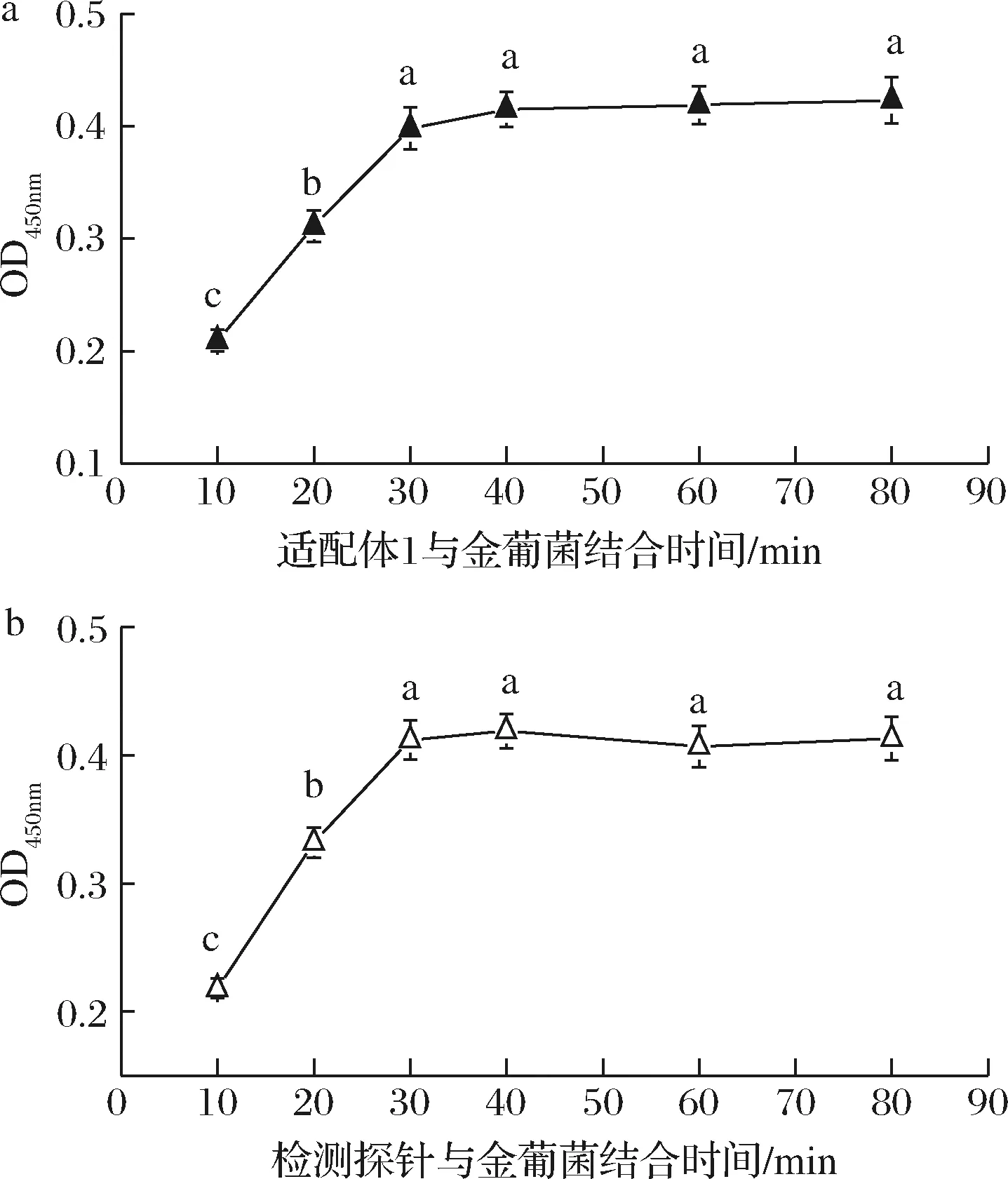
a-適配體1;b-檢測探針圖3 適配體與靶標結合時間對檢測性能的影響Fig.3 The effect of incubation time between S.aureus aptameron the detection performance
固定以上實驗條件,研究H1和H2雜交時間對檢測性能的影響。結果如圖4所示,隨著雜交時間的延長,吸光值逐漸增加,當時間達到60 min后,吸光值沒有顯著變化(P>0.05),說明雜交反應60 min左右基本達到飽和狀態。因此,H1和H2最佳反應濃度均為80 nmol/L,雜交時間選擇60 min。

a-H1和H2濃度;b-HCR雜交時間圖4 發夾探針(H1和H2)濃度及雜交時間對檢測性能的影響Fig.4 Effect of concentration and hybridization time of hairpin probe (HP1, HP2)on detection performance
2.1.5 SA-HRP濃度
SA-HRP是顯色反應的關鍵因素,SA-HRP 濃度過高易引起非特異性吸附,濃度過低則顯色反應不充分。本研究固定以上實驗條件,考察SA-HPR不同稀釋體積比(1∶10 000~1∶100 000)對檢測性能的影響。結果如圖5所示,SA-HRP稀釋比例在1∶10 000~1∶40 000時,吸光值變化不顯著(P>0.05),隨著稀釋比例進一步增大,與實驗組1∶10 000和1∶20 000相比,吸光值顯著降低(P<0.05)。故選擇SA-HRP稀釋比例為1∶40 000。
2.2 檢測性能評價
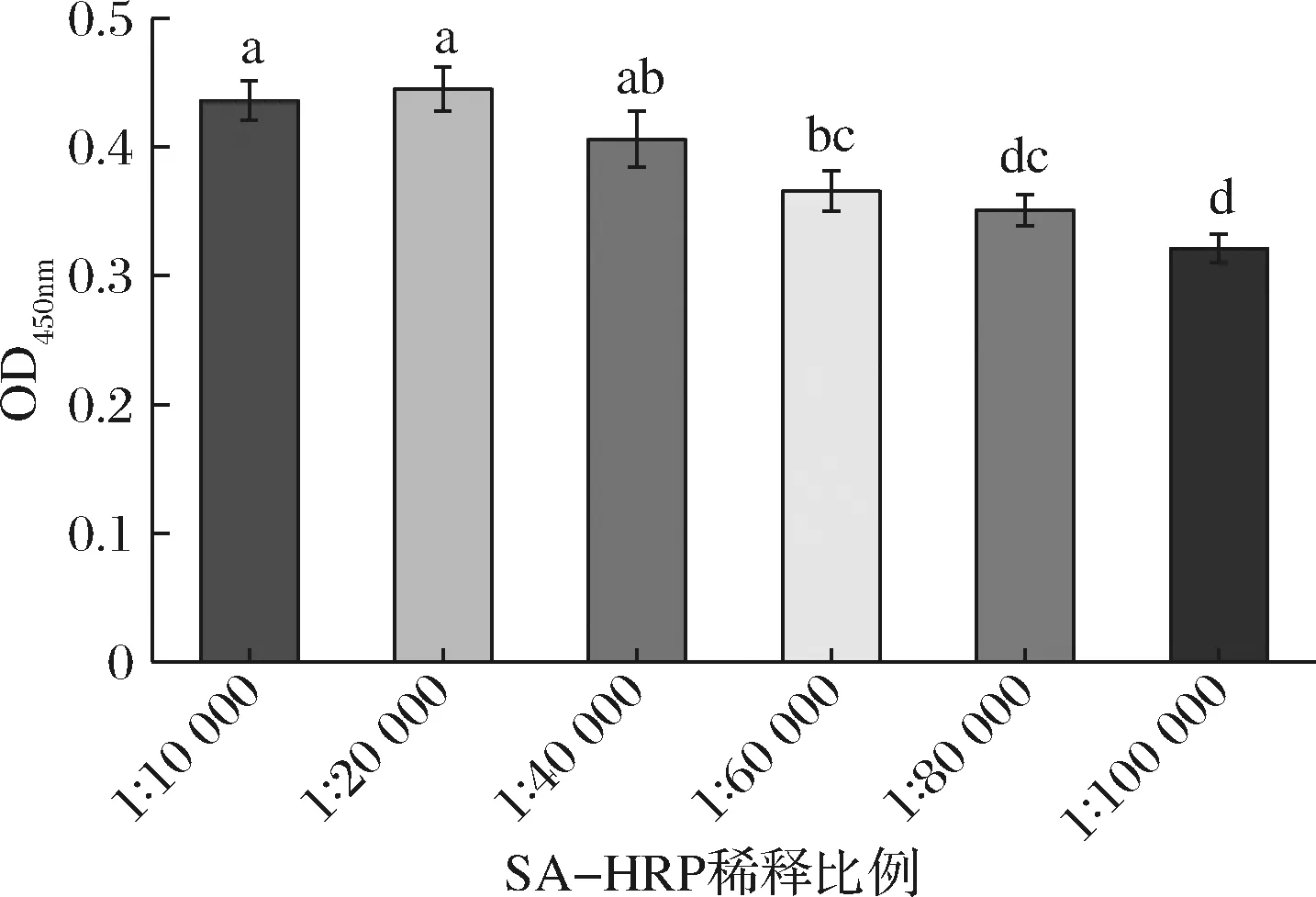
圖5 SA-HRP濃度對檢測性能的影響Fig.5 The effect of SA-HRP concentration on the detection performance
2.2.1 檢測限、線性范圍的確定
在優化條件下測定不同濃度的金葡菌(0、5、10、100、500、1 000、10 000、100 000 CFU/mL)。標準曲線如圖6所示,反應溶液吸光值隨著金葡菌濃度的增加而增大,吸光值強度在101~105CFU/mL呈良好線性關系,線性方程為y=0.140+0.497x,相關系數(R)為0.992。同時溶液顏色的變化與吸光值呈正相關,當金葡菌濃度為10 CFU/mL時,溶液顯色較明顯,故本方法可視化檢測限為10 CFU/mL。結果表明本方法具有高的靈敏度,完全可滿足食品中金葡菌限量值的檢測要求。
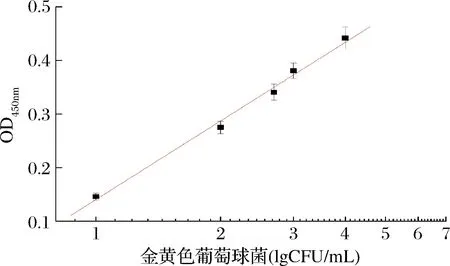
圖6 金葡菌濃度與吸光值(450 nm)的線性關系Fig.6 The plots of the absorbance versus at 450 nm versus S.aureus concentration
2.2.2 特異性分析
采用本方法檢測同等濃度的金葡菌、大腸桿菌、鼠傷寒沙門氏菌、單增李斯特菌等致病菌,同時設置空白對照,以評估本方法的特異性。結果如圖7所示,其余幾種致病菌引起的吸光值與空白對照組相近,說明適配體與其余致病菌無交叉反應,本方法具有高的特異性。
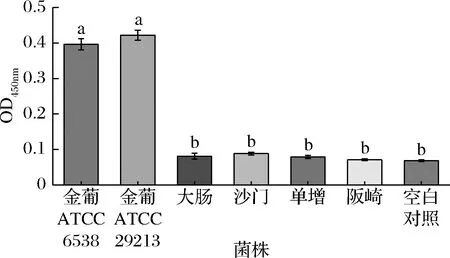
圖7 特異性分析Fig.7 Specificity analysis
2.2.3 方法的應用
通過加標回收實驗將本方法應用于實際樣品檢測,檢測結果與國標法[18]對比驗證。結果如表2所示,兩種方法的檢測結果沒有明顯差異(P>0.05),本方法加標回收率為91.8%~98.2%,相對標準偏差<6%,表明檢測結果準確可靠實。
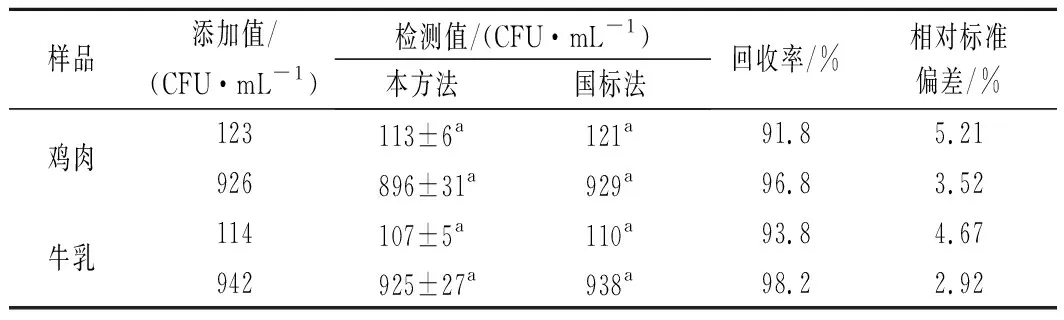
表2 加標回收率(n=3)Table 2 Recovery rates of S.aureus in spiked foods
2.2.4 方法的比較
與基于適配體的其他快速檢測方法相比(表3),本方法具有高靈敏度、高準確性、操作簡單、檢測結果直觀等優點。與電化學、拉曼生物傳感及壓電傳感檢測方法相比,本方法不需修飾電極,不需特殊專業設備。與基于納米材料的比色法和熒光法比較,不需制備納米材料和對適配體進行功能化修飾。與抗原-抗體識別原理的免疫分析技術相比,本方法具有識別分子易獲得、成本低廉等優點,可極大降低檢測成本。
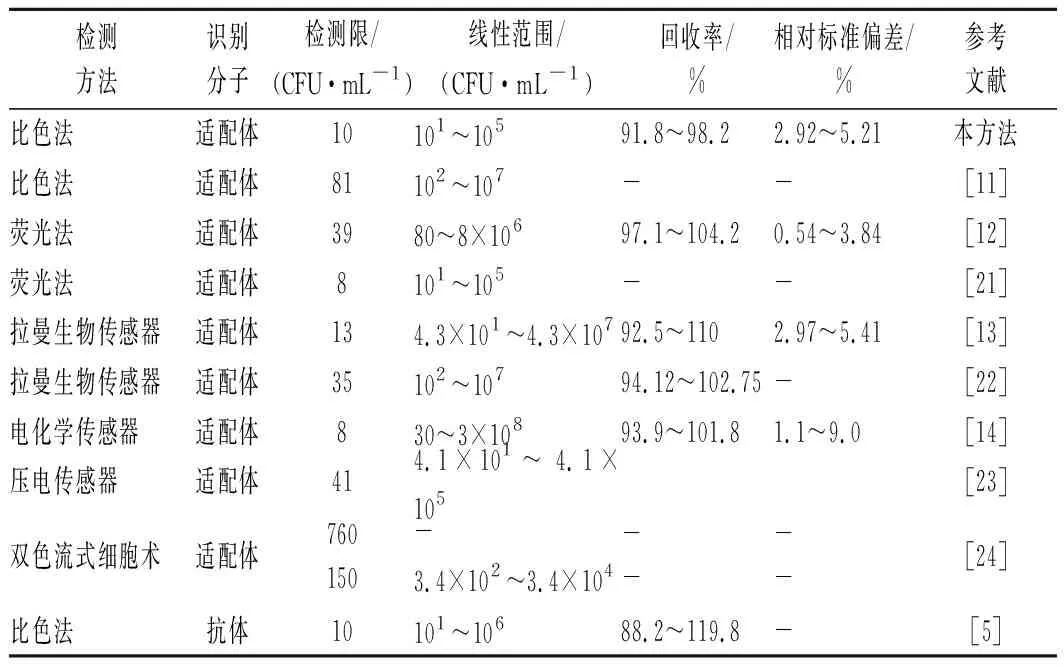
表3 金黃色葡萄球菌檢測方法比較Table 3 Comparison of analytical performance of the proposed methods for the detection of S.aureus
3 結論
本研究以金黃色葡萄球菌適配體為識別分子,結合HCR信號放大策略,建立了一種高靈敏、高通量的金黃色葡萄球菌快速檢測新方法。在優化條件下,金黃色葡萄球菌的檢測線性范圍為101~105CFU/mL,可視化檢測限為10 CFU/mL,在雞肉和牛乳中加標回收率達到91.8%~98.2%,檢測結果與國標方法無顯著差異。本方法前處理簡單,樣品不需要增菌,檢測靈敏度高,成本較低,更有利于現場檢測,對于其他食源性致病及目標物的檢測具有一定的借鑒和參考價值。

