雙響應值聯合優化藥桑葚酵素發酵工藝及其抗氧化性的研究
呂明珊,袁藝洋,邢軍,王亮,艾合買提江·艾海提,茹先古麗·買買提依明*
(1.新疆大學 生命科學與技術學院,烏魯木齊 830046;2.華南農業大學 食品學院,廣州 510642)
新疆藥桑在植物分類學上屬桑科(Moraceac)、桑屬(MorusL.)、黑桑種(MorusnigraL.)[1],是新疆特有生長環境下的桑種資源。藥桑葚富含多種氨基酸和固形物等營養物質,是新疆地區的民間藥材。藥桑性寒、無毒,具有保肝護肝,治療耳眼不靈,緩解風濕性關節疼痛等藥用價值。藥桑葚中多酚類化合物[2-3]、還原糖含量、總黃酮[4]和維生素含量均高于其他桑葚。但藥桑葚屬于季節性果蔬,果肉軟嫩多汁,不易儲存及運輸,常被加工成果酒、果醋、果醬、冰淇淋、糖漿等[5]。但藥桑葚酵素這種生物發酵制品卻很少見,與之相關的文獻也不多。
酵素是一種利用微生物進行發酵得到的保健食品,其采用各種水果、蔬菜,經過前處理后使用乳酸菌進行發酵,其產物富含各種有機酸[6]、維生素、多酚類化合物等。且果蔬汁經過發酵后較好地豐富了其原本的口感,發酵時產生的發酵產物還能起到調節腸道菌群、促進消化、抗炎、抗氧化等作用[7-8]。以藥桑葚為原材料制作酵素不但解決了藥桑葚不易儲存的問題,而且能滿足消費者們對營養的需求。現報道的新疆藥桑葚發酵果汁的發酵工藝多為單菌發酵,但是近年來有研究發現混菌發酵更能豐富酵素的營養和口感,不同乳酸菌發酵時利用碳水化合物產生乳酸等有機酸和風味物質,使酵素的口感更佳[9]。
超氧化物歧化酶(SOD)是人體內一種抗氧化酶,具有抗衰、抗疲勞的效果[10],同時也是評判酵素營養價值的重要指標,從藥桑葚中提取出的酚類化合物被證實擁有較強的自由基清除能力[11],故而以總酚質量濃度和SOD活力為指標優化發酵工藝。本實驗通過研究藥桑葚酵素工藝優化提高酵素內SOD活力、總酚含量,得到最優的藥桑葚酵素發酵工藝條件,并研究用最優工藝條件制得的藥桑葚酵素樣品的SOD值、總酚含量及抗氧化能力。
1 材料與方法
1.1 材料與試劑
藥桑葚:新疆阿克蘇地區庫車市生產;乳酸菌:中國微生物菌種保藏中心;福林酚試劑(1 mol/L):上海源葉生物科技有限公司;沒食子酸標準品(HPLC≥98%):天津市盛奧化學試劑有限公司;MRS肉湯培養基:北京奧博星生物技術有限公司;果膠酶、纖維素酶、半纖維素酶:諾維信有限公司。
1.2 儀器與設備
DHP-9052恒溫培養箱 上海齊欣科學儀器有限公司;WZS手持式糖度計 上海儀電物理光學儀器有限公司;HH數顯恒溫水浴鍋、KX-101恒溫干燥箱、RH-QG全溫振蕩器/搖床 江蘇科析儀器有限公司;1004分析天平 上海越平科學儀器有限公司;SW-CJ-2G超凈工作臺 上海滬凈醫療器械有限公司;LS-150LD立式壓力蒸汽滅菌器 江陰濱江醫療設備有限公司;UV752紫外可見分光光度計 上海佑科儀器儀表有限公司。
1.3 實驗方法
1.3.1 藥桑葚酵素工藝流程
新鮮的藥桑葚→打漿→酶解→調固形物→滅酶→(菌種→活化→擴大培養)接種→發酵→終止發酵→罐裝→4 ℃儲藏。
1.3.1.1 菌種活化及培養
乳酸菌:MRS液體培養基,在37 ℃恒溫培養箱中培養24 h,傳代2~3次備用。
1.3.1.2 藥桑葚酵素工藝要點
經過之前的工作,確定了最佳的藥桑葚發酵菌種配方為鼠李糖乳桿菌∶副干酪乳桿菌為1∶3,本文將應用這一配方進行藥桑葚酵素的工藝條件優化和抗氧化性評估。
選取紫色、成熟的藥桑葚,剔除病害果。使用破壁機打漿,將果汁放入1000 mL三角瓶中,酶添加量0.4%(果膠酶∶纖維素酶∶半纖維素酶為2∶1∶1)后放置在55 ℃恒溫水浴鍋內酶解3 h,調固形物,85 ℃滅酶30 min,冷卻至37 ℃接種,藥桑葚汁中菌密度為8.33×106CFU/mL,然后用膠塞封閉瓶口進行厭氧發酵,發酵時間為16.4 h。
1.3.2 測定方法
1.3.2.1 總酚質量濃度的測定
總酚質量濃度的測定采用福林酚法[12]。采用0~0.02 mg/mL的沒食子酸標準溶液制作標準曲線,得線性回歸方程為:y=0.8686x+0.0053(x為沒食子酸質量濃度,mg/mL;y為吸光值),R2=0.9987。根據線性回歸方程計算樣液的總酚質量濃度。
1.3.2.2 SOD活力的檢測
利用SOD活力檢測試劑盒進行檢測。
1.3.2.3 羥自由基清除率的測定[13]
藥桑葚酵素用去離子水稀釋,配制成濃度為10,20,30,40,50 mg/mL的酵素稀釋液;每組取0.5 mL 9 mmol/mL FeSO4溶液,0.5 mL 9 mmol/mL水楊酸溶液加入已標記的試管中,搖勻,分別加入1 mL不同濃度的酵素溶液,空白組加入1 mL去離子水,最后加入0.5 mL 9 mmol/mL H2O2溶液,搖勻后于37 ℃水浴避光加熱反應15 min后取出,用去離子水代替H2O2溶液的本底作為參比在510 nm處測定吸光度值。
式中:W為羥自由基清除率;A0為空白組吸光度;A1為實驗組吸光度;A2為參比吸光度。
1.3.2.4 DPPH自由基清除率的測定[14]
藥桑葚酵素用去離子水稀釋,配制成濃度為10,20,30,40,50 mg/mL的酵素稀釋液;每組取2 mL 0.2 mmol/mL DPPH溶液(由無水乙醇配制)加入標記好的試管中,再分別加入2 mL不同濃度的酵素溶液,空白組加入等量去離子水;常溫下避光反應30 min,以無水乙醇代替DPPH溶液的本底作為參比,測定其在517 nm下的吸光度值。
式中:W為DPPH自由基清除率;A0為空白組吸光度;A1為實驗組吸光度;A2為參比吸光度。
1.3.3 單因素實驗
1.3.3.1 發酵時間的選取
在發酵溫度37 ℃,總乳酸菌接種量6×106CFU/mL,固形物添加量1.5 °Brix,總酶添加量0.4%,酶解時間3 h,測定發酵時間0,3,6,9,12,15,18,21 h時發酵液的SOD活力及總酚含量。
1.3.3.2 最佳發酵溫度的選取
其他條件同1.3.3.1,測定發酵時間15 h,發酵溫度27,32,37,42,47 ℃時5個樣品中發酵液的SOD活力及總酚含量。
1.3.3.3 最佳接種量的選取
其他條件同1.3.3.1,測定發酵時間15 h,總乳酸菌接種量1×106,3×106,6×106,9×106,12×106,15×106CFU/mL時6個樣品中發酵液的SOD活力及總酚含量。
1.3.3.4 最佳固形物添加量的選取
其他條件同1.3.3.1,測定發酵時間15 h,固形物添加量0,0.5,1,1.5,2,2.5,3 °Brix時7個樣品中發酵液的SOD活力及總酚含量。
1.3.4 響應面優化藥桑葚酵素工藝
在單因素實驗的基礎上,使用Design Expert軟件,根據Box-Behnken的中心組合設計原理,選擇發酵時間(A)、發酵溫度(B)、接種量(C)、固形物添加量(D)為自變量,以發酵液的SOD活力、總酚含量為響應值,采用響應面分析法,設計四因素三水平實驗,因素水平見表1,對藥桑葚酵素發酵工藝參數進行優化。
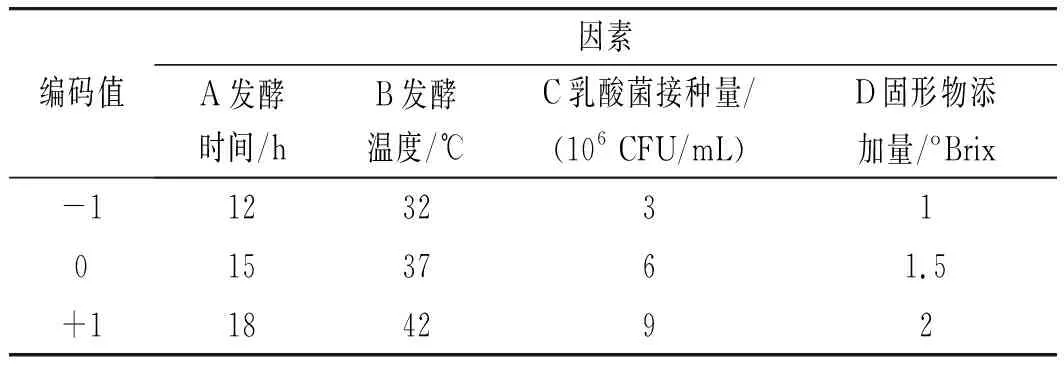
表1 Box-Behnken試驗設計因素水平
1.4 數據處理與分析
所有數據均為3次以上實驗的平均值±標準誤差。實驗數據采用SPSS 24.0進行分析,使用GraphPad Prism 8進行作圖。
2 結果與分析
2.1 單因素實驗結果
2.1.1 發酵時間對發酵液的影響
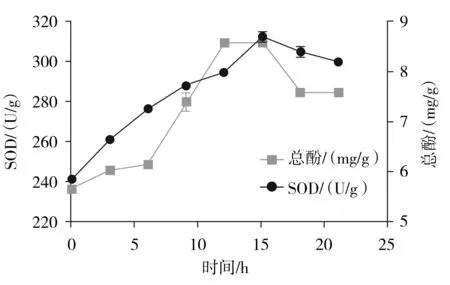
圖1 發酵時間對發酵液中SOD活力和總酚含量的影響Fig.1 Effect of fermentation time on SOD activity and total phenol content in fermentation broth
實驗所用乳酸菌進入對數生長期所需時間為6 h,進入穩定期所需培養時長為12 h,酵素中發酵產物隨著時間的增加不斷積累。由圖1可知,3~15 h,SOD活力迅速增長,SOD活力在15 h時達到最大值313 U/g,18 h后SOD活力呈現緩慢降低的趨勢。總酚質量濃度在12 h時達到最大值8.58 mg/g,隨著時間繼續增加,總酚質量濃度下降至7.58 mg/g,所以選擇發酵時間15 h較為合理。
2.1.2 發酵溫度對發酵液的影響

圖2 發酵溫度對發酵液中SOD活力和總酚含量的影響Fig.2 Effect of fermentation temperature on SOD activity and total phenol content in fermentation broth
發酵溫度是影響SOD值和總酚質量濃度的關鍵因素,由圖2可知,隨著溫度的升高,SOD活力在37 ℃時達到最高值311 U/g,隨著溫度繼續升高,SOD值持續下降。總酚質量濃度在32~37 ℃持續升高直至37 ℃時達到最高值8.52 mg/g,37 ℃后呈下降趨勢。乳酸菌的適宜生長溫度一般在30~37 ℃,兩者的下降可能是由于溫度過高影響菌體生長,導致SOD活力和總酚合成能力下降,因此最佳發酵溫度為37 ℃。
2.1.3 接種量對發酵液的影響

圖3 接種量對發酵液中SOD活力和總酚含量的影響Fig.3 Effect of inoculation amount on SOD activity and total phenol content in fermentation broth
由圖3可知,當乳酸菌接種量較低時,其生長代謝速度緩慢,代謝產物的SOD活力和總酚含量都明顯較低,當接種量達到6×106CFU/mL時,乳酸菌生長代謝速度適中,SOD活力達到最大值311 U/g,總酚質量濃度也達到最大值8.59 mg/g。當接種量增至9×106CFU/mL時,相較接種量6×106CFU/mL無顯著差異。當接種量達到1.2×107CFU/mL時,因為乳酸菌的生長代謝速度過快,發酵過度,總酸含量過高,從而影響SOD活力。適當增加乳酸菌含量,其代謝產物有機酸和固形物的存在有利于酚類物質的溶出。同時,大分子酚類物質降解成小分子酚類物質也能夠增加總酚的質量濃度[15],故選擇接種量為6×106CFU/mL最佳。
2.1.4 固形物添加量對發酵液的影響

圖4 固形物添加量對發酵液中SOD活力和總酚含量的影響Fig.4 Effect of solids additive amount on SOD activity and total phenol content in fermentation broth
由圖4可知,SOD活力隨著固形物添加量的增高呈現上升趨勢,但總體變化趨勢不明顯。隨著固形物添加量增大至1.5 °Brix,SOD活力達到最大值316 U/g。總酚質量濃度隨著固形物添加量的增高在1.5 °Brix時達到最大值8.58 mg/g,隨著固形物添加量的繼續增高,總酚質量濃度迅速下降,故選擇1.5 °Brix固形物添加量較為合適。
2.2 響應面法優化藥桑葚酵素發酵工藝
2.2.1 響應面實驗方差分析及結果
在單因素實驗的基礎上,根據Box-Behnken中心組合設計原理,選取發酵時間(A)、發酵溫度(B)、乳酸菌接種量(C)和固形物添加量(D)作為響應面優化的考察因素,以產品的SOD活力和總酚質量濃度為響應值,設計四因素三水平實驗,實驗結果見表2。

表2 響應面實驗結果Table 2 The experimental results of response surface
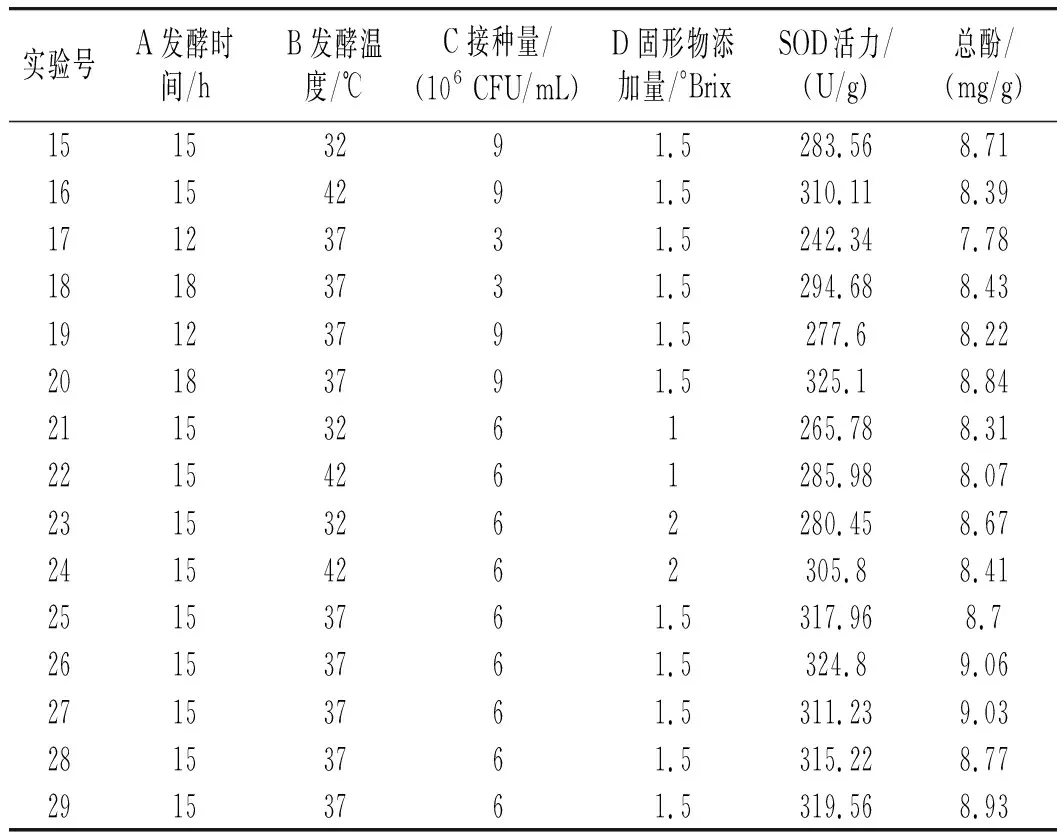
續 表
采用 Design-Expert 8.0.6 軟件進行多元回歸擬合,得出SOD活力(Y1)和總酚質量濃度(Y2)對發酵時間(A)、發酵溫度(B)、接種量(C)、固形物添加量(D)的二次多項回歸方程為分別為:
Y1=317.75+23.81A+11.17B+15.65C+9.36D-5.49AB-1.21AC-2.39AD+1.33BC+1.29BD+3.81CD-20.59A2-24.49B2-12.66C2-9.18D2。
(1)
Y2=8.90+0.34A-0.11B+0.22C+0.19D-0.022AB-7.500E-003AC-2.500E-003AD-0.067BC-5.000E-003BD-0.020CD-0.51A2-0.46B2-0.093C2-0.097D2。
(2)
式(1)、式(2)中:Y1為SOD活力,Y2為總酚質量濃度,A為發酵時間,B為發酵溫度,C為接種量,D為固形物添加量。
SOD的方差分析和顯著性檢驗結果見表3。
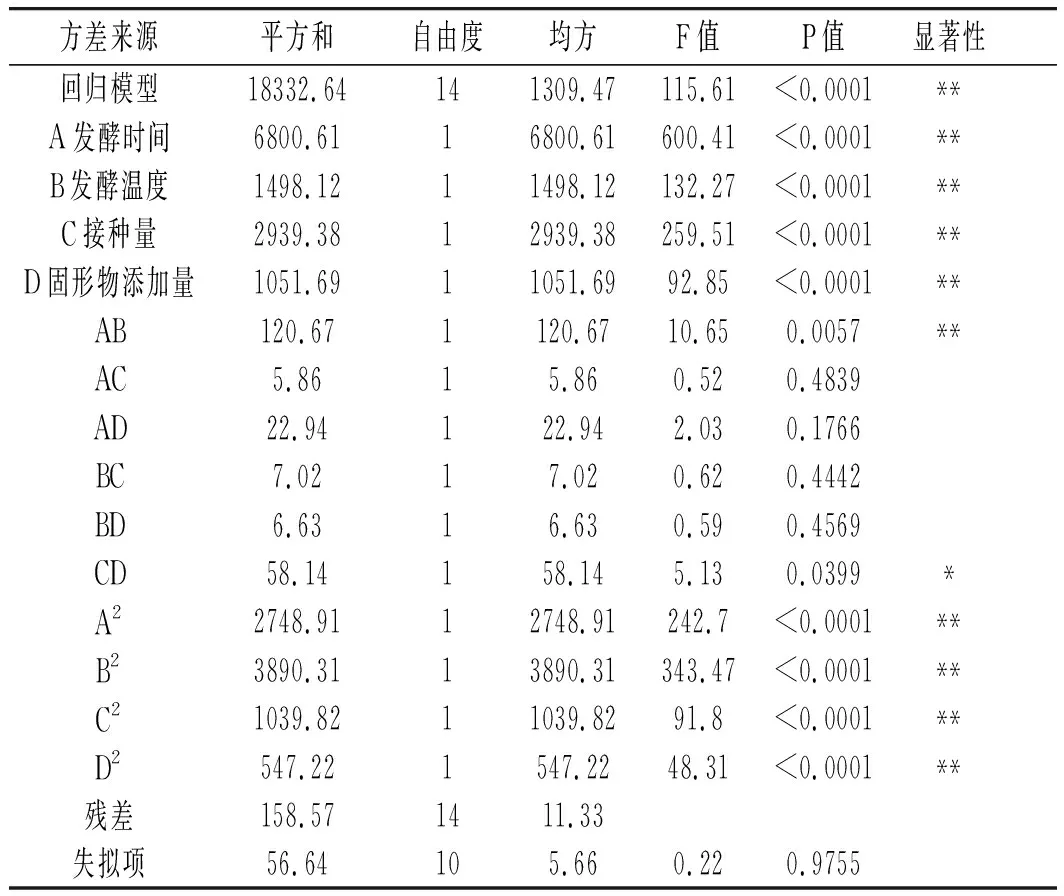
表3 SOD活力回歸模型方差分析及顯著性檢驗

續 表

表4 總酚質量濃度回歸模型方差分析及顯著性檢驗Table 4 Analysis of variance and significance test of regression model of total phenol concentration
由表3和表4可知,兩個回歸方程模型極顯著(P<0.0001),失擬項檢驗結果不顯著。相關系數R2(SOD活力)是0.9914,R2(總酚質量濃度)是0.9706,表明SOD活力和總酚質量濃度的實測值和預測值之間擬合度較好,所以此模型擬合效果好,可用來分析預測乳酸菌發酵藥桑葚酵素的工藝參數。
各因素對SOD活力的影響為 A(發酵時間)>C(接種量)>B(發酵溫度)>D(固形物添加量),各因素對總酚質量濃度的影響為A(發酵時間)>C(接種量)>D(固形物添加量)>B(發酵溫度)。
2.2.2 響應面分析各因素交互作用對發酵藥桑葚汁SOD活力和總酚質量濃度的影響
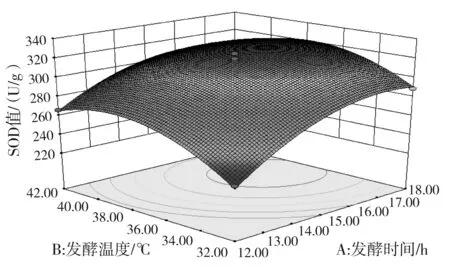
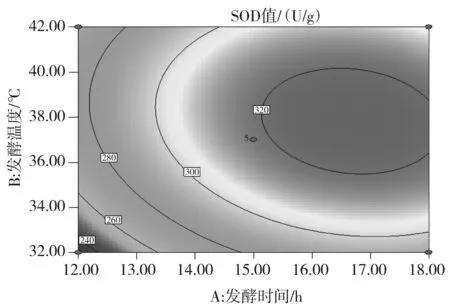
a.發酵溫度和發酵時間對SOD活力的交互影響
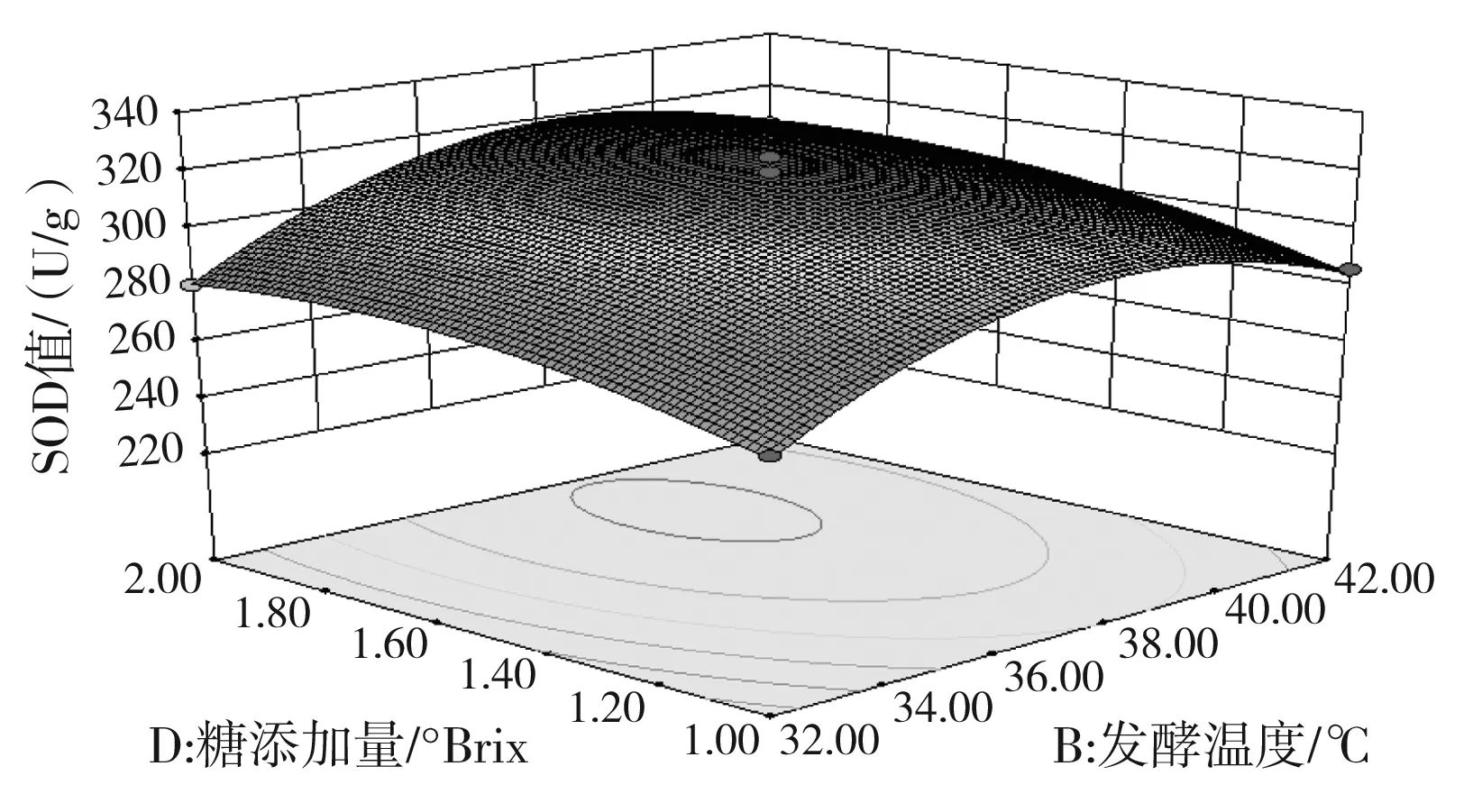

b.發酵溫度和固形物添加量對SOD活力的交互影響

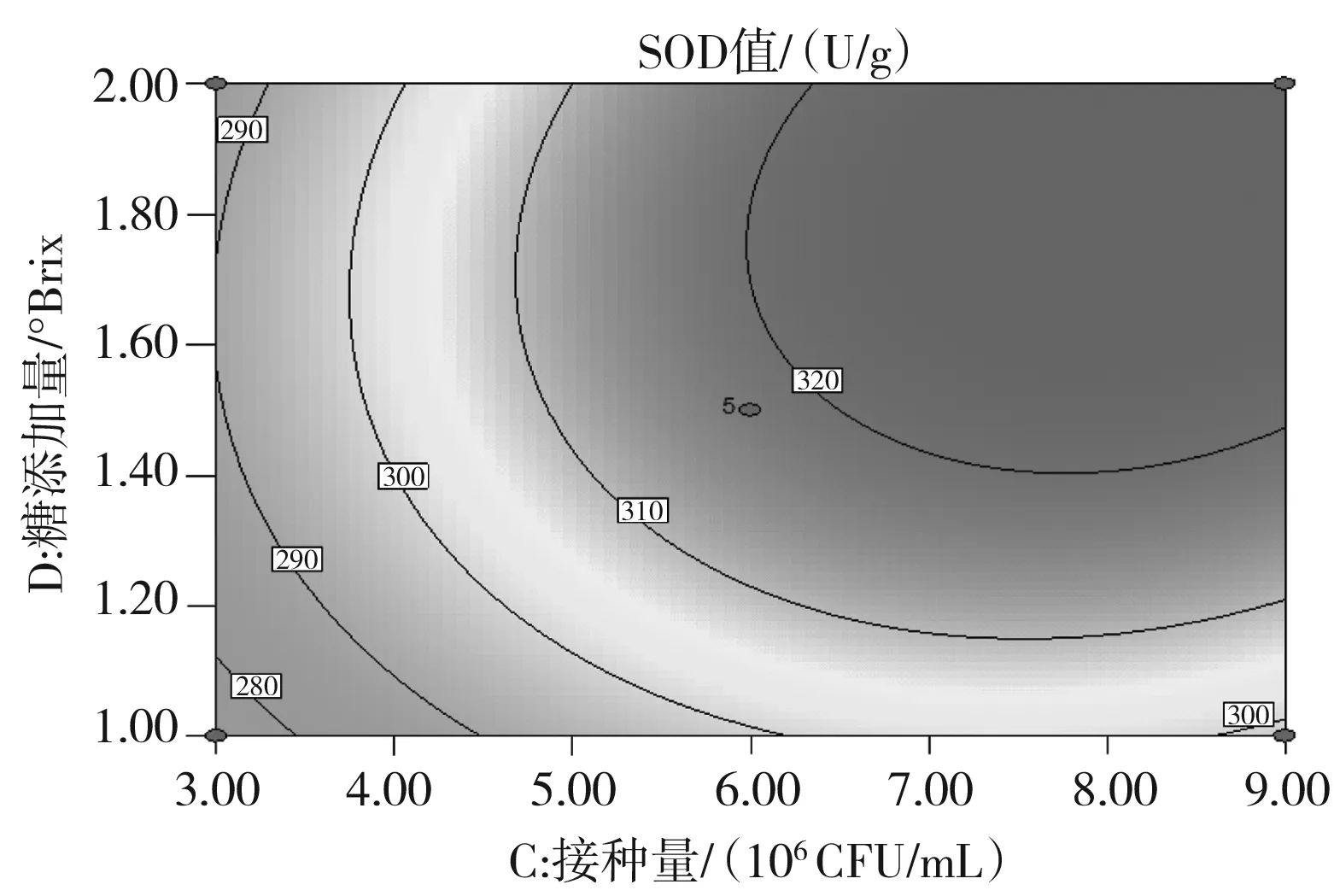
c.接種量和固形物添加量對SOD活力的交互影響


d.發酵時間和發酵溫度對總酚含量的交互影響
由圖 5可知,發酵時間與發酵溫度、接種量與固形物添加量的交互作用對SOD活力影響的顯著性與表3中交互項P值的分析結果一致。此外,等高線的形狀亦可以判斷交互作用的強弱,由圖5中b可知,發酵溫度與固形物添加量的交互作用也顯現出顯著性良好的橢圓形,等高線的頂點就是響應值SOD活力的最大值。a,b,c,d的響應面圖像均開口朝下,表明兩個響應值隨著各個因素值的增大而呈現出增大的趨勢,達到響應值最大值后,響應值即隨著因素值的增大而減小,此時,響應面的頂點處為響應值的最大值。
經Design-Expert 8.0.6軟件分析得到的最佳優化條件為發酵時間為16.37 h,發酵溫度36.23 ℃,乳酸菌接種量8.33×106CFU/mL,固形物添加量1.59 °Brix。采用這一結果并結合實際條件,發酵條件改為:發酵時間為16.4 h,發酵溫度36 ℃,乳酸菌接種量8.33×106CFU/mL,固形物添加量1.6 °Brix,得到的試驗結果為SOD活力329 U/g,總酚含量9.11 mg/g。與理論預測值基本一致,建立的模型很好地提高了發酵產物的SOD活力,同時也保證了總酚的質量濃度處于較高水平,模型較好地反映了發酵溫度和發酵時間是對發酵結果影響最大的因素。
2.3 抗氧化性實驗結果
2.3.1 藥桑葚酵素對羥自由基的清除能力

圖6 藥桑葚酵素對·OH清除能力Fig.6 The scavenging ability of Morus nigra L. enzyme on ·OH
羥自由基具有較強的抗氧化能力是評判樣品抗氧化性的一個重要指標。由圖6可知,藥桑葚酵素對羥自由基有很強的清除作用,并且隨著藥桑葚濃度增至40 mg/mL時羥自由基清除率達到最大值93.71%。結果表明,藥桑葚酵素具有羥自由基清除能力,且隨著藥桑葚濃度的增加清除率隨之增加。
2.3.2 藥桑葚酵素對DPPH自由基的清除能力

圖7 藥桑葚酵素對DPPH·清除能力Fig.7 The scavenging ability of Morus nigra L. enzyme on DPPH·
DPPH自由基是一種穩定的自由基,當具有抗氧化性的物質進入DPPH溶液中時,其吸光值會發生改變。由圖7可知,藥桑葚酵素對DPPH自由基的清除率隨著酵素濃度的升高而升高,加入低濃度酵素樣品時即表現出很強的自由基清除能力(90.85%),當藥桑葚酵素濃度為30 mg/mL時清除率穩定在97%左右,說明藥桑葚酵素對DPPH自由基的清除能力很強。
3 結論
這項工作通過單因素實驗確定了藥桑葚酵素混菌發酵響應面實驗的條件,并利用SOD活力、總酚質量濃度雙響應值聯合確定了藥桑葚酵素混菌發酵的最佳條件:發酵時間為16.4 h,發酵溫度36 ℃,乳酸菌接種量8.33×106CFU/mL,固形物添加量1.6 °Brix。得到的試驗結果為SOD活力329 U/g,總酚含量9.11 mg/g。并對所得到的藥桑葚酵素進行抗氧化性評估,DPPH自由基最大清除率達到97%,羥自由基清除率最大值為93.71%。藥桑葚酵素具有良好的抗氧化性,作為一種酵素飲品可以很好地滿足人們對營養的需求。

