基于GEO數據庫的肺纖維化相關差異表達基因生物信息學分析
冉小琴 姚欽 姜望予 屠思懿 龍夢 陳芳*
間質性肺病(Interstitial lung disease,ILD)是一類異質性疾病,以進行性發展的肺實質炎癥和纖維化為特征。特發性肺纖維化(Idiopathic pulmonary fibrosis,IPF)是ILD 中的特殊類型,病因不明,在老年男性、有吸煙史等群體中發病率高。相較其他類型ILD,IPF 預后差,死亡率逐年遞增,中位生存期2~3 年[1]。臨床上多使用抗纖維化、抗氧化、抗炎藥物等治療IPF,但存在藥品昂貴、副作用大等情況。生物信息學是跨學科領域,它結合了生物學、計算機和統計學來分析和解釋生物數據中所含的生物學意義。隨著公共數據庫的不斷完善,可以利用生物信息學方法來挖掘公共數據庫中肺纖維化的差異表達基因并進行分析,為探索IPF 的發病機制提供理論依據,為疾病的診治提供新思路及新方向。
1 資料與方法
1.1 IPF基因表達數據獲取 使用NCBI(National center for biotechnology)的GEO 在線數據庫(https://www.ncbi.nlm.nih.gov/gds/),以“Idiopathic pulmonary fibrosis”為關鍵詞進行檢索,芯片來源選擇“Homo sapiens”,獲得以GPL6480 為平臺的GSE53845 數據集,其中包括40份IPF 患者和8 份正常肺組織的基因表達數據。
1.2 差異表達基因篩選 使用GEO 數據庫在線分析工具GEO2R(https://www.ncbi.nlm.nih.gov/geo/geo2r/)獲取出IPF 與正常肺組織的差異表達基因原始數據,隨后以P值<0.01 且|log2 FC|>2(FC 為差異倍數)作為截斷值篩選出顯著差異表達基因,其中log2 FC>2 為上調基因,log2 FC<-2 為下調基因,并繪制火山圖。選取上調的前10 個基因與下調的前10 個基因,將其調整為二維矩陣格式后導入熱圖繪制網站(http://www.heatmapper.ca/expression/),使用該網站在線繪制聚類熱圖。
1.3 GO 與KEGG 通路富集分析 將所獲得的顯著差異基因導入DAVID(富集分析)數據庫(2021 版)(https://david.ncifcrf.gov/)并進行GO 與KEGG 通路富集分析。在GO 分析中輸出差異基因的前十條分子功能(molecular function)分析,在KEGG 通路富集分析中以P<0.05 輸出通路富集分析結果。
1.4 PPI 網絡構建與可視化分析 在STRING 數據庫(https://cn.string-db.org/)中輸入所獲得的顯著差異表達基因,進行蛋白互作(PPI)網絡構建。將所獲得的數據導出后使用Cytoscape 軟件對其進行可視化分析,利用Cytoscape中的Cytohubba插件對差異基因使用3種常規算法(MCC、Degree、Closeness)進行篩選,以每一種算法所獲得的前十位基因作為IPF 發病相關的核心基因。
2 結果
2.1 差異基因篩選結果 根據篩選條件,在數據集GSE53845 中,IPF 組和健康組之間共得到148 個差異表達基因,其中上調基因108 個,下調基因40 個。繪制火山圖(見圖1)其中紅色表示上調的表達基因,綠色表示下調的表達基因,黑色表示無明顯表達差異的基因,繪制聚類熱圖(見圖2)。
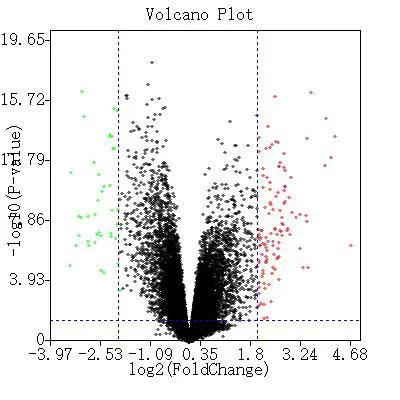
圖1 差異表達基因火山圖
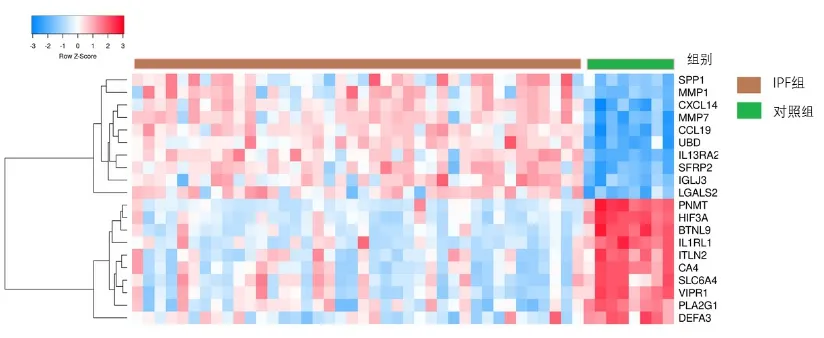
圖2 顯著差異表達基因聚類熱圖
2.2 差異基因的GO 與KEGG 通路富集分析 GO 分析顯示在分子功能方面,差異基因多富集于蛋白酶連接、趨化因子活性、免疫球蛋白受體結合、細胞外基質結構成分、細胞因子活性等(見表1)。KEGG 通路富集分析顯示差異基因多富集于細胞因子-細胞因子受體相互作用、蛋白質消化吸收、NF-κB 信號通路、趨化因子信號通路等(見表2)。

表1 差異基因GO富集分析結果
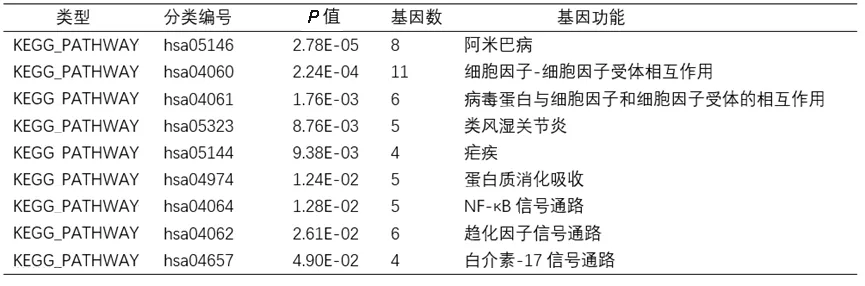
表2 差異基因KEGG通路富集分析結果
2.3 差異基因的PPI 網絡構建與關鍵基因篩選 將所獲得的148 個差異表達基因導入STRING 數據庫,構建PPI 網絡(見圖3)。再用Cytoscape 進行可視化分析(見圖4),其中紅色表示表達上調的基因,藍色表示表達下調的基因;最后使用Hubba 插件中的MCC、Degree、Closeness 算法得到12 個關鍵基因(CXCL12、MMP1、MMP7、CXCL1、SPP1、VCAM1、COL1A1、CCL2、CCR7、CCL19、SELE、THY1),(見圖5)。
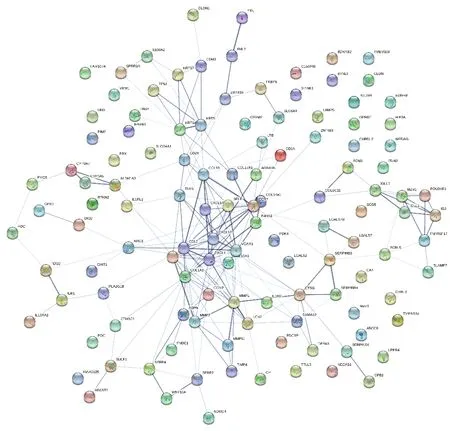
圖3 差異基因的蛋白互作網絡
圖4 差異表達基因的Cytoscape可視化分析
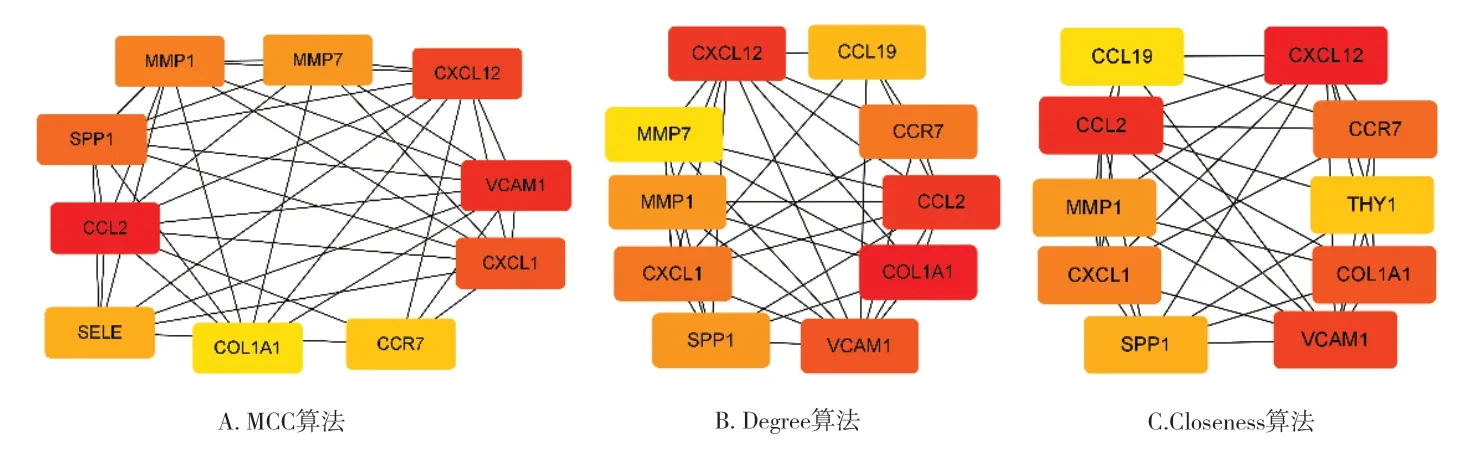
圖5 3種算法結果排名前10基因相互作用關系(節點顏色越深表示各算法分值越高)
3 討論
特發性肺纖維化屬于一種致死性、進行性發展的肺部疾病,病因不明,以肺間質彌漫性滲出、浸潤和纖維化為主要病變[2]。當前針對肺纖維化的治療主要包括藥物、肺康復、終末期肺移植等[3];藥物主要分為抗纖維化、抗氧化以及抗炎三類。目前臨床上公認的抗纖維化藥物包括吡非尼酮、尼達尼布,相關臨床研究報道[4]其具有減慢肺功能下降速度、改善生活質量等作用。但同時存在用藥周期長、價格高昂、副作用大等情況。隨著大數據時代的到來,生物信息學等技術得到了飛速發展,也為IPF 作用機制的研究提供了新方法新思路。
本研究通過篩選GEO 數據庫中的GSE53845 數據集得到特發性肺纖維化與正常肺組織差異表達的148個基因,其中在病變組織高表達的基因共108 個、低表達的基因共40 個,通過GO 與KEGG 通路富集分析獲得相關分子功能與作用通路。在分子功能分析方面,趨化因子活性分子功能相關研究[5]涉及支氣管哮喘等肺部疾病;細胞外基質結構成分相關研究[6]涉及支氣管發育不良等;細胞因子活性分子功能所涉及研究較多,全身各系統疾病[7]均與其相關,包括但不限于膿毒癥、腫瘤等。在通路富集分析方面,NF-κB 信號通路和趨化因子信號通路存在作用通路的重疊,在呼吸系統[8]中NF-kB 信號通路研究多見于肺損傷、哮喘等疾病。
通過Cytoscape 中的插件獲取到CXCL12、MMP1、MMP7、CXCL1、SPP1、VCAM1、COL1A1、CCL2、CCR7、CCL19、SELE、THY1 等12 個基因,通過對比上述基因的GO 分子功能分析與KEGG 通路富集分析及綜合MCC、Degree、Closeness 等算法篩除SELE、THY1,對余下10 個基因進行分析,此10 位基因在IPF 患者中均為高表達。VCAM-1(血管細胞黏附分子1)由VCAM1基因表達,其多存在于血管內皮細胞表面,在血管內皮細胞及細胞外基質和白細胞之間充當介質作用,使細胞與細胞之間或細胞與細胞外基質之間相互黏連。在炎癥發生時,VCAM-1 作為一種炎性介質,可參與中性粒細胞、嗜酸性粒細胞等炎癥細胞的黏附與遷移過程。目前在肺纖維化的相關研究中,VCAM-1 被認為通過介導細胞間的黏附聚集來引起纖維細胞增殖[9],從而在肺纖維化的發病過程中起著重要作用。
CXCL12、CCL2、CXCL1、CCL19 同為趨化因子家族,屬于一類可使白細胞定向移動的小分子分泌蛋白,在炎癥過程中可誘發免疫細胞遷移、參與炎性促腫瘤微環境形成。Hubba 插件中算法提示CXCL12、CCL2 可能與IPF 存在較大相關性。在呼吸系統疾病中,此兩種基因研究報道多見于肺癌、肺動脈高壓等,與IPF 相關性研究國內報道較少。鐘家寶等[10]通過一項臨床研究發現,在IPF 的診斷中,血清中CCL2水平聯合其他趨化因子水平曲線下面積可達0.944,具有良好預測價值,但未涉及具體作用機制的研究。CCR7是一種趨化因子受體,其主要配體為CCL19、CCL21,關于其研究報道多為癌癥領域相關。在對過敏性氣道疾病的研究中,CCR7 被認為可以通過參與細胞外信號的調節,參與氣道炎癥反應,增加黏液的分泌。同時KAUR 等[11]研究發現,在哮喘患者中,CCR7 與CCL19結合后會產生級聯反應,最終導致氣道平滑肌的增殖。因此合理預測在肺纖維化的患者中,也會出現上述病理生理過程,但目前相關報道較少,需待進一步研究。
SPP1 名為分泌磷酸蛋白1,又稱骨橋蛋白,其相關研究多涉及腫瘤類、炎癥相關性疾病。有研究[12]表明,SPP1 在非小細胞肺癌中表達顯著上調,通過細胞外基質(ECM)間的相互作用來參與調控腫瘤的發生發展過程。在SPP1 與臟器纖維化領域,國內外研究顯示抑制SPP1 表達可降低臟器纖維化的程度、增強SPP1表達可加快臟器纖維化導致細胞外基質在相關器官中異常表達與過度沉積[13]。多項研究證實SPP1 通過參與ECM 合成、代謝等過程在組織纖維化中起著重要作用,同時IPF 也是以細胞外基質過度沉積為特征的疾病,后期在基礎研究與臨床研究中,可將SPP1 作為靶點基因進行深入探討。
MMP1、MMP7 同屬基質金屬蛋白酶家族,基質金屬蛋白酶家族(MMPs)參與血管平滑肌生長、增殖、血管生成、組織修復等過程。嚴梅等[14]研究發現,MMP7在IPF 患者組織中高表達,且與肺功能損傷程度成正比,可作為IPF 的臨床輔助診斷生物標志物。同時在大鼠肺纖維化組織中,許夢婷等[15]發現MMP1 在組織中表達增加,且經MMP 組織抑制劑處理后肺纖維化程度有所下降,這在一定程度上說明MMP1 與組織肺纖維化進程密切關聯。COL1A1 屬于膠原蛋白家族,是I 型膠原蛋白的α1 鏈,其在IPF 中高表達并多沉積于胸膜下、血管周圍及肺泡間隔,是導致氣管壁增厚及氣道重塑的主要原因,明確了膠原蛋白在IPF 發病過程中的重要作用。
綜上所述,本研究利用生物信息學工具篩選出VCAM1 等10 位顯著差異表達基因并對其進行詳細分析。其中MMPs、COL1A1 等基因已被多項研究報道證實與纖維化組織密切相關,在后期肺纖維化的研究中,可將SPP1、趨化因子家族(CXCL12、CCL2、CXCL1、CCL19)作為關鍵基因靶點,進行動物研究與臨床資料驗證,以期在IPF 的診治方面得到突破。

