腸道菌群與神經免疫系統及神經退行性疾病的相關研究進展
曹原,曹展,高耀輝,蔚青,秦環龍
(同濟大學附屬第十人民醫院 a.病理科,b.上海人體腸道菌群功能開發工程技術研究中心,c.胃腸外科,上海 200072)
腸道菌群是人體中最大的微生物庫。腸道微生物對維持宿主體內免疫和神經系統的平衡有重要作用,包括病原體的清除、免疫系統的發展、中樞神經系統的調節等。阿爾茨海默病(Alzheimer′s disease,AD)是一種不可逆、進行性且與年齡相關的神經退行性疾病,影響著全球4 000多萬人[1],是引起癡呆的最常見原因。AD給患者造成沉重的經濟負擔,但目前其潛在機制仍不完全清楚[2]。研究表明,腸道菌群代謝紊亂可能通過不同的途徑促進AD的發生發展[3]。帕金森病(Parkinson′s disease,PD)是繼AD后第二大常見的神經退行性疾病。PD的特征為α-突觸素在大腦中積累以及運動和非運動癥狀。腸道菌群在調節PD及癥狀方面具有關鍵作用,口服特定的微生物代謝物可引起運動缺陷、小膠質細胞激活和α-突觸素聚集[4]。上述研究表明,菌-腸-腦軸在神經退行性疾病發生發展過程中發揮重要作用,腸道菌群通過影響機體神經免疫系統而干預神經退行性疾病的發生發展。現就腸道菌群與神經免疫系統及神經退行性疾病的相互作用及機制進行綜述。
1 菌-腸-腦軸
菌-腸-腦軸是指腸道菌群與腸道和大腦之間傳入(刺激)和傳出(反應)存在的溝通方式[5]。首先,腸道菌群由周圍神經系統(如腸神經、迷走神經)發現并識別,這些神經系統與腦干形成專門的物理連接[5]。在切除迷走神經的結腸炎小鼠模型中,長雙歧桿菌無法起到抗焦慮作用[6]。其次,腸道菌群可以通過合成一系列刺激神經分子(如乙酰膽堿、兒茶酚胺、γ-氨基丁酸、組胺、褪黑素和5-羥色胺)影響中樞神經系統的功能[7]。另外,腸道菌群可以通過影響周圍的免疫細胞,將信號傳遞給大腦。如依賴梭狀芽孢桿菌簇產生的短鏈脂肪酸或來自脆弱擬桿菌產生的多糖A能調節T細胞產生白細胞介素-10[8]。長鏈脂肪酸能促進腸道炎癥效應T細胞的分化,短鏈脂肪酸可促進調節性T細胞的分化,并將信號傳遞給大腦[9]。
多種傳遞途徑參與介導菌-腸-腦軸[10-11]。研究表明,腸道菌群產生的短鏈脂肪酸等代謝物通過介導腸道外在交感神經中cFos蛋白的表達,調控腸道交感神經的活性,而腦干感覺核團可以整合腸道的特定刺激[12]。來自細菌胞壁的肽聚糖片段可移位至大腦,激活大腦中的模式識別受體,對大腦發育和行為有潛在的關鍵調控作用[12]。菌群衍生的單鏈RNA通過激活陽離子通道Piezo1誘導腸道神經遞質5-羥色胺的生成[13]。長期使用益生菌鼠李糖乳桿菌處理可導致中樞神經系統中γ-氨基丁酸受體表達的改變,減少焦慮、抑郁和應激反應[14]。腸道定植的藍藻細菌產生的神經毒素[包括β-N-甲氨基-L-丙氨酸(β-N-methylamino-L-alanine,BMAA)、貝類毒素和類毒素-α]能進一步導致神經系統疾病,如肌萎縮性脊髓側索硬化癥、復雜的PD和AD[15]。
總之,腸道菌群與神經免疫系統及大腦具有密切溝通,腸道菌群通過一系列小分子,如菌群代謝產物(短鏈脂肪酸、γ-氨基丁酸、BMAA),神經遞質(包括乙酰膽堿、兒茶酚胺、組胺、褪黑素、5-羥色胺),以及T細胞、巨噬細胞等免疫細胞及其細胞因子白細胞介素-17等作用于中樞神經系統。據此推測,在神經退行性疾病中,腸道菌群通過作用于腸道中的神經遞質而調控免疫細胞分泌細胞因子,從而將信號傳遞給大腦。
2 腸道菌群與腸神經系統
2.1腸道菌群對腸道神經發育的影響 研究表明,無菌小鼠產后327 d如果腸道微生物群的多樣性沒有建立,則腸肌層的神經元較少[16]。此外,有證據表明,母體微生物源性因子和母體免疫系統參與子代的免疫和神經元穩態[17]。在發育的關鍵期,宿主與微生物的動態相互作用可能增加神經發育障礙的風險,并對神經功能產生長期影響[18]。
腸道微生物產生的信號能被模式識別受體識別,如Toll樣受體(Toll-like receptor,TLR)。TLR是一種進化保守的蛋白質,能夠對微生物組分進行先天免疫識別,它們在神經發育的關鍵期發揮重要作用[19]。如在TLR2缺乏和微生物群落減少的小鼠中,神經膠質細胞源性神經營養因子的表達水平顯著降低,而神經營養因子的使用可以改善腸神經系統缺陷,表明TLR-微生物通路對腸神經系統的發育和穩態的影響是通過間充質源性神經營養因子介導[18]。多種微生物因子(如短鏈脂肪酸、脂多糖)可以通過調節5-羥色胺的產生和有效性,促進腸神經系統功能的成熟。
無菌培養會影響小膠質細胞的成熟,而有復雜微生物群的成年無菌小鼠或用短鏈脂肪酸治療的成年無菌小鼠小膠質細胞可恢復正常,無菌小鼠小膠質細胞的基因表達變化在成年無菌小鼠中較新生無菌小鼠中更明顯[20]。無菌子代從胚胎開始,大腦小膠質細胞數量增加[19]。這些研究充分證明了微生物群調節小膠質細胞基因的表達、形態和功能,且這些影響在胚胎發育的早期出現。
2.2腸道菌群與腸神經系統的相互作用 有證據表明,腸道菌群對神經系統的影響包括介導炎癥的產生、下丘腦-垂體-腎上腺軸和神經遞質的調控[21]。腸道微生物群可以通過合成一系列刺激神經的分子(如乙酰膽堿、兒茶酚胺、γ-氨基丁酸、組胺、褪黑素和5-羥色胺)影響中樞神經系統的功能[7]。無菌小鼠和抗生素處理小鼠的社交活動減少,社交互動后多個腦區神經活動增加,而下丘腦室旁核中的促腎上腺皮質激素釋放激素神經元能調節小鼠社交行為,其失活可逆轉抗生素處理小鼠的社交障礙,而其激活可使腸道菌群正常小鼠出現社交障礙[22]。
腸神經系統功能障礙最常見的為巨結腸病。約30%的巨結腸病患者出現嚴重的腸道菌群失調,稱為巨結腸相關的小腸結腸炎。微生物群的耗竭會導致腸神經元的興奮性降低、運動程序發生改變以及延長腸道運輸時間[23]。腸道神經回路具有監測腸道內腔狀態并相應調節神經元活動的分子機制[24]。
3 腸道菌群與神經免疫系統
3.1腸道神經免疫系統 腸道內多種天然免疫細胞亞群能夠與腸神經細胞相互作用。如肥大細胞來源的組胺和胰蛋白酶分別能激活腸肌層和黏膜下神經元,肽能神經元通過產生P物質、降鈣素基因相關肽和血管活性腸肽調節肥大細胞[25]。肥大細胞蛋白酶也被證明可以裂解神經元P物質和血管活性腸肽,表明肥大細胞可以限制神經元的激活。同時,腸道神經元是共生微生物下游集落刺激因子1信號的主要來源。刺激迷走神經能激活腸基層巨噬細胞中的α7乙酰膽堿受體,α7乙酰膽堿受體可負性調節腺嘌呤核苷三磷酸誘導的鈣反應[26]。鼠傷寒沙門菌感染期間,腸肌層中的外在交感神經元激活和去甲腎上腺素釋放可以刺激肌層的巨噬細胞表達β2腎上腺素能受體[27]。上述研究表明,腸道中存在由微生物引起的腸道神經元與巨噬細胞的雙向互作單位。
固有淋巴細胞(innate lymphoid cell,ILC)在腸黏膜屏障處大量存在,并與神經元細胞存在相互作用。如腸神經膠質細胞能控制腸的ILC3,成年小鼠腸內ILC3表達神經調節因子酪氨酸激酶受體,而具有神經調節因子酪氨酸激酶受體缺陷的小鼠白細胞介素-22生成減少,上皮反應活性降低,對檸檬酸桿菌感染的易感性增加;當檢測到微生物存在時,神經膠質細胞以髓樣分化因子88依賴的方式產生膠質源性神經營養因子家族配體[28]。因此,腸膠質細胞通過將微生物信號轉化為神經營養因子來調節ILC3并維持腸道內穩態。除腸神經膠質細胞外,迷走神經源性信號也可調節ILC3對腹腔細菌感染的反應[29]。
3.2腸道菌群-神經免疫學說的分子機制 腸道的常駐細菌產生的代謝小分子可以擴散到大腦,對神經元細胞和常駐免疫細胞產生直接影響。膳食脂肪酸能夠直接影響腸道中適應性免疫細胞的分化,導致中樞神經系統發生自身免疫性病變,長鏈脂肪酸能促進腸道炎癥效應T細胞的分化,如輔助性T細胞1和產生白細胞介素-17的輔助性T細胞17,并加重實驗小鼠自身免疫性腦脊髓炎,而短鏈脂肪酸可減輕自身免疫性腦脊髓炎[30]。
腸道微生物能夠調節宿主免疫的關鍵方面。無菌小鼠存在多種免疫異常,包括盲腸腫大、次級淋巴樣發育失敗、抗體反應受損、T細胞和B細胞數量減少以及細胞因子產生缺陷。此外,腸道微生物群能一定程度上影響適應性和固有免疫。短鏈脂肪酸可以促進外周體內誘導的調節性T細胞分化[8]。迷走神經可通過微生物和神經信號調節飽腹感、壓力和情緒的信號通路[31-32]。這些數據表明,腸道菌群可以定性和定量地改變宿主免疫反應,微生物可以改變T細胞的分化。
幼年時期微生物和免疫的相互作用與神經系統的發展相關,可影響神經退行性疾病和神經精神類疾病,如AD和重度抑郁癥[19]。早期生活中的抗生素暴露和腸道微生物組的改變可減輕成人皮質和海馬中β淀粉樣蛋白的負擔。此外,產前和產后早期應激動物模型顯示,應激導致的乳酸菌減少與應激引起的免疫和行為異常相關,而這些異常與焦慮和抑郁相關[33]。
全基因組轉錄譜顯示,無菌小鼠杏仁核的神經元活性增強,而免疫系統相關基因下調[34]。此外,無菌小鼠的杏仁核增大可能與杏仁核神經元亞群的樹突狀肥大有關,而海馬神經元則出現樹突狀萎縮[35]。隨著無菌小鼠杏仁核和前額皮質中微RNA表達譜的改變,轉錄后基因表達也被證明由腸道菌群調控[36]。這些研究表明,微生物通過與神經免疫系統的相互作用對神經系統疾病產生影響。
4 腸道菌群對神經退行性疾病的影響
4.1腸道菌群參與神經退行性疾病的發展 有證據支持腸道菌群參與AD的發展和惡化[37]。人類腸道微生物組通過產生促炎細胞因子和細菌代謝物影響AD的神經炎癥,這些因子和代謝物可以進入循環并到達大腦,作用于神經免疫細胞群[38]。腸道菌群群落多樣性可以調節宿主的固有免疫并影響β淀粉樣蛋白的沉積[39]。腸道菌群的成分對AD進展,如腦容量減少、腦室增大和皮質變薄等已確定的腦結構標志物產生影響。腸道菌群代謝紊亂和衰老與腸道通透性增加有關,并可能導致AD的發生[40]。腸道菌群產物包括BMAA、脂多糖和腸道菌群衍生的淀粉樣蛋白。BMAA是腸道藍藻菌產生的神經毒素之一,長期暴露于BMAA可引發神經退行性改變,包括腦神經纖維纏結和淀粉樣蛋白[15]。AD患者大腦中β淀粉樣蛋白和血管周圍存在脂多糖,且脂多糖在體外增強了β淀粉樣蛋白纖維的形成[41]。腸道菌群代謝紊亂可能通過不同的途徑促進AD的發生發展[3]。飼養在無菌條件下的APPPS1轉基因小鼠的淀粉樣變和小膠質細胞增生明顯減少,表明在沒有腸道微生物群的情況下,AD的病理情況較輕,這支持了腸道微生物群在AD病理中起關鍵作用的假設[42]。有動物實驗顯示,16月齡AD小鼠的糞菌可成功定殖于抗生素處理后的3月齡AD小鼠腸道內,且后者腦組織中的β淀粉樣蛋白顯著增加[43]。三甲胺N-氧化物和短鏈脂肪酸等細菌代謝物可能在AD病變的發展中發揮作用[44]。
研究表明,腸桿菌科的豐度與PD的嚴重程度呈正相關[45]。PD患者的大腸埃希菌和血清脂多糖水平升高,表明PD患者腸道通透性與腸道內毒素暴露相關[46]。腸道菌群在調節PD和癥狀方面具有關鍵作用,抗生素治療可改善PD中α-突觸素的表達,而口服特定的微生物代謝物則會影響運動行為、小膠質細胞的激活和α-突觸素的聚集[4]。此外,預測功能分析強調在PD患者的糞便樣本中涉及脂多糖生物合成的基因表達增加,這可能與周圍和中心炎癥有關[46]。另一項研究發現,PD患者中阿克曼菌、乳酸桿菌、雙歧桿菌豐度增加,鉤毛藻科豐度減少[47]。
4.2腸道菌群優化改善神經退行性疾病 腸道菌群在控制復雜的大腦功能中發揮作用,有益菌可通過調控腸道環境來延緩認知能力的下降[48]。研究表明,C57BL/6小鼠的正常腸道菌群和檸檬酸桿菌在應激誘導后導致識別和工作記憶受損[6]。相反,正常腸道菌群添加乳酸雙歧桿菌和發酵乳桿菌可以改善糖尿病樣Wister大鼠的空間記憶,改善記憶障礙[49]。迷走神經刺激可減輕神經炎癥,恢復脂多糖誘導的認知衰退,并調節小膠質細胞活性[50]。在老年人和AD患者中,白細胞介素-5、白細胞介素-6、白細胞介素-1β、白細胞介素-8和腫瘤壞死因子-α等表達上調,而益生菌可以降低這些促炎細胞因子的表達水平[51]。研究發現,補充含雙歧桿菌的發酵乳產品4周可激活大腦中參與情緒和感覺中央控制的特定區域[52]。
Akbari等[53]評估了益生菌在AD患者中的作用,發現每天補充200 mg富含嗜酸乳桿菌、干酪乳桿菌、雙歧桿菌和乳酸菌酵母的牛奶,持續12周后,受試者簡易智力狀態檢查量表評分明顯優于補充無額外添加上述菌種的牛奶。AD的新藥GV-971(甘露特納)通過抑制腸道菌群失調和相關苯丙氨酸/異亮氨酸的積累來減輕神經炎癥,從而改善認知功能。
有研究證實,天然抗氧化劑多酚可能改變腸道菌群,這為多酚在輕度認知障礙、AD前驅期或AD早期患者中的應用開辟了新領域[52]。腦源性神經營養因子由腸道菌群產生,在PD患者中減少,增加合成腦源性神經營養因子的微生物組分能夠減輕PD的癥狀并減緩其進展[54]。在另一項強迫游泳任務的研究中,補充羅伊乳桿菌可改善應激動物行為障礙[55]。目前有關腸道菌群改善神經退行性疾病的研究正在開展,通過菌群治療PD患者的認知障礙可能是未來的研究方向。
5 菌-腸-腦軸與神經退行性疾病起源的假說
研究發現,路易體病可能通過逆行運輸傳播到不同的大腦區域。路易體病的病理學特征首次出現在腸道的神經元中(階段1),其出現遠早于中腦的多巴胺能神經元改變和明顯的PD癥狀的發生(階段3),且階段1出現后可能需要很長時間才會出現階段3[56]。病理學癥狀從外周通過迷走神經進入腦干,然后沿上行路徑到達黑質,隨后到達大腦皮質。無論是在體外培養的細胞中還是在PD動物模型的大腦中路易體病的病理學特征都可以從一個細胞傳播到另一個細胞。
有運動功能障礙的PD患者中腦多巴胺神經元會出現α-突觸素的聚集。研究發現,在α-突觸素轉基因小鼠和野生型小鼠的大腦中注射α-突觸素后,α-突觸素可以沿神經束傳播[57]。將預制的α-突觸素注射到十二指腸和幽門肌層后,α-突觸素首先出現在運動背核,然后在后腦的尾部分,隨后出現在杏仁基地外側核、中縫背核、黑質致密部[58]。隨著α-突觸素的傳遞,多巴胺能神經元的丟失以及運動和非運動癥狀也被陸續觀察到。PD患者大腦溶解產物中的α-突觸素被胃腸道攝取后,通過長距離的逆向傳輸沿著迷走神經從腸道到達大腦[56]。耳干迷走神經切開術和α-突觸素缺乏癥則會阻止α-突觸素從腸道向大腦傳遞,并會減少相關神經退行性改變[58]。這些研究表明,α-突觸素聚合可能起源于周圍組織,然后通過自主神經纖維傳遞到大腦。
有研究將熒光標記的β淀粉樣蛋白注射到小鼠的腸道中,這些蛋白質轉移到腸道的神經系統,1年后,在與AD認知缺陷有關的大腦部位發現了這些錯誤折疊的蛋白質,包括影響記憶的海馬體,且這些動物均出現了認知障礙[59]。表明大腦中神經退行性改變可能起源于腸道。
綜上所述,通過腸道菌群及其代謝產物的刺激作用,腸道中的神經細胞(膠質細胞、膽堿能神經元等)整合免疫細胞(包括巨噬細胞、單核細胞、ILC等),產生一系列的神經遞質和細胞因子等小分子。這些小分子可以通過直接或間接的途徑將信號傳遞給大腦,并最終導致神經退行性疾病的發生發展,菌-腸-腦軸與神經退行性疾病起源的假說圖見圖1。
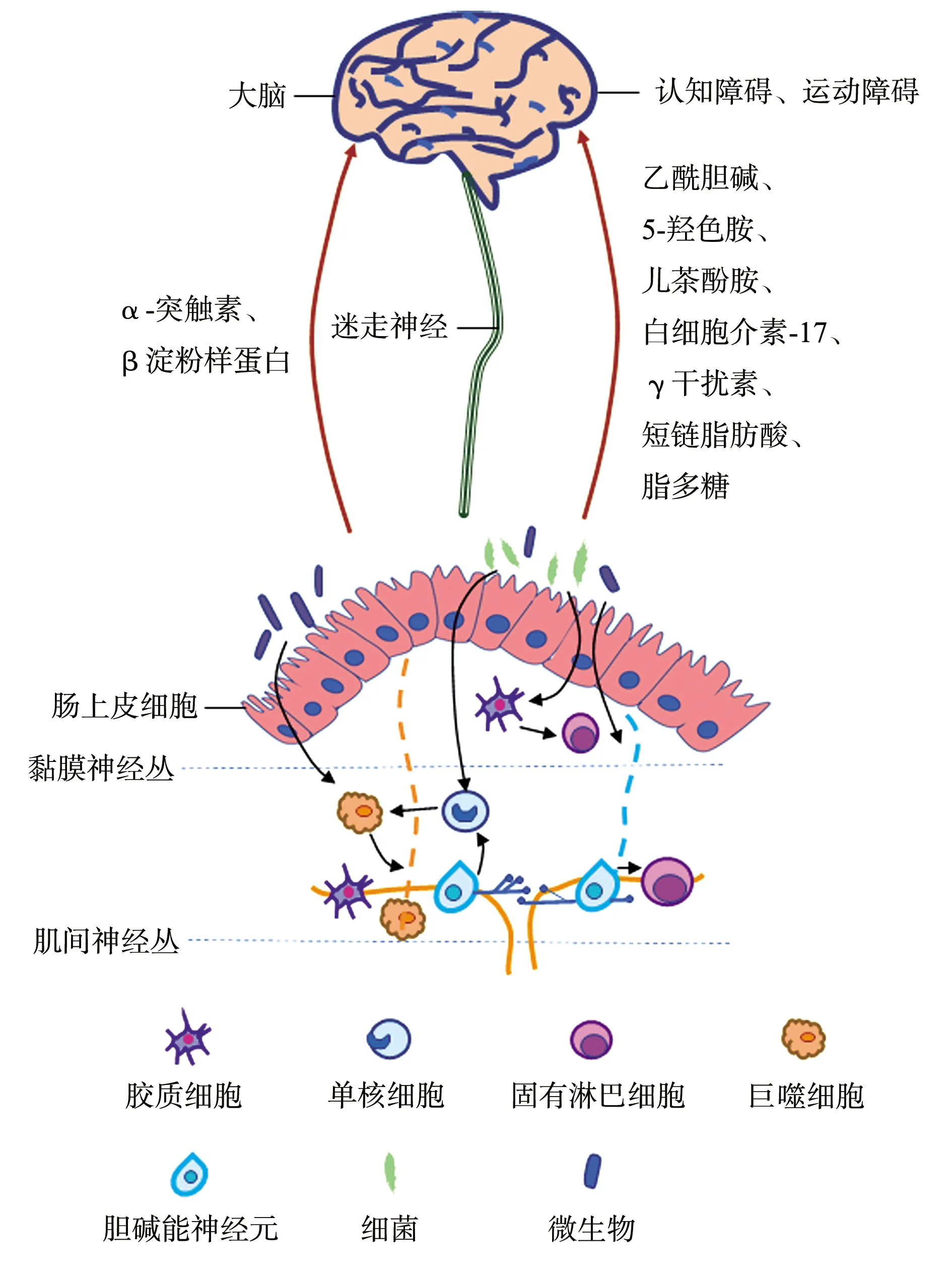
圖1 菌-腸-腦軸與神經退行性疾病起源的假說圖
6 結 語
腸道菌群能夠通過多種途徑影響大腦的功能,且腸道菌群對腸道神經系統、神經免疫系統和神經退行性疾病具有重要作用。迷走神經能夠直接聯系腸神經系統和中樞神經系統。此外,微生物可以通過調節神經免疫系統的發育和功能來影響神經退行性疾病(如AD、PD)。雖然這些疾病的病理生理等分子機制尚不完全清楚,但菌-腸-腦軸可以通過神經免疫系統影響神經退行性疾病的發生發展。對菌-腸-腦軸深入的研究有助于明確神經退行性疾病的發生發展過程。腸道菌群通過影響機體神經系統和免疫系統改變大腦功能,進一步干預神經退行性疾病的發展進程。未來,可以通過改善腸道菌群的微生態調節腸道神經免疫系統的功能,這有望成為治療和預防神經退行性疾病的有效措施。

