液相色譜法測定土壤中四環素含量前處理方法的優化
李金津,胡宏宇,王弘圣,伍玉鵬
華中農業大學資源與環境學院,湖北 武漢 430070
抗生素由于其在保護動物健康方面的作用,在我國規模化和集約化畜禽養殖中得到了廣泛應用[1-2]。然而,抗生素在畜禽體內不會被完全吸收,約40%~90%的抗生素以母體化合物或主要代謝物形式隨畜禽糞便或尿液排出體外[1]。其中,四環素類藥物是使用最多、最廣泛的一類抗生素,由于其具有水溶性較好、體內代謝后大部分以原形排出以及在環境中不易發生生物降解等特點,成為容易在環境中儲存和蓄積的一類抗生素[3]。尤其是在農田中,作為土壤有機質及養分重要來源的畜禽糞便年復一年地進行施用,導致了土壤中四環素類抗生素濃度不斷增加,對人類健康和生態造成了潛在的不利影響[3-5]。在此背景下,準確定量土壤四環素污染程度,是科學合理開展土壤利用及四環素污染治理的關鍵。
四環素類抗生素殘留的分析方法包括微生物法、酶聯免疫法、薄層色譜法和液相色譜法,其中微生物法和酶聯免疫法存在特異性差,耗時長及操作繁瑣等缺點,而薄層色譜法的測量靈敏度難以達到要求[6-8]。因此,液相色譜法成為目前最主要的分析測定方法,并廣泛應用于畜禽養殖農產品、食物樣品的監測中[9]。Na2EDTA-Mcllvaine緩沖溶液是動物性食品中四環素的常用浸提劑,但其對不同類型四環素浸提的效果存在較大差異[10-12]。李彥文等[13]在緩沖液中加入甲醇,抗生素的提取效率有了一定的提高,但仍存在濃縮時間較長提取雜質增多等問題。此外,土壤基質與食品基質差異較大,土壤含帶有負電性的有機質及具有多孔隙的粘土礦物質,對四環素類抗生素具有較強吸附作用,這對土壤中四環素類抗生素的前處理方法提出更高要求[14]。因此,本研究從浸提劑的選擇、浸提液固相萃取的方法及溶解液的選擇入手,通過三因素完全隨機實驗比較了不同組合下四環素提取率的差異,以期能夠通過對現有方法的優化進而提供一種更為高效、準確的土壤樣品四環素測定方法。
1 實驗部分
1.1 試劑與材料
1.1.1 主要化學試劑 四環素為標準品(Sigma公司),甲醇、乙腈、甲酸為色譜純(德國Merck公司),草酸、磷酸氫二鈉、檸檬酸、乙二胺四乙酸二鈉、草酸、乙醇、氯化鈉等試劑均為分析純。
1.1.2 供試土壤 供試土壤為黃棕壤,取自華中農業大學試驗田。供試牛糞取自湖北田申甲生物環保科技有限公司。供試四環素為標準品,購自Sigma公司。將土壤與牛糞按照1∶1比例混合以模擬畜禽糞便農田施肥。在混合物中加入5 mg/kg四環素-甲醇溶液,充分攪拌均勻,將物料攤平靜置2 d,讓甲醇揮發完全,隨后將物料置于50℃烘箱中烘干并研磨過孔徑2 mm篩,形成本研究中的待測物料。
1.2 實驗設計
從四環素浸提劑的選擇、浸提液固相萃取的方法及溶解液的選擇入手,開展三因素完全隨機實驗。本研究選擇2種浸提劑,分別是浸提劑1:Na2EDTA-Mcllvaine-甲 醇 浸 提 劑(Na2EDTAMcllvaine-甲醇提取液,pH=4.0),浸提劑2:草酸/乙醇浸提劑(1 mol/L NaCl、0.5 mol/L草酸和乙醇按照25∶25∶50的體積進行混合,pH=7.0)。本研究選擇2種浸提液固相萃取方法,分別是方法1:Oasis HLB固相萃取柱使用前,先用2 mL甲醇洗滌3次,然后用2 mL超純水洗滌3次,最后用2 mL鹽酸(pH=4)洗滌3次以進行預處理。將浸提液以1 mL/min的速率通過Oasis HLB固相萃取柱進行富集,萃取富集后,用6 mL超純水清洗固相萃取柱,并減壓抽干5 min。最后用6 mL甲醇緩慢洗脫到10 mL離心管中并編號[15-16]。方法2:用2 mL甲醇、2 mL超純水活化Oasis HLB固相萃取柱,將浸提液以1 mL/min的速率通過Oasis HLB固相萃取柱進行富集,萃取富集后,用5 mL超純水、5 mL甲醇-水(5∶95,V/V)淋洗,減壓抽干10 min后用5 mL的甲醇溶液緩慢洗脫到10 mL離心管里并編號。本研究選擇3種溶解液,分別是溶解液1:pH=4的鹽酸溶液,溶解液2:色譜純甲醇,溶解液3:超純水溶液[15-16]。因此,本研究共12個處理(2種浸提劑×2種固相萃取方法×3種溶解液)(表1),每個處理3個重復。
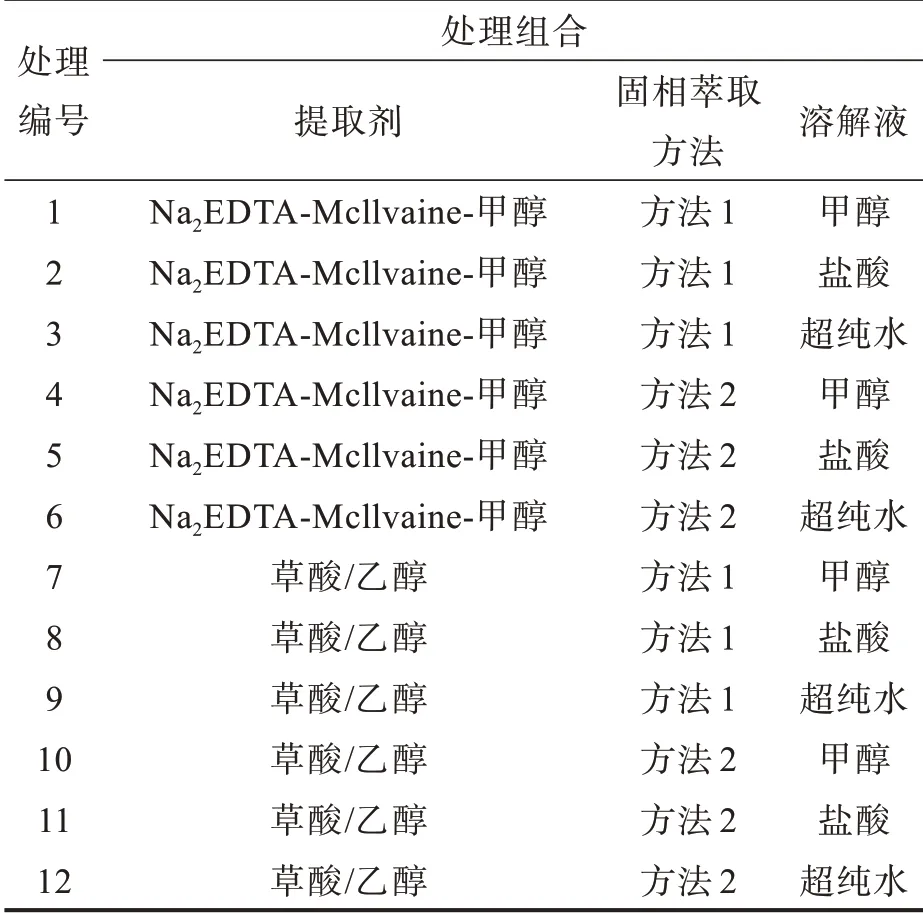
表1 提取四環素的不同處理Tab.1 Extractions of tetracycline under different treatments
取過篩的樣品1 g置于50 mL帶蓋塑料離心管中,分別吸取20 mL上述提取液(Na2EDTAMcllvaine-甲醇浸提劑或草酸/乙醇浸提劑),于機械振蕩提取儀中25℃下振蕩提取20 min,取出超聲20 min后于15℃下置于離心機上,離心速度為8 000 r/min,離心10 min,取上清液至另一50 mL離心管。殘渣再依次加入20、10 mL提取液,重復上述步驟提取2次,合并上清液[12-13]。上清液及洗滌液混合后采取上述2種方法(方法1和方法2)對浸提液進行固相萃取。將樣品倒入石英蒸發皿,在40℃下水浴蒸發至近干,分別用2 mL上述3種溶解液(pH=4的鹽酸溶液、色譜純甲醇、超純水溶液)攪拌溶解,過孔徑0.22μm濾膜后打入進樣瓶并編號。用高效液相色譜測定,測定色譜條件為:日本島津Shim-Pack,VP-ODS柱(250 mm×4.6 mm,5μm)色譜柱,色譜柱柱溫25℃,流動相為體積分數0.1%甲酸-乙腈(81∶19,V/V)等度洗脫,流速1.0 mL/min,進樣量20μL;紫外檢測器檢測:波長270 nm[9]。
1.3 數據統計與分析
所有實驗數據均以均值表示,采用SPSS 17.0(IBM,USA)統計軟件對不同處理進行相關的統計分析、差異檢驗等(顯著水平為0.05)。
2 結果與討論
圖1顯示,不同處理組合下四環素的提取率存在較大差異。其中第10號處理,即選擇草酸/乙醇作為浸提劑,采用浸提液固相萃取方法2并使用甲醇作為溶解液的組合四環素提取率達到100%,顯著高于其它處理。接下來為第4號處理,即選擇Na2EDTA-Mcllvaine-甲醇作為浸提劑,采用浸提液固相萃取方法2并使用甲醇作為溶解液的組合,其四環素提取率為75.2%。除此之外,第1、2號處理,即選擇Na2EDTA-Mcllvaine-甲醇作為浸提劑,采用浸提液固相萃取方法1并選擇甲醇或鹽酸作為溶解液的組合四環素提取率也達到了50%以上。本研究中第8號處理,即選擇草酸/乙醇作為浸提劑,采用浸提液固相萃取方法1并選擇鹽酸作為溶解液的組合未能提取到四環素,說明該方法完全不能應用于土壤四環素的測定。
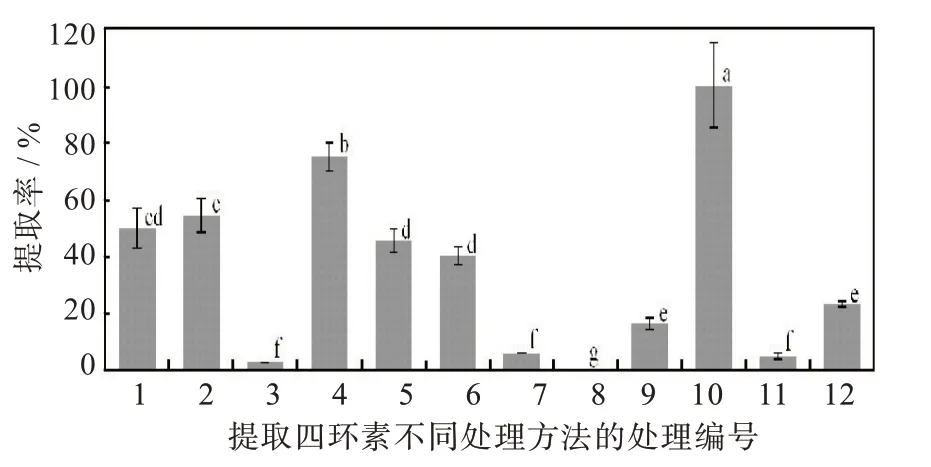
圖1 不同處理方法條件下的四環素提取率Fig.1 Extraction rates of tetracycline under different treatments
提取劑、固相萃取方法及溶解液三個因素對四環素提取效率的影響做進一步的主體間效應檢驗。結果顯示,提取劑、固相萃取方法及溶解液單獨作用下影響四環素提取率的Sig.值均為0.000,說明三因素單獨作用下均顯著影響了四環素的提取率;提取劑與固相萃取方法交互作用下影響四環素提取率的Sig.值為0.001,而提取劑與溶解液、固相萃取方法與溶解液交互作用下影響四環素提取率的Sig.值均為0.000,說明三因素中任意兩兩交互作用下顯著影響了四環素的提取率;提取劑、固相萃取方法及溶解液影響四環素提取率的Sig.值均為0.000,說明三因素之間交互作用亦顯著影響了四環素的提取率(表2)。
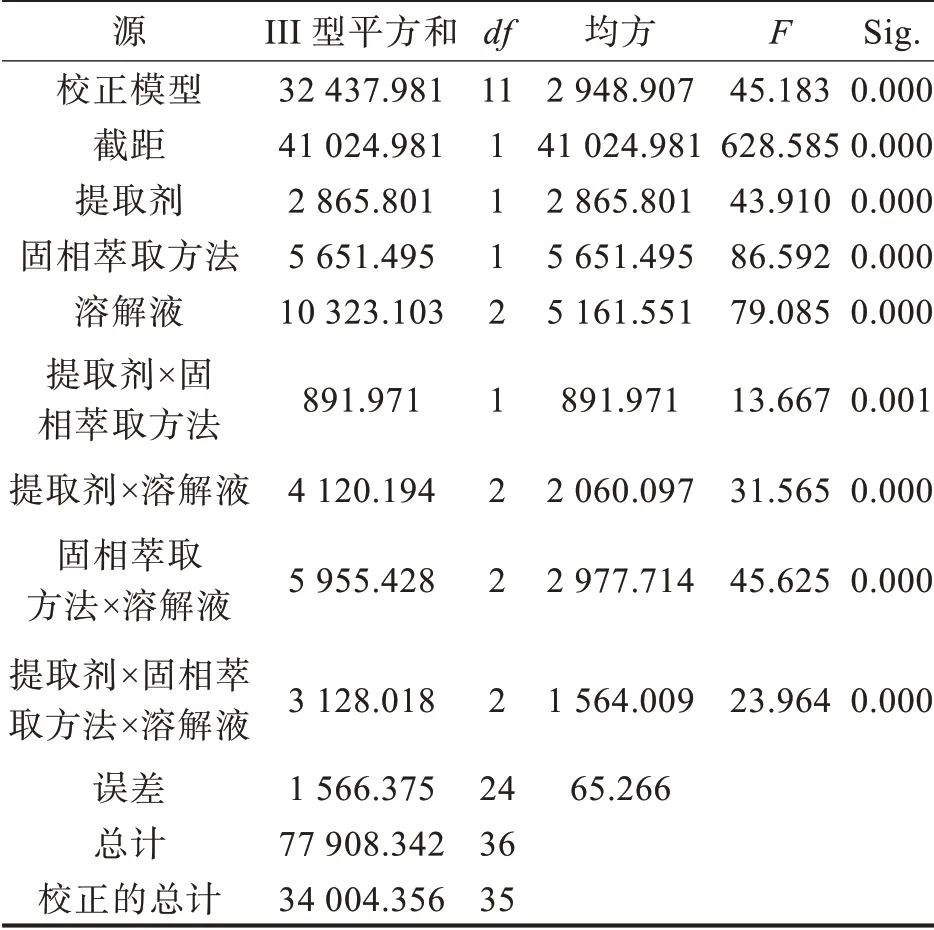
表2 不同提取劑、固相萃取方法及溶解液的四環素提取率方差分析結果Tab.2 Results of variance analysis in extraction rate of tetracycline obtained with different extractants,solid phase extraction methods and dissolved solutions
因本研究采用了3種不同的溶解液,因此進一步對溶解液之間的差異進行分析,發現使用甲醇與使用鹽酸作為溶解液的處理之間四環素提取率差值達31.565,差異顯著;使用甲醇與使用超純水作為溶解液的處理之間四環素提取率差值達37.125,差異顯著;而使用鹽酸與使用超純水作為溶解液的處理之間四環素提取率差值僅為5.560,差異不顯著(表3)。
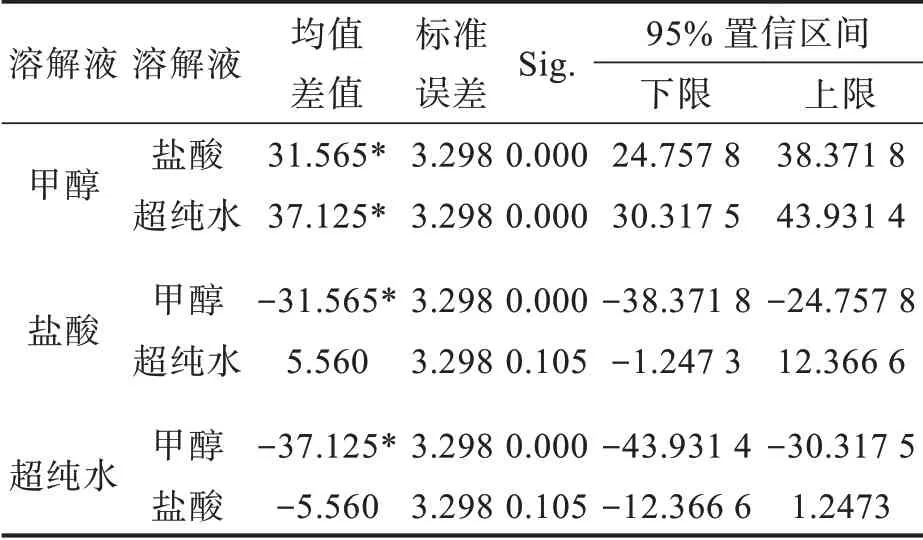
表3 不同溶解液對四環素提取率的影響Tab.3 Effectsof different dissolution solutionson extraction rates of tetracycline
3 結 論
選擇草酸/乙醇(1 mol/L NaCl、0.5 mol/L草酸和乙醇按照25∶25∶50的體積比進行混合,pH=7.0)作為萃取溶劑,用2 mL甲醇、2 mL超純水活化Oasis HLB固相萃取柱,將浸提液以1 mL/min的速率通過Oasis HLB固相萃取柱進行富集,用5 mL超純水、5 mL甲醇-水(5/95,V/V)淋洗,減壓抽干10 min后用5 mL的甲醇溶液緩慢洗脫,石英蒸發皿中40℃下水浴蒸發至近干,2 mL色譜純甲醇攪拌溶解,最后過孔徑0.22μm濾膜,是采用高效液相色譜測定土壤四環素含量較優的前處理方法。該前處理方法下四環素提取率可達100%,可有效提高土壤中四環素含量測定的效率與準確性。然而,針對其它不同的測定對象(如畜禽糞便),需要進一步針對性的開展研究以確定最優前處理方法。

