ZmJAZ與ZmMYC2的BiFC互作研究
呂迪 陳茹梅 周曉今
(中國農業科學院生物技術研究所,北京 100081)
茉莉酸(jasmonic acid,JA)是一類重要的植物激素,調節植物生長發育、生物脅迫及非生物脅迫的防御應答反應,包括根的伸長、病原菌侵染、葉片衰老和冷脅迫等[1-5]。JAZ蛋白是JA信號通路中的重要組成部分,當植物處于正常生長狀態時,體內的JA含量較低,大量積累的JAZ蛋白與下游轉錄因子MYC2結合并抑制其轉錄調控活性,從而調控JA信號通路下游基因的表達。當植物受到外界脅迫或接收到特定的生長發育信號時,體內的JA含量迅速升高,SCFCOI1復合體中的COI1蛋白與活性JA分子結合,從而促進該復合體與底物JAZ蛋白相互作用并將其泛素化降解。JAZ蛋白的泛素化降解解除了其對下游轉錄因子MYC2的抑制,從而激活下游JA信號通路基因的表達[6-9]。JAZ蛋白含有ZIM和Jas兩個保守結構域。ZIM結構域包含TIFY基序,其通過與其他蛋白形成二聚體發揮阻遏作用;Jas結構域位于JAZ蛋白的C端,與JAZ蛋白的泛素化降解相關[6,10]。目前玉米中已報道23個JAZ家族基因,它們的表達具有組織特異性。有研究表明,干旱脅迫會誘導ZmJAZ2、ZmJAZ4、ZmJAZ19和ZmJAZ21等基因的表達[11],說明JAZ基因在非生物脅迫中發揮重要作用。
MYC2屬于bHLH轉錄因子家族,其C端具有保守的bHLH結構域,是響應JA信號的核心轉錄因子。在許多生物途徑中,bHLH轉錄因子都是轉錄調控網絡的重要組成部分,而MYC2作為正調控因子在JA信號通路中發揮重要作用。MYC2能激活受JA誘導的抗蟲基因表達,增強植物的抗蟲能力[5,12]。Chen等[13]的 研 究 表 明 JA 以 MYC2依賴的方式抑制擬南芥初級根分生組織細胞的分裂;MYC2還是JAZ介導的黃酮類生物合成的正調控因子,過表達MYC2的擬南芥植株表現出更多的花青素積累[5]。JAZ還可以通過與其他信號通路調控因子的相互作用,調節MYC2的活性從而介導JA信號與其他的激素信號途徑產生交叉互話。例如,擬南芥中的赤霉素信號通路負調控因子RGA(repressor of ga1-3)通過與MYC2競爭結合JAZ1,從而抑制JAZ蛋白對MYC2的調控作用[14]。此外,最近的研究通過DAP-Seq分析發現ZmMYC2可結合許多植物激素生物合成和信號轉導因子編碼基因的啟動子[15],提示MYC2可作為樞紐整合多種植物內源生長發育和外源性環境信號[16-18]。
雖然JAZ蛋白對MYC2的調控作用在擬南芥和水稻中都有較為深入的研究[19-20],但是仍未見關于玉米中JAZ蛋白和MYC2在體內互作的報道。本研究篩選了玉米中不同表達模式的JAZ基因ZmJAZ4、ZmJAZ8和ZmJAZ12,通過玉米葉肉細胞原生質體瞬時轉化和BiFC技術研究ZmJAZ4、ZmJAZ8和ZmJAZ12與ZmMYC2的相互作用,探究這些JAZ蛋白是否都具有結合ZmMYC2的特征,為深入研究玉米JAZ蛋白的生理功能提供依據。
1 材料與方法
1.1 材料
溫室培養的玉米Z58自交系黃化苗,于三葉期分離葉片原生質體。
分析ZmJAZs基因相對表達量的植物材料為大田生長的玉米Z58自交系,分別取其根、莖、葉、雄穗和未授粉的雌穗,以及授粉后12 d、21 d和28 d的胚和胚乳保存至-80℃冰箱備用。
大腸桿菌菌株DH5α感受態和反轉錄試劑盒購自北京全式金公司;pRTL2-GFP、pRTL2-YFPN、pRTL2-YFPC(以下簡稱為pYFPC和pYFPN)載體由本實驗室構建并保存;核定位Marker載體pNLSDsRed由本實驗室保存;KOD one Mix為TOYOBO公司產品;限制性內切酶、Infusion克隆試劑盒為Fermentas公司產品;SYBR Green Mix為TaKaRa公司產品。
1.2 方法
1.2.1 ZmJAZs基因實時熒光定量表達分析 使用Primer Premier 6.0軟件設計ZmActin(內參)與ZmJAZs基因的特異性引物(表1),以1.1中植物材料提取的RNA反轉錄的cDNA為模板,參照SYBR Green Mix說明書進行實時熒光定量分析。熒光定量反應體系(20 μL):2 × SYBR Green Mix 10 μL、cDNA 1 μL、ddH2O 8 μL、 上 下 游 引 物 各 0.4 μL、ROX Ⅱ 0.2 μL。反應條件為 94℃預變性 30 s;94℃變性15 s,60℃退火及延伸34 s,循環40次。每個處理重復3次。采用Ct值法(2-ΔΔCt法)分析ZmJAZs基因在不同組織部位的相對表達水平。
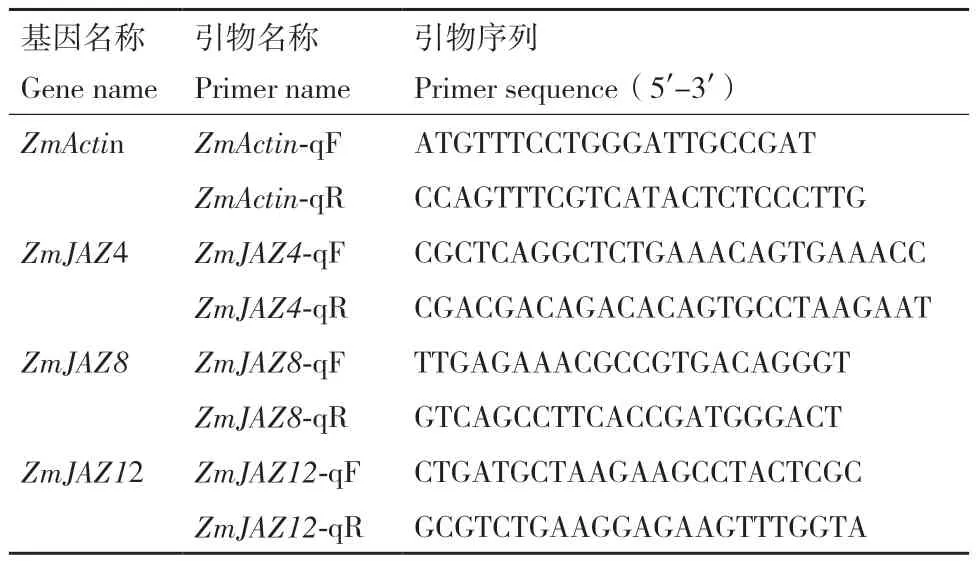
表1 實時熒光定量PCR所用引物Table 1 Primers used in qRT-PCR
1.2.2 含有同源重組末端序列的ZmMYC2、ZmJAZ4、ZmJAZ8和 ZmJAZ12基 因 克 隆 根 據文獻中報道的ZmMYC2基因,以及MaizeGDB玉米基因組數據庫(www.maizegdb.org)中ZmJAZ4(GRMZM2G024680)、ZmJAZ8(GRMZM2G086920)和ZmJAZ12(GRMZM2G101769)基因的全長CDS序列,設計擴增ORF的引物。利用Z58的cDNA做 模 板, 通 過 ZmMYC2、ZmJAZ4、ZmJAZ8和ZmJAZ12基因的特異上游引物和下游引物(表2)擴增得到目的基因的ORF序列。然后,設計Infusion克隆用的引物并以各基因的ORF序列回收產物為模板擴增獲得用于構建亞細胞定位和BiFC載體的Infusion插入片段。PCR程序為:94℃ 預變性 5 min;98℃ 變性 10 s,55℃ 退火 15 s,68℃延伸30 s,32個循環;68℃ 終延伸10 min。其中ZmMYC2基因擴增時延伸時間為90 s。
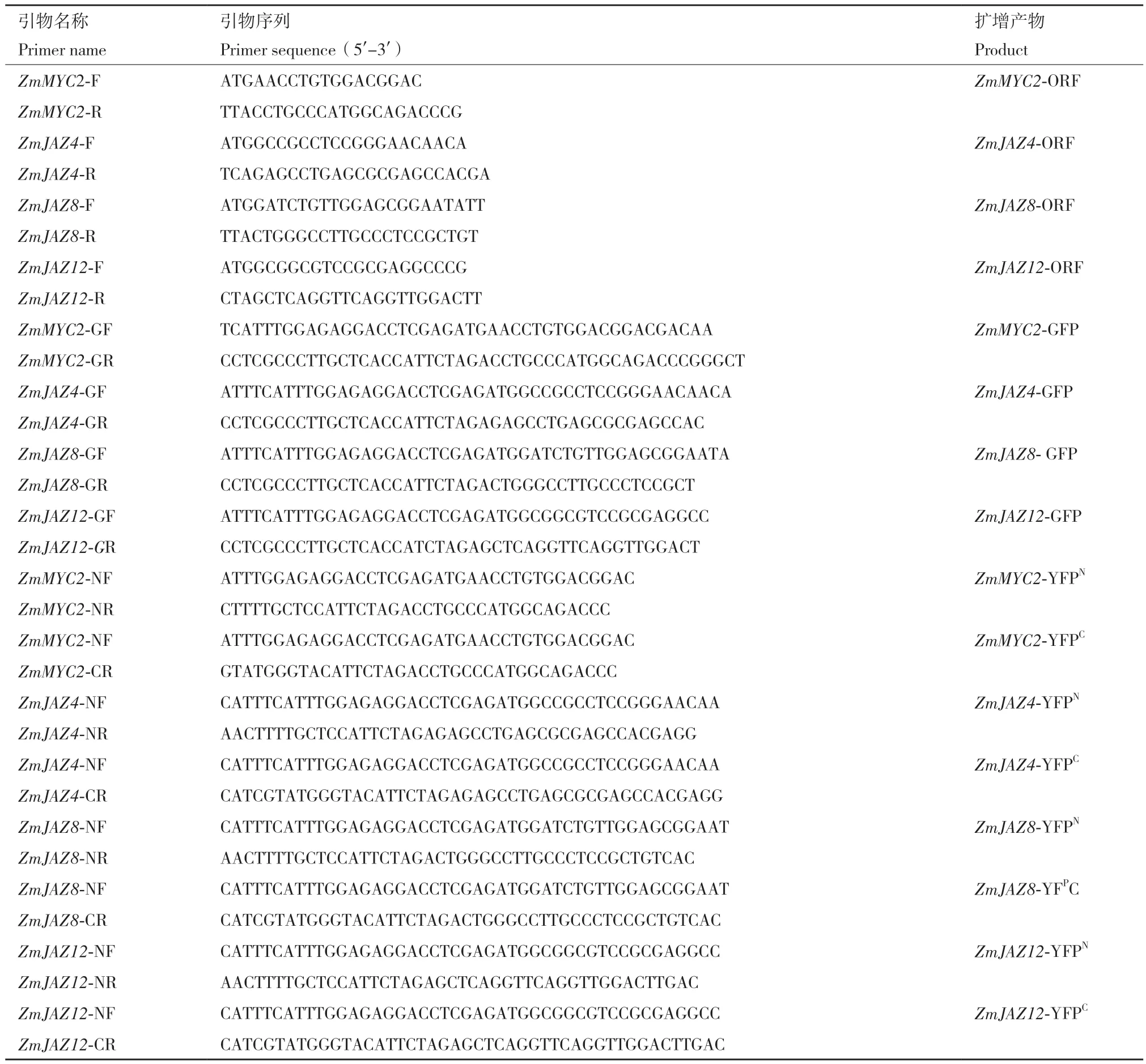
表2 PCR擴增所用引物Table 2 Primers used for gene cloning
1.2.3 亞細胞定位載體的構建 通過Xho I和Xba I雙酶切pRTL2-GFP載體,電泳并回收線性載體片段。之后用Infusion克隆試劑盒將片段ZmMYC2-GFP、ZmJAZ4-GFP、ZmJAZ8-GFP、ZmJAZ12-GFP和回收的載體片段相連接。將連接產物轉化大腸桿菌DH5α感受態細胞,在含有Amp抗性的LB培養基中37℃培養16 h,挑取單克隆搖菌,雙酶切鑒定后,將菌液送北京奧科鼎盛生物科技有限公司進行測序。構建成功的載體分別命名為pZmMYC2-GFP、pZmJAZ4-GFP、pZmJAZ8-GFP 和 pZmJAZ12-GFP。將上述載體大提質粒并定量至1 100 ng/μL待用。
1.2.4 BiFC載體的構建 通過Xho I和Xba I雙酶切pYFPN和pYFPC載體,電泳并回收線性載體片段。然后用Infusion克隆試劑盒將載體片段與帶有同源重組末端的目的基因序列連接。將連接產物轉化大腸桿菌DH5α感受態細胞,在含有Amp抗性的LB培養基中37℃培養16 h,挑取單克隆搖菌,雙酶切鑒定后,將菌液送北京奧科鼎盛生物科技有限公司進行測序。構建成功的載體分別命名為pZmMYC2-YFPN、pZmMYC2-YFPC、pZmJAZ4-YFPN、pZmJAZ4-YFPC、pZmJAZ8-YFPN、pZmJAZ8-YFPC、pZmJAZ12-YFPN和pZmJAZ12-YFPC。將上述載體大提質粒并定量至1 100 ng/μL待用。
1.2.5 載體轉化玉米葉肉細胞原生質體 首先配制轉化玉米葉肉細胞原生質體所需的試劑,酶解液(0.4 mol/L甘露醇、0.02 mol/L KCl、0.02 mol/L MES 調節pH 至 5.7、1.5% CelluLase R10、0.4% Macerozyme R10、0.01 mol/L CaCl2和 0.1% BSA)、W5緩 沖 液(0.002 mol/L MES 調節pH至 5.7、0.154 mol/L NaCl、0.125 mol/L CaCl2、0.005 mol/L KCl)、MMg 緩 沖 液(0.004 mol/L MES 調 節 pH至 5.7、0.4 mol/L甘 露醇、0.015 mol/L MgCl2)和40% PEG-Ca2+溶液(40%PEG4000、0.2 mol/L 甘露醇、0.1 mol/L CaCl2)。
取玉米黃化苗第二片真葉的中間5-7 cm部分,將其切成0.5-1 mm的細絲,轉移至含有酶解液的平皿中,在28℃ 搖床上以35 r/min的轉速于黑暗條件下酶解4 h。然后使用350目的過濾網將酶解液過濾至50 mL離心管中,加入等體積的W5緩沖液,混勻后在4℃、100×g轉速條件下離心2 min,沉淀原生質體,之后棄去上清液。再加入3 mL冷的W5緩沖液冰上孵育30 min。棄上清后加入3 mL的MMg緩沖液重懸細胞,此時即收集到了玉米葉肉細胞的原生質體,鏡檢觀察細胞數目和形態,冰上靜置待用。
亞細胞定位實驗中,在2 mL的離心管中分別加入細胞核定位的紅色熒光蛋白表達載體pNLS-DsRed和目標蛋白亞細胞定位載體各10 μL。BiFC實驗中,在2 mL的離心管中分別加入pNLSDsRed、融合表達YFPN和YFPC的載體各7 μL。混勻各載體后加入200 μL的原生質體。然后加入220 μL的40% PEGCa2+溶液,混勻,并于室溫靜置30 min。隨后加入880 μL W5緩沖液,100×g轉速室溫離心2 min,棄上清;加入1 mL的W5緩沖液,黑暗常溫培養12-16 h后用激光共聚焦顯微鏡觀察并拍照。
2 結果
2.1 玉米ZmJAZ4、ZmJAZ8和ZmJAZ12基因的表達分析
利用qRT-PCR的方法分析ZmJAZ4、ZmJAZ8和ZmJAZ12在玉米Z58自交系各個組織部位的相對表達量。結果如圖1所示,ZmJAZ4主要在胚乳中高表達,在根、莖、葉、雄穗和未授粉的雌穗中表達量相對較低;ZmJAZ8主要在雄花和雌穗這類生殖器官中高表達;ZmJAZ12在植株的絕大多數組織均有表達,且表達量相對穩定,在胚乳中表達量相對較低。
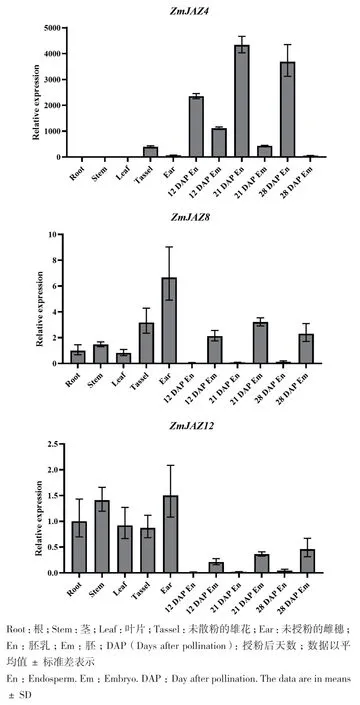
圖1 ZmJAZ4、ZmJAZ8和ZmJAZ12基因的相對表達量Fig.1 Relative expressions of ZmJAZ4,ZmJAZ8,and ZmJAZ12
2.2 亞細胞定位載體的構建及驗證
利用反轉錄玉米cDNA為模板用基因特異引物擴 增 ZmMYC2、ZmJAZ4、ZmJAZ8和 ZmJAZ12的ORF序列。通過Infusion方法將各基因的ORF與亞細胞定位載體骨架連接,最后構建成功的載體分別命 名 為 pZmMYC2-GFP、pZmJAZ4-GFP、pZmJAZ8-GFP和pZmJAZ12-GFP(圖2-A)。雙酶切鑒定分別獲得 1 460 bp 和 650 bp(ZmMYC2)、651 bp(ZmJAZ4)、651 bp(ZmJAZ8)、714 bp(ZmJAZ12)的特異條帶(圖2-B)。因為ZmMYC2的CDS在651 bp處存在一個Xho I的酶切位點,所以酶切檢測獲得了1 460 bp和650 bp兩個片段。同時對構建完成的載體進行了測序,結果通過DNAMAN比對與MaizeGDB數據庫中的序列一致,結合酶切檢測和測序結果表明亞細胞定位載體構建正確。
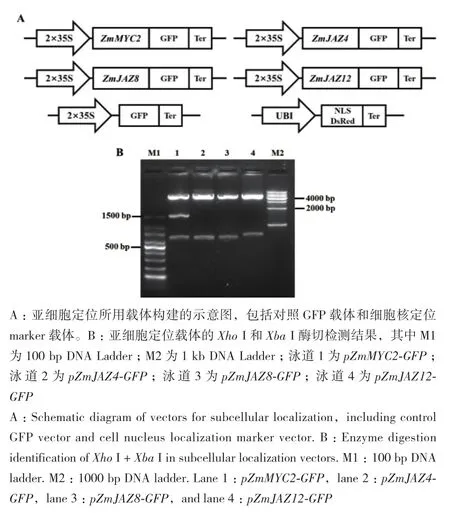
圖2 亞細胞定位載體和酶切鑒定電泳圖Fig.2 Vectors for subcellular localization and enzyme digestion identification
2.3 BiFC融合載體的構建及驗證
利用反轉錄玉米的cDNA為模板用上述引物擴 增 ZmMYC2、ZmJAZ4、ZmJAZ8和 ZmJAZ12的ORF序列。通過Infusion方法將各基因的ORF與BiFC載體連接,形成ZmMYC2、ZmJAZ4、ZmJAZ8和ZmJAZ12分別與YFPN和YFPC融合表達的載體(圖3-A)。雙酶切鑒定分別獲得1 460 bp和650 bp(ZmMYC2)、651 bp(ZmJAZ4)、651 bp(ZmJAZ8)、714 bp(ZmJAZ12)的特異條帶(圖3-B)。同時對構建完成的載體進行了測序,結果通過DNAMAN比對與MaizeGDB數據庫中的序列一致,結合酶切檢測和測序結果表明BiFC融合表達載體構建正確。
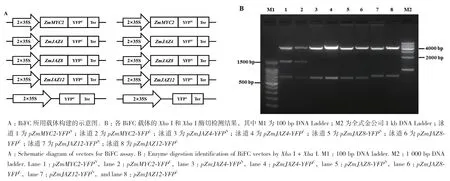
圖3 BiFC載體構建示意圖和酶切鑒定電泳圖Fig.3 Vectors for BiFC assay and enzyme digestion identification
2.4 亞細胞定位結果
取培養好的原生質體細胞進行激光共聚焦顯微觀察GFP熒光信號。結果顯示,在激光共聚焦顯微鏡下 pZmMYC2-GFP、pZmJAZ4-GFP、pZmJAZ8-GFP和ZmJAZ12-GFP均在細胞核中檢測到GFP熒光信號,同時該熒光信號與細胞核的紅色熒光信號重合(圖4)。亞細胞定位實驗設置pRTL-GFP轉化的空載GFP為對照,GFP在細胞質與細胞核中均有分布。亞細胞定位的結果表明ZmMYC2、ZmJAZ4、ZmJAZ8和ZmJAZ12均定位于細胞核中。
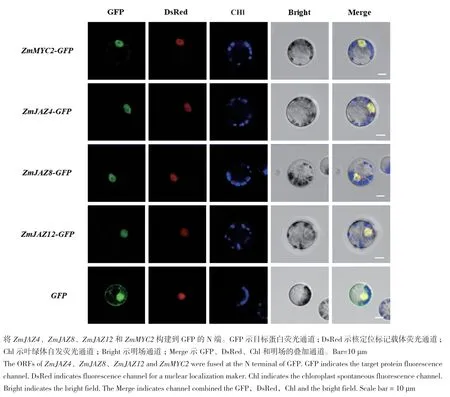
圖4 ZmJAZ4、ZmJAZ8、ZmJAZ12和ZmMYC2的亞細胞定位Fig. 4 Subcellular localization of ZmJAZ4,ZmJAZ8,ZmJAZ12 and ZmMYC2
2.5 BiFC檢測蛋白互作
取培養好的原生質體細胞進行激光共聚焦顯微觀察YFP熒光信號,設置pYFPC和pZmMYC2-YFPN、pYFPN和pZmMYC2-YFPC為陰性對照。結果顯示,在激光共聚焦顯微鏡下陰性對照無熒光信號,僅有核熒光信號;而pZmMYC2-YFPN和pZmJAZ4-YFPC、pZmMYC2-YFPN和 pZmJAZ8-YFPC、pZmMYC2-YFPN和 pZmJAZ12-YFPC、pZmMYC2-YFPC和pZmJAZ4-YFPN、pZmMYC2-YFPC和 pZmJAZ8-YFPN、pZmMYC2-YFPC和pZmJAZ12-YFPN均在細胞核中檢測到YFP熒光信號,同時該熒光信號與核熒光信號重合(圖5)。BiFC結果表明ZmMYC2和ZmJAZ4、ZmJAZ8、ZmJAZ12在植物體內存在蛋白互作,且相互作用發生在細胞核中。
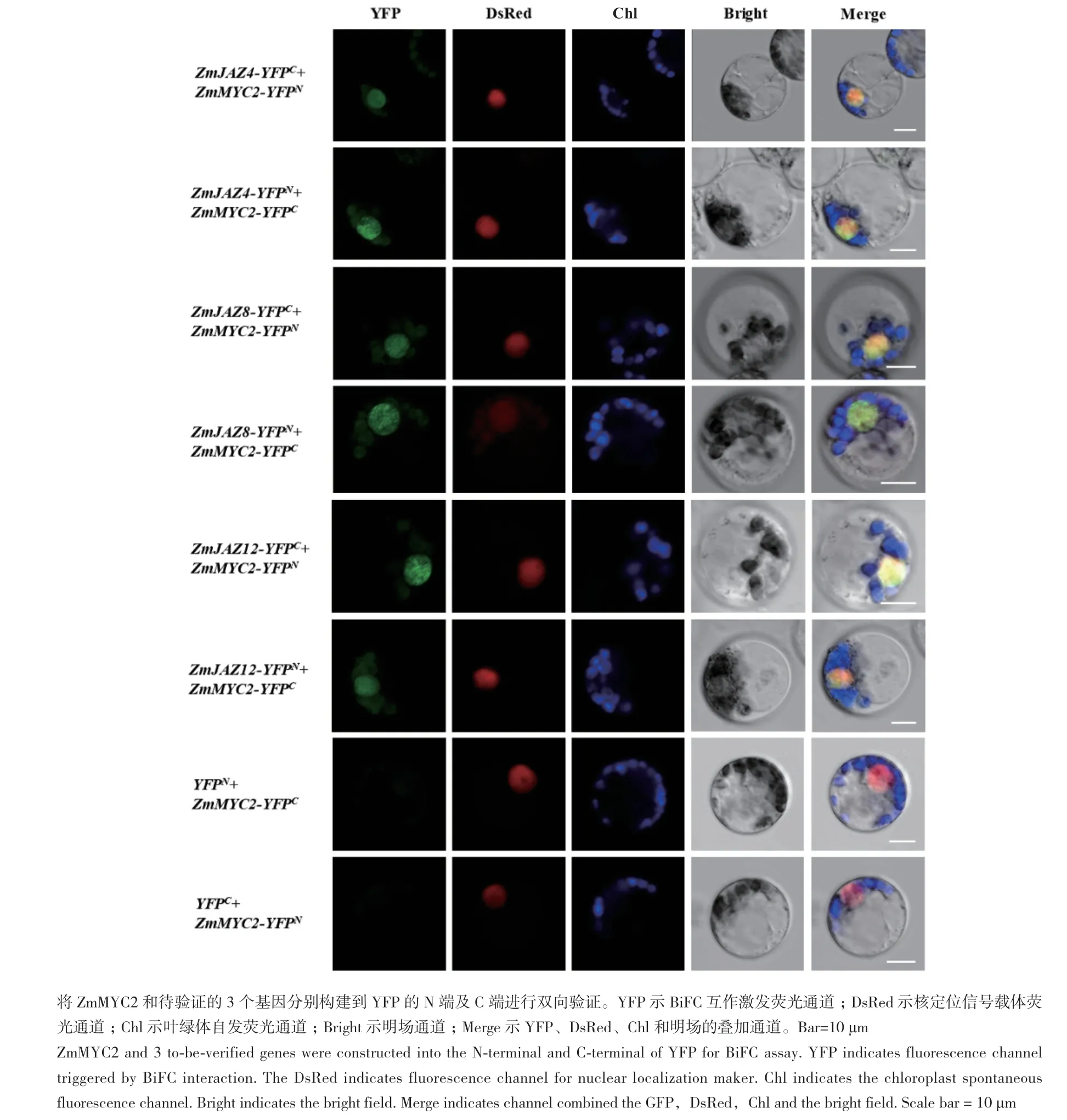
圖5 ZmMYC2與ZmJAZ4、ZmJAZ8和ZmJAZ12的BiFC互作驗證Fig. 5 BiFC assay to verify interactions between ZmJAZs with ZmMYC2
3 討論
多種植物激素中,普遍認為赤霉素、生長素、脫落酸和細胞分裂素是調節植物生長發育的重要激素,茉莉酸和水楊酸在植物應對生物和非生物脅迫中發揮主要作用。但是近些年隨著對JA信號通路的研究越來越多,發現JA不僅在植物抵抗生物脅迫過程中發揮作用,而且在植物的性別決定以及生長發育中也發揮重要作用。在玉米ts1(tasselseed1)突變體的研究中克隆得到的ts1基因,其編碼產物具有13-脂氧合酶(13-lipoxygenase,13-LOX)的特征,13-LOX酶類是茉莉酸合成途徑重要的酶類。ts1突變體未成熟雄花序中脂氧合酶的活性消失,且內源茉莉酸濃度降低至野生型玉米的十分之一,對突變體未成熟雄花序外施JA可恢復雄花的正常發育[21],說明JA的缺乏是造成突變體表型的原因,也說明JA是玉米雄花性別決定中的一種重要的信號物質。另外有研究表明JA對擬南芥葉肉細胞中的葉綠素有明顯的降解作用,進而使植物葉片生長受到抑制,表現出黃化衰老的特征[22]。JA通過COI1可抑制光合作用過程中的關鍵酶1,5-二磷酸核酮糖羧化酶的表達,干擾光合作用進程,進而抑制幼苗的生長[23]。擬南芥中的JA不敏感突變體coi1中的F-box蛋白突變使其不能參與形成SCF(Skp1/Cullin/F-box)復合體,導致JAZs蛋白降解調控失效,突變體表現為對JA激素不敏感且雄性不育[24]。與此不同的是,番茄中對應的jai1(jasmonic acid-insensitive1)突變體也是JA不敏感的突變體,突變位點同樣位于F-box蛋白,但是突變體表現為雌性不育[25]。由此可見,不同植物的JA信號調控機制既有保守性又存在差異性。
另有研究表明,ZmJAZ4在非生物脅迫處理(鹽、干旱、ABA等)時被誘導表達,推測ZmJAZ4蛋白可能作為轉錄調節因子在逆境脅迫信號通路中發揮一定的調控作用[26]。和ZmJAZ4相反,ZmJAZ12在干旱脅迫下被抑制表達[27];ZmJAZ4主要在籽粒中高表達,而ZmJAZ12在各個組織均有表達,提示玉米在應對環境脅迫時,不同的JAZ蛋白在各自表達的組織部位可能發揮不同的作用。在黑粉菌(Sphacelotheca reiliana)侵染后ZmJAZ4和ZmJAZ8被誘導表達,莖腐病菌(F.moniliforme)侵染后ZmJAZ12也被上調表達[27],提示ZmJAZ4、ZmJAZ8和ZmJAZ12在抵抗病原菌侵染的過程中發揮作用。
玉米的生殖發育過程和擬南芥以及水稻不同,玉米的生殖發育過程中還涉及雌雄花的性別決定,因此JA信號通路在玉米中的作用可能更為復雜。MYC2和JAZ蛋白的互作是JA信號通路傳導中的重要環節,同時MYC2還是JA和其他激素信號途徑交叉互話的核心轉錄因子,更深入細致地探究JA信號通路在玉米中的轉導機制就顯得很有必要。JAZ蛋白和MYC2作為JA信號通路中的重要組分,明確兩者之間的相互作用關系對后續研究將提供重要的基礎。同時,為后續通過Pull-down和Co-IP等實驗進一步驗證ZmJAZ和ZmMYC2的相互作用,探尋其互作位點提供了參考依據。
4 結論
本研究在玉米葉肉細胞原生質體中對JA信號通路中3個不同的JAZ家族蛋白ZmJAZ4、ZmJAZ8和ZmJAZ12與ZmMYC2的互作關系進行了BiFC驗證。結果顯示,3個不同的ZmJAZ蛋白均可與ZmMYC2在細胞核中互作。

