假單胞菌Tw224抗砷基因簇的功能研究
孫靖雅 馬玉超
(北京林業大學生物科學與技術學院,北京 100083)
砷(As)是廣泛存在于土壤、礦物質、水和生物圈中的一種劇毒、具有致癌作用的類金屬元素[1-2],在地殼中的含量排名居于第20位。砷在自然界中主要呈現 As3-、As0、As3+和 As5+四種價態[3-4],其中以As3+和As5+這兩種價態最為常見,且前者的毒性為后者的60-100倍甚至更多[5]。我國是砷污染問題最為嚴重的國家之一,自然和人為因素導致大量的砷被釋放到環境中,造成了嚴重的砷污染現象,使我國土壤平均砷含量約為世界平均值兩倍[6-7]。
自然界中As的生物化學循環依賴于微生物的轉化,長期在砷環境中生存的各種微生物也進化出了多種抗砷機制,其中較常見的4種機制為:As3+氧化,細胞質As5+還原,呼吸性As5+還原,As3+甲基化[8],4種抗砷機理皆由各種操縱子或基因進行表達調控。細胞質As5+還原是微生物實現自身砷解毒的一種重要機制,在有氧條件下,進入細胞質的五價砷被砷還原酶還原為三價砷后通過As3+通道蛋白排出胞外。ars operon調控是一種負調控機制,三基因操縱子(arsRBC)和五基因操縱子(arsRDABC)在原核生物中被大量發現,目前研究較為詳盡。在該操縱子結構中,arsR編碼阻遏蛋白ArsR,主要調控該操縱子中其他基因的表達;arsB編碼的通道蛋白ArsB使As3+排出細胞;arsC編碼的還原酶ArsC可以將As5+還原成As3+;arsA編碼一種As3+激活的ATPase,與As3+分子伴侶ArsD一起增強ArsB對As3+的外排能力[9];在近期的研究中,還發現了一個與砷代謝相關的功能不明確基因arsH,近年來有多項研究試圖探討驗證其作用機制[10-11]。
本實驗室前期從湖南康家灣鉛鋅礦區的土壤中分離獲得一批高抗砷菌株,經砷MIC值及氧化還原性測定得到砷耐受性優勢菌株Pseudomonas sp.Tw224[12]。本研究對該優勢菌株進行深入抗重金屬性能分析,通過測序基因組框架圖分析該菌抗砷和其他重金屬基因;并利用代謝工程法驗證ars基因簇與砷耐受性的相關性,旨在豐富假單胞菌中ars基因簇資源,揭示不同基因簇的抗砷功能差異,為砷污染環境的生物修復奠定理論基礎。
1 材料與方法
1.1 材料
1.1.1 菌株和質粒 本實驗中用到的全部菌株及質粒詳見表1。菌株Pseudomonas sp. Tw224為本實驗室前期分離自湖南康家灣鉛鋅礦區土壤的高抗砷菌株。E. coli S17-1、質粒pK18mobsacB和pSET152由實驗室保存,其他菌株和質粒由本實驗構建。
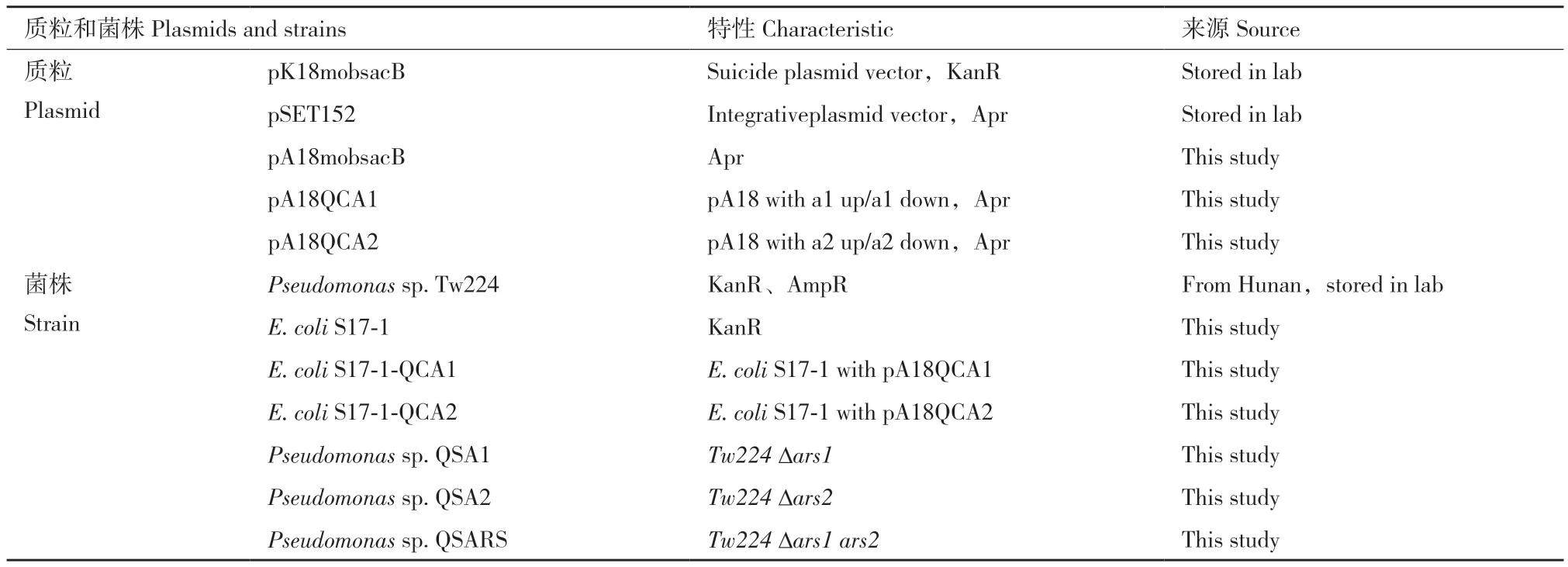
表1 實驗中使用的菌株和質粒Table 1 Plasmids and strains in this study
1.1.2 分子生物學試劑和引物 本文分子生物學實驗所用引物(表2)均由北京擎科生物科技有限公司合成,測序工作由北京睿博興科生物科技有限公司完成。膠回收試劑盒、PCR純化試劑盒、Marker、高保真PCR酶,限制性內切內EcoR I、BamH I和Hind III均購于寶日醫生物科技有限公司,基因組提取試劑盒、質粒提取試劑盒購于天根生化科技有限公司,無縫克隆試劑盒購于碧云天生物科技有限公司,Na2HAsO4·7H2O、安普霉素、卡那霉素均購于西格瑪奧德里奇(上海)貿易有限公司。

表2 實驗中使用的引物Table 2 Primers in this study
1.1.3 培養基 LB培養基:酵母提取物5 g,胰蛋白胨10 g,NaCl 10 g,無菌水定容至1 L,調節pH至7.2,固體培養基加Agar 16 g。LBS培養基:每升LB培養基中加蔗糖20 g。如需要培養基中添加抗生素,安普霉素(Apr)和卡那霉素(Kn)終濃度均為50 μg/mL。鉬藍試劑:取67.3 mL濃硫酸緩慢加入200 mL蒸餾水,至冷卻后定容至1 L,加入6 g鉬酸銨,10.8 g抗壞血酸,0.136 g酒石酸銻鉀至完全溶解。
1.2 方法
1.2.1 細菌全基因組提取、測序及分析 使用細菌基因組提取試劑盒提取Pseudomonas sp. Tw224的全基因組,檢測合格后送至北京諾禾致源生物信息科技有限公司進行全基因組測序。用7個數據庫(GO/KEGG/COG/NR/TCDB/Swiss-Prot/TrEMBL)對基因進行功能注釋,在此基礎上對全基因組進行了Blast比對。用SignalP數據庫對分泌蛋白進行預測。
1.2.2 砷及重金屬MIC值測定 將目的菌株在含不同濃度砷/重金屬的LB培養基固體平板上劃線接種,28℃倒置培養3 d觀查結果。液體砷MIC值測定使用含不同濃度砷液體LB培養基,接種后28℃,180 r/min培養72 h檢測結果。實驗設置3個重復。
1.2.3 生長曲線的測定 將目的菌株活化后,挑單菌落接種至10 mL液體LB培養基,28℃,180 r/min培養14 h左右,至OD600為1.0作為種子液,取1 mL種子液接種至100 mL培養基中(1%),28℃,180 r/min連續培養。選擇不同時間點,吸取200 μL菌液至96孔板,使用酶標儀測定其在600 nm處吸光度,以培養時間為橫坐標,OD600值為縱坐標繪制生長曲線,實驗設置3組重復。
1.2.4 pK18mobsacB質粒的改造 利用位于卡那霉素抗性基因(KanR)內部的EcoRI和HindIII酶切pK18mobsacB質粒,并純化獲得KanR基因缺失的線性化質粒片段。以質粒pSET152為模板,利用引物對Apr-U/D,在高保真酶體系中PCR擴增安普霉素抗性基因片段。利用PCR擴增產物末端同源臂序列,對上述pK18mobsacB線性片段和安普霉素抗性基因片段進行無縫克隆操作,轉化dH5α感受態細胞,并利用引物對YZ UP/DOWN進行菌落PCR驗證和卡那霉素培養基培養驗證。
1.2.5 基因簇敲除載體pA18QCA1和pA18QCA2的構建 質粒pA18mobsacB經BamHI和HindIII雙酶切、純化后獲得線性化片段。以Pseudomonas sp.Tw224基因組DNA為模板,利用引物對MQa1U S/A和MQa1D S/A分別PCR擴增ars1基因簇的上游(a1 up-1 092 bp)和下游(a1 down-822 bp)DNA片段;利用引物對MQa2U S/A和MQa2D S/A分別擴增Pseudomonas sp. Tw224基因組中ars2基因簇的上游(a2 up-728 bp)和下游(a2 down-585 bp)DNA片段。純化后的ars1基因簇的上下游片段(a1 up和a1 down),ars2基因簇的上下游片段(a2 up 和a2 down),分別與線性化的pA18mobsacB進行無縫克隆操作,分別構建基因簇敲除載體pA18QCA1和pA18QCA2。
1.2.6 抗砷基因簇突變株的構建 將基因簇敲除載體pA18QCA1和pA18QCA2分別電轉化導入E. coli S17-1,獲得雙親接合供體菌E. coli S17-1-QCA1和E. coli S17-1-QCA2(后簡稱為QCA1/QCA2)。將液體培養24 h的供體菌(QCA1/QCA2)分別與受體菌(Tw224)進行雙親接合。利用氨芐青霉素和安普霉素篩選同源單交換突變株,利用LBS培養基篩選同源雙交換突變株。利用引物對YZA1 Y S/A和YZA2 Y S/A進行菌落PCR,分別同源單交換和雙交換突變株,并將雙交換突變株分別命名為Pseudomonas sp. QSA1和Pseudomonas sp. QSA2(后簡稱為QSA1/QSA2)。以構建成功的ars1缺失突變株QSA1為受體菌,與供體菌(QCA2)進行雙親接合,利用抗生素和蔗糖篩選分別篩選同源單交換和雙交換突變株,經菌落PCR驗證獲得ars1-ars2雙基因簇缺失突變株Pseudomonas sp. QSARS(后簡稱為QSARS)。
1.2.7 砷還原能力測定 使用砷鉬藍法定量測量菌株對五價砷的還原能力。將保藏菌種活化后取單菌落接種于液體LB培養基,28℃,180 r/min培養至OD600為1.0。將種子液8 000 r/min離心10 min,使用PIPES緩沖液兩次洗滌菌體后,將菌體懸浮于含1 mmol/L Na2HAsO4·7H2O的 PIPES 中,調整菌懸液的OD600為1.0,并于28℃,180 r/min持續培養,每24 h取樣1 mL測定菌株對砷的還原能力,樣品經8 000 r/min離心10 min后用不含砷的PIPES將上清稀釋10倍,取稀釋后上清液各300 μL,一份加入 100 μL KIO3溶液(5 mmol/L KIO3溶于 50 mmol/L HCl);另一份加入 100 μL 25 mmol/L HCl。將全部樣品25℃水浴10 min,統一加入600 μL鉬藍試劑,然后立即轉移至78℃水浴10 min,結束后放至冰上。取處理后樣品200 μL加入96孔板,測定其OD865吸光度。以Na2HAsO4·7H2O濃度0、200、400、600、800和1 000 μmol/L為橫坐標,吸光度 OD865為縱坐標,繪制標準曲線。處理二為樣本中As5+濃度,處理一與處理二差值為As3+濃度,依此計算菌株對As5+還原率。實驗設置3組重復。
2 結果
2.1 Pseudomonas sp. Tw224的抗重金屬譜
菌株Tw224在固體LB平板上As5+和As3+的最低抑菌濃度分別為600 mmol/L和20 mmom/L。為評估該菌的抗重金屬性能,我們檢測了除砷以外的8種重金屬的耐受性,結果表明,該菌對這8種重金屬均具有不同程度的耐受性(表3)具有廣譜的抗重金屬能力。其中,Cu、Zn和Ni的最低抑菌濃度分別達到20 mmol/L、12 mmol/L和12 mmol/L。
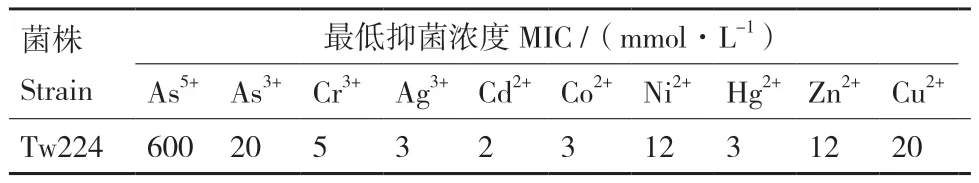
表3 Pseudomonas sp. Tw224對8種重金屬的MIC值Table 3 MIC to 8 heavy metals of Pseudomonas sp. Tw224
2.2 Pseudomonas sp. Tw224抗砷性能分析
為深入分析Tw224的抗砷性能,將該菌培養于含不同濃度砷的液體LB,不同時間取樣測定菌濃,并繪制生長曲線。自0-275 mmol/L,共設置15個As5+濃度梯度,結果表明,隨著As5+濃度增加,Tw224進入對數生長期的時間明顯延后,最高OD600值明顯降低(圖1)。Tw224在不含砷的LB培養中,約6 h就進入了對數生長期,在30 h時最高OD600達到約1.7;而在50 mmol/L,180 mmol/L As5+存在的條件下,分別約8 h和36 h才進入對數生長期,在約38 h和60 h最高OD600才達到約1.3和1.0;且在275 mmol/L As5+存在的條件下,該菌幾乎不能生長。該結果充分體現了As5+對細菌細胞的生長抑制作用,同時也證明了Tw224的強抗砷能力。
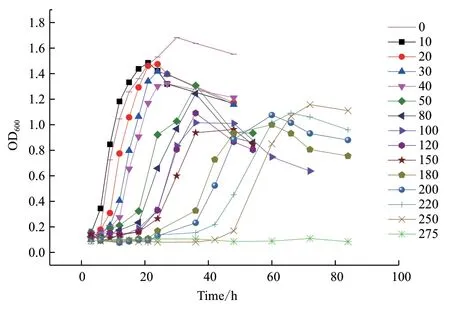
圖1 Pseudomonas sp. Tw224在不同濃度砷培養下的生長曲線Fig. 1 Growth curve of Pseudomonas sp. Tw224 in different concentrations of arsenic
2.3 Pseudomonas sp. Tw224的抗砷基因分析
鑒于Pseudomonas sp. Tw224的抗砷能力強,抗重金屬譜廣,我們對該菌株進行全基因組測序和生物信息學分析。該菌基因組中共包含了20個與抗砷相關的基因,包括1個arsH,4個arsC,arsB和ACR(3)各2個,11個arsR。這20個基因中,arsH-arsC2-arsB-arsR和arsR-arsB-arsC2分別以基因簇的形式存在(圖2),長度分別為2.8 kb和2.2 kb,分別將其命名為基因簇ars1和ars2,其他基因分散在基因組中。其中arsB-arsC-arsR是與砷抗性相關的最基本的基因構成,主要介導As5+的還原外排。除了存在兩個抗砷基因簇外,在基因位置GM_1097和GM_5883上還單獨存在還原酶基因arsC1,編碼外排泵的基因ACR(3)(GM_1626和GM_2250)也單獨存在。位于ars基因簇上和散布在基因組上的arsH基因同源性均在97%以上。雖然該菌具有砷氧化能力,但未發現砷氧化、砷甲基化相關基因。同時,在該菌基因組中發現了多種重金屬(銅、鎳、鋅、鎘、鉻、銀、汞等)抗性相關基因基因簇(圖2),這與該菌抗廣譜重金屬結果相一致(表3)。
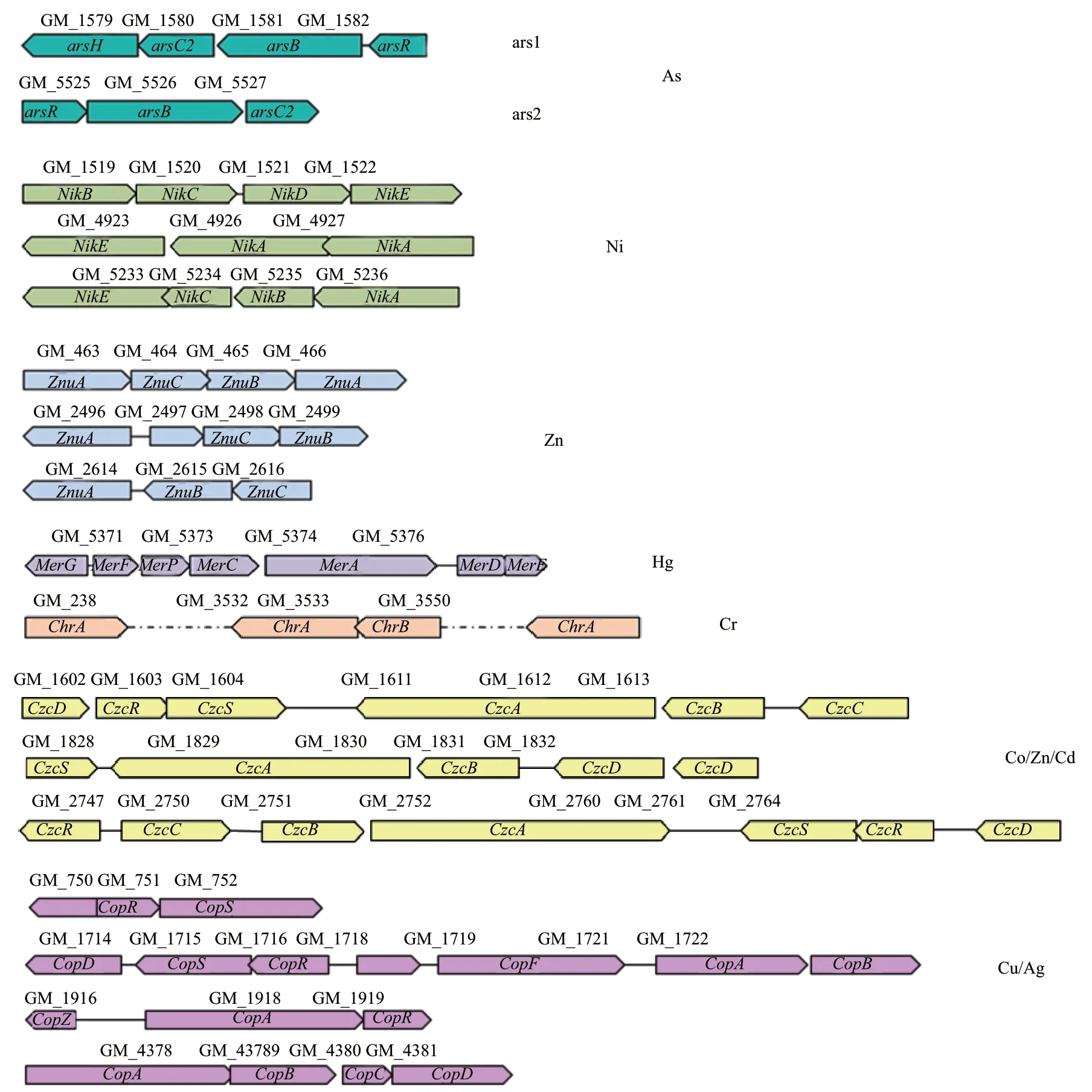
圖2 Pseudomonas sp. Tw224中與砷與其他重金屬抗性相關的基因和基因簇Fig. 2 Genes and gene clusters related to resistances to arsenic and other heavy metals in Pseudomonas sp. Tw224
2.4 質粒載體的構建及基因簇敲除突變株的篩選
2.4.1 pA18mobsacB質粒的構建 在前期實驗過程中,我們了解到Tw224具有卡那霉素抗性,但是對安普霉素敏感。為了在雙親接合后能夠利用抗生素篩選同源重組突變株,我們需要將pK18mobsacB載體中卡那霉素抗性基因替換為安普霉素抗性基因。采用無縫克隆技術成功構建載體pA18mobsacB。含有該載體的E. coli DH5α,不能生長于含有50 μg/mL卡那霉素的LB培養基中,能夠生長于含有50 μg/mL安普霉素LB培養基中。在插入位置的上下游設計引物對YZ UP/YZ DOWN以用于菌落PCR擴增驗證,若以重組質粒pA18mobsacB為模板,擴增片段大小應為1 176 bp;若以原質粒pK18mobsacB為模板,擴增產物應為579 bp。利用該引物進行菌落PCR擴增驗證,結果表明該質粒構建成功(圖3-A)。
2.4.2 突變株構建及篩選 采用無縫克隆技術構建基因簇敲除載體pA18QCA1和pA18QCA2。為驗證敲除載體構建成功,在修改片段的上下游設計了引物對YZ UP/DOWN,以pA18QCA1和pA18QCA2為模板,擴增片段分別為1 510 bp和1 067 bp。以此引物對進行PCR驗證結果表明,上述兩個基因簇敲除載體均構建成功(圖3-B)。
2.4.3 抗砷基因簇敲除突變株的構建與篩選 通過雙親接合分別將基因簇敲除載體pA18QCA1和pA18QCA2導入Pseudomonas sp. Tw224,經抗生素和蔗糖篩選分別獲得ars1和ars2的同源單交換和雙交換突變株。以QSA1為受體,繼續敲除ars2基因簇,以獲得ars1-ars2雙缺失突變株。在ars1和ars2基因簇上下游同源臂上設計引物對YZA1Y S/A和YZA2Y S/A用于突變株PCR驗證。對突變株和野生株進行PCR驗證。兩對引物的位置均位于敲除片段上下游同源臂上,若敲除成功,擴增條帶應為689 bp(ars1)和628 bp(ars2),若未敲除成功,擴增條帶應為3 060 bp(ars1)和2 692 bp(ars2)。以野生菌和抗生素篩選獲得的突變株為模板,利用上述兩對引物進行突變株驗證,結果表明ars1、ars2和ars1-ars2基因簇缺失突變株均構建成功(圖3-C),分別命名為Pseudomonas sp. QSA1(簡稱QSA1),Pseudomonas sp. QSA2(簡稱QSA2)和Pseudomonas sp. QSARS(簡稱 QSARS)。
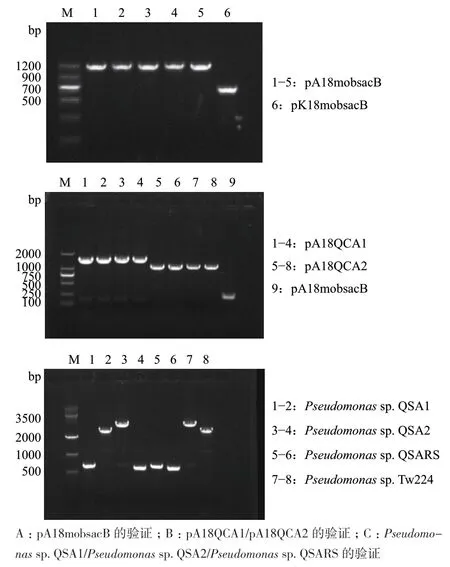
圖3 各重組質粒及突變株的驗證Fig. 3 Verification of recombinant plasmids and mutants
2.5 突變株的生長和抗砷能力分析
無論單基因簇敲除還是雙基因簇敲除均未影響菌體的生長(圖4-A)。但基因簇敲除后,菌株的抗砷能力明顯減弱。圖4-B縱坐標表示菌體可耐受的As5+濃度。野生菌的As5+MIC值為250 mmol/L;ars2缺失突變株QSA2為野生株的80%,下降幅度較小;ars1缺失突變株QSA1的As5+MIC值為10 mmol/L,僅為野生株的4%;而ars1-ars2雙基因簇缺失突變株QSARS在含有5 mmol/L As5+培養基中不能生長僅能在2 mmol/L As5+濃度下極微弱生長,幾乎完全失去As5+耐受性(圖4-B),3組平行實驗的菌體耐受性結果相同。上述結果表明,在Pseudomonas sp.Tw224中,ars1基因簇其主要的抗砷作用,ars2基因簇起輔助作用。
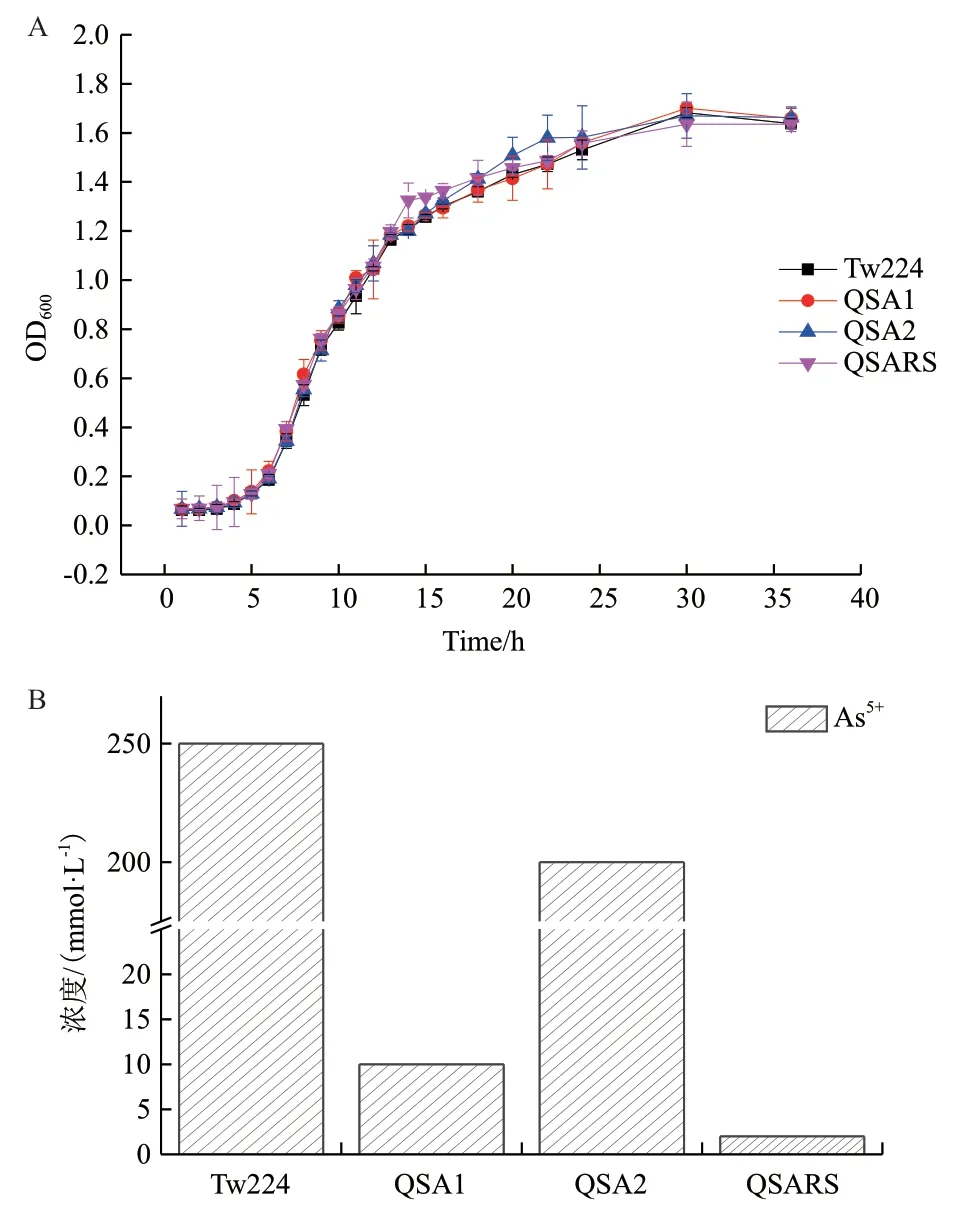
圖4 抗砷基因簇缺失突變株生長曲線(A)及砷耐受性(B)Fig. 4 Growth curve and arsenic resistance of the gene cluster-inactivated mutants
2.6 突變株的砷還原能力
在突變株還原As5+的不同時間點取樣,利用砷鉬藍法測定光密度值,根據標準曲線獲得As5+和As3+的濃度,計算得出As5+還原率。結果表明,Tw224在48 h對As5+的還原率達到最高值52%;QSA1、QSA2的還原率隨培養時間持續增長,在48 h分別僅為5%和28%,僅是野生菌的9.8%和53.8%,QSA1在120 h的還原率達到最高值7%,QSA2在120 h的還原率達到最高值35%(圖5);QSARS在含砷培養基中無法正常生長,在還原試驗中也未檢測出還原反應。ars基因簇主要介導砷還原外排機制,ars1基因簇的缺失,菌株的砷還原能力明顯減弱,且ars1-ars2雙基因簇缺失,菌株幾乎喪失了砷耐受性和還原性,這一結果從還原能力角度證明了ars1基因簇在抗砷功能方面起主要作用。
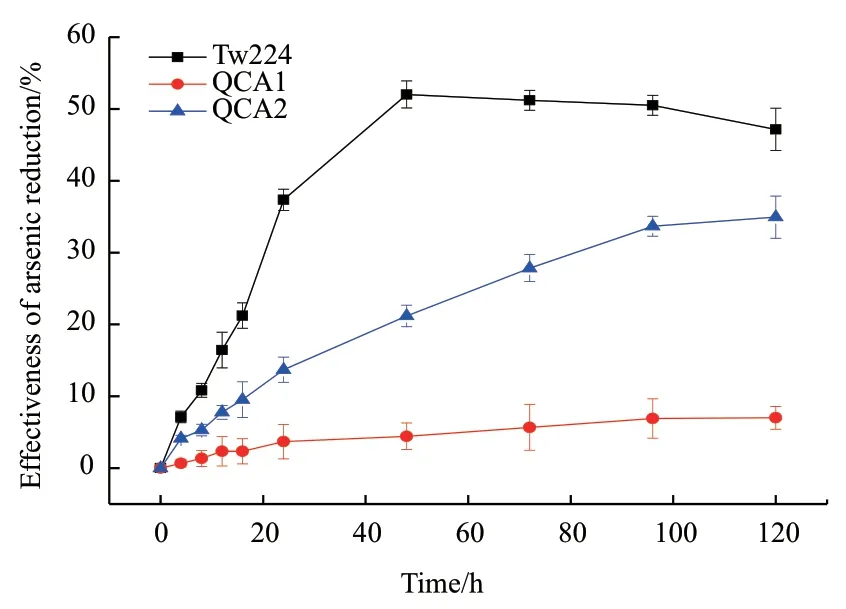
圖5 各菌株As5+還原率差異Fig. 5 Arsenic reduction difference of the mutants
3 討論
本文所研究的砷耐受性優勢菌株Pseudomonas sp. Tw224同時具有砷氧化性和還原性[12],檢測到其基因組中含有砷還原性相關基因,在不同濃度的砷酸鹽培養條件下,其生長速度與砷還原性出現了一定相關性,該菌的生物量隨著砷濃度的升高而明顯降低。
在許多抗砷細菌中,可能不只存在單一的基因簇,而是含有多個抗砷基因或基因簇的拷貝。ars operon調控機制以三基因操縱子(arsRBC)和五基因操縱子(arsRDABC)最為常見,在多種不同微生物中已被大量發現和研究,且不同基因型的ars operon在砷代謝上的優勢及其相互之間作用和影響當前未見報道[13]。本研究中Pseudomonas sp. Tw224存在兩個抗砷基因簇,為arsHCBR和arsCBR。其中arsC、arsB和arsR基因分別負責As5+還原、As3+外排和調節過程,這個過程主要體現的是As5+還原機制,細菌細胞吸收As5+后,在還原酶ArsC作用下被還原成As3+,然后再由外排蛋白ArsB排出,從而達到自身解毒的目的。而且在菌株Pseudomonas putida S13.1.2[14]和 Pseudomonas putida KT2440[15]的一些研究中也發現了相同的基因簇,均由抗砷基因arsH、arsC、arsB和arsR組成,但在Pseudomonas putida W619、Pseudomonas sp. TS44等菌株中,抗砷基因簇中的基因ACR3代替了arsB發揮As3+外排作用。除此之外,在 Pseudomonas xanthomarina S11[16]和Bacillus cereusstrain SJ1[17]中還存在 arsD、arsA 等基因,其中arsD編碼一種阻遏蛋白,arsA編碼與ATP酶相關的蛋白,而Pseudomonas sp. Tw224菌株中缺少這些基因,但是在一些砷代謝機制的研究中發現arsA的存在與否對砷的抗性水平影響不是很大[18]。在抗砷細菌Achromobacter sp. SY8、Agrobacterium tumefaciens 5A和Rhizobium sp. NT-26等細菌中,通過As3+氧化機制來實現砷解毒的過程也是廣泛存在的,其次還存在一種As3+甲基化機制,可以將As3+經過一系列的甲基化過程,最終轉變成氣態的砷化合物揮發出去,從而達到解毒效果。通過抗砷基因分析,在Pseudomonas sp. Tw224中沒有發現As3+甲基化酶基因arsM和相關的氧化酶基因,初步推測在該菌株中可能存在其他的氧化基因或氧化途徑。
在Pseudomonas sp. Tw224中不僅存在抗砷相關的基因,還發現了抗其他重金屬的基因,如鋅、鎳、銅、汞、鎘等。其中含有最多的基因是抗銅基因,是通過cop系統介導的,抗其他重金屬的系 統還有 Nik[19]、Znu[20]、Mer等, 其中 czc家族[21-22]的基因與多種重金屬氧離子的抗性相關,包括鈷、鋅、鎘等。在同一菌株中存在多種抗重金屬的基因和機制,這在Pseudomonas putida S13.1.2[14]、Mesorhizobium amorphae CCNWGS0123和 Agrobacterium tumefaciens CCNWGS0286[20]等 菌株的研究中均有報道。在該菌株中,與鉻(Cr)抗性相關的基因較少,只有chrA和chrB,這與鉻對Pseudomonas sp.Tw224的最低抑菌濃度低相符。
本實驗利用代謝工程法,通過構建ars基因簇缺失突變株來探究ars基因簇的功能,實驗結果表明,失去ars2基因簇(arsC-arsB-arsR)并不會極大影響菌株的砷耐受性,而失去ars1基因簇(arsH-arsC-arsB-arsR)則使菌株幾乎完全失去砷抗性。其中,功能尚不明確的arsH基因可能起到重要作用。在關于微生物抗砷機制的歷年研究中,對于基因arsH的功能始終沒有明確驗證。在陳倩等[10]的研究中,闡述了arsH編碼NADPH依賴的黃素單核苷酸還原酶,具有O2還原性,可將其還原為H2O2,目前已發現其晶體結構,但是對其具體作用始終不能明確。Páez-Espino等[11]的最新研究發現 P.putida KT2440的arsH1和arsH2基因在較小程度上增強了其對無機砷(V)和As(III)的耐受性,并減輕了暴露于任一氧陰離子的細胞所經歷的氧化應激。arsH1、arsH2在大腸桿菌中異源表達實驗的結果表明,除了對有機砷有直接作用外,arsH還通過介導暴露于氧陰離子時體內產生的ROS的減少,例如通過產生FMNH2來促進ROS猝滅活性,從而有助于減輕As對物種的毒性。此外,Serrato-Gami?o等[23]也在Burkholderia xenovorans LB400中發現了含有arsH的ars基因簇(arsR3,ACR3,arsC1和 arsH),Cai等[24]在Pseudomonas sp. TS44中發現了含有arsH的ars基因簇(arsC1-arsR-arsC2-ACR3-arsH),但均未對基因功能進行進一步驗證。在Pseudomonas sp. Tw224中,兩基因簇arsHCBR和arsCBR高度重復,為精確對比arsH的功能及其對砷抗性的影響研究有極大優勢。
4 結論
本文深入研究了Pseudomonas sp. Tw224的抗重金屬譜和抗砷性能,通過基因組測序和分析預測到兩個抗砷基因簇,通過同源重組法構建了ars1、ars2和ars1-ars2缺失突變株,基因簇缺失未對菌株生長產生影響,但突變株的抗砷和As5+還原能力明顯減弱。基因簇ars1、ars2缺失突變株的抗砷能力(As5+MIC值)分別為10 mmol/L和200 mmol/L,分別是野生株的4%和80%;48 h時的砷還原能力分別為野生菌的9.8%和53.8%;ars1-ars2雙基因簇缺失突變株幾乎完全喪失了抗砷能力和砷還原能力。上述結果充分表明在Pseudomonas sp. Tw224,ars1起主要的抗砷作用,ars2起輔助功能。

