RNA干擾Livin基因聯(lián)合順鉑對喉鱗狀細胞癌Hep-2細胞增殖和凋亡的影響
李志勇, 馮 俊, 馬 鵬, 彭 濤, 張欣平, 楊荃荃
(四川省南充市中心醫(yī)院, 1. 耳鼻咽喉頭頸外科, 2. 口腔科, 四川 南充, 637000)
喉癌為臨床常見的頭頸部惡性腫瘤,其中鱗狀細胞癌最為常見(占95%以上)[1-2]。喉癌患者確診時大多已為中晚期,手術(shù)結(jié)合放療的效果并不理想,5年存活率僅20%~40%[3-4]。Livin基因是凋亡抑制蛋白(IAPs)家族成員,屬于凋亡負向調(diào)控基因,與細胞凋亡及腫瘤發(fā)生發(fā)展密切相關(guān),在多種惡性腫瘤中高表達且與腫瘤的復發(fā)、轉(zhuǎn)移、預后存在一定關(guān)聯(lián)[5-6]。目前,已有一些研究分析了Livin基因在喉鱗狀細胞癌細胞中的表達及對預后的影響,但較少涉及細胞增殖與凋亡機制。惡性腫瘤的發(fā)生與細胞增殖失控和凋亡抑制有關(guān),胃癌、腸癌、腎癌中Livin均與凋亡基因Bcl-2、Bax相關(guān),但喉鱗狀細胞癌中Livin是否與Bcl-2、Bax相關(guān)尚存爭議[7]。此外,凋亡基因調(diào)控往往會引起細胞周期改變,這可能是Livin基因引起細胞分裂周期改變的機制。本研究探討了RNA干擾技術(shù)下調(diào)Livin基因聯(lián)合順鉑處理對喉鱗狀細胞癌細胞系Hep-2細胞增殖和凋亡的影響,旨在為喉鱗狀細胞癌Livin基因的深入研究提供參考。
1 材料與方法
1.1 實驗材料
人喉鱗狀細胞癌Hep-2細胞株1株,購自中科院上海細胞所。
1.2 儀器與試劑
Annexin V-FITC/PI雙染細胞凋亡試劑盒(含Binding Buffer試劑)、噻唑藍(MTT)試劑購自上海BestBio貝博生物有限公司。注射用順鉑(國藥準字H20073653),購自齊魯制藥有限公司。HAJ3270恒溫CO2細胞培養(yǎng)箱,購自上海新諾公司。Annexin流式細胞儀,購自美國貝克曼庫爾特有限公司。伯樂PCR基因擴增儀,購自美國BioRad公司。
1.3 方法
1.3.1 細胞培養(yǎng)與分組: 將人喉鱗狀細胞癌Hep-2細胞株的凍存管從液氮中取出,置于RPMI1640培養(yǎng)基上,于37 ℃恒溫、5% CO2細胞培養(yǎng)箱中進行細胞培養(yǎng)。取對數(shù)生長期細胞,接種于24孔板專用細胞玻片,進行脂質(zhì)體轉(zhuǎn)染。RNA干擾轉(zhuǎn)染Livin基因所用的序列: 上游引物5′-GGGACCACGUGGAUGGGC-3′, 下游引物5′-UGCCCAUCCACGUGGUCC-3′。轉(zhuǎn)染后,需要經(jīng)蛋白免疫印跡法證實是否轉(zhuǎn)染成功(Livin表達下調(diào)表示轉(zhuǎn)染成功),經(jīng)熒光顯微鏡觀察轉(zhuǎn)染率。采用簡單隨機分組法將細胞分為陰性對照組(細胞未經(jīng)任何處理)、干擾組(細胞經(jīng)RNA干擾Livin轉(zhuǎn)染)、順鉑組(細胞經(jīng)6 μmol/L順鉑處理)、聯(lián)合組(細胞經(jīng)RNA干擾Livin轉(zhuǎn)染+6 μmol/L順鉑處理),每組均設(shè)置6個復孔,另設(shè)置無細胞的培養(yǎng)液作為空白孔調(diào)零。
1.3.2 細胞增殖抑制率檢測: 采用四甲基偶氮唑鹽微量酶反應比色法(MTT法)檢測各組細胞增殖抑制率。分組處理48 h后,收集對數(shù)生長期細胞,調(diào)整細胞懸液濃度至5×104個/mL, 37 ℃恒溫、5% CO2條件下孵育。當細胞單層鋪滿96孔平底板后,每孔滴加0.5% MTT試劑20 μL, 37 ℃恒溫、5% CO2細胞培養(yǎng)箱孵育4 h, 終止培養(yǎng); 然后向每孔加入二甲基亞砜試劑150 μL, 輕輕震蕩10 min; 最后使用Varioskan LUX酶標儀,于570 nm處測量光密度(OD)值。細胞增殖抑制率=[1-(實驗孔OD-空白孔OD)/(對照孔OD-空白孔OD)]×100%。
1.3.3 細胞凋亡和細胞周期檢測: 采用流式細胞儀Annexin V-FITC/PI雙染法檢測細胞凋亡率和細胞周期分布。分組處理48 h后,調(diào)整細胞濃度至1×106個/mL。加入20 μg/mL濃度Annexin V-FITC試劑10 μL,37 ℃避光孵育30 min; 再加入50 μg/mL濃度PI試劑5 μL, 37 ℃ 避光孵育 5 min; 最后加入Binding Buffer試劑400 μL, 37 ℃避光孵育5 min。陰性對照為不加Annexin V-FITC/PI試劑的細胞孔。使用流式細胞儀PI染色法對細胞內(nèi)DNA含量進行檢測,將細胞周期各時相區(qū)分為G1/G0期、S期和G2/M期,通過CELLQuest軟件計算流式直方圖對應的細胞周期各時相細胞的百分率。
1.3.4 細胞Bcl-2mRNA、BaxmRNA檢測: 采用逆轉(zhuǎn)錄聚合酶鏈反應(RT-PCR)法檢測。分組處理48 h后,細胞經(jīng)超聲波細胞破碎儀破碎,再加入0.25%胰蛋白酶消化細胞, 10 000轉(zhuǎn)/min離心棄上清,加入Trizol試劑抽提細胞總RNA,干燥RNA沉淀物, -20 ℃保存待檢。引物設(shè)計由生工生物工程(上海)有限公司負責,Bcl-2mRNA上游引物5′-CCTTTGTGTAACTGTACGGCC-3′, 下游引物5′-CTTTGGCAGTAAATAGCTGATTCGAC-3′;BaxmRNA上游引物5′-GGATGCGTCCACCAAGAA-3′, 下游引物5′-TCCCGGAGGAAGTCCATT-3′; β-actin為內(nèi)參。反應條件為94 ℃ 5 min, 94 ℃ 40 s, 60 ℃ 40 s, 72 ℃ 15 s循環(huán)30次, 72 ℃延伸10 min, 最后4 ℃冷卻結(jié)束; 擴增完畢后進行凝膠電泳。
1.4 統(tǒng)計學分析
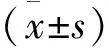
2 結(jié) 果
2.1 喉鱗狀細胞癌Hep-2細胞經(jīng)RNA干擾Livin轉(zhuǎn)染結(jié)果
喉鱗狀細胞癌Hep-2細胞經(jīng)RNA干擾后,Livin表達顯著下調(diào),見圖1。熒光顯微鏡觀察結(jié)果顯示, 24、48、72 h的綠色熒光密度分別為(51.13±15.22)%、(72.17±10.26)%、(76.30±12.48)%, 48、72 h的綠色熒光密度顯著高于24 h, 并呈時間依賴性,見圖2。采用流式細胞術(shù)檢測細胞轉(zhuǎn)染率發(fā)現(xiàn),與48 h相比, 72 h細胞死亡較多,不利于后續(xù)實驗,故本研究選擇48 h為最佳轉(zhuǎn)染時間,見圖3。
2.2 各組細胞增殖與凋亡情況比較
干擾組、順鉑組、聯(lián)合組的細胞增殖抑制率、細胞凋亡率均高于對照組,差異有統(tǒng)計學意義(P<0.05); 聯(lián)合組的細胞增殖抑制率、細胞凋亡率均高于干擾組、順鉑組,差異有統(tǒng)計學意義(P<0.05)。見表1。流式細胞儀Annexin V-FITC/PI雙染法檢測細胞凋亡的流式熒光圖見圖4,各組細胞增殖抑制率、細胞凋亡率比較的柱狀圖見圖5。Annexin V-FITC/PI染色可見,聯(lián)合組細胞核破裂及凋亡小體形成,見圖6。

表1 各組細胞增殖與凋亡情況比較 %

A: Hep-2細胞Livin表達的蛋白免疫印跡圖(N為陰性對照, T為RNA干擾Livin的Hep-2細胞株, β-actin為內(nèi)參); B: Livin表達量的柱狀圖(與N比較, ?P<0.05)。圖1 喉鱗狀細胞癌Hep-2細胞Livin表達的蛋白免疫印跡圖及表達量柱狀圖

圖2 熒光顯微鏡觀察轉(zhuǎn)染效率(放大倍數(shù)100倍)

圖3 24、48、72 h細胞轉(zhuǎn)染率的流式細胞術(shù)檢測結(jié)果

圖4 流式細胞術(shù)檢測各組細胞凋亡的流式熒光圖

A: 各組細胞增殖抑制率柱狀圖; B: 各組細胞凋亡率柱狀圖。與對照組比較, ?P<0.05; 與聯(lián)合組比較, #P<0.05。圖5 各組細胞增殖抑制率、細胞凋亡率比較

圖6 Annexin V-FITC/PI染色顯示細胞核形態(tài)改變(放大倍數(shù)400倍,箭頭處為細胞核破裂及凋亡小體形成)
2.3 各組細胞周期分布情況比較
干擾組、順鉑組、聯(lián)合組的G0/G1期細胞占比均高于對照組, S期和G2/M期細胞占比均低于對照組,差異有統(tǒng)計學意義(P<0.05); 聯(lián)合組G0/G1期細胞占比高于干擾組、順鉑組, S期和G2/M期細胞占比低于干擾組、順鉑組,差異有統(tǒng)計學意義(P<0.05), 見表2。

表2 各組細胞周期分布情況比較 %
2.4 各組細胞Bcl-2 mRNA、Bax mRNA水平比較
干擾組、順鉑組、聯(lián)合組的Bcl-2mRNA水平低于對照組,BaxmRNA水平高于對照組,差異有統(tǒng)計學意義(P<0.05); 聯(lián)合組Bcl-2mRNA水平低于干擾組、順鉑組,BaxmRNA水平高于干擾組、順鉑組,差異有統(tǒng)計學意義(P<0.05), 見表3。各組細胞Bcl-2mRNA、BaxmRNA表達水平柱狀圖見圖7, RT-PCR電泳圖見圖8。

表3 各組細胞Bcl-2 mRNA、Bax mRNA水平比較 ×10-3

A: 各組細胞Bcl-2 mRNA柱狀圖; B: 各組細胞Bax mRNA柱狀圖。與對照組比較, ?P<0.05; 與聯(lián)合組比較, #P<0.05。圖7 各組細胞Bcl-2 mRNA、Bax mRNA表達水平比較

A: Bcl-2 mRNA的RT-PCR電泳圖; B: Bax mRNA的RT-PCR電泳圖。1、2、3、4分別表示對照組、干擾組、順鉑組、聯(lián)合組。圖8 各組細胞Bcl-2 mRNA、Bax mRNA的RT-PCR電泳圖
3 討 論
基因靶向治療應用前景廣闊,有望成為喉鱗狀細胞癌治療的新方向,因此尋找喉鱗狀細胞癌凋亡相關(guān)基因十分重要。Livin基因是21世紀新發(fā)現(xiàn)的凋亡抑制基因,可調(diào)控凋亡抑制蛋白的表達,發(fā)揮抗細胞凋亡的作用,主要機制是通過Caspase蛋白酶激活級聯(lián)反應途徑、激酶活性調(diào)節(jié)H2A. XY142磷酸化通路抑制細胞凋亡[8-9]。Livin基因在骨肉瘤[10]、非小細胞肺癌[11]、胃癌[12]、腮腺瘤[13]等多種惡性腫瘤中高表達,且與腫瘤的復發(fā)、轉(zhuǎn)移、預后生存有一定關(guān)聯(lián)。相關(guān)研究[14-15]顯示,Livin基因沉默靶向誘導惡性腫瘤細胞凋亡,故Livin可作為免疫介導腫瘤凋亡的靶點。研究[16]報道,喉鱗狀細胞癌組織中Livin表達陽性率為71.26%, 顯著高于癌旁喉組織,且陽性率與臨床分期、淋巴結(jié)轉(zhuǎn)移等呈正相關(guān),說明分析Livin對于探討喉鱗狀細胞癌的凋亡機制具有重要價值。
盡管目前尚未檢索到關(guān)于RNA干擾Livin對喉鱗狀細胞癌細胞系Hep-2細胞增殖和凋亡影響的相關(guān)研究,但參考肺腺癌SPC-A1細胞[17]、子宮內(nèi)膜癌HEC-1-A細胞[18]采取RNA干擾Livin聯(lián)合順鉑處理的類似研究,發(fā)現(xiàn)RNA干擾Livin可促進癌細胞凋亡。本研究結(jié)果顯示,對照組細胞凋亡率超過10%,比率稍高,這可能與細胞培養(yǎng)時消化時間稍長有關(guān)。本研究還發(fā)現(xiàn),干擾組、順鉑組、聯(lián)合組喉鱗狀細胞癌Hep-2細胞的增殖抑制率和凋亡率均顯著高于對照組,且聯(lián)合組細胞增殖抑制率和凋亡率顯著高于干擾組、順鉑組。由此證明: ① 敲低Livin表達可抑制喉鱗狀細胞癌細胞增殖,促進細胞凋亡; ② RNA干擾Livin聯(lián)合順鉑化療具有協(xié)同作用,可增強腫瘤細胞對化療藥物順鉑的敏感性,加強細胞增殖抑制,促進細胞凋亡,這為喉鱗狀細胞癌Livin基因靶向治療提供了思路。
進一步研究發(fā)現(xiàn), RNA干擾Livin聯(lián)合順鉑處理后,細胞分裂周期變化顯著, G0/G1期細胞占比升高, S期和G2/M期細胞占比下降。由此說明,下調(diào)Livin延長了G0/G1期,具體表現(xiàn)為細胞合成RNA和核糖體時間延長,未能快速進入增殖期,表現(xiàn)為細胞增殖受阻,此外細胞DNA復制和有絲分裂時間減少,同樣說明細胞增殖受阻。這種細胞分裂周期的變化可能是RNA干擾Livin的機制之一,最終導致細胞增殖減少。為進一步闡明Livin表達下調(diào)介導細胞凋亡的分子機制,本研究分析了Bcl-2mRNA和BaxmRNA水平,發(fā)現(xiàn)RNA干擾Livin聯(lián)合順鉑處理后Bcl-2mRNA水平呈下調(diào)趨勢,BaxmRNA水平呈上調(diào)趨勢。Bax基因?qū)儆诩毎蛲龃龠M基因,Bax表達上調(diào)可拮抗Bcl-2, 促進細胞凋亡[19]。由此說明,Livin表達下調(diào)與Bcl-2和Bax基因表達具有內(nèi)在聯(lián)系。結(jié)直腸癌相關(guān)研究[20-21]發(fā)現(xiàn),Livin與凋亡相關(guān)蛋白Bcl-2的異常表達有關(guān),本研究發(fā)現(xiàn)喉鱗狀細胞癌Livin表達下調(diào)與Bcl-2和Bax基因表達具有關(guān)聯(lián),在一定程度上驗證了Livin的抗凋亡作用。
綜上所述, RNA干擾Livin聯(lián)合順鉑處理喉鱗狀細胞癌Hep-2細胞,可抑制細胞增殖并促進細胞凋亡。

